Tratamiento de los tumores limítrofes de ovario (PDQ®)–Versión para profesionales de salud
Información general sobre los tumores limítrofes de ovario
Incidencia y mortalidad
Los tumores limítrofes de ovario (es decir, los tumores de bajo potencial maligno, escasa malignidad o borderline) representan el 15 % de todos los cánceres epiteliales de ovario. Casi el 75 % de los tumores limítrofes están en estadio I en el momento del diagnóstico.[1] Es importante reconocer estos tumores porque su pronóstico y tratamiento son diferentes a los de los carcinomas invasivos claramente malignos.
En una revisión de 22 series (que incluyeron a 953 pacientes), con una media de seguimiento de 7 años, se observó una tasa de supervivencia del 92 % en las pacientes con tumores limítrofes de ovario en estadio avanzado, cuando se excluyó del análisis a las pacientes con implantes invasivos. Las causas de muerte en estas pacientes fueron: complicaciones benignas de la enfermedad (por ejemplo, obstrucción del intestino delgado), complicaciones del tratamiento y, en escasas ocasiones (0,7 % de las pacientes), transformación maligna.[2] En una serie, las tasas de supervivencia a 5, 10, 15 y 20 años de las pacientes con tumores limítrofes (todos los estadios), como se demostró en el análisis clínico de la tabla de mortalidad, fueron del 97 %, 95 %, 92 % y 89 %, respectivamente.[3] En esta serie, la mortalidad dependió del estadio: el 0,7 % de las pacientes con tumores en estadio I, el 4,2 % de las pacientes con tumores en estadio II y el 26,8 % de las pacientes con tumores en estadio III murieron por la enfermedad.[3] En contraste con las tasas de supervivencia favorables para la enfermedad en estadio temprano notificadas antes, en el Fédération Internationale de Gynécologie et d’Obstétrique Annual Report (volumen 21) se incluyeron 529 pacientes con tumores en estadio I con una tasa de supervivencia actuarial a 5 años del 89,1 %. También se notificó buena supervivencia en un estudio prospectivo grande.[4] Estas tasas de supervivencia contrastan claramente con la tasa de supervivencia del 30 % en las pacientes con tumores invasivos (todos los estadios).
En otro estudio retrospectivo grande, se observó que el estadio temprano, el tipo histológico seroso y la edad más temprana se relacionan con un pronóstico más favorable en las pacientes con tumores limítrofes de ovario.[5]
Tumores endometrioides
Los tumores endometrioides limítrofes son menos comunes y no se deben considerar malignos porque casi nunca metastatizan. Sin embargo, es posible que se produzca una transformación maligna vinculada con un tumor similar fuera del ovario. Dichos tumores son el resultado de un segundo tumor primario o la ruptura del tumor endometrial primario.[6]
Bibliografía
- Berek JS, Renz M, Kehoe S, et al.: Cancer of the ovary, fallopian tube, and peritoneum: 2021 update. Int J Gynaecol Obstet 155 (Suppl 1): 61-85, 2021. [PUBMED Abstract]
- Kurman RJ, Trimble CL: The behavior of serous tumors of low malignant potential: are they ever malignant? Int J Gynecol Pathol 12 (2): 120-7, 1993. [PUBMED Abstract]
- Leake JF, Currie JL, Rosenshein NB, et al.: Long-term follow-up of serous ovarian tumors of low malignant potential. Gynecol Oncol 47 (2): 150-8, 1992. [PUBMED Abstract]
- Zanetta G, Rota S, Chiari S, et al.: Behavior of borderline tumors with particular interest to persistence, recurrence, and progression to invasive carcinoma: a prospective study. J Clin Oncol 19 (10): 2658-64, 2001. [PUBMED Abstract]
- Kaern J, Tropé CG, Abeler VM: A retrospective study of 370 borderline tumors of the ovary treated at the Norwegian Radium Hospital from 1970 to 1982. A review of clinicopathologic features and treatment modalities. Cancer 71 (5): 1810-20, 1993. [PUBMED Abstract]
- Norris HJ: Proliferative endometrioid tumors and endometrioid tumors of low malignant potential of the ovary. Int J Gynecol Pathol 12 (2): 134-40, 1993. [PUBMED Abstract]
Información sobre los estadios de los tumores limítrofes de ovario
Estadificación FIGO
La Federación Internacional de Ginecología y Obstetricia (FIGO) y el American Joint Committee on Cancer (AJCC) han creado estadificaciones para definir los tumores limítrofes de ovario; el sistema FIGO se usa con mayor frecuencia.[1,2]
| Estadio | Definición | Ilustración |
|---|---|---|
| FIGO = Federación Internacional de Ginecología y Obstetricia. | ||
| aAdaptación de FIGO Committee for Gynecologic Oncology.[1] | ||
| I | Tumor confinado en los ovarios o las trompas de Falopio. |
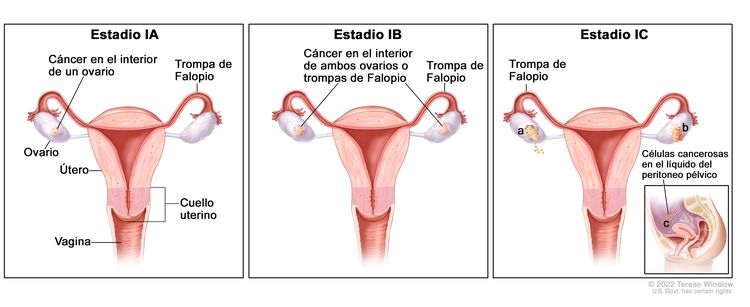 |
| IA | Tumor limitado a un ovario (cápsula intacta) o una trompa de Falopio; no hay tumor en la superficie del ovario o las trompas de Falopio; no hay células malignas en el líquido de la ascitis o los lavados peritoneales. | |
| IB | Tumor limitado a ambos ovarios (cápsulas intactas) o a las trompas de Falopio; no hay tumor en la superficie del ovario o la trompa de Falopio; no hay células malignas en el líquido de la ascitis o los lavados peritoneales. | |
| IC | Tumor limitado a uno o ambos ovarios, o a las trompas de Falopio, y se presenta cualquiera de las siguientes situaciones: | |
| IC1: Derrame quirúrgico. | ||
| IC2: Ruptura de la cápsula antes de la cirugía, o tumor en la superficie del ovario o la trompa de Falopio. | ||
| IC3: Células malignas en el líquido de la ascitis o los lavados peritoneales. | ||
| Estadio | Definición | Ilustración |
|---|---|---|
| FIGO = Federación Internacional de Ginecología y Obstetricia. | ||
| aAdaptación de FIGO Committee for Gynecologic Oncology.[1] | ||
| II | El tumor compromete uno o ambos ovarios o trompas de Falopio con extensión pélvica (debajo del borde de la pelvis) o cáncer primario de peritoneo. |
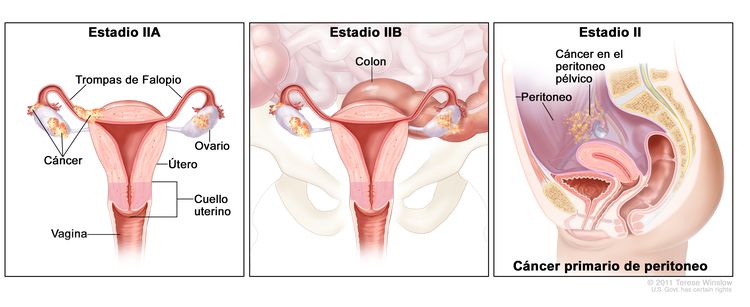 |
| IIA | Diseminación o implantes en el útero, las trompas de Falopio o los ovarios. | |
| IIB | Diseminación a otros tejidos pélvicos intraperitoneales. | |
| Estadio | Definición | Ilustración |
|---|---|---|
| FIGO = Federación Internacional de Ginecología y Obstetricia. | ||
| aAdaptación de FIGO Committee for Gynecologic Oncology.[1] | ||
| III | El tumor compromete uno o ambos ovarios o trompas de Falopio, o hay un cáncer primario de peritoneo, con diseminación al peritoneo fuera de la pelvis confirmada por pruebas citológicas o histológicas, o metástasis en los ganglios linfáticos retroperitoneales. | |
| IIIA1 | Solo hay compromiso tumoral de ganglios linfáticos retroperitoneales (confirmado por pruebas citológicas o histológicas): |
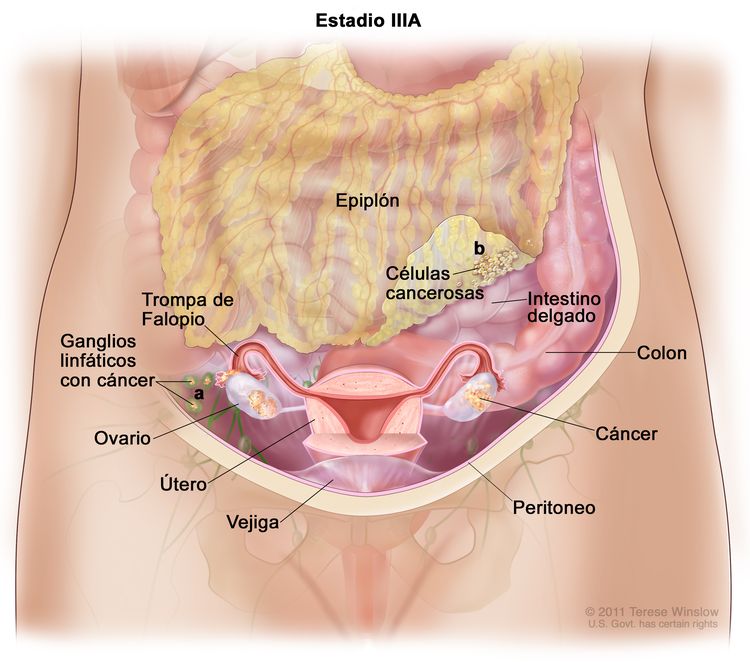 |
| IIIA1(i): Metástasis ≤10 mm en su mayor dimensión. | ||
| IIIA1(ii): Metástasis >10 mm en su mayor dimensión. | ||
| IIIA2 | Compromiso peritoneal extrapélvico microscópico (encima del borde de la pelvis), con compromiso de los ganglios linfáticos retroperitoneales o sin este. | |
| IIIB | Metástasis peritoneales macroscópicas fuera de la pelvis de ≤2 cm en su mayor dimensión, con metástasis en los ganglios linfáticos retroperitoneales o sin estas. |
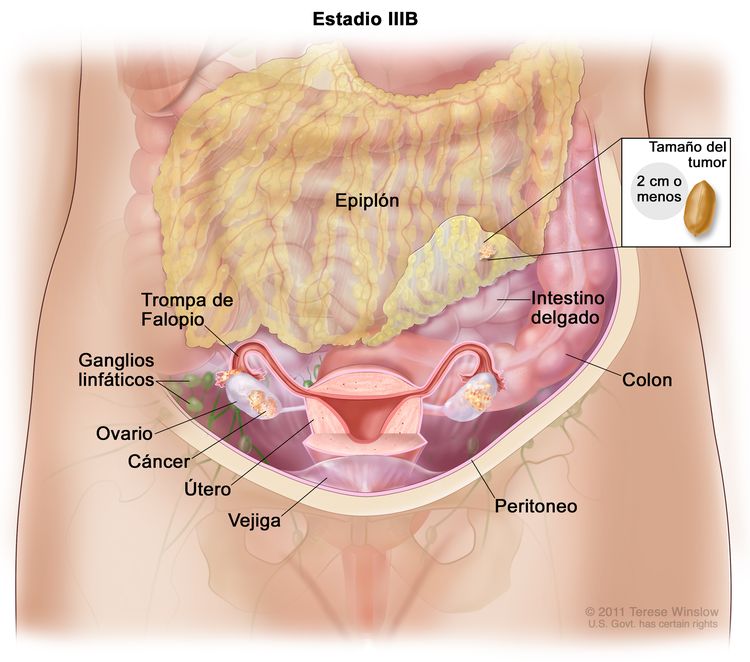 |
| IIIC | Metástasis peritoneales macroscópicas fuera de la pelvis de >2 cm en su mayor dimensión, con metástasis en los ganglios linfáticos retroperitoneales o sin estas (incluye diseminación del tumor a la cápsula del hígado y el bazo, sin compromiso parenquimatoso de ninguno de estos órganos). |
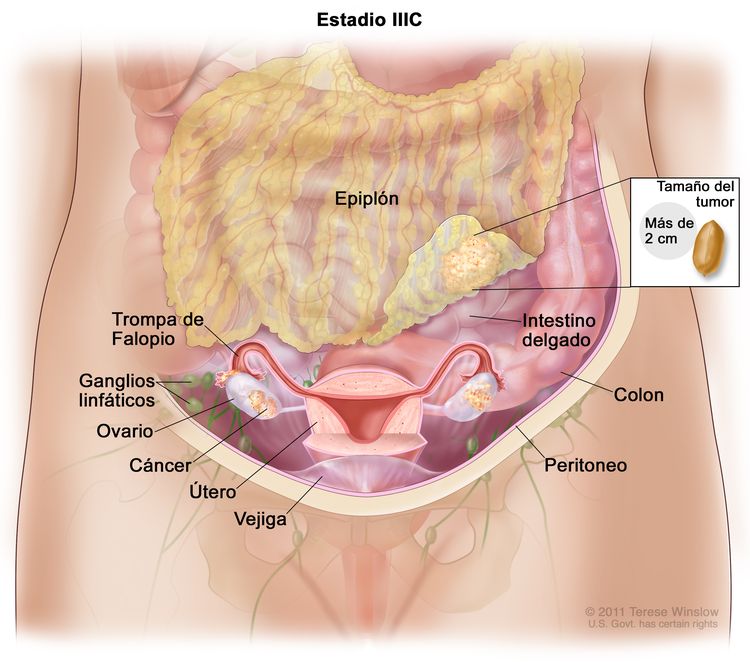 |
| Estadio | Definición | Ilustración |
|---|---|---|
| FIGO = Federación Internacional de Ginecología y Obstetricia. | ||
| aAdaptación de FIGO Committee for Gynecologic Oncology.[1] | ||
| IV | Metástasis a distancia con exclusión de metástasis peritoneales. |
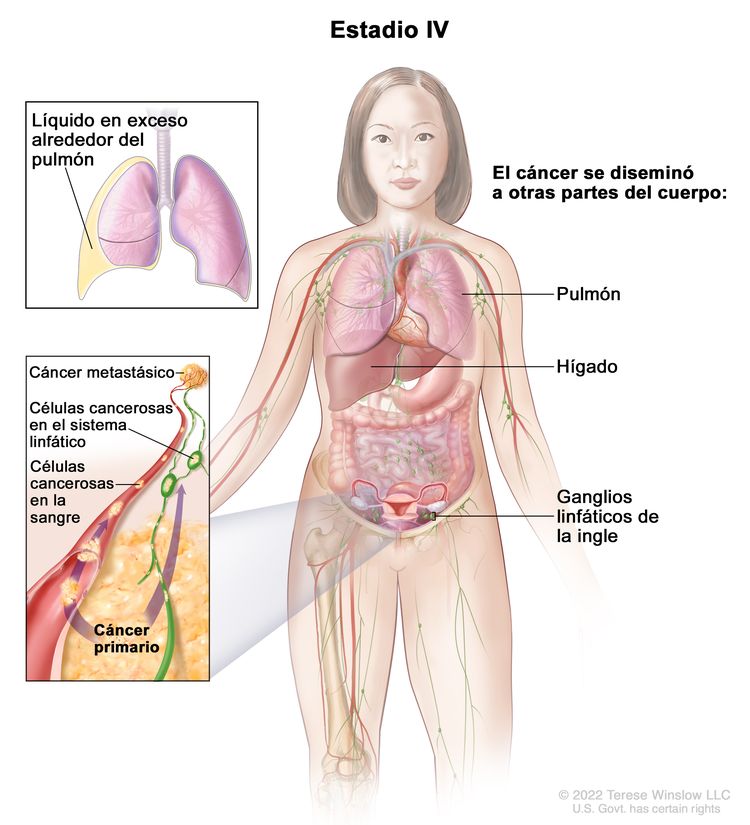 |
| IVA | Derrame pleural con prueba citológica positiva para compromiso tumoral. | |
| IVB | Metástasis parenquimatosas y metástasis en órganos extraabdominales (incluso en los ganglios linfáticos inguinales y los ganglios linfáticos fuera de la cavidad abdominal). | |
Bibliografía
- Berek JS, Renz M, Kehoe S, et al.: Cancer of the ovary, fallopian tube, and peritoneum: 2021 update. Int J Gynaecol Obstet 155 (Suppl 1): 61-85, 2021. [PUBMED Abstract]
- Ovary, fallopian tube, and primary peritoneal carcinoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 681-90.
Tratamiento de los tumores limítrofes de ovario en estadio temprano
Opciones de tratamiento de los tumores limítrofes de ovario en estadio temprano
Las opciones de tratamiento de los tumores limítrofes de ovario en estadio temprano son las siguientes:
Cirugía
En la enfermedad en estadio temprano (estadio I o II), no se indica tratamiento adicional para las pacientes con un tumor limítrofe completamente resecado.[1]
Importancia de la estadificación para el tratamiento
No se ha demostrado el valor de la estadificación completa en las pacientes con enfermedad en estadio temprano, pero se debe evaluar cuidadosamente el ovario contralateral para detectar indicios de enfermedad bilateral. Aunque no se ha definido el efecto de la estadificación quirúrgica en el abordaje terapéutico, en un estudio de 29 pacientes con presunta enfermedad localizada, en 7 pacientes se reclasificó el estadio a uno más alto después de la estadificación quirúrgica completa.[2]
En otros 2 estudios, en el 16 % y el 18 % de las pacientes con presuntos tumores limítrofes localizados se hizo la reclasificación del estadio a uno más alto después de una laparotomía de estadificación.[3,4] En uno de estos estudios, el rendimiento para los tumores serosos fue del 30,8 %, en comparación con el 0 % para los tumores mucinosos.[3]
En otro estudio, las pacientes con enfermedad intraperitoneal localizada sin compromiso ganglionar tuvieron una incidencia baja de recidiva (5 %), mientras que las pacientes con enfermedad intraperitoneal localizada y compromiso ganglionar tuvieron una incidencia estadísticamente significativa más alta de recidiva (50 %).[5]
Conservación de la fertilidad
Cuando una paciente desea conservar la capacidad reproductiva, el tratamiento apropiado es una salpingooforectomía unilateral.[6,7] En presencia de neoplasias quísticas ováricas bilaterales, o en pacientes con un solo ovario, se puede usar una ooforectomía parcial para conservar la capacidad reproductiva.[8] Algunos médicos destacan la importancia de limitar la cistectomía ovárica para pacientes con enfermedad en estadio IA con márgenes sin compromiso tumoral en la muestra de la cistectomía.[9]
En una serie grande, la tasa de recaída fue más alta en las pacientes sometidas a una cirugía más conservadora (cistectomía > ooforectomía unilateral > histerectomía abdominal total y salpingooforectomía bilateral). Sin embargo, las diferencias no fueron estadísticamente significativas y la supervivencia fue de casi el 100 % en todos los grupos.[5,10] Cuando la posibilidad de quedar embarazada no es una consideración, el tratamiento apropiado es histerectomía abdominal total y salpingooforectomía bilateral. Una vez que la familia de la paciente está completa, la mayoría, pero no todos,[9] los médicos prefiere la extirpación del tejido ovárico restante, ya que hay riesgo de recidiva de un tumor limítrofe o, en escasas ocasiones, aparece un carcinoma.[3,6]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Tropé C, Kaern J, Vergote IB, et al.: Are borderline tumors of the ovary overtreated both surgically and systemically? A review of four prospective randomized trials including 253 patients with borderline tumors. Gynecol Oncol 51 (2): 236-43, 1993. [PUBMED Abstract]
- Yazigi R, Sandstad J, Munoz AK: Primary staging in ovarian tumors of low malignant potential. Gynecol Oncol 31 (3): 402-8, 1988. [PUBMED Abstract]
- Snider DD, Stuart GC, Nation JG, et al.: Evaluation of surgical staging in stage I low malignant potential ovarian tumors. Gynecol Oncol 40 (2): 129-32, 1991. [PUBMED Abstract]
- Leake JF, Rader JS, Woodruff JD, et al.: Retroperitoneal lymphatic involvement with epithelial ovarian tumors of low malignant potential. Gynecol Oncol 42 (2): 124-30, 1991. [PUBMED Abstract]
- Leake JF, Currie JL, Rosenshein NB, et al.: Long-term follow-up of serous ovarian tumors of low malignant potential. Gynecol Oncol 47 (2): 150-8, 1992. [PUBMED Abstract]
- Kaern J, Tropé CG, Abeler VM: A retrospective study of 370 borderline tumors of the ovary treated at the Norwegian Radium Hospital from 1970 to 1982. A review of clinicopathologic features and treatment modalities. Cancer 71 (5): 1810-20, 1993. [PUBMED Abstract]
- Lim-Tan SK, Cajigas HE, Scully RE: Ovarian cystectomy for serous borderline tumors: a follow-up study of 35 cases. Obstet Gynecol 72 (5): 775-81, 1988. [PUBMED Abstract]
- Rice LW, Berkowitz RS, Mark SD, et al.: Epithelial ovarian tumors of borderline malignancy. Gynecol Oncol 39 (2): 195-8, 1990. [PUBMED Abstract]
- Piura B, Dgani R, Blickstein I, et al.: Epithelial ovarian tumors of borderline malignancy: a study of 50 cases. Int J Gynecol Cancer 2 (4): 189-197, 1992. [PUBMED Abstract]
- Casey AC, Bell DA, Lage JM, et al.: Epithelial ovarian tumors of borderline malignancy: long-term follow-up. Gynecol Oncol 50 (3): 316-22, 1993. [PUBMED Abstract]
Tratamiento de los tumores limítrofes de ovario en estadio avanzado
Opciones de tratamiento para los tumores limítrofes de ovario en estadio avanzado
Las opciones de tratamiento de los tumores limítrofes de ovario en estadio avanzado son las siguientes:
Cirugía
Las pacientes con enfermedad avanzada deben someterse a una histerectomía total, salpingooforectomía bilateral, omentectomía, muestreo ganglionar y cirugía citorreductora radical. Las pacientes con enfermedad en estadio III o IV sin tumor residual macroscópico tuvieron una tasa de supervivencia del 100 % en algunas series, independientemente de la duración del seguimiento.[1,2] La tasa de supervivencia a 7 años de las pacientes con enfermedad residual macroscópica fue de solo el 69 % en una serie grande [3] y fue inversamente proporcional a la duración del seguimiento.[3]
Ni la quimioterapia ni la radioterapia están indicadas para las pacientes con enfermedad en estadio más avanzado o enfermedad residual microscópica o macroscópica. Hay poca evidencia de que la quimioterapia o la radioterapia posoperatorias alteren la evolución de esta enfermedad de alguna manera beneficiosa.[1,3-6] En un estudio retrospectivo de 364 pacientes sin tumor residual, la terapia adyuvante no tuvo efecto en la supervivencia sin enfermedad o la supervivencia corregida cuando se estratificó por estadio de la enfermedad.[7] Las pacientes sin tumor residual que no recibieron tratamiento adyuvante tuvieron una tasa de supervivencia igual o superior a la de los grupos tratados. No hay estudios controlados de comparación del tratamiento posoperatorio con la ausencia de tratamiento posoperatorio.
En una revisión de 150 pacientes con tumores de ovario limítrofes, la supervivencia de las pacientes con un tumor residual de menos de 2 cm fue significativamente mejor que la supervivencia de aquellas con un tumor residual de 2 cm a 5 cm o de más de 5 cm (P < 0,05).[8] No está claro si los implantes invasivos acarrean un pronóstico más precario. Algunos investigadores han correlacionado la presencia de implantes invasivos con un pronóstico precario [9] mientras que otros no lo han hecho.[2,10] En algunos estudios se ha indicado que la presencia de ploidía del DNA en los tumores puede identificar a las pacientes que presentarán una enfermedad de gran malignidad.[11,12] En un estudio no se pudo correlacionar la presencia de ploidía del DNA en un tumor seroso primario con la supervivencia de las pacientes, pero se encontró que los implantes invasivos aneuploides se relacionaron con un pronóstico precario.[13] No hay evidencia que indique que el tratamiento de pacientes con tumores aneuploides tenga ningún efecto en la supervivencia. No se encontró una asociación significativa entre la sobreexpresión de TP53 y HER2/neu y la recidiva tumoral o la supervivencia de la paciente.[14]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Barnhill D, Heller P, Brzozowski P, et al.: Epithelial ovarian carcinoma of low malignant potential. Obstet Gynecol 65 (1): 53-9, 1985. [PUBMED Abstract]
- Bostwick DG, Tazelaar HD, Ballon SC, et al.: Ovarian epithelial tumors of borderline malignancy. A clinical and pathologic study of 109 cases. Cancer 58 (9): 2052-65, 1986. [PUBMED Abstract]
- Leake JF, Currie JL, Rosenshein NB, et al.: Long-term follow-up of serous ovarian tumors of low malignant potential. Gynecol Oncol 47 (2): 150-8, 1992. [PUBMED Abstract]
- Casey AC, Bell DA, Lage JM, et al.: Epithelial ovarian tumors of borderline malignancy: long-term follow-up. Gynecol Oncol 50 (3): 316-22, 1993. [PUBMED Abstract]
- Tumors of the ovary: neoplasms derived from coelomic epithelium. In: Morrow CP, Curtin JP: Synopsis of Gynecologic Oncology. 5th ed. Churchill Livingstone, 1998, pp 233-281.
- Sutton GP, Bundy BN, Omura GA, et al.: Stage III ovarian tumors of low malignant potential treated with cisplatin combination therapy (a Gynecologic Oncology Group study). Gynecol Oncol 41 (3): 230-3, 1991. [PUBMED Abstract]
- Kaern J, Tropé CG, Abeler VM: A retrospective study of 370 borderline tumors of the ovary treated at the Norwegian Radium Hospital from 1970 to 1982. A review of clinicopathologic features and treatment modalities. Cancer 71 (5): 1810-20, 1993. [PUBMED Abstract]
- Tamakoshi K, Kikkawa F, Nakashima N, et al.: Clinical behavior of borderline ovarian tumors: a study of 150 cases. J Surg Oncol 64 (2): 147-52, 1997. [PUBMED Abstract]
- Bell DA, Scully RE: Serous borderline tumors of the peritoneum. Am J Surg Pathol 14 (3): 230-9, 1990. [PUBMED Abstract]
- Michael H, Roth LM: Invasive and noninvasive implants in ovarian serous tumors of low malignant potential. Cancer 57 (6): 1240-7, 1986. [PUBMED Abstract]
- Friedlander ML, Hedley DW, Swanson C, et al.: Prediction of long-term survival by flow cytometric analysis of cellular DNA content in patients with advanced ovarian cancer. J Clin Oncol 6 (2): 282-90, 1988. [PUBMED Abstract]
- Kaern J, Trope C, Kjorstad KE, et al.: Cellular DNA content as a new prognostic tool in patients with borderline tumors of the ovary. Gynecol Oncol 38 (3): 452-7, 1990. [PUBMED Abstract]
- de Nictolis M, Montironi R, Tommasoni S, et al.: Serous borderline tumors of the ovary. A clinicopathologic, immunohistochemical, and quantitative study of 44 cases. Cancer 70 (1): 152-60, 1992. [PUBMED Abstract]
- Eltabbakh GH, Belinson JL, Kennedy AW, et al.: p53 and HER-2/neu overexpression in ovarian borderline tumors. Gynecol Oncol 65 (2): 218-24, 1997. [PUBMED Abstract]
Tratamiento del carcinoma seroso de grado bajo
Opciones de tratamiento del carcinoma seroso de grado bajo
El carcinoma seroso de grado bajo, también conocido como carcinoma seroso micropapilar invasivo, surge de tumores limítrofes o como un tumor de novo. Estos tumores son infrecuentes, representan el 5 % de los carcinomas de ovario y se presentan en mujeres más jóvenes. Esta neoplasia tiene mejor pronóstico clínico que los carcinomas serosos de grado alto. La caracterización molecular del carcinoma seroso de grado bajo muestra una frecuencia más baja de mutaciones en el gen TP53, mayor expresión de receptores de estrógeno y progesterona, y una prevalencia alta de mutaciones en los genes BRAF y NRAS.[1] A diferencia de las pacientes con un tipo histológico de grado alto, las pacientes con carcinoma seroso de grado bajo a menudo no tienen concentraciones de CA-125 muy elevadas en el momento del diagnóstico.[2] El carcinoma seroso de grado bajo se presenta en pacientes con mutaciones en genes asociados con la deficiencia de recombinación homóloga; la tasa de mutaciones es mucho más baja en las pacientes con carcinoma seroso de grado bajo (alrededor del 11 %) que en las pacientes con un tipo histológico de grado alto (27 %).[3]
Los abordajes de tratamiento para las pacientes con enfermedad recidivante incluyen cirugía citorreductora, quimioterapia citotóxica, terapia hormonal o fármacos dirigidos.
Las opciones de tratamiento para el carcinoma seroso de grado bajo son las siguientes:
- Cirugía con quimioterapia o sin esta.
- Cirugía citorreductora secundaria.
- Terapias dirigidas.
- Terapia hormonal sola o combinada con quimioterapia (en evaluación clínica [NCT04095364]).
Cirugía con quimioterapia o sin esta
Si bien la cirugía citorreductora completa es un componente importante del abordaje de tratamiento del carcinoma seroso de grado bajo, estos tumores tienden a ser quimiorresistentes.[4] A pesar de esto, dada la falta de evidencia que respalde el uso de otros tratamientos, muchas pacientes reciben quimioterapia doble con derivados del platino y taxanos, similar a la quimioterapia que se usa para pacientes con cáncer de ovario más invasivo. Las pacientes que requieren quimioterapia neoadyuvante antes de la cirugía citorreductora tienen un desenlace más precario que aquellas que se someten a cirugía citorreductora primaria.[5]
Cirugía citorreductora secundaria
Evidencia (cirugía citorreductora secundaria):
- En una revisión retrospectiva de una sola institución se evaluó la cirugía citorreductora secundaria realizada entre 1995 y 2002 en 41 pacientes con carcinoma seroso de grado bajo recidivante. En el estudio se concluyó que la citorreducción secundaria es beneficiosa.[6][Nivel de evidencia C3] La mediana de tiempo desde la citorreducción del tumor primario hasta la citorreducción secundaria fue de 33,2 meses.
- En este estudio, 32 pacientes (78 %) presentaron enfermedad residual macroscópica al completar la citorreducción secundaria.
- Las pacientes sin enfermedad residual macroscópica después de la citorreducción secundaria tuvieron una mediana de supervivencia sin progresión (SSP) de 60,3 meses, en comparación con 10,7 meses en aquellas con enfermedad residual macroscópica (P = 0,008).
- La supervivencia general (SG) a partir de la cirugía de citorreducción secundaria fue de 93,6 meses para aquellas pacientes sin enfermedad residual macroscópica después de la cirugía, en comparación con 45,8 meses para aquellas con enfermedad macroscópica (P = 0,04).
Terapias dirigidas
Dado que el carcinoma seroso de grado bajo es relativamente resistente a la quimioterapia, la atención se ha centrado en las terapias dirigidas.
- Anastrozol: la expresión del receptor de estrógeno (ER) se observa en la mayoría de los carcinomas serosos de grado bajo y es una posible diana terapéutica. En el ensayo en cesta de fase II PARAGON se evaluó la actividad del anastrozol en pacientes con tumores positivos para ER, incluso en 36 pacientes con carcinoma seroso de grado bajo recidivante.[7][Nivel de evidencia C3]
- En el ensayo se demostró un beneficio clínico en el 61 % de las pacientes a los 6 meses y en el 34 % de las pacientes a los 12 meses. En el estudio no solo se examinaron pacientes con carcinoma seroso de grado bajo.
- La mediana de duración del beneficio clínico fue de 9,5 meses.
- Trametinib: el trametinib es un inhibidor alostérico selectivo y reversible y de MEK1/MEK2. En un reciente ensayo internacional aleatorizado multicéntrico de fase II/III, se evaluó el trametinib en pacientes con carcinoma seroso de grado bajo. Se permitió un número ilimitado de terapias previas, incluso quimioterapia o terapia hormonal. Las pacientes tenían que haber recibido por lo menos un régimen previo a base de derivados del platino, pero no todos los 5 medicamentos del tratamiento estándar. Las pacientes recibieron trametinib oral (2 mg una vez al día) o el tratamiento estándar con la quimioterapia elegida por el médico (paclitaxel, doxorrubicina liposomal pegilada, topotecán, letrozol oral o tamoxifeno oral).[8][Nivel de evidencia B1]
- La mediana de SSP fue de 13,0 meses (intervalo de confianza [IC] 95 %, 9,9–15,0) en el grupo de trametinib y de 7,5 meses (IC 95 %, 5,6–9,9) en el grupo de atención estándar (cociente de riesgos instantáneos [CRI], 0,48; IC 95 %, 0,36–0,64; P unilateral < 0,0001).
- Se llevó a cabo un análisis posterior en un subgrupo de 87 pacientes para quienes se había planificado desde antes que recibieran letrozol si se asignaban al azar al grupo de atención estándar. La mediana de SSP fue de 15,0 meses (IC 95 %, 7,7–23,1) en el grupo de trametinib y de 10,6 meses (IC 95 %, 6,5–12,8) en el grupo de letrozol (CRI, 0,58; IC 95 %, 0,36–0,95; P unilateral = 0,085).
- La tasa de respuesta general fue del 26 % (34 de 130 pacientes) en el grupo de trametinib. Otro 59 % de las pacientes (77 de 130) presentaron enfermedad estable durante al menos 8 semanas.
- La mediana de SG fue de 37,6 meses (IC 95 %, 32,0–no evaluable) en el grupo de trametinib y de 29,2 meses (23,5–51,6) en el grupo de tratamiento estándar (CRImuerte, 0,76; IC 95 %, 0,51–1,12; P unilateral = 0,056).
- No hay evidencia de que el estado de las mutaciones en BRAF, KRAS o NRAS sea predictor de la SSP.
- Binimetinib: el ensayo MILO/ENGOT-ov11 (NCT01849874) fue un ensayo fase III de binimetinib, un inhibidor de molécula pequeña de MEK1/MEK2. En el ensayo participaron 303 pacientes con carcinoma seroso de grado bajo recidivante que habían recibido de 1 a 3 líneas previas de quimioterapia. Las pacientes se asignaron al azar en una proporción de 2:1 para recibir binimetinib (45 mg por vía oral 2 veces al día) o la quimioterapia elegida por el médico (doxorrubicina liposomal pegilada, paclitaxel o topotecán).[9]
- La mediana de SSP fue de 9,1 meses (IC 95 %, 7,3–11,3) para las pacientes que recibieron binimetinib y de 10,6 meses (IC 95 %, 9,2–14,5) para las pacientes que recibieron quimioterapia. El estudio se cerró de manera anticipada por el límite de futilidad preespecificado.
- La tasa de respuesta general fue del 16 % en las pacientes que recibieron binimetinib (incluso 32 pacientes con respuesta completa o parcial) y del 13 % en las pacientes que recibieron quimioterapia (incluso 13 pacientes con respuesta completa o parcial).
- La mediana de duración de la respuesta fue de 8,1 meses (intervalo, 0,03 a ≥ 12,0) para las pacientes que recibieron binimetinib y de 6,7 meses (intervalo, 0,03 a ≥ 9,7) para las pacientes que recibieron quimioterapia.
- La SG fue de 25,3 meses para las pacientes que recibieron binimetinib y de 20,8 meses para las pacientes que recibieron quimioterapia.
- La SG fue similar y no se consideró mejor ni peor que la quimioterapia.
- Se llevó a cabo un análisis posterior con las muestras de las pruebas moleculares tumorales de 215 pacientes. Se observó una mutación en KRAS en el 32 % al 34 % de las pacientes. En el análisis se observó que la mutación en KRAS se relacionó con la respuesta al tratamiento con binimetinib (oportunidad relativa, 3,4; IC 95 %, 1,53–7,66; P no ajustada = 0,003) y con una SSP prolongada en las pacientes tratadas con binimetinib (mediana de SSP: mutación en KRAS, 17,7 meses [IC 95 %, 12–no alcanzada]; KRAS natural, 10,8 meses [IC 95 %, 5,5–16,7]; P = 0,006).
- Bevacizumab: el bevacizumab es un anticuerpo monoclonal anti-VEGFA. En una sola institución se inscribieron 13 pacientes con carcinoma seroso de grado bajo y 4 pacientes con tumores limítrofes. En este estudio, 2 pacientes recibieron bevacizumab en monoterapia, mientras que las otras pacientes lo recibieron en combinación con quimioterapia (es decir, paclitaxel, topotecán, ciclofosfamida oral y gemcitabina, o gemcitabina y carboplatino).[10][Nivel de evidencia C3]
- Después de una mediana de duración de 23 semanas (intervalo, 6–79,4), no se presentaron respuestas completas, y 6 pacientes presentaron una respuesta parcial (5 de las cuales había recibido paclitaxel simultánea y 1 que había recibido gemcitabina simultánea). La tasa de respuesta general fue del 40 % en todas las pacientes evaluables y del 55 % en el subgrupo de pacientes con carcinoma seroso de grado bajo.
- Ribociclib y letrozol: el GOG-3026 (NCT03673124) fue un ensayo de fase II en el que se evaluó la combinación de ribociclib y letrozol en pacientes con carcinoma seroso de grado bajo recidivante. Las pacientes recibieron 600 mg diarios de ribociclib, un inhibidor de CDK4/6, como parte de un programa de 3 semanas de tratamiento y 1 semana de descanso, además de 2,5 mg de letrozol oral una vez al día durante un ciclo de 28 días.[11]
- La tasa de respuesta general fue del 23 % (IC 90 %, 13,4–35 %) y la tasa de beneficio clínico fue del 97 % (IC 90 %, 67,2–88,2 %).
- La mediana de duración de la respuesta fue de 19,1 meses. La mediana de SSP fue de 19,1 meses y la mediana de SG no se alcanzó.
- Selumetinib: el selumetinib es un inhibidor de molécula pequeña selectivo para MEK1 y MEK2. En un estudio de fase II se incluyeron 52 pacientes con carcinoma seroso de grado bajo recidivante que recibieron 50 mg de selumetinib 2 veces al día hasta la progresión.[12][Nivel de evidencia C3]
- Se presentaron respuestas completas en 8 pacientes (15 %), respuestas parciales en 7 pacientes (13 %) y 34 pacientes (65 %) tenían una enfermedad estable.
- La mediana de tiempo hasta la respuesta fue de 4,8 meses y la mediana de duración de la respuesta fue de 10,5 meses.
- La mediana de SSP fue de 11 meses y el 63 % de las pacientes presentó una SSP de más de 6 meses.
- Las respuestas fueron independientes de la presencia de mutaciones en BRAF o KRAS.
- Imatinib: el carcinoma seroso de grado bajo tiene una expresión alta de PDGFR-β y BCR::ABL. En un estudio de fase II, se evaluó el mesilato de imatinib en pacientes con carcinoma seroso de grado bajo recidivante resistente a los derivados del platino. En el ensayo participaron 13 pacientes que habían recibido al menos 4 líneas previas de quimioterapia con derivados del platino o taxanos y en quienes se había detectado un biomarcador dirigido (es decir, c-KIT, PDGFR-β o BCR::ABL). Las pacientes recibieron 600 mg de mesilato de imatinib al día durante 6 semanas.[13]
- No hubo evidencia de eficacia en las pacientes que recibieron mesilato de imatinib a pesar de la expresión alta de PDGFR-β.
Bibliografía
- Gershenson DM: Low-grade serous carcinoma of the ovary or peritoneum. Ann Oncol 27 (Suppl 1): i45-i49, 2016. [PUBMED Abstract]
- Fader AN, Java J, Krivak TC, et al.: The prognostic significance of pre- and post-treatment CA-125 in grade 1 serous ovarian carcinoma: a gynecologic Oncology Group study. Gynecol Oncol 132 (3): 560-5, 2014. [PUBMED Abstract]
- Norquist BM, Brady MF, Harrell MI, et al.: Mutations in Homologous Recombination Genes and Outcomes in Ovarian Carcinoma Patients in GOG 218: An NRG Oncology/Gynecologic Oncology Group Study. Clin Cancer Res 24 (4): 777-783, 2018. [PUBMED Abstract]
- Gershenson DM, Sun CC, Lu KH, et al.: Clinical behavior of stage II-IV low-grade serous carcinoma of the ovary. Obstet Gynecol 108 (2): 361-8, 2006. [PUBMED Abstract]
- Scott SA, Llaurado Fernandez M, Kim H, et al.: Low-grade serous carcinoma (LGSC): A Canadian multicenter review of practice patterns and patient outcomes. Gynecol Oncol 157 (1): 36-45, 2020. [PUBMED Abstract]
- Crane EK, Sun CC, Ramirez PT, et al.: The role of secondary cytoreduction in low-grade serous ovarian cancer or peritoneal cancer. Gynecol Oncol 136 (1): 25-9, 2015. [PUBMED Abstract]
- Tang M, O'Connell RL, Amant F, et al.: PARAGON: A Phase II study of anastrozole in patients with estrogen receptor-positive recurrent/metastatic low-grade ovarian cancers and serous borderline ovarian tumors. Gynecol Oncol 154 (3): 531-538, 2019. [PUBMED Abstract]
- Gershenson DM, Miller A, Brady WE, et al.: Trametinib versus standard of care in patients with recurrent low-grade serous ovarian cancer (GOG 281/LOGS): an international, randomised, open-label, multicentre, phase 2/3 trial. Lancet 399 (10324): 541-553, 2022. [PUBMED Abstract]
- Monk BJ, Grisham RN, Banerjee S, et al.: MILO/ENGOT-ov11: Binimetinib Versus Physician's Choice Chemotherapy in Recurrent or Persistent Low-Grade Serous Carcinomas of the Ovary, Fallopian Tube, or Primary Peritoneum. J Clin Oncol 38 (32): 3753-3762, 2020. [PUBMED Abstract]
- Grisham RN, Iyer G, Sala E, et al.: Bevacizumab shows activity in patients with low-grade serous ovarian and primary peritoneal cancer. Int J Gynecol Cancer 24 (6): 1010-4, 2014. [PUBMED Abstract]
- Slomovitz B, Deng W, Killion J, et al.: GOG 3026 A phase II trial of letrozole + ribociclib in women with recurrent low-grade serous carcinoma of the ovary, fallopian tube or peritoneum: A GOG foundation study. [Abstract] Gynecol Oncol 176 (Suppl 1): A-001, S2, 2023.
- Farley J, Brady WE, Vathipadiekal V, et al.: Selumetinib in women with recurrent low-grade serous carcinoma of the ovary or peritoneum: an open-label, single-arm, phase 2 study. Lancet Oncol 14 (2): 134-40, 2013. [PUBMED Abstract]
- Noguera IR, Sun CC, Broaddus RR, et al.: Phase II trial of imatinib mesylate in patients with recurrent platinum- and taxane-resistant low-grade serous carcinoma of the ovary, peritoneum, or fallopian tube. Gynecol Oncol 125 (3): 640-5, 2012. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (02/14/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Este resumen fue objeto de revisión integral y se cambió el título Tratamiento de los tumores de ovario de bajo potencial maligno por Tratamiento de los tumores limítrofes de ovario.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento de los tumores limítrofes de ovario. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento de los tumores limítrofes de ovario son:
- Olga T. Filippova, MD (Lenox Hill Hospital)
- Marina Stasenko, MD (New York University Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento de los tumores limítrofes de ovario. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/ovario/pro/tratamiento-tumores-limitrofes-ovario-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.