Aprobaciones de la FDA - Temas y relatos
Noticias sobre aprobaciones recientes de terapias para el cáncer por parte de la Administración de Alimentos y Medicamentos (FDA). Incluyen comentarios de expertos sobre cómo la aprobación podría influir en el cuidado del paciente y en futuras investigaciones.
-
Se aprobó la combinación de dabrafenib con trametinib para los tumores sólidos con mutaciones en BRAF
La FDA aprobó la combinación de los medicamentos de terapia dirigida dabrafenib (Tafinlar) y trametinib (Mekinist) para casi cualquier tipo de tumor sólido avanzado con una mutación específica en el gen BRAF. La aprobación se fundamentó en datos del estudio clínico NCI-MATCH.
-
La FDA aprobó Opdualag, la primera inmunoterapia dirigida a LAG-3
La inmunoterapia combina relatlimab (inhibidor de puntos de control inmunitario de LAG-3) con nivolumab (inhibidor de PD-1). Es el primer inhibidor de puntos de control inmunitario que se aprueba en los últimos 8 años. Ambos medicamentos sirven para tratar el melanoma avanzado y se administran al paciente en una sola infusión.
-
Se aprueba Carvykti, la segunda terapia de células T con CAR para el mieloma múltiple
Las personas con mieloma múltiple avanzado tienen ahora otra opción de terapia de células T con CAR con la aprobación reciente de ciltacabtagén autoleucel (Carvykti). Al igual que la primera terapia de células T con CAR, Carvykti se dirige a la proteína BCMA en las células del mieloma.
-
Tecartus es la primera terapia de células T con CAR aprobada para adultos con leucemia linfoblástica aguda
La terapia de células T con CAR Tecartus es el primer tratamiento de este tipo aprobado por la Administración de Alimentos y Medicamentos (FDA) para tratar a adultos con leucemia linfoblástica aguda (LLA). La aprobación es para pacientes cuyo cáncer no respondió al tratamiento o volvió después del tratamiento.
-
Se aprobó una inmunoterapia adyuvante para algunos pacientes con cáncer de pulmón
La Administración de Alimentos y Medicamentos (FDA) aprobó el uso del atezolizumab (Tecentriq) como inmunoterapia adyuvante o adicional para tratar a algunos pacientes con cáncer de pulmón de células no pequeñas. La aprobación se basó en los resultados de un estudio clínico llamado IMpower010.
-
Se aprobó el belzutifán para tratar tumores relacionados con la enfermedad hereditaria de Von Hippel-Lindau
La FDA aprobó el belzutifán (Welireg) para tratar a adultos con enfermedad de Von Hippel-Lindau (VHL) que tienen tumores de riñón, encéfalo, sistema nervioso o páncreas. Al achicar los tumores, el medicamento tal vez ayude a que estos pacientes eviten o retrasen la cirugía.
-
La FDA aprueba el belumosudil para tratar la enfermedad de injerto contra huésped crónica
La FDA aprobó el belumosudil (Rezurock) para el tratamiento de la enfermedad de injerto contra huésped (EICH) crónica. La aprobación es para el uso del belumosudil en personas de 12 o más años que ya recibieron al menos otras dos terapias.
-
La FDA aprueba Rylaze ante la escasez de medicamentos para la leucemia linfoblástica aguda infantil
La FDA aprobó Rylaze, una nueva forma de asparaginasa. Este medicamento se creó para aliviar la escasez de la asparaginasa de Erwinia, un componente principal del tratamiento de niños y adultos con leucemia linfoblástica aguda.
-
La Administración de Alimentos y Medicamentos aprueba el sotorasib, el primer inhibidor de KRAS para el cáncer de pulmón
La FDA aprobó el primer medicamento inhibidor de KRAS, el sotorasib (Lumakras). La aprobación del sotorasib para tratar a algunos pacientes con cáncer de pulmón avanzado sienta las bases para otros inhibidores de KRAS que están en desarrollo, comentaron los investigadores.
-
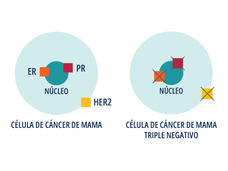
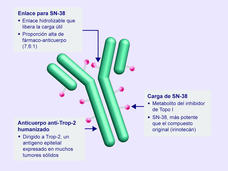
El sacituzumab govitecán recibió la aprobación definitiva para el tratamiento del cáncer de seno (mama) triple negativo
La FDA otorgó la aprobación definitiva al sacituzumab govitecán (Trodelvy) para las personas con cáncer de seno (mama) triple negativo localmente avanzado o metastásico. La actualización se hizo después de que la FDA otorgó la aprobación acelerada del medicamento el año pasado para las personas con este tipo de cáncer.
-
Se aprobó la terapia de células T con CAR dirigida al antígeno de maduración de células B (BCMA) para el mieloma múltiple
La Administración de Alimentos y Medicamentos (FDA) aprobó el idecabtagén vicleucel (Abecma) para tratar a algunas personas con mieloma múltiple. Esta aprobación surge, en parte, de los resultados de un estudio pequeño en el que el idecabtagén vicleucel achicó en parte o por completo los tumores en el 72 % de los pacientes.
-
Se espera que el relugolix cambie el tratamiento del cáncer de próstata avanzado
La Administración de Alimentos y Medicamentos (FDA) aprobó el relugolix (Orgovyx) y se prevé que afectará el tratamiento de los hombres con cáncer de próstata avanzado. En un estudio clínico grande se demostró que el relugolix es más eficaz para disminuir las concentraciones de testosterona que otro tratamiento común.
-
La FDA amplió la aprobación de una biopsia líquida en sangre para el cáncer
La Administración de Alimentos y Medicamentos (FDA) amplió los usos aprobados de una biopsia líquida en sangre llamada FoundationOne Liquid CDx que ayudará a los médicos a elegir tratamientos específicos para algunas personas con cáncer. Cuando se usa con este propósito, se llama prueba diagnóstica con fines terapéuticos.
-
La FDA aprueba dos pruebas que usan muestras de sangre para orientar el tratamiento del cáncer
Hace poco, la FDA aprobó dos biopsias líquidas en muestras de sangre que permiten obtener información genética para orientar las decisiones sobre el tratamiento de las personas con cáncer. En este artículo de Temas y relatos se describe las formas en que se usan estas pruebas y quiénes las pueden obtener.
-
La FDA aprobó la terapia de células T con CAR para el linfoma de células de manto
La Administración de Alimentos y Medicamentos (FDA) aprobó una terapia de células T con CAR llamada brexucabtagén autoleucel (Tecartus) para algunos pacientes con linfoma de células de manto. Esta es la tercera terapia de células T con CAR que la FDA aprueba para pacientes de cáncer.
-
La FDA otorga otra aprobación que afianza la función de la genómica en el tratamiento del cáncer
La aprobación que otorgó la FDA para el uso del pembrolizumab (Keytruda) en el tratamiento de personas con cáncer con carga mutacional del tumor alta destaca la importancia de las pruebas genómicas para guiar el tratamiento del cáncer, incluso en los niños, comenta el doctor Ned Sharpless, director del NCI.
-
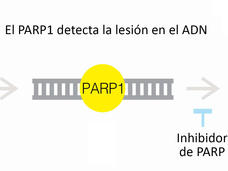
Cáncer de próstata: dos aprobaciones de la FDA inician la era del tratamiento con PARP
La FDA aprobó el olaparib (Lynparza) y el rucaparib (Rubraca) para el tratamiento de algunos hombres con cáncer de próstata metastásico. Los inhibidores de PARP se aprobaron para los hombres cuyos cánceres dejaron de responder al tratamiento hormonal y que tienen alteraciones genéticas específicas.
-
Se aprobó el sacituzumab govitecán para tratar el cáncer de seno (mama) metastásico triple negativo
La FDA aprobó el sacituzumab govitecán (Trodelvy) para tratar el cáncer de seno triple negativo que se diseminó a otras partes del cuerpo. El medicamento se aprobó para el uso en pacientes que ya recibieron al menos dos regímenes de tratamiento anteriores.
-
Se aprueba el uso del selpercatinib para el cáncer de tiroides y cáncer de pulmón con alteraciones en el gen RET
La FDA otorgó la aprobación acelerada del medicamento selpercatinib (Retevmo) para tratar a pacientes de cáncer de tiroides o cáncer de pulmón de células no pequeñas cuyos tumores presentan alteraciones en el gen RET. El medicamento, que impide la actividad de las proteínas RET, se aprobó a partir de los resultados del estudio LIBRETTO-001.
-
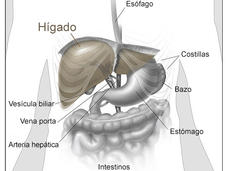
Se aprobó la combinación de atezolizumab y bevacizumab para tratar el cáncer de hígado
La FDA aprobó el atezolizumab (Tecentriq) y el bevacizumab (Avastin) como tratamiento inicial del cáncer de hígado avanzado en algunas personas. Esta es la primera aprobación en 13 años de un tratamiento que es más eficaz que el sorafenib, el estándar actual.