Aspectos generales de la genética del cáncer (PDQ®)–Versión para profesionales de salud
Introducción
[Nota: El Diccionario de genética del NCI contiene muchos de los términos médicos y científicos de este resumen. Al pulsar sobre un término con un enlace, aparece la definición en una ventana separada.]
[Nota: La comunidad del ámbito de la genética está poniendo en práctica una iniciativa común para modificar la terminología que se usa para describir la variabilidad genética. La tendencia es usar el término “variante” en lugar del término “mutación” para describir una diferencia identificada entre una secuencia de una persona o grupo en estudio y la secuencia de referencia, particularmente con relación a estas diferencias en la línea germinal. Además, las variantes se clasifican como benignas (inofensivas o inocuas), probablemente benignas, de significado incierto, probablemente patogénicas, o patogénicas (patógenas o causales de enfermedad). En este resumen, el término variante patogénica se utiliza para describir una mutación causal de la enfermedad. Para obtener más información consultar el Cuadro 1. Clasificación de las variantes de acuerdo a la patogenicidad.]
El cáncer tiene un origen multifactorial; hay factores genéticos, ambientales, médicos y de estilo de vida que interactúan y producen una neoplasia maligna determinada. El conocimiento de las características genéticas del cáncer ha aumentado rápidamente la comprensión del fundamento biológico de esta enfermedad, lo que facilita la detección de las personas en riesgo, mejora la caracterización de las neoplasias malignas, permite establecer tratamientos personalizados a partir de la huella molecular de la enfermedad, y conduce al desarrollo de nuevas modalidades terapéuticas. Como consecuencia, esta ampliación de la base teórica repercute en todos los aspectos del abordaje del cáncer, entre ellos, la prevención, los exámenes de detección y el tratamiento.
La información genética es un medio para identificar a las personas con un aumento del riesgo de cáncer. Las fuentes de información genética son las muestras biológicas de DNA, la información derivada de los antecedentes de la enfermedad en la historia familiar, los hallazgos del examen físico y los datos de la historia clínica. La información que se obtiene del DNA se puede recoger, almacenar y analizar en cualquier momento de la vida, incluso antes de la concepción y después de la muerte. La historia familiar a veces permite identificar a personas con un aumento modesto o moderado del riesgo de cáncer; en otras ocasiones es el primer paso para encontrar una predisposición hereditaria al cáncer que confiere un riesgo muy alto durante toda la vida. En un número creciente de enfermedades, es posible usar las pruebas de DNA para identificar variantes patogénicas específicas que explican el riesgo hereditario, y para determinar si los miembros de una familia heredaron la variante relacionada con la enfermedad.
La penetrancia es la proporción de personas portadoras de una variante patogénica que expresarán la enfermedad. En general, las variantes genéticas comunes que se asocian con una susceptibilidad al cáncer exhiben una penetrancia más baja que las variantes genéticas raras. Esto se ilustra en la Figura 1. En las enfermedades que inician en la edad adulta, la penetrancia a menudo se describe a partir de la edad y el sexo del portador. Por ejemplo, la penetrancia del cáncer de mama en mujeres portadoras de variantes patogénicas en BRCA1/BRCA2 a menudo se describe como "a la edad de 50 años" o "a la edad de 70 años". Ninguno de los diferentes métodos utilizados para calcular la penetrancia está exento de posibles sesgos. La determinación del riesgo de un portador específico conlleva cierto grado de imprecisión.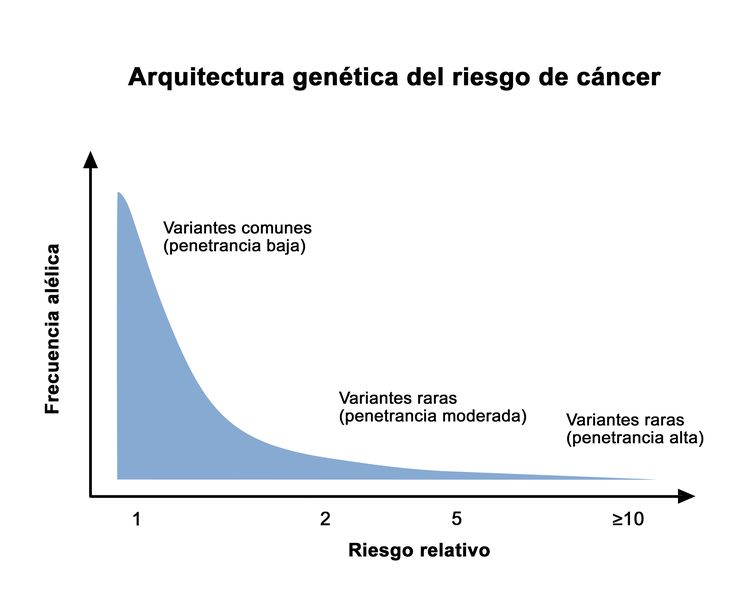
Las variantes genéticas o los cambios en la secuencia habitual de DNA de un gen determinado pueden tener efectos perjudiciales, beneficiosos, neutros o indeterminados sobre la salud, que se heredan como rasgos autosómicos dominantes, autosómicos recesivos o ligados al cromosoma X. En general, las variantes patogénicas que producen incapacidad grave desde el comienzo de la vida son raras pues conllevan efectos adversos que afectan la esperanza de vida y la reproducción. Sin embargo, si la variante patogénica se hereda de manera autosómica recesiva —es decir, si el efecto sobre la salud solo aparece cuando se heredan 2 copias de la variante (1 de cada progenitor) del gen alterado— los portadores de la variante patogénica (portadores sanos de 1 copia del gen alterado) son relativamente comunes dentro de la población general. En este contexto, por convención el término variante común se utiliza para describir una variante con una prevalencia del 1 % o superior. Algunas variantes patogénicas, entre ellas, variantes patogénicas que se sabe producen predisposición al cáncer en personas de edad mediana o avanzada, también son relativamente comunes. Muchos rasgos de predisposición al cáncer se heredan de manera autosómica dominante, es decir, la susceptibilidad al cáncer se presenta incluso cuando solo se hereda 1 copia del gen alterado. En el caso de las afecciones de herencia autosómica dominante, a menudo se usa el término portador en un sentido más coloquial para describir a las personas que heredaron la predisposición genética conferida por la variante patogénica. (Para obtener información detallada sobre los síndromes de susceptibilidad al cáncer que se conocen, consultar cada uno de los resúmenes del PDQ que tratan sobre las características genéticas de síndromes conocidos de susceptibilidad al cáncer).
Cada vez es más frecuente que el público general busque información en Internet acerca de la susceptibilidad genética y familiar al cáncer, además de información sobre las pruebas genéticas y la evaluación del riesgo genético. En algunas comunidades también se hace publicidad dirigida al consumidor de pruebas genéticas para el cáncer de mama y colon hereditarios. La amplia disponibilidad de información sobre el riesgo de cáncer hereditario causa preocupación en algunas personas que antes no conocían las implicaciones inherentes a su historia familiar. Es posible que esta información los lleve a consultar al médico de atención primaria para obtener consejos y recomendaciones. En muchos casos, la evaluación y el consejo serán relativamente sencillos para médicos con un conocimiento básico del cáncer familiar. En algunos pacientes quizás la evaluación sea más compleja, lo que exige la derivación a profesionales especializados en genética para obtener evaluación y asesoramiento.
Una de las funciones esenciales de los proveedores de atención primaria y de otros profesionales de la salud es la detección y clasificación correcta de las personas y las familias con un riesgo de cáncer elevado. Una vez que se identifican estas personas entonces se procede a remitirlos para que obtengan asesoramiento genético, evaluación del riesgo y se considere la necesidad de obtener pruebas genéticas, así como un plan de tratamiento. Cuando la historia familiar y los antecedentes personales ofrecen señales cardinales que apuntan a la presencia subyacente de un trastorno familiar o genético de susceptibilidad al cáncer (consultar la lista a continuación), entonces [1] se necesita evaluación adicional. (Para obtener más información sobre los componentes de la evaluación del riesgo genético de cáncer, consultar el resumen del PDQ Evaluación del riesgo de cáncer y asesoramiento genético).
A continuación se indican características del cáncer hereditario.
- Características del paciente:
- Más de 1 tumor primario en el mismo órgano.
- Tumores primarios en órganos diferentes.
- Tumores primarios bilaterales en órganos pares.
- Multifocalidad en el mismo órgano (por ejemplo, múltiples tumores en la misma mama, todos derivados de un tumor original único).
- Diagnóstico del tumor a menor edad que la habitual.
- Tumores de tipos histológicos infrecuentes.
- Tumores que se presentan en personas del sexo opuesto al que por lo general afecta (por ejemplo, cáncer de mama en varones).
- Tumores relacionados con otros rasgos genéticos.
- Tumores relacionados con anomalías congénitas.
- Tumores relacionados con una lesión precursora hereditaria.
- Tumores en personas que presentan otra enfermedad rara.
- Tumores en personas que exhiben lesiones cutáneas vinculadas con trastornos de susceptibilidad al cáncer (por ejemplo, genodermatosis).
- Características de la familia del paciente:
- 1 familiar de primer grado con el mismo tumor o un tumor relacionado y que exhibe una de las características mencionadas antes.
- 2 o más familiares de primer grado con tumores en el mismo sitio.
- 2 o más familiares de primer grado con tumores característicos de un síndrome de cáncer familiar conocido.
- 2 o más familiares de primer grado con tumores raros.
- 3 o más familiares en 2 generaciones diferentes que presentan tumores en el mismo sitio o en sitios que tienen un vínculo etiológico.
Establecer que una persona tiene un aumento del riesgo de cáncer tiene implicaciones importantes para poder implementar intervenciones específicas para reducir el riesgo y en algunos casos administrar tratamientos para prolongar la vida (por ejemplo, tamoxifeno para el cáncer de mama, colonoscopia para el cáncer de colon o una salpingooforectomía preventiva para el cáncer de ovario). A veces, la información sobre el riesgo de cáncer familiar también orienta a la persona en la planificación de su futuro (como decisiones de estilo de vida, atención médica y planificación familiar, entre otras). La información genética también puede brindar beneficio directo sobre la salud al indicar la ausencia de una susceptibilidad hereditaria al cáncer. Por ejemplo, cuando se sabe que una familia es portadora de una variante de predisposición al cáncer en un gen específico, es posible que un miembro de la familia reduzca su preocupación y los gastos en atención médica si el resultado de su prueba genética indica que no tiene la variante asociada a la enfermedad que porta el resto de la familia. Por el contrario, la información sobre el riesgo de cáncer familiar a veces produce efectos psicológicos o costos sociales (por ejemplo, preocupación, culpa o aumento de los gastos en atención médica). En ocasiones también cambia la dinámica familiar. Por ejemplo, con el fin de obtener un resultado informativo de una prueba genética quizás se necesite que uno o más miembros de una familia se sometan a pruebas, lo que a veces conlleva culpa en los progenitores por transmitir el riesgo hereditario a sus hijos.
El conocimiento de la presencia de una variante de predisposición al cáncer es un dato informativo no solo para la persona que se somete a la prueba sino para otros miembros de su familia. Es posible que familiares que antes no habían pensado en las implicaciones médicas de su historia familiar decidan hacerse pruebas genéticas, lo que brinda información más definitiva sobre su riesgo genético de cáncer. En familias afectadas, algunos familiares se enteran de su estado de portador sin hacerse pruebas ellos mismos, por ejemplo, cuando se concluye que un progenitor es un portador obligatorio porque se descubre que su hijo biológico es portador de una variante patogénica. El efecto fundador implica que se sabe que determinados grupos étnicos tienen una prevalencia más alta de ciertas variantes patogénicas; este conocimiento tiene utilidad clínica (permite un uso más racional de las pruebas genéticas) o puede ser estigmatizante. Las pruebas en ocasiones también indican la ausencia de paternidad biológica en una familia. Existe una posibilidad teórica de que la información genética se utilice de manera inapropiada y hay preocupación sobre discriminación durante el aseguramiento médico o la contratación laboral. La información genética también puede afectar las decisiones médicas y de estilo de vida.
Para consultar la evidencia relacionada con todos estos temas complementarios, consultar los resúmenes del PDQ sobre cada tema.
Bibliografía
- Lindor NM, McMaster ML, Lindor CJ, et al.: Concise handbook of familial cancer susceptibility syndromes - second edition. J Natl Cancer Inst Monogr (38): 1-93, 2008. [PUBMED Abstract]
Asesoramiento genético
El asesoramiento genético es el proceso de comunicación entre un profesional especializado en genética y sus pacientes. El objetivo del asesoramiento genético es brindar a las personas y sus familiares información sobre aspectos pertinentes de la salud genética, las pruebas de detección disponibles y las opciones de tratamiento. Además, durante el asesoramiento se brinda apoyo a medida que mejora la comprensión de la información, y el paciente pone en práctica esta información en su vida diaria. El asesoramiento genético por lo general abarca los siguientes 6 pasos:
- Evaluación de la historia familiar y los antecedentes médicos.
- Análisis de la información genética.
- Comunicación de la información genética.
- Educación sobre el patrón hereditario, las pruebas genéticas, el tratamiento, la reducción del riesgo, los recursos y las oportunidades de investigación.
- Asesoramiento y apoyo para facilitar la toma de decisiones informadas y la adaptación al riesgo o la afección.
- Seguimiento.[1]
La evaluación genética conlleva una interacción con un médico genetista u otro profesional especializado en genética. Además del asesoramiento genético, esta evaluación a veces incluye un examen físico y pruebas diagnósticas. Los componentes centrales de la filosofía del asesoramiento genético incluyen los siguientes principios: toma de decisiones informadas y voluntarias, asesoramiento que no sea dirigido ni coactivo, y protección de la confidencialidad y privacidad del consultante.[1-5] (Para obtener más información sobre la naturaleza y la historia del asesoramiento genético, consultar el resumen del PDQ Evaluación del riesgo de cáncer y asesoramiento genético).
A partir de la mitad de la década de los 90 y hasta la mitad de la primera década del 2000 se amplió el asesoramiento genético a fin de incluir conversaciones sobre las pruebas genéticas que determinan el riesgo de cáncer a medida que se descubrían más genes asociados con el riesgo de cáncer hereditario. El asesoramiento genético del cáncer a menudo, lo realiza un equipo multidisciplinario de profesionales de la salud que puede incluir, entre otros, un asesor genético, un profesional especializado en enfermería genética o un médico genetista; un profesional de la salud mental; y varios médicos especialistas en áreas como la oncología, la cirugía o la medicina interna. Es posible que el proceso de asesoramiento conlleve varias consultas diferentes para abordar los aspectos médicos, las pruebas genéticas y los temas psicosociales. Incluso cuando el asesoramiento del riesgo de cáncer lo solicita una persona, el riesgo de cáncer hereditario tiene implicaciones para toda la familia del consultante. Debido a que el riesgo genético afecta a un número desconocido de familiares biológicos del consultante, a menudo es esencial comunicarse con estos familiares de manera que se logre recopilar con exactitud la historia familiar y los antecedentes médicos. Es posible que durante el asesoramiento genético del cáncer participen varios miembros de la misma familia, algunos con antecedentes de cáncer y otros sin antecedentes.
El objetivo de la evaluación del riesgo y las pruebas genéticas de predisposición es mejorar los desenlaces. La evaluación del riesgo y las pruebas genéticas sirven para identificar a las personas en riesgo antes de que presenten un cáncer. Esto permite a los proveedores de atención de la salud diseñar un abordaje personalizado para el paciente de manera que se optimizan los desenlaces de salud a largo plazo. Por lo tanto, el proveedor de atención de la salud puede intervenir más temprano para disminuir el riesgo de cáncer, o para diagnosticar el cáncer en un estadio más temprano cuando las posibilidades de administrar un tratamiento eficaz son más altas. La información obtenida puede cambiar las recomendaciones terapéuticas y el seguimiento a largo plazo. Por ejemplo, quizás se utilice para modificar el abordaje terapéutico inicial del cáncer, aclarar el riesgo de otros tipos de cáncer o predecir la respuesta de un cáncer a formas de tratamiento específicas.
Bibliografía
- Resta R, Biesecker BB, Bennett RL, et al.: A new definition of Genetic Counseling: National Society of Genetic Counselors' Task Force report. J Genet Couns 15 (2): 77-83, 2006. [PUBMED Abstract]
- Baker DL, Schuette JL, Uhlmann WR, eds.: A Guide to Genetic Counseling. Wiley-Liss, 1998.
- Bartels DM, LeRoy BS, Caplan AL, eds.: Prescribing Our Future: Ethical Challenges in Genetic Counseling. Aldine de Gruyter, 1993.
- Kenen RH: Genetic counseling: the development of a new interdisciplinary occupational field. Soc Sci Med 18 (7): 541-9, 1984. [PUBMED Abstract]
- Kenen RH, Smith AC: Genetic counseling for the next 25 years: models for the future. J Genet Couns 4 (2): 115-24, 1995.
Síndromes familiares de susceptibilidad al cáncer
Los resúmenes del PDQ enfocados en las características genéticas de cánceres específicos contienen información detallada sobre muchos de los síndromes de susceptibilidad al cáncer que se conocen hasta el momento. Si bien no es una lista exhaustiva, a continuación se mencionan los síndromes de susceptibilidad al cáncer descritos en los resúmenes del PDQ en inglés sobre las características genéticas del cáncer (el título de los resúmenes se menciona entre paréntesis):
- Síndrome de nevo de células basales, síndrome de Gorlin, síndrome de Gorlin-Goltz o síndrome del carcinoma nevoide de células basales (Genética del cáncer de piel).
- Síndrome de Birt-Hogg-Dubé (Síndrome de Birt-Hogg-Dubé).
- Síndrome de Bloom (Genética del cáncer de piel).
- Cáncer de mama o cáncer ginecológico hereditarios (Genetics of Breast and Gynecologic Cancers).
- Síndrome de Brooke-Spiegler (Genética del cáncer de piel).
- Síndrome de Carney-Stratakis (Genetics of Endocrine and Neuroendocrine Neoplasias).
- Cáncer de colon hereditario no polipósico o síndrome de Lynch (Genetics of Colorectal Cancer).
- Síndrome de Cowden y síndrome de tumor hamartomatoso relacionado con PTEN (Genetics of Breast and Gynecologic Cancers; Genetics of Colorectal Cancer; Genética del cáncer de piel).
- Disqueratosis congénita (síndrome de Zinsser-Cole-Engman) (Genética del cáncer de piel).
- Epidermodisplasia verruciforme (Genética del cáncer de piel).
- Epidermólisis ampollosa (Genética del cáncer de piel).
- Cilindromatosis familiar (Genética del cáncer de piel).
- Anemia de Fanconi (Genética del cáncer de piel; Genetics of Breast and Gynecologic Cancers).
- Cáncer gástrico difuso y cáncer de mama lobulillar (Genetics of Breast and Gynecologic Cancers).
- Síndrome de Li-Fraumeni (Genetics of Breast and Gynecologic Cancers).
- Hiperparatiroidismo familiar (Genetics of Endocrine and Neuroendocrine Neoplasias).
- Cáncer de tiroides medular familiar (Genetics of Endocrine and Neuroendocrine Neoplasias).
- Melanoma hereditario (Genética del cáncer de piel).
- Síndrome de Muir-Torre (Genética del cáncer de piel).
- Síndrome de neoplasia endocrina múltiple de tipo 1 (Genetics of Endocrine and Neuroendocrine Neoplasias).
- Síndrome de neoplasia endocrina múltiple de tipo 2A, y de tipo 2B (síndrome de Sipple) (Genetics of Endocrine and Neuroendocrine Neoplasias).
- Tricoepitelioma múltiple familiar (Genética del cáncer de piel).
- Albinismo oculocutáneo (Genética del cáncer de piel).
- Oligopoliposis (Genetics of Colorectal Cancer).
- Paraganglioma hereditario (Genetics of Endocrine and Neuroendocrine Neoplasias).
- Feocromocitoma hereditario (Genetics of Endocrine and Neuroendocrine Neoplasias).
- Síndrome de Peutz-Jeghers (Genetics of colorectal Cancer; Genetics of Breast and Gynecologic Cancers).
- Poliposis, poliposis adenomatosa familiar y poliposis familiar adenomatosa atenuada (Genetics of Colorectal Cancer).
- Poliposis familiar juvenil (Genetics of Colorectal Cancer).
- Poliposis hereditaria mixta (Genetics of Colorectal Cancer).
- Poliposis asociada a MUTYH (Genetics of Colorectal Cancer).
- Poliposis serrada (Genetics of Colorectal Cancer).
- Cáncer de próstata hereditario.
- Cáncer de células renales hereditario con leiomiomas uterinos (Leiomiomatosis hereditaria y cáncer de células renales; Genética del cáncer de piel).
- Cáncer renal papilar hereditario (Carcinoma renal papilar hereditario).
- Síndrome de Rothmund-Thomson (Genética del cáncer de piel).
- Enfermedad de Von Hippel-Lindau (Enfermedad de Von Hippel-Lindau)
- Síndrome de Werner (Genética del cáncer de piel).
- Xeroderma pigmentoso (Genética del cáncer de piel).
Métodos para el análisis genético y el descubrimiento de genes
Los métodos en esta sección brindan información breve sobre el origen del análisis genético y las estrategias de descubrimiento que se han usado durante los últimos 10 a 15 años con el fin de identificar genes de susceptibilidad a enfermedades. Estos métodos llevaron al descubrimiento de importantes genes del cáncer, como BRCA1, BRCA2 y otros genes vinculados con el riesgo de cáncer de mama. Desde entonces, se produjo una transición en los métodos que se emplean para el análisis genético, de manera que ahora se utilizan métodos de secuenciación de última generación que se describen en la sección Secuenciación clínica en este resumen.
Análisis de ligamiento
Desde que se reconoció que el cáncer se agrupa dentro de las familias, los investigadores han recopilado datos de familias con múltiples casos de cáncer. El objetivo de estos investigadores es ubicar los genes de susceptibilidad al cáncer mediante estudios de ligamiento o vinculación.
Estos estudios normalmente se hacen en familias y parientes que exhiben un riesgo alto debido a que se han identificado múltiples casos de una enfermedad específica dentro de la familia. El objetivo de los estudios de ligamiento es identificar genes de susceptibilidad a la enfermedad. En el análisis de ligamiento se realiza una comparación estadística de los genotipos entre las personas afectadas y las personas no afectadas. El análisis de ligamiento también sirve para comprobar que los marcadores genéticos conocidos se heredaron junto con el rasgo de la enfermedad. La identificación de este tipo de evidencia (ligamiento) aporta datos estadísticos de que la región cromosómica cercana al marcador genético conocido también alberga un gen de susceptibilidad a la enfermedad. Después de que se identifica una región genómica de interés mediante el análisis de ligamiento, se necesitan más estudios para comprobar la presencia de un gen de susceptibilidad en esta posición. Los siguientes factores afectan el análisis de ligamiento:
- Tamaño familiar y suficientes miembros de la familia que proporcionen muestras de DNA.
- Número de casos de la enfermedad en cada familia.
- Factores relacionados con la edad de inicio de la enfermedad (por ejemplo, uso de exámenes de detección).
- Diferencias en el riesgo de enfermedad a partir del sexo (irrelevante en tipos de cáncer específicos de determinado sexo).
- Heterogeneidad de la enfermedad entre los casos (por ejemplo, fenotipo de gran malignidad vs fenotipo de poca malignidad).
- Exactitud o veracidad de la información de la historia familiar.
- Prevalencia de fenocopias.
Otro problema de los estudios de ligamiento es la tasa de incidencia de fondo de cáncer esporádico en el contexto de los estudios familiares. Por ejemplo, el riesgo de un hombre de presentar cáncer de próstata durante toda la vida es de 1 en 8,[1] debido a esto es posible que en las familias en estudio se presenten ambos tipos de casos de cáncer de próstata: casos hereditarios y casos esporádicos. Es decir, que es posible que un varón presente cáncer de próstata incluso si no heredó el gen de susceptibilidad presente en su familia. Por lo tanto, en los estudios se ha buscado resolver las incongruencias de los datos de ligamiento al exigir el uso de criterios de inclusión estrictos que definan la enfermedad como clínicamente significativa. [2-6] Este abordaje tiene como fin definir un conjunto homogéneo de casos o familias con el fin de aumentar la posibilidad de identificar una señal de ligamiento.
Estudios de asociación del genoma completo
Los estudios de asociación del genoma completo (GWAS) permiten encontrar alelos de susceptibilidad comunes que tienen penetrancia baja para muchas enfermedades complejas,[7] como el cáncer. Este método contrasta con el de los análisis de ligamiento, en donde se buscan variantes de riesgo genético cosegregadas en familias con una prevalencia alta de la enfermedad. Mientras que los análisis de ligamiento se llevan a cabo para descubrir variantes raras de penetrancia alta que se segregan con una distribución hereditaria predecible (por ejemplo, herencia autosómica dominante, autosómica recesiva, ligada al cromosoma X y mitocondrial), los GWAS son más apropiados para descubrir múltiples polimorfismos genéticos comunes de penetrancia baja. Los GWAS se realizan con la premisa de que los fundamentos genéticos de fenotipos complejos, por ejemplo, cáncer de próstata, se rigen por la presencia de muchos alelos y que cada uno de ellos confiere un riesgo modesto. La mayoría de los polimorfismos genéticos genotipados en los GWAS son comunes, con frecuencias alélicas que superan del 1 al 5 % en ciertas poblaciones (por ejemplo, hombres de ascendencia europea). Los GWAS capturan una gran porción de la variabilidad común en todo el genoma.[8,9] La correlación sólida entre muchos alelos cercanos dentro de un cromosoma se conoce como desequilibrio de ligamiento. Esto permite la “exploración” del genoma sin tener que examinar los 10 millones de polimorfismos de un solo nucleótido (SNP) conocidos. En cada estudio de GWAS, se examinan entre 1 y 5 millones de SNP, por lo tanto se evalúan casi todas las variantes hereditarias comunes en el genoma.
En los GWAS, la frecuencia alélica de cada SNP se compara entre los casos y los controles. Las señales prometedoras —cuya frecuencia alélica es significativamente diferente entre los casos y los controles— se validan en cohortes de replicación. Con el fin de obtener un poder estadístico apropiado para identificar las variantes asociadas con un fenotipo, es necesario estudiar una gran cantidad de casos y controles, por lo general, miles en cada grupo. Debido a que en un GWAS se analizan hasta 1 millón de SNP, cuando se utilizan los límites estadísticos habituales se espera que ocurran resultados positivos falsos. Por lo tanto, se emplean reglas estadísticas más estrictas para definir un hallazgo positivo, por lo general se usa un límite de P < 1 × 10-7.[10-12]
Hasta la fecha, en los GWAS con poder estadístico adecuado se han encontrado cientos de variantes relacionadas con el riesgo de cáncer que han sido validadas en cohortes independientes.[13] Estos estudios han revelado asociaciones uniformes entre variantes hereditarias específicas y el riesgo de cáncer. No obstante, los resultados se deben matizar teniendo en cuenta las siguientes consideraciones importantes:
- Hasta el momento los GWAS conocidos se han diseñado para identificar polimorfismos genéticos relativamente comunes. Es muy improbable que un alelo con frecuencia alta en la población contribuya por sí solo de manera sustancial al riesgo de cáncer. Esto, junto con la naturaleza poligénica de la carcinogénesis, implica que la contribución de cualquier variante identificada hasta el momento en los GWAS es muy pequeña, por lo general con una oportunidad relativa de riesgo de enfermedad de menos de 1,3. A pesar de la búsqueda de polimorfismos comunes en el genoma completo de decenas de miles de casos y controles, hasta ahora los resultados de los GWAS no explican ni siquiera la mitad del componente genético del riesgo de cáncer.[14]
- Las variantes descubiertas en los GWAS probablemente no afecten de manera directa el riesgo de enfermedad. Como ya se mencionó, los SNP se encuentran en bloques de desequilibrio de ligamiento y tan solo son indicadores indirectos de un conjunto de variantes —conocidas o desconocidas— dentro de un bloque específico. El alelo causal está en alguna parte de ese bloque de desequilibrio de ligamiento.
- La mezcla de grupos de ascendencia diferente a menudo confunde los resultados de un GWAS (por ejemplo, un resultado estadísticamente significativo quizás refleje un número excesivamente alto de personas en el grupo de casos versus el grupo de control, en lugar de reflejar una asociación verdadera con la enfermedad). Por lo tanto, los GWAS suelen tener más capacidad para analizar un solo grupo con una ascendencia predominante. Como consecuencia, algunas poblaciones no cuentan con una representación apropiada en los análisis del genoma completo.
- La importancia clínica de las variantes identificadas en los GWAS todavía está por aclararse. [15-17]
Las repercusiones de estos aspectos se analizan con más detalle en los siguientes resúmenes en inglés del PDQ: Genetics of Breast and Gynecologic Cancers; Genetics of Colorectal Cancer y Genetics of Prostate Cancer.[18]
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2024. American Cancer Society, 2024. Available online. Last accessed December 30, 2024.
- Stanford JL, McDonnell SK, Friedrichsen DM, et al.: Prostate cancer and genetic susceptibility: a genome scan incorporating disease aggressiveness. Prostate 66 (3): 317-25, 2006. [PUBMED Abstract]
- Chang BL, Isaacs SD, Wiley KE, et al.: Genome-wide screen for prostate cancer susceptibility genes in men with clinically significant disease. Prostate 64 (4): 356-61, 2005. [PUBMED Abstract]
- Lange EM, Ho LA, Beebe-Dimmer JL, et al.: Genome-wide linkage scan for prostate cancer susceptibility genes in men with aggressive disease: significant evidence for linkage at chromosome 15q12. Hum Genet 119 (4): 400-7, 2006. [PUBMED Abstract]
- Cancer risks in BRCA2 mutation carriers. The Breast Cancer Linkage Consortium. J Natl Cancer Inst 91 (15): 1310-6, 1999. [PUBMED Abstract]
- Easton DF, Bishop DT, Ford D, et al.: Genetic linkage analysis in familial breast and ovarian cancer: results from 214 families. The Breast Cancer Linkage Consortium. Am J Hum Genet 52 (4): 678-701, 1993. [PUBMED Abstract]
- Wellcome Trust Case Control Consortium: Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls. Nature 447 (7145): 661-78, 2007. [PUBMED Abstract]
- The International HapMap Consortium: The International HapMap Project. Nature 426 (6968): 789-96, 2003. [PUBMED Abstract]
- Thorisson GA, Smith AV, Krishnan L, et al.: The International HapMap Project Web site. Genome Res 15 (11): 1592-3, 2005. [PUBMED Abstract]
- Evans DM, Cardon LR: Genome-wide association: a promising start to a long race. Trends Genet 22 (7): 350-4, 2006. [PUBMED Abstract]
- Cardon LR: Genetics. Delivering new disease genes. Science 314 (5804): 1403-5, 2006. [PUBMED Abstract]
- Chanock SJ, Manolio T, Boehnke M, et al.: Replicating genotype-phenotype associations. Nature 447 (7145): 655-60, 2007. [PUBMED Abstract]
- Chang CQ, Yesupriya A, Rowell JL, et al.: A systematic review of cancer GWAS and candidate gene meta-analyses reveals limited overlap but similar effect sizes. Eur J Hum Genet 22 (3): 402-8, 2014. [PUBMED Abstract]
- Ioannidis JP, Castaldi P, Evangelou E: A compendium of genome-wide associations for cancer: critical synopsis and reappraisal. J Natl Cancer Inst 102 (12): 846-58, 2010. [PUBMED Abstract]
- Park JH, Gail MH, Greene MH, et al.: Potential usefulness of single nucleotide polymorphisms to identify persons at high cancer risk: an evaluation of seven common cancers. J Clin Oncol 30 (17): 2157-62, 2012. [PUBMED Abstract]
- Lindström S, Schumacher FR, Cox D, et al.: Common genetic variants in prostate cancer risk prediction--results from the NCI Breast and Prostate Cancer Cohort Consortium (BPC3). Cancer Epidemiol Biomarkers Prev 21 (3): 437-44, 2012. [PUBMED Abstract]
- Wacholder S, Hartge P, Prentice R, et al.: Performance of common genetic variants in breast-cancer risk models. N Engl J Med 362 (11): 986-93, 2010. [PUBMED Abstract]
- Jorgenson E, Witte JS: Genome-wide association studies of cancer. Future Oncol 3 (4): 419-27, 2007. [PUBMED Abstract]
Secuenciación clínica
Introducción
Los métodos de secuenciación del genoma a gran escala, como los análisis multigénicos, la secuenciación del exoma completo (WES) y la secuenciación del genoma completo (WGS), se están desarrollando rápidamente y empleando cada vez más en una variedad de entornos asistenciales oncológicos, como la terapéutica oncológica y la evaluación del riesgo de cáncer. Varias organizaciones y empresas ofrecen secuenciación tumoral, y algunas de ellas están desarrollando programas de medicina personalizada de precisión para secuenciar genomas de tumores a fin de identificar alteraciones genéticas iniciadoras para usar como dianas terapéuticas en beneficio de los pacientes.[1-3] En muchos de estos abordajes basados en el tumor, se usan secuencias del DNA de línea germinal como referencia para diferenciar los cambios en el DNA que solo se presentan en el tumor de aquellos que posiblemente son de origen hereditario. En el entorno del asesoramiento genético y la evaluación del riesgo de cáncer, cada vez, es más común el uso de pruebas multigénicas para evaluar el riesgo de cáncer hereditario. Quizás en un futuro cercano estas pruebas se consideren rutinarias gracias a que varias organizaciones y empresas ofrecen pruebas multigénicas para detectar alteraciones en una serie de genes asociados con riesgo de cáncer.
Estos avances en las técnicas de secuenciación génica también permiten identificar variantes en genes relacionados con la indicación principal por la que se recomendaron las pruebas de secuenciación genética, junto con otros hallazgos no relacionados con el trastorno en estudio. Estos últimos datos genéticos se conocen como hallazgos imprevistos o secundarios, y en el momento son objeto de debate de tipo clínico, ético, legal y de asesoramiento. El American College of Medical Genetics and Genomics (ACMG) y la Presidential Commission for the Study of Bioethical Issues han publicado documentos que abordan algunos de estos temas y brindan orientación y recomendaciones para su uso.[4-7] Sin embargo, aún persiste la controversia acerca del tipo de resultados y cuando se deben comunicar al paciente y a sus proveedores de atención de la salud. Esta sección se elaboró para brindar información sobre las técnicas de secuenciación genómica en el entorno de la secuenciación clínica, y destaca áreas adicionales de incertidumbre clínica que exigen más investigación y nuevos abordajes.
Antecedentes
Las técnicas de secuenciación del DNA han evolucionado de manera rápida, en especial desde 2005 cuando se introdujo la tecnología de secuenciación masiva en paralelo o la secuenciación de última generación (NGS).[8]
La secuenciación de Sanger automatizada se considera la primera generación de técnicas de secuenciación.[9] El método de Sanger para la secuenciación de genes de cáncer incluye la amplificación de las regiones genéticas de interés mediante reacción en cadena de la polimerasa (PCR) seguida por secuenciación de los productos de la PCR usando terminadores marcados con fluorescencia, separación de los productos por electroforesis capilar y detección de la señal de la secuencia de nucleótidos usando un láser.[10,11] Aunque es una técnica de secuenciación exacta, las limitaciones principales de la secuenciación de Sanger son el rendimiento bajo, la capacidad limitada para secuenciar al mismo tiempo más de unos pocos genes, y la incapacidad de detectar reordenamientos estructurales.[10]
La NGS incluye las técnicas de secuenciación del DNA de rendimiento alto que son capaces de procesar en paralelo múltiples secuencias de DNA.[11] Aunque hay diferencias en las plataformas que se utilizan para generar el molde y consultar la secuencia, el método general de las técnicas de NGS implica cortar e inmovilizar las moléculas de la plantilla de DNA en una superficie sólida, lo que permite la separación de las moléculas para obtener reacciones de secuenciación simultáneas (millones a miles de millones) en paralelo.[10,12] Por lo anterior, las principales ventajas de las técnicas de NGS son la capacidad de secuenciar miles de genes al mismo tiempo y con un costo más bajo, y la capacidad de detectar múltiples tipos de alteraciones genómicas, como inserciones, deleciones, alteraciones en el número de copias y reordenamientos.[10] Las limitaciones de esta técnica incluyen la posibilidad de que se omitan regiones génicas específicas, un tiempo prolongado en procesar resultados (si bien está disminuyendo), y la necesidad de tener un apoyo informático para manejar la cantidad masiva de datos genéticos, lo que retrasa la capacidad de secuenciación. La falta de una infraestructura informática avanzada para conservar, procesar y analizar la gran cantidad de datos genéticos es un obstáculo bien conocido para el empleo de los datos de la NGS. La cantidad de las variantes obtenidas de la NGS es exponencial; los métodos bioinformáticos deben ser capaces de evaluar las variantes genéticas en cuanto a sus posibles consecuencias funcionales en los aspectos biológicos de la enfermedad. También es necesario contar con canales bioinformáticos fáciles de usar para analizar e integrar los datos genéticos obtenidos a fin de influenciar a la comunidad científica y médica.[11,13]
Los siguientes términos se definen con el fin de comprender mejor las aplicaciones clínicas de las pruebas de NGS y de los resultados notificados.
- Variante genética: alteración en la secuencia más común de nucleótidos de DNA. El término variante se utiliza para describir una alteración que puede ser benigna, patogénica o de significado incierto. El término variante cada vez se usa más en lugar del término mutación, particularmente para las alteraciones en la línea germinal. En el Cuadro 1 se clasifican las secuencias variantes de acuerdo con la capacidad de producir enfermedad.[6]
- Variante de la línea germinal: cambio génico en una célula reproductora (óvulo o espermatozoide) que se incorpora en el DNA de todas las células de la descendencia. Una variante dentro de la línea germinal pasa del progenitor a su descendencia, por lo tanto, es hereditaria.
- Mutación somática: alteración en el DNA que ocurre después de la concepción y no se encuentra en la línea germinal. Las mutaciones somáticas ocurren en cualquier célula del cuerpo, excepto en las células germinales (espermatozoides y óvulos) y por lo tanto, no se transmiten a la descendencia. En ocasiones, las mutaciones somáticas causan cáncer y otras enfermedades.
- Hallazgos secundarios: resultados de las pruebas genéticas que no se relacionan con la indicación por la que se hizo la secuenciación del exoma o del genoma, pero que quizás sean de importancia médica o sean útiles para el médico que ordenó la prueba, el paciente o la familia del paciente. (Adaptación de ACMG [4]). El ACMG ha adoptado el término hallazgo secundario en lugar de hallazgo imprevisto como nomenclatura estándar.
- Información genética aplicable: conocimiento de la presencia o ausencia de una variante genética en un tumor o de la línea germinal y que sirve para orientar el abordaje clínico. (Adaptación de Dancey et al.[1]).
| Tipo de variante | Descripción |
|---|---|
| Adaptación de Richards et al.[6] | |
| Patogénica | Participa de manera directa en el desarrollo de una enfermedad. No se anticipa que la clasificación de esta variante sea modificada a partir de evidencia nueva. [Nota: No todas las variantes patogénicas exhiben penetrancia completa.] |
| Probablemente patogénica | Es muy probable que participe en el desarrollo de una enfermedad, pero hasta el momento la evidencia científica no es suficiente para comprobarlo de manera concluyente. |
| Significado incierto | Hasta el momento no hay suficiente información para respaldar una clasificación más definitiva de este tipo de variante. |
| Probablemente benigna | Se piensa que no produce un efecto patógeno importante, pero hasta el momento la evidencia científica no es suficiente para comprobarlo de manera concluyente. |
| Benigna | No causa enfermedad. No se anticipa que la clasificación de esta variante sea modificada a partir de evidencia nueva. |
Aplicaciones clínicas novedosas
La NGS tiene varias posibles aplicaciones clínicas. En oncología, las 2 aplicaciones dominantes son las siguientes: 1) evaluación de las alteraciones somáticas en los tumores con el fin de orientar el pronóstico y el tratamiento; 2) evaluación de la línea germinal para identificar alelos relacionados con riesgo de cáncer.
Pruebas somáticas
Se utilizan una multiplicidad de métodos para identificar las alteraciones somáticas en los tumores. Con las pruebas multigénicas dirigidas, se evalúan varios genes al mismo tiempo. Estas pruebas multigénicas dirigidas abarcan grupos de genes diferentes que se ajustan según el tipo de tumor específico. Las pruebas multigénicas dirigidas restringen los datos que se analizan y abarcan solo genes conocidos, lo que simplifica la interpretación en comparación con los métodos de evaluación del exoma o el genoma completo. Además, una prueba multigénica dirigida permite obtener mayor profundidad de cobertura que las pruebas de WES o WGS. La profundidad de cobertura se refiere al número de veces que un nucleótido se ha secuenciado; a mayor profundidad de cobertura, menores errores de secuenciación. La profundidad de cobertura también ayuda a diferenciar los polimorfismos de un solo nucleótido de los errores de secuenciación.
La WES y la WGS son métodos más exhaustivos y su objetivo es descubrir variantes de genes conocidos y de otros genes de los que no se sospechaba que fueran relevantes antes de hacer el análisis. El descubrimiento de una variante inesperada en un tipo de tumor específico a veces conlleva al empleo de un tratamiento dirigido a esta variante lo que contribuye a mejorar el pronóstico del paciente. La WES produce datos de secuenciación de las regiones codificadoras del genoma (cerca del 1 % del genoma humano), en lugar del genoma completo (WGS). Como consecuencia, la WES es menos costosa que la WGS.
Las variantes no codificantes se identifican mediante WGS pero no mediante WES. Los factores que limitan el uso de la WGS son el costo y la gran capacidad bioinformática necesaria para su interpretación. Si bien el costo de la secuenciación ha bajado rápidamente, el análisis todavía es una tarea descomunal.[14]
Aunque el objetivo de la WES y la WGS es mejorar la atención del paciente mediante la detección de variantes genéticas aplicables (mutaciones como objetivo terapéutico), hay varios aspectos que exigen análisis. Es posible que en estas pruebas se detecten variantes patogénicas, variantes de significado incierto o que no se detecten anormalidades. Además, a veces se encuentran variantes patogénicas en genes que se piensa que tienen un vínculo claro con la carcinogénesis, pero otras veces las variantes se encuentran en genes de los que no se conoce su importancia (especialmente, con los métodos de WES y WGS). Las variantes de significado incierto tienen implicaciones inciertas, porque no siempre afectan el funcionamiento de la proteína. La definición de los términos aplicable o accionable varía; a menudo estos términos se usan cuando se detecta una anomalía que conduce a formular recomendaciones para evitar determinados tratamientos (como las variantes en RAS), y para las que se dispone de un ensayo clínico o de tratamientos con un fármaco dirigido conocido. Aunque hay informes de resultados favorables con este abordaje, casi nunca es tan sencillo. En la actualidad continúan los estudios sobre este tema.
Algunas pruebas comerciales y de instituciones individuales analizan solamente el tumor. Las variantes claramente patogénicas en genes importantes que se encuentran en el tumor pueden tener un origen somático o un origen en la línea germinal. Cuando se parea el análisis somático con el análisis de la línea germinal, entonces es posible determinar si la alteración identificada es hereditaria. En un estudio en el que se estimó la prevalencia de variantes de la línea germinal en pacientes sometidos a secuenciación del tumor y se pareó la información con secuenciación del DNA normal, se identificaron genes de susceptibilidad al cáncer en 198 de 1566 personas (12,6 %). Solo 81 de 198 personas (40,9 %) exhibían variantes patogénicas en los genes de susceptibilidad al cáncer que eran compatibles con el tipo de tumor. Cuando el análisis se amplió para incluir genes propios de enfermedades no neoplásicas conocidas con herencia mendeliana, se encontró que 246 de 1566 personas (15,7 %) exhibían variantes de la línea germinal patogénicas o posiblemente patogénicas.[15]
La secuenciación tumoral, a veces, lleva a identificar variantes patogénicas hereditarias (de la línea germinal).[16] Las variantes patogénicas con efecto fundador en genes de susceptibilidad al cáncer bien caracterizados son indicadoras potentes de una variante patogénica de la línea germinal. Un tumor con un fenotipo hipermutado puede indicar que hay un defecto constitucional subyacente en la reparación del DNA. Las características clínicas compatibles con una predisposición genética específica, como la historia familiar, una edad temprana en el momento del diagnóstico, o un tipo tumoral específico, también pueden generar la sospecha de que hay una variante de la línea germinal que se correlaciona con una variante en el tumor. Una fracción alélica alta para la variante también es indicadora de una variante de la línea germinal. Todos estos factores indican la utilidad del asesoramiento genético y la utilización de pruebas genéticas de la línea germinal que sean posiblemente confirmatorias.
La ausencia de una variante en un gen evaluado en una prueba somática no descarta la presencia de una susceptibilidad hereditaria. Todos los pacientes con una historia familiar compatible con un cáncer hereditario deben considerar someterse a pruebas de la línea germinal sin importar los resultados de las pruebas somáticas.
En ensayos clínicos en curso, como el Estudio de Análisis Molecular para Opciones de Terapia del NCI (MATCH), se está evaluando la importancia de la secuenciación somática para encontrar dianas aplicables. La secuenciación de la línea germinal es un componente del estudio mencionado.
Pruebas de la línea germinal
El objetivo de las pruebas de la línea germinal es identificar variantes patogénicas asociadas con el riesgo hereditario de cáncer y orientar las decisiones de la atención sanitaria según el riesgo de cáncer. Además, las pruebas de la línea germinal también sirven para tomar decisiones sobre el tratamiento en el momento del diagnóstico (por ejemplo, decisiones sobre el tipo de colectomía en pacientes con un cáncer de colon relacionado con el síndrome de Lynch, o una mastectomía contralateral en portadoras de variantes patogénicas de BRCA1/BRCA2). Asimismo, cada vez hay más información de que el estado de la línea germinal ayuda a determinar el tratamiento sistémico (por ejemplo, el uso de cisplatino o de inhibidores de la poli-[ADP-ribosa]–polimerasa [PARP] en tipos de cáncer vinculados con BRCA1/BRCA2).
Hasta el momento, la mayoría de las pruebas genéticas de la línea germinal se han obtenido de manera dirigida para identificar variantes en genes que se sabe se relacionan con el cuadro clínico (por ejemplo, BRCA1 y BRCA2 en cáncer de mama y de ovario hereditario; o genes relacionados con la reparación de los errores de emparejamiento [MMR] en el síndrome de Lynch). No obstante, las pruebas comerciales multigénicas o las que se usan en organizaciones específicas contienen diferentes grupos de genes. Algunas pruebas se dirigen a todos los tipos de cáncer, otras son específicas para determinados tipos (por ejemplo, cáncer de mama, colon o próstata). Los genes analizados en las pruebas multigénicas abarcan genes de penetrancia alta relacionados con un tumor específico (como BRCA1/BRCA2 en la prueba para el cáncer de mama); genes de penetrancia alta relacionados con un tipo de cáncer diferente pero que acarrean un riesgo moderado para el tumor de referencia (como CDH1 o MSH6 en la prueba para el cáncer de mama); y genes de penetrancia moderada con utilidad clínica incierta (como NBN en la prueba para el cáncer de mama). Debido a que estas pruebas incluyen muchos genes, se anticipa que se encuentre por lo menos una variante de significado incierto en la mayoría o quizás en todas las personas que se someten a ellas. Como no es posible establecer un modelo estándar para el asesoramiento genético previo a las pruebas de grupos de 20 genes, se hace necesario crear nuevos modelos de asesoramiento. Hay temas no resueltos, como los aspectos éticos de la posibilidad de que los pacientes decidan excluir resultados específicos (por ejemplo, TP53 o CDH1 en cáncer de mama) y la manera cómo se aplicaría en la práctica clínica.
Para obtener más información sobre el uso de las pruebas multigénicas consultar la sección Análisis multigénicos en el resumen del PDQ Evaluación del riesgo de cáncer y asesoramiento genético.
Es posible comprar una prueba comercial de WES para la susceptibilidad al cáncer hereditario. Es probable que se obtengan hallazgos secundarios. El abordaje de estos resultados está en evolución.
Gobernanza, interpretación y supervisión institucional de la secuenciación de última generación
En el modelo ACCE se usan 4 componentes principales para evaluar las pruebas genéticas nuevas: validez analítica, validez clínica, utilidad clínica, y aspectos éticos, legales y sociales.[17]
- La validez analítica refleja la exactitud y la fiabilidad de la medición del genotipo.
- La validez clínica se refiere a la exactitud del resultado (como una variación genética) para predecir el desenlace de interés (como es el riesgo de cáncer).
- La utilidad clínica se determina al analizar si el desenlace del paciente mejora al conocerse el resultado de la prueba. En 2015, el ACMG publicó una declaración de política sobre la necesidad de ampliar la definición de la utilidad clínica de manera que abarcase la utilidad de los servicios de genética y genómica para pacientes individuales, la familia y la sociedad.[5]
- Es posible que con cada nueva prueba genética, surjan nuevos aspectos éticos, legales y sociales, incluso temas relacionados con el consentimiento informado.
El modelo ACCE se ha adoptado a nivel mundial para la evaluación de las pruebas genéticas.
El empleo de las NGS presenta varios niveles de complejidad en el ámbito clínico. Desde un punto de vista técnico, las mejoras en las técnicas de secuenciación han permitido secuenciar el genoma completo, no solo el exoma. Se espera que la secuenciación exómica y genómica de un tumor o de tejido normal se vuelva rutinaria a medida que el costo disminuye.
Con el uso rutinario de WGS surgen grandes desafíos para la interpretación. El desafío más destacado es la clasificación de las variaciones de la secuencia en genes de predisposición al cáncer ya conocidos según su repercusión: variantes patológicas, variantes inofensivas o variantes que exigen más evaluación para determinar su significado. Este desafío no es nuevo. Varios grupos han formulado procesos para la interpretación y la gestión de la base de datos en crecimiento que contiene las variantes y su significado, y que continúa creciendo. Por ejemplo, la International Society for Gastrointestinal Hereditary Tumors en colaboración con el Human Variome Project y el International Mismatch Repair Consortium plantearon un proceso para los genes de MMR.
Estos procesos quizás sean útiles como punto de partida para afrontar el nuevo desafío de interpretar el significado de las variaciones en la secuencia de genes cuya función es incierta o indeterminada en la regulación de la progresión neoplásica o en otras enfermedades. Hay laboratorios comerciales que han desarrollado pruebas multigénicas de predisposición al cáncer más amplias con su propio proceso para interpretación. Las pruebas multigénicas cada vez son más amplias e incluyen genes de significado incierto, de manera que la gobernanza del proceso de interpretación exige que las instituciones académicas, que ofrecen pruebas multigénicas propias o utilizan pruebas comerciales externas, creen un proceso voluntario de gestión de la garantía de calidad para el rendimiento e interpretación de las pruebas (que incluya aspectos de las Enmiendas para el Mejoramiento de Laboratorios Clínicos [CLIA], cuando sea necesario).
El ACMG ha publicado las siguientes recomendaciones para lograr la transparencia en la interpretación y la notificación de los hallazgos secundarios:[4,18]
- El laboratorio debe notificar al profesional que solicitó la prueba las variantes constitucionales en cualquier gen de una lista de 56 genes, sin importar la indicación para la secuenciación clínica ni la edad del paciente. Lo anterior incluye la muestra normal del par de muestras secuenciadas: muestra del tumor y muestra del tejido normal. Los pacientes pueden renunciar a este análisis después de que comprendan claramente las implicaciones de esta decisión, y siempre y cuando pasen por un proceso detallado de consentimiento informado antes de la secuenciación clínica.
- Solo se deben notificar las variantes reconocidas causales de un trastorno, o las variantes que no se conocen, pero que se piensa son causa de un trastorno.
- Cuando se obtiene una secuenciación de escala genómica, un profesional de la salud experto en genética debe documentar el proceso de consentimiento informado, registrar la naturaleza de la prueba, y abordar diferentes aspectos como la incertidumbre de la interpretación, la privacidad, las repercusiones familiares y la presencia de hallazgos secundarios.
- Los profesionales deben conocer a fondo los atributos básicos y las limitaciones de la secuenciación clínica.
- El ACMG, trabajando con expertos en contenido y otras organizaciones profesionales, debe continuar clarificando y actualizando estas recomendaciones cada año.
Todavía persiste la preocupación de que la notificación rutinaria de las variantes de la línea germinal en el entorno de la secuenciación tumoral exigirá la revisión de los resultados de los laboratorios por parte de expertos en genoma de la línea germinal y genoma tumoral, lo que aumentaría el costo, el trabajo del laboratorio y el tiempo de entrega de los resultados. La naturaleza de las conversaciones entre oncólogos y pacientes cambiará para incorporar los múltiples aspectos que abarcan las pruebas de la línea germinal y los posibles resultados de estas. Es posible que las conversaciones previas y posteriores a la prueba exijan la participación de asesores genéticos o genetistas, que actualmente son un recurso humano escaso en las prácticas oncológicas. En recientes declaraciones de expertos se mencionó que se necesita más información sobre los beneficios de la notificación a los pacientes oncológicos de los resultados secundarios de la línea germinal cuando también se obtienen pruebas de secuenciación tumoral. Además, se indicó la necesidad de recomendaciones por expertos de la comunidad del ámbito de la genética y la oncología.[19]
El proceso de desarrollo está en una etapa muy incipiente como para que esto se pueda supervisar a nivel institucional. Por ejemplo, un centro oncológico de gran volumen implementó los siguientes procesos:
- Cuando se analiza el tejido tumoral con fines de investigación, se pregunta a los pacientes si dan su consentimiento para someterse a un grupo numeroso de pruebas en tejido somático (tumoral) que se acompañan de las mismas pruebas en tejido constitucional (normal). Las actividades clave durante la investigación abarcan la evaluación de las diferencias en el pronóstico y la respuesta al tratamiento a partir de la distribución de las variantes en los tumores.
- Durante el proceso de consentimiento, se describe la posibilidad de que las variantes indiquen una susceptibilidad tumoral subyacente. Se les pregunta a los pacientes si desean recibir este tipo de información en caso de encontrarse una variante genética aplicable. Estos pacientes también reciben el asesoramiento genético de manera más rápida que lo usual (mediante asesores que participan en el protocolo de investigación). Si un paciente decide que no quiere recibir la información de la variante genética aplicable, de todas formas el resultado se notifica al médico de atención primaria del paciente. Todavía no se resuelve el dilema de cuándo volver a abordar a un paciente para hablar sobre los resultados, cuando este paciente indicó antes que no quería recibir esa información.
- Cuando se encuentran resultados considerados significativos, a veces se repite la misma prueba en un laboratorio con certificación según las normas CLIA.
- Se convocó un comité para revisar las variantes y determinar si se consideran patogénicas o aplicables de otra forma.
- Se conformó otro comité para supervisar la aplicación de dichos protocolos, con la intención de mejorar los procesos mencionados de manera congruente con la aplicación rutinaria que se anticipa en pacientes de cáncer, así como valorar la necesidad de mantener la autonomía del paciente y un proceso de consentimiento informado detallado y adecuado.
Problemas del consentimiento informado que surgen con la aplicación de la secuenciación de última generación
El proceso de consentimiento informado para la secuenciación de genes de penetrancia muy alta se lleva a cabo desde mediados de la década de los 90 en familias seleccionadas que tienen enfermedades hereditarias conocidas o enfermedades que se sospechan son hereditarias. Sin embargo, todavía no se ha determinado el método y el abordaje más apropiado para educar y asesorar a las personas sobre los beneficios, las limitaciones y los perjuicios posibles de las pruebas genéticas con el fin de facilitar la toma de decisiones fundadas. La aplicación de las técnicas de NGS en entornos clínicos y de investigación conllevó a que emergieran nuevas dificultades para el proceso de consentimiento informado. Las dificultades del proceso de consentimiento informado son las siguientes:
- Proporcionar una visión personalizada del alcance y la diversidad de los riesgos médicos identificables con la secuenciación genómica. Aplicar un proceso de consentimiento informado en poblaciones con escaso acceso a la atención médica que no están familiarizadas con el concepto de riesgo de enfermedad, así como en personas que no cuentan con información ni experiencia en la enfermedad para la que se determina que tienen un mayor riesgo.
- Usar la secuenciación para enfermedades que no cuentan con algoritmos de atención bien definidos ni prácticas óptimas reconocidas.
- Interpretar las variantes posiblemente patogénicas, pero que no se ha comprobado que sean patogénicas.
- Comunicar la información genética que quizás sea relevante para otros familiares del paciente.
- Se anticipan dificultades adicionales a medida que los proveedores de atención de la salud sin formación en medicina genética o genómica soliciten pruebas y reciban los resultados de sus pacientes con la expectativa de obtener información aplicable para la atención médica.
El aumento en la disponibilidad de las técnicas de NGS y la disminución de los costos han ampliado la utilización de las pruebas del genoma completo en muestras de tumores con el objetivo de identificar mutaciones somáticas como posibles dianas terapéuticas en el entorno oncológico. Aunque la identificación de variantes patogénicas de la línea germinal es un objetivo secundario cuando se hacen pruebas tumorales, la posibilidad de hallazgos secundarios de variantes patogénicas de predisposición al cáncer que conlleven una aplicación clínica apoya la necesidad de establecer asesoramiento genético en estos entornos. Se han planteado abordajes para el asesoramiento genético y el proceso de consentimiento informado en el entorno de la secuenciación tumoral.[20,21]
Conclusión
Los avances en las técnicas de secuenciación genética han reducido mucho el costo de la secuenciación del genoma o exoma completo de una persona. Cada vez se utilizan más la WGS y la WES en ámbitos clínicos para identificar mutaciones somáticas y variantes de la línea germinal. Además, estas pruebas multigénicas son accesibles, ya sea de manera comercial o en algunas instituciones académicas. Los aspectos clínicos, éticos, legales y del asesoramiento relacionados con la NGS y los análisis de genes múltiples son objeto de intenso debate. Se necesita más investigación para resolver estos temas de debate.
Bibliografía
- Dancey JE, Bedard PL, Onetto N, et al.: The genetic basis for cancer treatment decisions. Cell 148 (3): 409-20, 2012. [PUBMED Abstract]
- Meric-Bernstam F, Farhangfar C, Mendelsohn J, et al.: Building a personalized medicine infrastructure at a major cancer center. J Clin Oncol 31 (15): 1849-57, 2013. [PUBMED Abstract]
- Sleijfer S, Bogaerts J, Siu LL: Designing transformative clinical trials in the cancer genome era. J Clin Oncol 31 (15): 1834-41, 2013. [PUBMED Abstract]
- Green RC, Berg JS, Grody WW, et al.: ACMG recommendations for reporting of incidental findings in clinical exome and genome sequencing. Genet Med 15 (7): 565-74, 2013. [PUBMED Abstract]
- ACMG Board of Directors: Clinical utility of genetic and genomic services: a position statement of the American College of Medical Genetics and Genomics. Genet Med 17 (6): 505-7, 2015. [PUBMED Abstract]
- Richards S, Aziz N, Bale S, et al.: Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med 17 (5): 405-24, 2015. [PUBMED Abstract]
- Presidential Commission for the Study of Bioethical Issues: Anticipate and Communicate: Ethical Management of Incidental and Secondary Findings in the Clinical, Research, and Direct-to-Consumer Contexts. Washington, DC: U.S. Government Printing Office, 2013. Available online. Last accessed May 8, 2025.
- National Human Genome Research Institute: DNA Sequencing Costs: Data from the NHGRI Genome Sequencing Program (GSP). 2014. Available online. Last accessed May 8, 2025.
- Sanger F, Nicklen S, Coulson AR: DNA sequencing with chain-terminating inhibitors. Proc Natl Acad Sci U S A 74 (12): 5463-7, 1977. [PUBMED Abstract]
- MacConaill LE: Existing and emerging technologies for tumor genomic profiling. J Clin Oncol 31 (15): 1815-24, 2013. [PUBMED Abstract]
- Rizzo JM, Buck MJ: Key principles and clinical applications of "next-generation" DNA sequencing. Cancer Prev Res (Phila) 5 (7): 887-900, 2012. [PUBMED Abstract]
- Linnarsson S: Recent advances in DNA sequencing methods - general principles of sample preparation. Exp Cell Res 316 (8): 1339-43, 2010. [PUBMED Abstract]
- Fernald GH, Capriotti E, Daneshjou R, et al.: Bioinformatics challenges for personalized medicine. Bioinformatics 27 (13): 1741-8, 2011. [PUBMED Abstract]
- Mardis ER: The $1,000 genome, the $100,000 analysis? Genome Med 2 (11): 84, 2010. [PUBMED Abstract]
- Schrader KA, Cheng DT, Joseph V, et al.: Germline Variants in Targeted Tumor Sequencing Using Matched Normal DNA. JAMA Oncol 2 (1): 104-11, 2016. [PUBMED Abstract]
- Raymond VM, Gray SW, Roychowdhury S, et al.: Germline Findings in Tumor-Only Sequencing: Points to Consider for Clinicians and Laboratories. J Natl Cancer Inst 108 (4): , 2016. [PUBMED Abstract]
- Haddow J, Palomaki G: A model process for evaluating data on emerging genetic tests. In: Khoury M, Little J, Burke W, eds.: Human Genome Epidemiology: A Scientific Foundation for Using Genetic Information to Improve Health and Prevent Disease. Oxford University Press, 2004, pp 217-33.
- ACMG Board of Directors: ACMG policy statement: updated recommendations regarding analysis and reporting of secondary findings in clinical genome-scale sequencing. Genet Med 17 (1): 68-9, 2015. [PUBMED Abstract]
- Parsons DW, Roy A, Plon SE, et al.: Clinical tumor sequencing: an incidental casualty of the American College of Medical Genetics and Genomics recommendations for reporting of incidental findings. J Clin Oncol 32 (21): 2203-5, 2014. [PUBMED Abstract]
- Everett JN, Gustafson SL, Raymond VM: Traditional roles in a non-traditional setting: genetic counseling in precision oncology. J Genet Couns 23 (4): 655-60, 2014. [PUBMED Abstract]
- Catenacci DV, Amico AL, Nielsen SM, et al.: Tumor genome analysis includes germline genome: are we ready for surprises? Int J Cancer 136 (7): 1559-67, 2015. [PUBMED Abstract]
Estructura y contenido de los resúmenes del PDQ
Los resúmenes del PDQ sobre las características genéticas del cáncer se enfocan en la herencia genética de tipos específicos de cáncer, síndromes de cáncer hereditario, y las implicaciones éticas, sociales y psicológicas del conocimiento genético en oncología. Las secciones sobre las características genéticas de tipos concretos de cáncer incluye información específica de cada síndrome, entre otras, la repercusión sobre el riesgo de los antecedentes de cáncer en la historia familiar, la prevalencia y las características de las variantes de predisposición al cáncer, los modificadores de riesgo genético conocidos, las oportunidades para las pruebas genéticas, los resultados de las pruebas y el asesoramiento genético, así como las intervenciones disponibles para las personas cuyo riesgo alto de cáncer se debe a una predisposición hereditaria.
Las fuentes de bibliografía médica citadas en los resúmenes del PDQ sobre las características genéticas del cáncer son publicaciones científicas con revisión externa, cuya calidad y fiabilidad es evaluada en términos de niveles de evidencia. Cuando es relevante, se cita el nivel de evidencia, los puntos fuertes de los estudios o las limitaciones de la evidencia descrita.
Para obtener más información sobre los niveles de evidencia que se utilizan en los resúmenes del PDQ sobre las características genéticas del cáncer, consultar el resumen Niveles de evidencia de los estudios sobre la genética del cáncer.
Recursos de genética
Se pueden encontrar proveedores de atención de la salud que brindan servicios genéticos, entre ellos asesoramiento genético, en las organizaciones profesionales del ámbito local, regional o nacional como la National Society of Genetic Counselors. Los profesionales de los servicios de genética del cáncer no se restringen a una especialidad, abarcan genetistas médicos, asesores genéticos, profesionales de enfermería especializados en genética, oncólogos (médicos, radiólogos y cirujanos), otros médicos, por ejemplo, cirujanos, internistas, pediatras, especialistas en medicina familiar y profesionales de la salud mental. Un proveedor de atención de la salud especializado en genética del cáncer ayudará a elaborar el árbol genealógico, obtener y evaluar la historia médica familiar y los antecedentes personales, además de calcular el riesgo de cáncer, brindar la información sobre el riesgo y la probabilidad de que una variante patogénica se relacione con el cáncer en determinada familia. Asímismo, si se cuenta con una prueba genética, estos proveedores de atención pueden ayudar con el asesoramiento previo a la prueba, la elección del laboratorio, el proceso de consentimiento informado, la interpretación de la prueba, el asesoramiento posterior a la prueba y el seguimiento.
| Recurso | Descripción |
|---|---|
| ClinGen | Recursos en inglés para la evaluación de la importancia clínica de las variantes genéticas con el fin de usarlas en la medicina personalizada y en investigación. |
| ClinVar | Base de datos de archivo, en inglés, de acceso público que consolida la información sobre la variabilidad genómica y su vínculo con la salud humana. |
| Genetic Testing Registry (GTR) de los Institutos Nacionales de la Salud | Espacio para que los proveedores de pruebas genéticas envíen de manera voluntaria información, en inglés, sobre estas pruebas. El alcance incluye el objetivo de la prueba, la metodología, la validez, la evidencia que respalda la utilidad de la prueba, además de la información de acreditación y contacto del laboratorio. |
| Online Mendelian Inheritance in Man (OMIM) | Catálogo, en inglés, de genes humanos y trastornos genéticos. |
| Recurso | Descripción |
|---|---|
| Guías de práctica clínica del American College of Medical Genetics and Genomics (ACMG) | Conjunto de guías de práctica clínica, en inglés, creadas por grupos de expertos para ser usadas durante la evaluación del riesgo, las pruebas y el asesoramiento de personas con diversas afecciones hereditarias, incluso algunos tipos de cáncer, o personas con riesgo elevado de presentar alguna de estas afecciones. |
| Guías de práctica clínica de la American Society of Clinical Oncology (ASCO) | Conjunto de guías de práctica clínica, en inglés, creadas por grupos de expertos para ser usadas en situaciones clínicas específicas (según la enfermedad) o para definir el empleo de productos médicos, procedimientos y pruebas aprobadas (según la modalidad). |
| Guías de práctica clínica de la National Comprehensive Cancer Network (NCCN) | Guías de práctica clínica, en inglés, formuladas por grupos de expertos en las que se describe la secuencia para la toma de decisiones asistenciales e intervenciones de los tipos de neoplasias malignas que afectan al 97 % de los pacientes de cáncer. Además, incluye otras guías separadas relacionadas con temas de prevención general y exámenes de detección, así como otros protocolos asistenciales enfocados en aspectos importantes de los cuidados médicos de apoyo. |
| National Guideline Clearinghouse de la Agency for Healthcare Research and Quality (AHRQ) | Recurso público, en inglés, que contiene guías de práctica clínica basadas en la evidencia. |
| Recurso | Descripción |
|---|---|
| Diccionario de genética del NCI | Recurso que contiene definiciones para más de 200 términos de genética. |
| DNA Learning Center | Selección de recursos educativos, en inglés, entre ellos un componente sobre el desarrollo cronológico del conocimiento sobre el DNA. |
| The DNA Files | Información y una serie de 14 documentales radiales de 1 hora para el público general, en inglés. |
| Facing Our Risk of Cancer Empowered (FORCE) | Apoyo e información para personas y familias afectadas por cáncer de mama y ovario hereditario que se brinda mediante una línea de atención telefónica gratuita, foros virtuales, salas de chat y grupos de apoyo. |
| Genetic and Rare Diseases Information Center del Instituto Nacional de Investigación del Genoma Humano (NHGRI) | Servicio de información, en inglés, dirigido al público general, pacientes y familias; además, contiene información dirigida a profesionales de la salud e investigadores biomédicos. |
| Genetic Science Learning Center de la University of Utah | Información, en inglés, sobre genética básica, trastornos genéticos, genética en la sociedad y muchas unidades temáticas. |
| Pruebas genéticas para detectar el riesgo de cáncer hereditario, del NCI | Hoja informativa sobre las pruebas genéticas para evaluar el riesgo hereditario de cáncer, incluso los tipos de pruebas, quiénes deben pensar en hacerse pruebas, cómo interpretar los resultados de las pruebas y quiénes tienen acceso a los resultados de las pruebas genéticas. Además, contiene información sobre las pruebas genéticas dirigidas al consumidor o que se hacen en el hogar. |
| MedlinePlus: Genética (Biblioteca Nacional de Medicina de los EE. UU. | Información para el público general sobre las afecciones genéticas y los genes o cromosomas responsables de dichas afecciones. |
| Glosario parlante de términos genómicos y genéticos del Instituto Nacional de Investigación del Genoma Humano (NHGRI) | Contiene definiciones de casi 250 términos de genética y un cuestionario en el que se evalúa el conocimiento en terminología genética. Además, muchos términos contienen imágenes, animaciones y explicaciones de especialistas en el campo de la genética. |
| Recurso | Descripción |
|---|---|
| bioethicstoday.org | Enlaces a artículos, en inglés, sobre genética y bioética. |
| DNA Patent Database | Base de datos indexada, en inglés, que contiene las patentes de secuencias de DNA en los Estados Unidos y las solicitudes de patentes emitidas por la Oficina de Patentes y Marcas de Estados Unidos. |
| Ethical, Legal, and Social Issues del Departamento de Energía de Estados Unidos | Información, artículos y enlaces a una amplia variedad de información, en inglés, de temas de genética. |
| Genetic Information Nondiscrimination Act (GINA) of 2008 del Instituto Nacional de Investigación del Genoma Humano (NHGRI) | Información, en inglés, para el público general acerca de la discriminación genética y la ley GINA. |
| Genome Statute and Legislation Database del NHGRI | Base de datos indexada, en inglés, que contiene leyes o estatutos sobre la privacidad de la información genética y la confidencialidad del proceso de consentimiento informado; el proceso de consentimiento informado; la discriminación durante el aseguramiento médico o la contratación laboral; las pruebas y el asesoramiento genético; y la comercialización y obtención de patentes. |
| HumGen International | Base de datos integral internacional, en inglés, sobre aspectos legales, sociales y éticos de la genética humana. |
| National Information Resource on Ethics and Human Genetics de Georgetown University | Motor de búsqueda bibliográfica, en inglés, sobre temas específicos relacionados con aspectos éticos y de la genética humana. |
| National Society of Genetic Counselors Code of Ethics | Declaración en inglés dirigida a los asesores genéticos que aclara y orienta sobre el comportamiento ético en esta profesión. |
| Congress.gov de la Biblioteca del Congreso | Base de datos indexada, en inglés, que contiene la legislación de los Estados Unidos (Congreso vigente y anteriores). |
| Your Genes, Your Choices: Exploring the Issues Raised by Genetic Research | Descripción, en inglés, del Proyecto Genoma Humano, contiene el fundamento científico y sus aspectos éticos, legales y sociales. |
| Recurso | Descripción |
|---|---|
| Family Health History de Genetic Alliance | Consejos, en inglés, para recopilar la información de la historia familiar y enlaces a otros recursos. |
| Family Health History de los Centros para el Control y la Prevención de Enfermedades (CDC) | Sitio en Internet con información, en inglés, sobre el uso de la historia familiar para promover la salud. Este sitio incluye enlaces a My Family Health Portrait, un recurso, en inglés, para recopilar la historia familiar. |
| Family History Resources de la National Society of Genetic Counselors | Información, en inglés, sobre el proceso para recopilar la historia médica familiar. |
| Family Medical History de la American Medical Association | Instrumentos, en inglés, para recopilar la historia familiar y enlaces a otros recursos. |
| Recurso | Descripción |
|---|---|
| UCSC = University of California, Santa Cruz. | |
| Chromosomal Variation in Man | Base de datos indexada de citas bibliográficas, en inglés, sobre variantes y anomalías cromosómicas. |
| Proyecto Ensembl: programa informático conjunto entre el European Bioinformatics Institute y el Wellcome Trust Sanger Institute | Conjuntos de datos, en inglés, derivados de análisis genómicos automáticos, además del proceso de anotación. |
| International Cancer Genome Consortium Data Portal | Recopilación de datos genómicos, en inglés, de más de 25 proyectos sobre el cáncer que abarcan muestras de genomas de 3500 tumores de 13 tipos y subtipos de cáncer. La mayoría de los datos son de acceso libre. |
| Leiden Open Variation Database | Recurso, en inglés, de acceso libre y flexible para la recopilación de información génica, su conservación y la visualización de la variabilidad del DNA. |
| KMcancerDB | Base de datos, en inglés, que contiene variantes patogénicas en seres humanos con una representación gráfica de la información molecular de los genes relacionados con el cáncer. |
| National Center for Biotechnology Information: Genomic Biology | Información, en inglés, relacionada con cromosomas, mapas y locus; además, enlaces a otros recursos del NCBI. |
| Online Mendelian Inheritance in Man (OMIM) | Catálogo, en inglés, de genes humanos y trastornos genéticos en inglés. |
| UCSC Genome Bioinformatics | Instrumento con secuencias de referencia para el genoma humano y el genoma de C. elegans, además, incluye proyectos en curso para los genomas de ratón, rata, pez globo, drosófila, C. briggsae, levaduras y SARS. |
| Human Subjects Research in Genomics del Instituto Nacional de Investigación del Genoma Humano (NHGRI) | Información, en inglés, sobre aspectos problemáticos para los Consejos de revisión institucional, los investigadores y los encargados de formular políticas. |
| Recurso | Descripción |
|---|---|
| Centre for Genetics Education | Recursos educativos, en inglés, y servicios para pacientes y profesionales. |
| DNA Learning Center | Selección de recursos educativos, en inglés, entre ellos un componente sobre el desarrollo cronológico del conocimiento sobre el DNA. |
| Essentials of Genetic and Genomic Nursing: Competencies, Curricula Guidelines, and Outcome Indicators, segunda edición | Documento, en inglés, que establece las bases mínimas para la capacitación de profesionales de enfermería con el fin de que ofrezcan cuidados competentes enfocados en aspectos genómicos y genéticos. |
| Genetics/Genomics Competency Center (G2C2) | Archivo de recursos educativos, en inglés, sobre genética y genómica para asesores genéticos, profesionales de enfermería, farmacéuticos, asistentes médicos y médicos. |
| Genetics Toolkit de la American Society of Clinical Oncology | Recopilación de instrumentos y recursos de apoyo, en inglés, para que los profesionales del ámbito de la oncología incorporen en su práctica la evaluación del riesgo de cáncer hereditario. |
| Genetics Toolkit de la Society of Gynecologic Oncology | Documento, en inglés, que contiene una serie de estudios de casos que abordan preguntas y dificultades frecuentes a las que se enfrentan los profesionales de la salud y los pacientes con respecto a la función de la genética en los cánceres ginecológicos. Este recurso, se desarrolló gracias a la colaboración de la Society of Gynecologic Oncology, la National Society of Genetic Counselors, Bright Pink y Facing Our Risk of Cancer Empowered (FORCE). |
| Medical School Core Curriculum in Genetics | Información, en inglés, sobre las competencias de la asignatura en la facultad de Medicina, así como las habilidades, el conocimiento y los comportamientos que se deben cubrir en un plan de estudios sobre genética creado por la Association of Professors of Human and Medical Genetics y la American Society of Human Genetics. |
| National Genetics and Genomics Education Centre | Información, en inglés, sobre este Centro, el cual formula, ofrece y evalúa oportunidades de educación en genética y recursos relacionados. |
| Recurso | Descripción |
|---|---|
| American Board of Genetic Counseling (ABGC) | Información, en inglés, sobre la certificación de los asesores genéticos. |
| American Board of Medical Genetics and Genomics (ABMGG) | Información, en inglés, sobre los programas de formación en genética médica y la certificación de los genetistas. |
| American College of Medical Genetics and Genomics (ACMG) | Recursos y directrices, en inglés, sobre la política y las guías de práctica médica en genética médica. |
| American Society of Human Genetics (ASHG) | Recursos proyectos y políticas, en inglés, relacionadas con la genética humana. |
| Genetics Society of America (GSA) | Enlaces a sitios web educativos; clases para el público general; revistas y publicaciones, en inglés, sobre genética. |
| International Society of Nurses in Genetics (ISONG) | Recursos, en inglés, para ayudar a los profesionales de enfermería a incorporar el conocimiento nuevo sobre la genética humana en las actividades prácticas, educativas y de investigación. |
| National Society of Genetic Counselors (NSGC) | Información, en inglés, sobre el asesoramiento genético: guías prácticas, enlaces a asesores genéticos y recursos distinguidos sobre la genética. |
| Recurso | Descripción |
|---|---|
| Breast Cancer Genetics Referral Screening Tool (B-RST) | Instrumento, en inglés, de detección para ayudar a identificar a las personas que tal vez presenten un aumento del riesgo de cáncer de mama y de ovario hereditarios debido a los antecedentes de su historia familiar.[1,2] |
| Breast Cancer Risk Assessment Tool del Instituto Nacional del Cáncer (NCI) | Instrumento interactivo, en inglés, para calcular el riesgo de una mujer de presentar cáncer de mama invasivo. |
| Colorectal Cancer Risk Assessment Tool del NCI | Instrumento interactivo, en inglés, para calcular el riesgo de cáncer colorrectal en hombres o mujeres blancos no hispanos de 50 a 85 años. |
| Family Health Risk Calculator de The Ohio State University Medical Center | Instrumento interactivo, en inglés, para calcular el riesgo de cáncer al revisar la distribución de los casos de cáncer en una familia. |
| Melanoma Risk Assessment Tool del NCI | Instrumento interactivo, en inglés, para calcular en una persona el riesgo absoluto de presentar melanoma. |
| Recurso | Descripción |
|---|---|
| MMR = reparación de errores de emparejamiento; MRC = Medical Research Council. | |
| MRC Human Genetics Unit, Edinburgh | Instrumento, en inglés, para predecir la probabilidad de las variantes patogénicas en un gen MMR en personas con cáncer de colon. |
| PREMM5 Model: modelo de predicción para las variantes patogénicas en MLH1, MSH2, MSH6, PMS2 y EPCAM | Modelo, en inglés, para calcular en una persona la probabilidad de que porte una variante patogénica en los genes MLH1, MSH2, MSH6, PMS2 o EPCAM. Este modelo reemplazó el modelo PREMM(1,2,6). |
| Recurso | Descripción |
|---|---|
| GWAS = estudios de asociación del genoma completo; HuGE = Human Genome Epidemiology; SNP = polimorfismo de un solo nucleótido. | |
| Catalog of Published Genome-Wide Association Studies | Catálogo, en inglés, que se encuentra en Internet y que contiene información sobre las asociaciones entre rasgos y los SNP obtenidas de los GWAS que se emplean durante la investigación de las características genómicas de los SNP vinculados con determinados rasgos o enfermedades. |
| HuGE Navigator | Base de conocimientos integrada e indexada, en inglés, sobre asociaciones genéticas y epidemiología del genoma humano. |
| National Information Resource on Ethics and Human Genetics de Georgetown University | Motor de búsqueda bibliográfica, en inglés, sobre temas específicos relacionados con los aspectos éticos y la genética humana. |
| Recurso | Descripción |
|---|---|
| Public Health Genomics at CDC | Información, en inglés, sobre la manera en que los descubrimientos genómicos en seres humanos se pueden usar para mejorar la salud y prevenir las enfermedades, incluye enlaces a muchos recursos. |
| Instituto Nacional del Cáncer | Resúmenes de información sobre las características genéticas del cáncer. |
| Instituto Nacional de Investigación del Genoma Humano | Información, en inglés, sobre investigación, política, ética, educación y capacitación, así como otros recursos sobre la genética y las enfermedades raras. |
| Departamento de Energía de Estados Unidos | Recursos formativos, en inglés, sobre genómica. |
Bibliografía
- Bellcross CA, Lemke AA, Pape LS, et al.: Evaluation of a breast/ovarian cancer genetics referral screening tool in a mammography population. Genet Med 11 (11): 783-9, 2009. [PUBMED Abstract]
- Bellcross C: Further development and evaluation of a breast/ovarian cancer genetics referral screening tool. Genet Med 12 (4): 240, 2010. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (02/28/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre la genética del cáncer es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre la genética del cáncer. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre la genética del cáncer, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Aspectos generales de la genética del cáncer son:
- Doreen Agnese, MD (The Ohio State University)
- Melyssa D. Aronson, MS, CGC, CCGC (Sinai Health System)
- Erica Blouch, MS, CGC (Massachusetts General Hospital Cancer Center)
- Kathleen A. Calzone, PhD, RN, AGN-BC, FAAN (National Cancer Institute)
- Ilana Cass, MD (Dartmouth-Hitchcock Medical Center)
- Lee-may Chen, MD (UCSF Helen Diller Family Comprehensive Cancer Center)
- Julia Cooper, MS, CGC (Ohio State University)
- Mary B. Daly, MD, PhD (Fox Chase Cancer Center)
- Courtney DiNardo, MD, MSC (University of Texas, M.D. Anderson Cancer Center)
- Grace-Ann O. Fasaye, ScM, CGC (National Cancer Institute)
- Zachariah Foda, MD, PhD (Johns Hopkins University School of Medicine)
- Megan Frone, MS, CGC (National Cancer Institute)
- Veda N. Giri, MD (Yale University)
- Jessica Hatton , MS, CGC (National Cancer Institute)
- Joanne Marie Jeter, MD (City of Hope)
- Joanne Kotsopoulos, PhD (University of Toronto and Women's College Hospital)
- Alexandra Perez Lebensohn, MS, CGC (National Cancer Institute)
- David Liska, MD, MA (Cleveland Clinic)
- Gautam Mankaney, MD (Virginia Mason Franciscan Health)
- Kelly Carter Nelson, MD, FAAD (M.D. Anderson Cancer Center at University of Texas)
- Suzanne C. O'Neill, PhD (Georgetown University)
- Tuya Pal, MD, FACMG, FCCMG (Vanderbilt-Ingram Cancer Center)
- Nancy D. Perrier, MD, FACS (University of Texas, M.D. Anderson Cancer Center)
- Mark Pomerantz, MD (Dana-Farber Cancer Institute)
- John M. Quillin, PhD, MPH, MS (Virginia Commonwealth University)
- Padma Sheila Rajagopal, MD, MPH, MSC (National Cancer Institute)
- Charite Ricker, MS, CGC (University of Southern California)
- Sarah Scollon, MS, CGC (Baylor College of Medicine & Texas Children's Hospital)
- Brian Matthew Shuch, MD (UCLA Health)
- Ramaprasad Srinivasan, MD, PhD (National Cancer Institute)
- Douglas Stewart, MD (National Cancer Institute)
- Amanda Ewart Toland, PhD, FACMG (The Ohio State University)
- Catharine Wang, PhD, MSc (Boston University School of Public Health)
- Marcin Wlodarski, MD, PhD (St. Jude Children's Research Hospital)
- Matthew B. Yurgelun, MD (Dana-Farber Cancer Institute)
- Kevin Zbuk, MD, FRCPC (Margaret and Charles Juravinski Cancer Centre)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre la genética del cáncer emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre la genética del cáncer. PDQ Aspectos generales de la genética del cáncer. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/cancer/causas-prevencion/genetica/aspectos-generales-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.