Cannabis y canabinoides (PDQ®)–Versión para profesionales de salud
Aspectos generales
Este resumen de información sobre el cáncer proporciona una visión general de la utilidad de Cannabis y sus componentes como tratamiento para personas con síntomas relacionados con el cáncer, causados por la enfermedad misma o su tratamiento.
Este resumen contiene la siguiente información clave:
- Cannabis se ha utilizado con propósitos medicinales durante miles de años.
- Según la ley federal, la posesión de Cannabis es ilegal en los Estados Unidos, excepto en entornos de investigación autorizados; sin embargo, un número creciente de estados, territorios y el Distrito de Columbia han aprobado leyes para legalizar su consumo con fines medicinales y recreativos.
- La Administración de Alimentos y Medicamentos de los Estados Unidos no ha aprobado Cannabis como tratamiento para el cáncer o para otras afecciones.
- Los componentes químicos de Cannabis, llamados canabinoides, activan determinados receptores en todo el cuerpo que producen efectos farmacológicos; en particular, en el sistema nervioso central y el sistema inmunitario.
- Los canabinoides de venta comercial, como el dronabinol y la nabilona, son fármacos aprobados para el tratamiento de los efectos secundarios relacionados con el cáncer.
- Es posible que los canabinoides produzcan beneficios para el tratamiento de los efectos secundarios relacionados con el cáncer.
Muchos de los términos médicos y científicos en este resumen tienen un enlace al Diccionario de cáncer del NCI la primera vez que se mencionan en cada sección. Este diccionario se orienta a personas sin conocimientos especializados. Al pulsar sobre un término con un enlace, aparece la definición en una ventana separada.
Las referencias bibliográficas citadas en algunos de los resúmenes de información sobre el cáncer del PDQ pueden tener enlaces a otros sitios de Internet gestionados por individuos u organizaciones con el propósito de comercializar o promover el uso de tratamientos o productos específicos. Estas referencias bibliográficas se ofrecen solo con fines informativos. Su inclusión no se debe interpretar como la aprobación del contenido de las páginas de Internet ni de ningún tratamiento o producto por parte del Consejo editorial del PDQ sobre las terapias integrales, alternativas y complementarias, o del Instituto Nacional del Cáncer.
Información general
Cannabis, también conocida como marihuana, es originaria de Asia Central, pero en la actualidad se cultiva en todo el mundo. En los Estados Unidos, es una sustancia controlada y se considera como una droga de clasificación I (droga con un potencial adictivo elevado y sin utilidad médica aceptada hoy en día). La planta de Cannabis produce una resina que contiene compuestos terpenofenólicos de 21 átomos de carbono llamados canabinoides, además de otros compuestos de origen vegetal, como los terpenos y los flavonoides. La concentración más alta de canabinoides se encuentra en las flores femeninas de la planta.[1] Si bien el Δ-9-tetrahidrocanabinol (THC) es el principal canabinoide psicoactivo, se notificó que la planta tiene más de otros 100 canabinoides. El canabidiol (CBD) no produce el estado de conciencia alterada que se relaciona con Cannabis. Se piensa que tiene posible eficacia terapéutica y hace poco se aprobó en la forma del preparado farmacéutico Epidiolex para el tratamiento de trastornos convulsivos resistentes al tratamiento en niños. Otros canabinoides que están en estudio por sus posibles beneficios médicos incluyen el canabinol (CBN), el canabigerol (CBG) y la tetrahidrocanabivarina (THCV).
Los ensayos clínicos sobre Cannabis medicinal son limitados. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) no ha aprobado el uso de Cannabis como tratamiento de ninguna afección, aunque sí se otorgaron licencias y se aprobaron algunos productos farmacéuticos aislados con THC y CBD. Para llevar a cabo una investigación clínica de fármacos con Cannabis botánico en los Estados Unidos, los investigadores deben presentar una solicitud de medicamento nuevo experimental (Investigational New Drug [IND]) ante la FDA, obtener una autorización de clasificación I de la U.S. Drug Enforcement Administration y una aprobación del National Institute on Drug Abuse.
En la Farm Bill de 2018 de los Estados Unidos, el término cáñamo se usó para describir variedades cultivadas de Cannabis que contienen menos del 0,3 % de THC. El aceite de cáñamo y el aceite de CBD son productos elaborados a partir de extractos de cáñamo industrial (es decir, variedades cultivadas de Cannabis con contenido bajo de THC) mientras que, el aceite de semilla de cáñamo es un aceite comestible que prácticamente no tiene canabinoides (consultar el Cuadro 1). Algunos productos contienen otros extractos botánicos o analgésicos de venta libre. Estos productos están disponibles como tinturas de uso oral y tópico, o en otras formulaciones que se promocionan a menudo para el tratamiento del dolor y también con otros propósitos. Los productos del cáñamo que contienen menos del 0,3 % de Δ-9-THC no son sustancias clasificadas como controladas y se considera que cumplen lo exigido en la Farm Bill. Aunque el CBD es una sustancia controlada, el cáñamo no lo es.
| Nombre o material | Componentes o composición | |
|---|---|---|
| CBD = canabidiol; THC = tetrahidrocanabinol. | ||
| Especies de Cannabis, incluso C. sativa | Canabinoides, también terpenoides y flavonoides | |
| • Cáñamo (es decir, cáñamo industrial) | Bajo Δ9-THC (<0,3 %); alto CBD | |
| • Marijuana o marihuana | Alto Δ9-THC (>0,3 %); bajo CBD | |
| Nabiximols (nombre comercial: Sativex) | Mezcla de extractos de etanol de especies de Cannabis; contiene Δ9-THC y CBD en una proporción 1:1 | |
| Aceite de cáñamo o aceite de CBD | Solución de un extracto con solvente, de las flores o las hojas de Cannabis disuelto en un aceite comestible; suele contener un 1–5 % de CBD | |
| Aceite de semilla de cáñamo | Aceite graso comestible elaborado con semillas de Cannabis; no contiene canabinoides o solo tiene restos | |
| Dronabinol (nombres comerciales: Marinol y Syndros) | Δ9-THC sintético 9-THC | |
| Nabilona (nombres comerciales: Cesamet y Canemes) | Análogo de THC sintético | |
| Canabidiol (nombre comercial: Epidiolex) | CBD de origen vegetal muy puro (>98 %) | |
Los posibles beneficios medicinales de Cannabis para personas afectadas por un cáncer incluyen los siguientes:[2]
- Efectos antieméticos.
- Estímulo del apetito.
- Alivio del dolor.
- Mejora del sueño.
Un estudio de 13 180 pacientes con varios tipos de cáncer tratados en 12 de los centros oncológicos designados por el NCI reveló observaciones importantes sobre la prevalencia, patrones y percepciones del consumo de Cannabis en personas con cáncer.[3] Las cifras sobre la frecuencia estimada de consumo se obtuvieron de 12 614 personas encuestadas en 10 sitios donde se extrajeron muestras de probabilidad, y el 33 % de los participantes reportó consumo de Cannabis desde el diagnóstico de cáncer. Se observó poca variación en el consumo notificado según el estado legal estatal de Cannabis. Se notificó un 26 % de consumo en una encuesta de un estado donde Cannabis es ilegal. El 90 % de los participantes que notificaron consumir Cannabis reportaron diversos beneficios: control del dolor (75 %), mejora del sueño (67 %), alivio de las náuseas (65 %) y mejora del apetito (56 %). El 65 % de los pacientes con cáncer notificó algunos efectos adversos como incapacidad para conducir, dificultad para concentrarse, lesión pulmonar y alteración de la memoria. Los riesgos notificados de adicción y problemas legales fueron más comunes en estados donde Cannabis es ilegal. Si bien el 70 % de los pacientes expresó interés en aprender más sobre el uso médico de Cannabis, solo el 21,5 % habló sobre este tema con sus proveedores de atención oncológica y el 15 % notificó que recibieron orientación de su equipo de atención de salud. En el estudio se resaltó una brecha importante entre el interés de los pacientes y la participación de los proveedores, lo que enfatiza la necesidad de mejorar la educación y comunicación sobre el consumo de Cannabis en la atención oncológica.
Aunque hay algunas encuestas relevantes sobre los patrones de práctica clínica, los médicos que atienden pacientes con cáncer en los Estados Unidos recomiendan el consumo de Cannabis de manera primaria para el tratamiento sintomático.[4]
En este resumen, se revisará la función de Cannabis y los canabinoides en el tratamiento de las personas con cáncer, y de los efectos secundarios relacionados con la enfermedad o el tratamiento. El NCI organizó una reunión virtual, el NCI Cannabis, Cannabinoids, and Cancer Research Symposium, del 15 al 18 de diciembre de 2020. Las 7 sesiones se resumen en el Journal of the National Cancer Institute Monographs y contienen información científica y clínica básica, así como un resumen de los obstáculos para llevar a cabo investigación sobre Cannabis.[5-11]
Bibliografía
- Adams IB, Martin BR: Cannabis: pharmacology and toxicology in animals and humans. Addiction 91 (11): 1585-614, 1996. [PUBMED Abstract]
- Abrams DI: Integrating cannabis into clinical cancer care. Curr Oncol 23 (2): S8-S14, 2016. [PUBMED Abstract]
- Ellison GL, Helzlsouer KJ, Rosenfield SM, et al.: Perceptions, prevalence, and patterns of cannabis use among cancer patients treated at 12 NCI-Designated Cancer Centers. J Natl Cancer Inst Monogr 2024 (66): 202-217, 2024. [PUBMED Abstract]
- Doblin RE, Kleiman MA: Marijuana as antiemetic medicine: a survey of oncologists' experiences and attitudes. J Clin Oncol 9 (7): 1314-9, 1991. [PUBMED Abstract]
- Ellison GL, Alejandro Salicrup L, Freedman AN, et al.: The National Cancer Institute and Cannabis and Cannabinoids Research. J Natl Cancer Inst Monogr 2021 (58): 35-38, 2021. [PUBMED Abstract]
- Sexton M, Garcia JM, Jatoi A, et al.: The Management of Cancer Symptoms and Treatment-Induced Side Effects With Cannabis or Cannabinoids. J Natl Cancer Inst Monogr 2021 (58): 86-98, 2021. [PUBMED Abstract]
- Cooper ZD, Abrams DI, Gust S, et al.: Challenges for Clinical Cannabis and Cannabinoid Research in the United States. J Natl Cancer Inst Monogr 2021 (58): 114-122, 2021. [PUBMED Abstract]
- Braun IM, Abrams DI, Blansky SE, et al.: Cannabis and the Cancer Patient. J Natl Cancer Inst Monogr 2021 (58): 68-77, 2021. [PUBMED Abstract]
- Ward SJ, Lichtman AH, Piomelli D, et al.: Cannabinoids and Cancer Chemotherapy-Associated Adverse Effects. J Natl Cancer Inst Monogr 2021 (58): 78-85, 2021. [PUBMED Abstract]
- McAllister SD, Abood ME, Califano J, et al.: Cannabinoid Cancer Biology and Prevention. J Natl Cancer Inst Monogr 2021 (58): 99-106, 2021. [PUBMED Abstract]
- Abrams DI, Velasco G, Twelves C, et al.: Cancer Treatment: Preclinical & Clinical. J Natl Cancer Inst Monogr 2021 (58): 107-113, 2021. [PUBMED Abstract]
Antecedentes
El consumo de Cannabis con propósitos medicinales se remonta a, por lo menos, 3000 años.[1-5] Se introdujo en la medicina occidental en 1839 por W.B. O’Shaughnessy, un cirujano que aprendió sobre sus propiedades medicinales mientras trabajaba en India para la British East India Company. Su consumo se fomentó al conocerse sus efectos analgésicos, sedantes, antiinflamatorios, antiespasmódicos y anticonvulsivos.
En 1937, el Departamento del Tesoro de los Estados Unidos promulgó la Marihuana Tax Act. Esta ley impuso un gravamen de $1 por onza para el consumo medicinal de Cannabis y de $100 por onza para el uso no medicinal. Los médicos de los Estados Unidos fueron los principales opositores a la ley. La American Medical Association (AMA) se opuso a la ley porque exigía que los médicos pagaran un impuesto especial para recetar Cannabis, que usaran formularios de pedido especiales para solicitarlo y que mantuvieran registros especiales sobre su uso profesional. Además, la AMA opinaba que no había ninguna evidencia objetiva de que Cannabis fuera dañina y que la aprobación de la ley impediría realizar nuevas investigaciones para determinar el valor medicinal.[6] En 1942, Cannabis se excluyó de la farmacopea de los Estados Unidos debido a las inquietudes persistentes en cuanto a su potencial dañino.[2,3] Recientemente, la U.S. Pharmacopeia ha renovado su interés por Cannabis.[7]
En 1951, el Congreso de los Estados Unidos aprobó la Boggs Act que, por primera vez, incluyó Cannabis en la lista de drogas de tipo narcótico. En 1970, con la aprobación de la Controlled Substances Act, el Congreso clasificó la marihuana como una droga de clasificación I. En los Estados Unidos, las drogas de clasificación I se distinguen por no tener ninguna utilidad medicinal aceptada en la actualidad. Otras sustancias incluidas en la lista de clasificación I son la heroína, la LSD, la mezcalina y la metacualona.
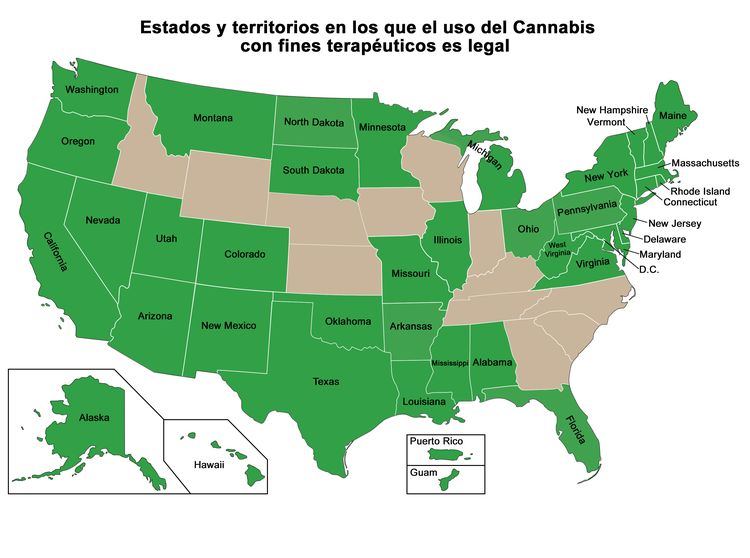
El Gobierno de los Estados Unidos distribuyó Cannabis a pacientes, de acuerdo con cada caso específico, según lo dispuesto en el programa Compassionate Use Investigational New Drug establecido en 1978, a pesar de su denominación de que no tiene utilidad medicinal. La distribución de Cannabis a nuevos pacientes en este programa terminó en 1992.[1-4] Aunque la ley federal prohíbe el consumo de Cannabis, en la Figura 1 a continuación se muestran los estados y territorios en los que se ha legalizado Cannabis para su uso con fines medicinales. Otros estados legalizaron solo un ingrediente de Cannabis como el canabidiol (CBD); estos estados no se incluyen en el mapa. Algunas de las leyes sobre la marihuana médica son más amplias que otras, y hay variaciones entre los estados en cuanto al tipo de afecciones para las que se permite dicho tratamiento.[8]
El principal componente psicoactivo de Cannabis se identificó como Δ-9-tetrahidrocanabinol (THC). En 1986, se autorizó y aprobó un isómero sintético del Δ-9-THC presente en el aceite de sésamo para el tratamiento de las náuseas y los vómitos causados por la quimioterapia con el nombre genérico dronabinol. En ensayos clínicos se determinó que el dronabinol era al menos tan eficaz como los otros antieméticos disponibles en ese momento.[9] Al final de la década de 1980, también se estudió el dronabinol por su capacidad de estimular el aumento de peso en pacientes de SIDA. En consecuencia, en 1992 se expandieron las indicaciones para incluir el tratamiento de la anorexia relacionada con la infección por el virus de la inmunodeficiencia humana. En los resultados de ensayos clínicos no se observó ningún aumento de peso significativo, aunque los pacientes notificaron una mejoría del apetito.[10,11] Otro canabinoide importante que se halla en Cannabis es el CBD.[12]Este es un canabinoide sin efectos psicoactivos que es un análogo del THC.
En décadas recientes, se han analizado las características neurobiológicas de los canabinoides.[13-16] El primer receptor de canabinoides, CB1, se identificó en el encéfalo en 1988. El segundo receptor de canabinoides, CB2, se identificó en 1993. La expresión más alta de los receptores CB2 se encuentra en los linfocitos B y en los linfocitos citolíticos naturales, lo que sugiere una posible función en la inmunidad. Se identificaron canabinoides endógenos (endocanabinoides) que cumplen una función en la modulación del dolor, el control del movimiento, la conducta de alimentación, el estado de ánimo, el crecimiento óseo, la inflamación, la neuroprotección y la memoria.[17]
El nabiximols (Sativex), un extracto de Cannabis con una proporción 1:1 de THC:CBD, está aprobado en Canadá (de acuerdo con la Notice of Compliance with Conditions) para el alivio de los síntomas del dolor en el cáncer avanzado y la esclerosis múltiple.[18] El nabiximols es una preparación herbaria que contiene una cantidad definida de canabinoides específicos formulada para su administración como aerosol en la mucosa oral; es posible que tenga actividad analgésica. El nabiximols contiene extractos de dos variedades de la planta de Cannabis. La mezcla de los extractos se estandariza según las concentraciones del Δ-9-THC psicoactivo y del CBD no psicoactivo. La preparación también contiene una cantidad menor de otros canabinoides, flavonoides y terpenoides.[19] Canadá, Nueva Zelanda y la mayoría de los países de Europa occidental también aprobaron el nabiximols para la espasticidad que causa la esclerosis múltiple, un síntoma habitual que incluye rigidez muscular, movilidad reducida y dolor, cuyo tratamiento vigente es insatisfactorio.
Bibliografía
- Abel EL: Marihuana, The First Twelve Thousand Years. Plenum Press, 1980. Also available online. Last accessed June 2, 2021.
- Joy JE, Watson SJ, Benson JA, eds.: Marijuana and Medicine: Assessing the Science Base. National Academy Press, 1999. Also available online. Last accessed June 2, 2021.
- Mack A, Joy J: Marijuana As Medicine? The Science Beyond the Controversy. National Academy Press, 2001. Also available online. Last accessed June 2, 2021.
- Booth M: Cannabis: A History. St Martin's Press, 2003.
- Russo EB, Jiang HE, Li X, et al.: Phytochemical and genetic analyses of ancient cannabis from Central Asia. J Exp Bot 59 (15): 4171-82, 2008. [PUBMED Abstract]
- Schaffer Library of Drug Policy: The Marihuana Tax Act of 1937: Taxation of Marihuana. Washington, DC: House of Representatives, Committee on Ways and Means, 1937. Available online. Last accessed June 2, 2021.
- Sarma ND, Waye A, ElSohly MA, et al.: Cannabis Inflorescence for Medical Purposes: USP Considerations for Quality Attributes. J Nat Prod 83 (4): 1334-1351, 2020. [PUBMED Abstract]
- National Academies of Sciences, Engineering, and Medicine: The Health Effects of Cannabis and Cannabinoids: The Current State of Evidence and Recommendations for Research. The National Academies Press, 2017.
- Sallan SE, Zinberg NE, Frei E: Antiemetic effect of delta-9-tetrahydrocannabinol in patients receiving cancer chemotherapy. N Engl J Med 293 (16): 795-7, 1975. [PUBMED Abstract]
- Gorter R, Seefried M, Volberding P: Dronabinol effects on weight in patients with HIV infection. AIDS 6 (1): 127, 1992. [PUBMED Abstract]
- Beal JE, Olson R, Laubenstein L, et al.: Dronabinol as a treatment for anorexia associated with weight loss in patients with AIDS. J Pain Symptom Manage 10 (2): 89-97, 1995. [PUBMED Abstract]
- Adams R, Hunt M, Clark JH: Structure of cannabidiol: a product isolated from the marihuana extract of Minnesota wild hemp. J Am Chem Soc 62 (1): 196-200, 1940. Also available online. Last accessed June 2, 2021.
- Devane WA, Dysarz FA, Johnson MR, et al.: Determination and characterization of a cannabinoid receptor in rat brain. Mol Pharmacol 34 (5): 605-13, 1988. [PUBMED Abstract]
- Devane WA, Hanus L, Breuer A, et al.: Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science 258 (5090): 1946-9, 1992. [PUBMED Abstract]
- Pertwee RG, Howlett AC, Abood ME, et al.: International Union of Basic and Clinical Pharmacology. LXXIX. Cannabinoid receptors and their ligands: beyond CB₁ and CB₂. Pharmacol Rev 62 (4): 588-631, 2010. [PUBMED Abstract]
- Felder CC, Glass M: Cannabinoid receptors and their endogenous agonists. Annu Rev Pharmacol Toxicol 38: 179-200, 1998. [PUBMED Abstract]
- Pacher P, Bátkai S, Kunos G: The endocannabinoid system as an emerging target of pharmacotherapy. Pharmacol Rev 58 (3): 389-462, 2006. [PUBMED Abstract]
- Howard P, Twycross R, Shuster J, et al.: Cannabinoids. J Pain Symptom Manage 46 (1): 142-9, 2013. [PUBMED Abstract]
- Nabiximols. Bethesda, MD: National Center for Biotechnology Information, 2009. Available online. Last accessed June 2, 2021.
Estudios preclínicos de laboratorio o con animales
Los canabinoides son un grupo de compuestos terpenofenólicos con 21 átomos de carbono que solo las especies de Cannabis producen (por ejemplo, Cannabis sativa L.).[1,2] Estos compuestos derivados de plantas también se conocen como fitocanabinoides. Aunque el Δ-9-tetrahidrocanabinol (THC) es el ingrediente psicoactivo principal, otros compuestos conocidos con actividad biológica son el canabinol, el canabidiol (CBD), el canabicromeno, el canabigerol, la tetrahidrocanabivarina y el Δ-8-THC. Se piensa que el CBD, en particular, tiene actividad analgésica, antiinflamatoria y ansiolítica significativa sin el efecto psicoactivo (alto) del Δ-9-THC.
Efectos antitumorales
En un estudio con ratones y ratas se indicó que los canabinoides quizás tengan un efecto protector contra la formación de ciertos tipos de tumores.[3] Durante los 2 años del estudio, grupos de ratones y ratas recibieron distintas dosis de THC mediante administración por sonda. En los ratones se observó una disminución de la incidencia de tumores de adenoma hepático y carcinoma hepatocelular (CHC) relacionada con la dosis. En las ratas también se observó una disminución de la incidencia de tumores benignos (pólipos y adenomas) en otros órganos (glándula mamaria, útero, hipófisis, testículos y páncreas). En otro estudio se observó que Δ-9-THC, Δ-8-THC y canabinol inhiben la multiplicación in vitro e in vivo de las células de Lewis en el adenocarcinoma de pulmón.[4] Además, se ha observado que otros tumores son sensibles a la inhibición del crecimiento inducido por canabinoides.[5-8]
Es posible que los canabinoides produzcan efectos antitumorales mediante diversos mecanismos, como la inducción de la muerte celular, la inhibición de la multiplicación celular y la inhibición de la invasión por angiogénesis tumoral y de las metástasis.[9-12] En 2 revisiones se resumieron los mecanismos de acción molecular de los canabinoides como antitumorales.[13,14] Parece que los canabinoides destruyen las células tumorales, pero no afectan sus equivalentes no transformadas y tal vez las protejan de la muerte celular. Por ejemplo, se observó que esos compuestos causan la apoptosis en las células de glioma en cultivo y la regresión de los tumores de glioma en ratones y ratas, al mismo tiempo que protegen las células gliales normales de linaje astroglial y oligodendroglial de la apoptosis mediada por el receptor CB1.[9]
En el entorno del CHC, se estudiaron los efectos del Δ-9-THC y un agonista sintético del receptor CB2.[15] Ambos fármacos redujeron la viabilidad de las células de CHC in vitro y demostraron efectos antitumorales en xenoinjertos subcutáneos de CHC en ratones atímicos. En las investigaciones se documentó que los efectos contra el CHC están mediados por vía del receptor CB2. De modo similar a los hallazgos en las células de glioma, se observó que los canabinoides desencadenan la muerte celular a través de la estimulación de una vía de estrés del retículo endoplasmático que activa la autofagia y promueve la apoptosis. En otras investigaciones se confirmó que los receptores CB1 y CB2 son posibles dianas en el carcinoma de pulmón de células no pequeñas. [16] y el cáncer de mama.[17]
En un estudio in vitro sobre el efecto del CBD en la muerte celular programada de líneas celulares de cáncer de mama, se observó que el CBD produjo la muerte celular programada, con independencia de los receptores CB1, CB2 o los receptores vaniloides. El CBD inhibió la supervivencia de las líneas celulares de cáncer de mama con receptor de estrógeno positivo y receptor de estrógeno negativo mediante la inhibición de la apoptosis, de modo dependiente de la concentración y, al mismo tiempo, con poco efecto en las células mamarias no oncógenas.[18] En otros estudios también se observó el efecto antitumoral de los canabinoides (es decir, CBD y THC) en modelos preclínicos de cáncer de mama.[19,20]
Además, se demostró que el CBD produce un efecto quimioprofiláctico en un modelo murino de cáncer de colon .[21] En este sistema experimental, el azoximetano aumentó las lesiones premalignas y malignas en el colon murino. La administración simultánea de azoximetano y CBD protegió de la formación de lesiones premalignas y malignas a los animales tratados. En experimentos in vitro con líneas celulares de cáncer colorrectal, los investigadores hallaron que el CBD protegía el ADN contra el daño oxidativo, aumentaba las concentraciones de endocanabinoides y reducía la proliferación celular. En un estudio posterior, los investigadores observaron que antagonistas selectivos de los receptores CB1, pero no de los receptores CB2, contrarrestaron el efecto antiproliferativo de CBD, lo que indica una participación de los receptores CB1.[22]
En otra investigación sobre los efectos antitumorales del CBD se examinó la función de la molécula de adhesión intercelular-1 (ICAM-1).[12] Se notificó que la expresión de ICAM-1 en las células tumorales tiene una correlación inversa con la metástasis del cáncer. En las líneas celulares del cáncer de pulmón, el CBD produjo un aumento regulado de ICAM-1, lo que llevó a la disminución de la proliferación de células cancerosas.
En un modelo in vivo de ratones con inmunodeficiencia combinada grave se generaron tumores subcutáneos mediante la inoculación de células de líneas celulares de carcinoma de pulmón de células no pequeñas humanas en los ratones.[23] El crecimiento tumoral se inhibió en el 60 % de los ratones tratados con THC, en comparación con los ratones de control tratados con vehículo. En las muestras tumorales se reveló que el THC tuvo efectos antiangiogénicos y antiproliferativos. Sin embargo, en la investigación con modelos de tumores murinos inmunocompetentes se demostró inmunodepresión y aumento del crecimiento tumoral en ratones tratados con THC.[24,25]
Además, se han estudiado los efectos antiinflamatorios de los fitocanabinoides y los canabinoides endógenos. En un estudio con ratones se demostró que es probable que la señalización del sistema canabinoide endógeno proporcione una protección intrínseca contra la inflamación del colon.[26] A partir de esto, se formuló la hipótesis de que los fitocanabinoides y endocanabinoides son útiles para la reducción del riesgo y en el tratamiento del cáncer colorrectal.[27-30]
También es posible que el CBD aumente la absorción de fármacos citotóxicos en las células malignas. Se observó que la activación del receptor de potencial transitorio vaniloide de tipo 2 (TRPV2) inhibe la proliferación de células del glioblastoma multiforme humano y supera la resistencia al fármaco la quimioterapéutico carmustina.[31] En un estudio se observó que la administración conjunta de THC y CBD en comparación con la monoterapia produjo mayor actividad antiproliferativa en un estudio in vitro con múltiples líneas celulares humanas de glioblastoma multiforme.[32] En un modelo in vitro, el CBD aumentó la activación de TRPV2 y la captación de fármacos citotóxicos; lo que produjo apoptosis de las células de glioma sin que se afectaran los astrocitos humanos normales. Esto indica que la administración conjunta de CBD y citotóxicos tal vez aumente la captación del fármaco y potencie la muerte celular de las células de glioma humano. Además, el CBD junto con el THC quizás aumenten la actividad antitumoral de los fármacos quimioterapéuticos clásicos, como la temozolomida, en algunos modelos murinos de cáncer.[13,33] En un metanálisis de 34 estudios in vitro e in vivo sobre el uso de canabinoides para el tratamiento del glioma se notificó que en todos los estudios menos en 1 los canabinoides destruyeron las células tumorales de forma selectiva.[34]
Efectos antieméticos
En investigaciones preclínicas se indicó que los endocanabinoides controlan de manera tónica las vías eméticas. Se piensa que los efectos antieméticos de los canabinoides están mediados por la interacción con el receptor 5-hidroxitriptamina 3 (5-HT3). Los receptores CB1 y 5-HT3 se encuentran en las neuronas gabaérgicas (que liberan GABA [ácido γ-aminobutírico]), donde tienen efectos opuestos en la liberación de GABA.[35] Es posible que también haya inhibición directa de las corrientes iónicas de compuerta del 5-HT3 mediante vías diferentes a las de los receptores CB1. Se ha observado que los antagonistas del receptor CB1 inducen la emesis en la musaraña enana, mientras que los agonistas canabinoides la revierten.[36] Se demostró que el receptor CB1 participa en la prevención de la emesis por la capacidad de los antagonistas de CB1 de revertir los efectos del THC y de otros canabinoides sintéticos, que son agonistas de CB1, de contener el vómito causado por el cisplatino en la musaraña casera y por el cloruro de litio en la musaraña enana. En este último modelo, también se observó eficacia del CBD.[37,38]
Estímulo del apetito
En muchos estudios con animales se mostró con anterioridad que el Δ-9-THC y otros canabinoides tienen un efecto estimulante sobre el apetito y que aumentan la ingesta de alimentos. Se cree que el sistema endógeno de canabinoides sirve como regulador del comportamiento alimentario. El canabinoide endógeno anandamida produce un aumento intenso del apetito en los ratones.[39] Además, es posible que los receptores CB1 en el hipotálamo participen en los aspectos de motivación o recompensa de la alimentación.[40]
Analgesia
La comprensión de los mecanismos de la analgesia causada por los canabinoides ha aumentado gracias al estudio de los receptores canabinoides, los endocanabinoides, y los agonistas y antagonistas sintéticos. Los canabinoides producen analgesia mediante mecanismos de acción supraespinales, espinales y periféricos, que actúan en vías de dolor ascendentes y descendentes.[41] El receptor CB1 se encuentra en el sistema nervioso central (SNC) y en las terminaciones de los nervios periféricos. De modo similar a los receptores de opioides, hay concentraciones altas del receptor CB1 en las regiones del encéfalo que regulan el procesamiento nociceptivo.[42] Los receptores CB2, que se encuentran sobre todo en el tejido periférico, se presentan en concentraciones muy bajas en el SNC. Gracias a la formulación de antagonistas de receptores específicos, se ha obtenido información adicional acerca de las funciones de los receptores y los canabinoides endógenos en la modulación del dolor.[43,44]
Los canabinoides quizás también contribuyan a la modulación del dolor a través de un mecanismo antiinflamatorio; se describió un efecto CB2 de los canabinoides que, al actuar sobre los receptores de mastocitos, atenúan la liberación de sustancias inflamatorias, como la histamina y la serotonina, y en los queratinocitos mejoran la liberación de analgésicos opioides.[45-47] En un estudio se notificó que la eficacia de los agonistas sintéticos de los receptores CB1 y CB2 fue comparable a la de la morfina en un modelo murino de dolor tumoral.[48]
Se ha observado que los canabinoides previenen la neuropatía causada por la quimioterapia en modelos de animales expuestos a paclitaxel, vincristina o cisplatino.[49-51]
Ansiedad y sueño
Se piensa que el sistema endocanabinoide cumple una función esencial en la regulación del estado de ánimo y en la extinción de memorias aversivas. En los estudios con animales se observó que el CBD tiene propiedades ansiolíticas. En el caso de las ratas, se observó que esas propiedades ansiolíticas están mediadas por mecanismos desconocidos.[52] Se han observado efectos ansiolíticos del CBD en múltiples modelos animales.[53,54]
También se ha demostrado que el sistema de endocanabinoides tiene una función importante en la modulación del ciclo de sueño y vigilia en las ratas.[55,56]
Bibliografía
- Adams IB, Martin BR: Cannabis: pharmacology and toxicology in animals and humans. Addiction 91 (11): 1585-614, 1996. [PUBMED Abstract]
- Grotenhermen F, Russo E, eds.: Cannabis and Cannabinoids: Pharmacology, Toxicology, and Therapeutic Potential. The Haworth Press, 2002.
- National Toxicology Program: NTP toxicology and carcinogenesis studies of 1-trans-delta(9)-tetrahydrocannabinol (CAS No. 1972-08-3) in F344 rats and B6C3F1 mice (gavage studies). Natl Toxicol Program Tech Rep Ser 446: 1-317, 1996. [PUBMED Abstract]
- Bifulco M, Laezza C, Pisanti S, et al.: Cannabinoids and cancer: pros and cons of an antitumour strategy. Br J Pharmacol 148 (2): 123-35, 2006. [PUBMED Abstract]
- Sánchez C, de Ceballos ML, Gomez del Pulgar T, et al.: Inhibition of glioma growth in vivo by selective activation of the CB(2) cannabinoid receptor. Cancer Res 61 (15): 5784-9, 2001. [PUBMED Abstract]
- McKallip RJ, Lombard C, Fisher M, et al.: Targeting CB2 cannabinoid receptors as a novel therapy to treat malignant lymphoblastic disease. Blood 100 (2): 627-34, 2002. [PUBMED Abstract]
- Casanova ML, Blázquez C, Martínez-Palacio J, et al.: Inhibition of skin tumor growth and angiogenesis in vivo by activation of cannabinoid receptors. J Clin Invest 111 (1): 43-50, 2003. [PUBMED Abstract]
- Blázquez C, González-Feria L, Alvarez L, et al.: Cannabinoids inhibit the vascular endothelial growth factor pathway in gliomas. Cancer Res 64 (16): 5617-23, 2004. [PUBMED Abstract]
- Guzmán M: Cannabinoids: potential anticancer agents. Nat Rev Cancer 3 (10): 745-55, 2003. [PUBMED Abstract]
- Blázquez C, Casanova ML, Planas A, et al.: Inhibition of tumor angiogenesis by cannabinoids. FASEB J 17 (3): 529-31, 2003. [PUBMED Abstract]
- Vaccani A, Massi P, Colombo A, et al.: Cannabidiol inhibits human glioma cell migration through a cannabinoid receptor-independent mechanism. Br J Pharmacol 144 (8): 1032-6, 2005. [PUBMED Abstract]
- Ramer R, Bublitz K, Freimuth N, et al.: Cannabidiol inhibits lung cancer cell invasion and metastasis via intercellular adhesion molecule-1. FASEB J 26 (4): 1535-48, 2012. [PUBMED Abstract]
- Velasco G, Sánchez C, Guzmán M: Towards the use of cannabinoids as antitumour agents. Nat Rev Cancer 12 (6): 436-44, 2012. [PUBMED Abstract]
- Cridge BJ, Rosengren RJ: Critical appraisal of the potential use of cannabinoids in cancer management. Cancer Manag Res 5: 301-13, 2013. [PUBMED Abstract]
- Vara D, Salazar M, Olea-Herrero N, et al.: Anti-tumoral action of cannabinoids on hepatocellular carcinoma: role of AMPK-dependent activation of autophagy. Cell Death Differ 18 (7): 1099-111, 2011. [PUBMED Abstract]
- Preet A, Qamri Z, Nasser MW, et al.: Cannabinoid receptors, CB1 and CB2, as novel targets for inhibition of non-small cell lung cancer growth and metastasis. Cancer Prev Res (Phila) 4 (1): 65-75, 2011. [PUBMED Abstract]
- Nasser MW, Qamri Z, Deol YS, et al.: Crosstalk between chemokine receptor CXCR4 and cannabinoid receptor CB2 in modulating breast cancer growth and invasion. PLoS One 6 (9): e23901, 2011. [PUBMED Abstract]
- Shrivastava A, Kuzontkoski PM, Groopman JE, et al.: Cannabidiol induces programmed cell death in breast cancer cells by coordinating the cross-talk between apoptosis and autophagy. Mol Cancer Ther 10 (7): 1161-72, 2011. [PUBMED Abstract]
- Caffarel MM, Andradas C, Mira E, et al.: Cannabinoids reduce ErbB2-driven breast cancer progression through Akt inhibition. Mol Cancer 9: 196, 2010. [PUBMED Abstract]
- McAllister SD, Murase R, Christian RT, et al.: Pathways mediating the effects of cannabidiol on the reduction of breast cancer cell proliferation, invasion, and metastasis. Breast Cancer Res Treat 129 (1): 37-47, 2011. [PUBMED Abstract]
- Aviello G, Romano B, Borrelli F, et al.: Chemopreventive effect of the non-psychotropic phytocannabinoid cannabidiol on experimental colon cancer. J Mol Med (Berl) 90 (8): 925-34, 2012. [PUBMED Abstract]
- Romano B, Borrelli F, Pagano E, et al.: Inhibition of colon carcinogenesis by a standardized Cannabis sativa extract with high content of cannabidiol. Phytomedicine 21 (5): 631-9, 2014. [PUBMED Abstract]
- Preet A, Ganju RK, Groopman JE: Delta9-Tetrahydrocannabinol inhibits epithelial growth factor-induced lung cancer cell migration in vitro as well as its growth and metastasis in vivo. Oncogene 27 (3): 339-46, 2008. [PUBMED Abstract]
- Zhu LX, Sharma S, Stolina M, et al.: Delta-9-tetrahydrocannabinol inhibits antitumor immunity by a CB2 receptor-mediated, cytokine-dependent pathway. J Immunol 165 (1): 373-80, 2000. [PUBMED Abstract]
- McKallip RJ, Nagarkatti M, Nagarkatti PS: Delta-9-tetrahydrocannabinol enhances breast cancer growth and metastasis by suppression of the antitumor immune response. J Immunol 174 (6): 3281-9, 2005. [PUBMED Abstract]
- Massa F, Marsicano G, Hermann H, et al.: The endogenous cannabinoid system protects against colonic inflammation. J Clin Invest 113 (8): 1202-9, 2004. [PUBMED Abstract]
- Patsos HA, Hicks DJ, Greenhough A, et al.: Cannabinoids and cancer: potential for colorectal cancer therapy. Biochem Soc Trans 33 (Pt 4): 712-4, 2005. [PUBMED Abstract]
- Liu WM, Fowler DW, Dalgleish AG: Cannabis-derived substances in cancer therapy--an emerging anti-inflammatory role for the cannabinoids. Curr Clin Pharmacol 5 (4): 281-7, 2010. [PUBMED Abstract]
- Malfitano AM, Ciaglia E, Gangemi G, et al.: Update on the endocannabinoid system as an anticancer target. Expert Opin Ther Targets 15 (3): 297-308, 2011. [PUBMED Abstract]
- Sarfaraz S, Adhami VM, Syed DN, et al.: Cannabinoids for cancer treatment: progress and promise. Cancer Res 68 (2): 339-42, 2008. [PUBMED Abstract]
- Nabissi M, Morelli MB, Santoni M, et al.: Triggering of the TRPV2 channel by cannabidiol sensitizes glioblastoma cells to cytotoxic chemotherapeutic agents. Carcinogenesis 34 (1): 48-57, 2013. [PUBMED Abstract]
- Marcu JP, Christian RT, Lau D, et al.: Cannabidiol enhances the inhibitory effects of delta9-tetrahydrocannabinol on human glioblastoma cell proliferation and survival. Mol Cancer Ther 9 (1): 180-9, 2010. [PUBMED Abstract]
- Torres S, Lorente M, Rodríguez-Fornés F, et al.: A combined preclinical therapy of cannabinoids and temozolomide against glioma. Mol Cancer Ther 10 (1): 90-103, 2011. [PUBMED Abstract]
- Rocha FC, Dos Santos Júnior JG, Stefano SC, et al.: Systematic review of the literature on clinical and experimental trials on the antitumor effects of cannabinoids in gliomas. J Neurooncol 116 (1): 11-24, 2014. [PUBMED Abstract]
- Pacher P, Bátkai S, Kunos G: The endocannabinoid system as an emerging target of pharmacotherapy. Pharmacol Rev 58 (3): 389-462, 2006. [PUBMED Abstract]
- Darmani NA: Delta(9)-tetrahydrocannabinol and synthetic cannabinoids prevent emesis produced by the cannabinoid CB(1) receptor antagonist/inverse agonist SR 141716A. Neuropsychopharmacology 24 (2): 198-203, 2001. [PUBMED Abstract]
- Darmani NA: Delta-9-tetrahydrocannabinol differentially suppresses cisplatin-induced emesis and indices of motor function via cannabinoid CB(1) receptors in the least shrew. Pharmacol Biochem Behav 69 (1-2): 239-49, 2001 May-Jun. [PUBMED Abstract]
- Parker LA, Kwiatkowska M, Burton P, et al.: Effect of cannabinoids on lithium-induced vomiting in the Suncus murinus (house musk shrew). Psychopharmacology (Berl) 171 (2): 156-61, 2004. [PUBMED Abstract]
- Mechoulam R, Berry EM, Avraham Y, et al.: Endocannabinoids, feeding and suckling--from our perspective. Int J Obes (Lond) 30 (Suppl 1): S24-8, 2006. [PUBMED Abstract]
- Fride E, Bregman T, Kirkham TC: Endocannabinoids and food intake: newborn suckling and appetite regulation in adulthood. Exp Biol Med (Maywood) 230 (4): 225-34, 2005. [PUBMED Abstract]
- Baker D, Pryce G, Giovannoni G, et al.: The therapeutic potential of cannabis. Lancet Neurol 2 (5): 291-8, 2003. [PUBMED Abstract]
- Walker JM, Hohmann AG, Martin WJ, et al.: The neurobiology of cannabinoid analgesia. Life Sci 65 (6-7): 665-73, 1999. [PUBMED Abstract]
- Meng ID, Manning BH, Martin WJ, et al.: An analgesia circuit activated by cannabinoids. Nature 395 (6700): 381-3, 1998. [PUBMED Abstract]
- Walker JM, Huang SM, Strangman NM, et al.: Pain modulation by release of the endogenous cannabinoid anandamide. Proc Natl Acad Sci U S A 96 (21): 12198-203, 1999. [PUBMED Abstract]
- Facci L, Dal Toso R, Romanello S, et al.: Mast cells express a peripheral cannabinoid receptor with differential sensitivity to anandamide and palmitoylethanolamide. Proc Natl Acad Sci U S A 92 (8): 3376-80, 1995. [PUBMED Abstract]
- Ibrahim MM, Porreca F, Lai J, et al.: CB2 cannabinoid receptor activation produces antinociception by stimulating peripheral release of endogenous opioids. Proc Natl Acad Sci U S A 102 (8): 3093-8, 2005. [PUBMED Abstract]
- Richardson JD, Kilo S, Hargreaves KM: Cannabinoids reduce hyperalgesia and inflammation via interaction with peripheral CB1 receptors. Pain 75 (1): 111-9, 1998. [PUBMED Abstract]
- Khasabova IA, Gielissen J, Chandiramani A, et al.: CB1 and CB2 receptor agonists promote analgesia through synergy in a murine model of tumor pain. Behav Pharmacol 22 (5-6): 607-16, 2011. [PUBMED Abstract]
- Ward SJ, McAllister SD, Kawamura R, et al.: Cannabidiol inhibits paclitaxel-induced neuropathic pain through 5-HT(1A) receptors without diminishing nervous system function or chemotherapy efficacy. Br J Pharmacol 171 (3): 636-45, 2014. [PUBMED Abstract]
- Rahn EJ, Makriyannis A, Hohmann AG: Activation of cannabinoid CB1 and CB2 receptors suppresses neuropathic nociception evoked by the chemotherapeutic agent vincristine in rats. Br J Pharmacol 152 (5): 765-77, 2007. [PUBMED Abstract]
- Khasabova IA, Khasabov S, Paz J, et al.: Cannabinoid type-1 receptor reduces pain and neurotoxicity produced by chemotherapy. J Neurosci 32 (20): 7091-101, 2012. [PUBMED Abstract]
- Campos AC, Guimarães FS: Involvement of 5HT1A receptors in the anxiolytic-like effects of cannabidiol injected into the dorsolateral periaqueductal gray of rats. Psychopharmacology (Berl) 199 (2): 223-30, 2008. [PUBMED Abstract]
- Crippa JA, Zuardi AW, Hallak JE: [Therapeutical use of the cannabinoids in psychiatry]. Rev Bras Psiquiatr 32 (Suppl 1): S56-66, 2010. [PUBMED Abstract]
- Guimarães FS, Chiaretti TM, Graeff FG, et al.: Antianxiety effect of cannabidiol in the elevated plus-maze. Psychopharmacology (Berl) 100 (4): 558-9, 1990. [PUBMED Abstract]
- Méndez-Díaz M, Caynas-Rojas S, Arteaga Santacruz V, et al.: Entopeduncular nucleus endocannabinoid system modulates sleep-waking cycle and mood in rats. Pharmacol Biochem Behav 107: 29-35, 2013. [PUBMED Abstract]
- Pava MJ, den Hartog CR, Blanco-Centurion C, et al.: Endocannabinoid modulation of cortical up-states and NREM sleep. PLoS One 9 (2): e88672, 2014. [PUBMED Abstract]
Estudios clínicos con seres humanos
Aspectos farmacológicos de Cannabis
Cuando se ingiere Cannabis por vía oral, hay una biodisponibilidad oral variable baja (6–20 %).[1,2] Las concentraciones plasmáticas máximas de Δ-9-tetrahidrocanabinol (THC) se producen después de 1 a 6 horas y se mantienen elevadas con una semivida terminal de 20 a 30 horas. Cuando se ingiere por vía oral, el Δ-9-THC se metaboliza primero en el hígado a 11-OH-THC, un metabolito psicoactivo potente. Los canabinoides inhalados se absorben rápido en el torrente sanguíneo con una concentración máxima en 2 a 10 minutos, que disminuye también rápido durante un período de 30 minutos, y generan menos metabolitos 11-OH psicoactivos.
Se sabe que los canabinoides interactúan con el sistema enzimático citocromo P450 hepático.[3,4] En un estudio se trató a 24 pacientes con cáncer con irinotecán por vía intravenosa (600 mg, n = 12) o docetaxel (180 mg, n = 12), seguidos 3 semanas después de los mismos fármacos administrados de manera simultánea con Cannabis medicinal en forma de un té de hierbas durante 15 días consecutivos, comenzando 12 días antes del segundo tratamiento.[4] La administración de Cannabis no influyó de manera significativa en la exposición y la eliminación de irinotecán o docetaxel, aunque la ruta de administración del té de hierbas quizá no reproduzca los efectos de la inhalación o la ingestión oral de los canabinoides liposolubles.
Los extractos de aceites de THC o de canabidiol (CBD) muy concentrados, se promueven de manera ilegal como posibles curas para el cáncer.[5] No se han evaluado en ensayos clínicos ni la actividad anticancerígena ni la inocuidad de estos aceites. Debido a que el CBD es un posible inhibidor de ciertas enzimas del sistema citocromo P450, el uso de aceites de CBD muy concentrados junto con terapias convencionales que se metabolizan mediante esas enzimas, tal vez aumente la toxicidad o disminuya la efectividad de estas terapias.[6,7]
Además, se han planteado múltiples problemas en cuanto a la fiabilidad y calidad de las pruebas analíticas de Cannabis, alegando el exceso de contenido de canabinoides en diferentes productos de Cannabis. En un estudio se observaron importantes incoherencias en el contenido de THC notificado debido a una estabilización insuficiente en la preparación de las muestras y en los métodos de análisis.[8]
Riesgo de cáncer
En varios estudios se obtuvo evidencia contradictoria sobre los riesgos de presentar diferentes tipos de cáncer relacionados con el consumo de cigarrillos de Cannabis.
En un análisis conjunto de 3 estudios de casos y cohortes de hombres del noroeste de África (430 casos y 778 controles), se observó un aumento significativo del riesgo de cáncer de pulmón entre los fumadores de tabaco que también inhalaban Cannabis.[9]
En un gran estudio retrospectivo de cohorte de 64 855 hombres de 15 a 49 años de los Estados Unidos, se observó que el consumo de Cannabis no se asoció con cánceres relacionados con el tabaco ni con una serie de neoplasias malignas comunes. Sin embargo, en el estudio se observó que, entre las personas no fumadoras, el haber consumido alguna vez Cannabis se relacionó con un aumento del riesgo de cáncer de próstata.[10]
En un estudio de casos y controles poblacional de 611 pacientes con cáncer de pulmón, se observó que la baja exposición crónica a Cannabis no se relacionó con un aumento de riesgo de cáncer de pulmón u otros cánceres del tracto aerodigestivo superior. En el estudio tampoco se observaron relaciones directas con ningún tipo de cáncer (oral, faríngeo, laríngeo, pulmonar o esofágico) al ajustar por factores de confusión como el consumo de cigarrillos.[11]
En una revisión sistemática de 19 estudios en los que se examinaron lesiones pulmonares premalignas o malignas en personas de 18 años o más que inhalaron Cannabis, se llegó a la conclusión de que los estudios de observación no permitieron demostrar ninguna relación estadísticamente significativa entre la inhalación de Cannabis y el cáncer de pulmón después de hacer el ajuste por consumo de tabaco.[12] En la revisión del metanálisis publicado, en el informe de la National Academies of Sciences, Engineering, and Medicine (NASEM) se llegó a la conclusión de que había una evidencia moderada, pero sin relación estadística, entre fumar Cannabis y la incidencia del cáncer de pulmón.[13]
En los estudios epidemiológicos en los que se examinó la relación entre el consumo de Cannabis y los carcinomas de células escamosas de cabeza y cuello, los resultados también fueron contradictorios. En un análisis conjunto de 9 estudios de casos y controles del U.S./American International Head and Neck Cancer Epidemiology (INHANCE) Consortium se incluyó información sobre 1921 casos de cáncer de orofaringe, 356 casos de cáncer de lengua y 7639 controles. En el estudio, se encontró que los fumadores de Cannabis tenían un aumento del riesgo de presentar cánceres de orofaringe y una disminución del riesgo de cáncer de lengua en comparación con quienes nunca fumaron Cannabis. Estos resultados del estudio reflejan los mismos efectos contradictorios de los canabinoides en la incidencia de cáncer observados en estudios previos e indican que se necesita más investigación para entender la posible función de la infección por el virus del papiloma humano.[14] En una revisión sistemática y un metanálisis de 9 estudios de casos y controles en los que participaron 13 931 personas, también se llegó a la conclusión de que no había suficientes datos para demostrar un vínculo favorable o desfavorable entre el consumo de cigarrillos de Cannabis y la incidencia de cánceres de cabeza y cuello.[15]
La hipótesis de que el consumo crónico de marihuana produce efectos adversos en los sistemas endocrino y reproductor humanos, impulsó a que se examinara la relación entre el consumo de Cannabis y la incidencia de tumores de células germinativas de testículo (TCGT).[16-18] En 3 estudios poblacionales de casos y controles se notificó una relación entre el consumo de Cannabis y el riesgo elevado de TCGT, en especial de tumores no seminoma o de características histológicas mixtas.[16-18] Sin embargo, los tamaños de las muestras en estos estudios fueron insuficientes para considerar la dosis de Cannabis al abordar las relaciones entre la actualidad, la frecuencia y la duración del consumo. En un estudio de 49 343 hombres suecos de 19 a 21 años enrolados en el servicio militar entre 1969 y 1970, se les preguntó a los participantes en el momento del reclutamiento acerca de su consumo de Cannabis y se les dio seguimiento de hasta 42 años.[19] En el estudio no se encontró ninguna correlación importante entre no haber consumido "nunca" Cannabis y presentar cáncer de testículo, pero se observó que el consumo “intenso” de Cannabis (más de 50 veces durante toda la vida) se relacionó con un aumento del riesgo de 2,5 veces. Las limitaciones del estudio se debieron a que se basó en la evaluación indirecta del consumo de Cannabis y que no se recopiló ninguna información sobre el consumo de Cannabis después del período de reclutamiento o si los cánceres de testículo eran de subtipo seminoma o no seminoma. Estos informes establecieron la necesidad de realizar estudios prospectivos de mayor tamaño y potencia; en particular, estudios sobre la evaluación de la función de la señalización endocanabinoide y los receptores canabinoides en los TCGT.
Se realizó un análisis de 84 170 participantes en el California Men’s Health Study para investigar la relación entre el consumo de Cannabis y la incidencia de cáncer de vejiga. Durante los 16 años de seguimiento, 89 usuarios de Cannabis (0,3 %) presentaron cáncer de vejiga, en comparación con 190 (0,4 %) de los hombres que notificaron que no consumían Cannabis (P < 0,001). Después del ajuste por edad, raza, origen étnico e índice de masa corporal, el consumo de Cannabis se relacionó con una reducción del 45 % en la incidencia de cáncer de vejiga (cociente de riesgos instantáneos, 0,55; intervalo de confianza [IC] 95 %, 0,33–1,00).[20]
En una monografía detallada de Health Canada sobre la marihuana se concluyó que, si bien hay muchos estudios celulares y moleculares que proporcionan evidencia sólida de que la marihuana inhalada es cancerígena, la evidencia epidemiológica de una relación entre el consumo de marihuana y el cáncer todavía no son concluyentes.[21]
Modelos de consumo de Cannabis en pacientes de cáncer
Se realizó una encuesta transversal de pacientes con cáncer atendidos en la Seattle Cancer Care Alliance durante un período de 6 semanas entre 2015 y 2016.[22] En el estado de Washington, se legalizó el uso medicinal de Cannabis en 1998 y su uso recreativo en 2012. De los 2737 participantes posibles, 936 (34 %) completaron el cuestionario anónimo. El 24 % de los pacientes se consideraron consumidores activos de Cannabis. Un número similar de pacientes lo inhalaban (70 %) o lo ingerían (70 %); fue común que lo consumieran de ambas formas (40 %). Los motivos del consumo de Cannabis, que no se excluían mutuamente, fueron: síntomas físicos (75 %), síntomas neuropsiquiátricos (63 %), consumo recreativo o por placer (35 %) y tratamiento de cáncer (26 %). Los síntomas físicos que se citaron con mayor frecuencia fueron dolor, náuseas y pérdida de apetito. La mayoría de los pacientes (74 %) declararon que preferirían obtener información sobre Cannabis de su equipo de atención del cáncer, pero menos del 15 % notificaron haber recibido información del personal médico o de enfermería a cargo del tratamiento.
Durante 6 meses se recopilaron los datos de 2970 pacientes con cáncer en Israel que usaron Cannabis proporcionada por el Gobierno para evaluar la mejora de los síntomas, en comparación con los valores iniciales.[23] Los síntomas que más mejoraron desde el inicio fueron los siguientes:
- Náuseas y vómitos (91 %).
- Trastornos del sueño (87,5 %).
- Agitación (87,5 %).
- Ansiedad y depresión (84,2 %).
- Prurito (82,1 %).
- Cefaleas (81,4 %).
Antes de comenzar el tratamiento, el 52,9 % de los pacientes notificaron puntajes de dolor en el intervalo entre 8 y 10, mientras que en el momento de la evaluación de los 6 meses solo el 4,6 % de los pacientes notificó esa intensidad. A partir de los datos observacionales, es difícil determinar si las mejoras se debieron a Cannabis o al tratamiento del cáncer.[23] De manera similar, en un estudio de un subgrupo de pacientes con cáncer del programa de Cannabis medicinal de Minnesota se analizaron los cambios en la gravedad de 8 síntomas (es decir, ansiedad, pérdida de apetito, depresión, trastornos del sueño, fatiga, náuseas, dolor y vómitos) que experimentaron estos pacientes.[24] Se observaron mejoras sintomáticas significativas (38,4–56,2 %) en pacientes con cada síntoma. Debido a la naturaleza observacional y a que no se usaron controles en este estudio, no es posible generalizar los hallazgos; sin embargo, como indicaron los autores, quizás sean útiles para diseñar estudios de investigación más rigurosos en el futuro.
El 42 % de las mujeres (257 de 612) con un diagnóstico de cáncer de mama en los últimos 5 años que participaron en una encuesta anónima en Internet notificaron que consumieron Cannabis para el alivio de los síntomas, en especial para el dolor (78 %), el insomnio (70 %), la ansiedad (57 %), el estrés (51 %), así como las náuseas y vómitos (46 %).[25] Entre los usuarios de Cannabis, el 79 % consumieron Cannabis durante el tratamiento del cáncer y el 75 % notificaron que Cannabis fue sumamente útil o muy útil para aliviar los síntomas. El 49 % de los usuarios de Cannabis sintieron que Cannabis sería útil para el tratamiento del mismo cáncer. Solo el 39 % de los participantes notificaron que analizaron el uso de Cannabis con el equipo médico.
Los pacientes con cáncer usan el Cannabis medicinal incluso en aquellos estados de los Estados Unidos en los que no ha sido legalizado. Los investigadores de la Medical University of South Carolina realizaron un estudio de encuestas en el que se analizó la prevalencia, tendencias y motivaciones que respaldan el uso de Cannabis entre los pacientes con cáncer y sobrevivientes en un estado sin acceso legal a Cannabis hasta 2023.[26] A pesar de la ausencia de acceso legal, un porcentaje significativo de los participantes notificaron que usaban el Cannabis para el tratamiento de los síntoma, como el dolor, las náuseas y otros síntomas. Además, los participantes notificaron mejoras en el estado de ánimo, el sueño y, en general, una mejor calidad de vida. Este estudio da una idea de por qué muchos pacientes y sobrevivientes de cáncer usan Cannabis para el manejo de los síntomas, destacando la importancia de comprender y abordar las necesidades de los pacientes, incluso en los estados sin acceso legal a Cannabis.
Tratamiento del cáncer
En una búsqueda realizada en PubMed, no se identificó ningún ensayo clínico en curso de Cannabis para el tratamiento del cáncer en seres humanos. El único ensayo de canabinoides publicado es un pequeño estudio piloto sobre la inyección intratumoral de Δ-9-THC en pacientes de glioblastoma multiforme recidivante, en el que no se comprobó ninguna ventaja clínica significativa.[27,28] En el Reino Unido se llevó a cabo un pequeño estudio exploratorio de fase IB con enmascaramiento doble en el que se usó nabiximols, en una proporción 1:1 de THC:CBD, que se administró en aerosol por la mucosa oral como extracto medicinal de Cannabis, y se combinó con temozolomida de dosis densa para el tratamiento de pacientes con glioblastoma multiforme recidivante.[29][Nivel de evidencia: 1iA] De los 27 pacientes incluidos en el estudio, 6 pertenecían a un grupo sin anonimato y 21 a un grupo aleatorizado (12 recibieron nabiximols y 9 placebo). La supervivencia sin progresión a 6 meses fue del 33 % en ambos grupos del estudio. Sin embargo, al cabo de un año, el 83,3 % de los pacientes que recibieron nabiximols estaban vivos, en comparación con el 44,4 % de aquellos que recibieron placebo (P = 0,042). Los investigadores advirtieron que este estudio de fase temprana no tenía la potencia necesaria para un criterio de valoración de supervivencia. Las tasas de supervivencia general a 2 años continuaron favoreciendo al grupo de nabiximols (50 %), en comparación con el grupo de placebo (22 %); estas tasas incluyeron resultados de los 6 pacientes del grupo sin anonimato que recibieron nabiximols.[29]
En un estudio de una serie de casos consecutivos realizado en 2016, 9 pacientes con diferentes estadios de tumores de encéfalo, incluso 6 pacientes con glioblastoma multiforme, recibieron 200 mg de CBD dos veces por día además de someterse a extirpación quirúrgica y quimiorradiación.[30][Nivel de evidencia: 3iiiA] Los autores informaron que todos los pacientes de la cohorte menos 1 seguían vivos en el momento de la publicación. Sin embargo, es probable que la heterogeneidad de los pacientes con tumores de encéfalo contribuyera a los hallazgos.
Otro grupo israelí propuso que los efectos antiinflamatorios e inmunodepresores del CBD podrían convertirlo en un fármaco complementario valioso para tratar a pacientes con enfermedad de injerto contra huésped (EICH) aguda que se sometieron a trasplante alogénico de células madre hematopoyéticas. Los autores investigaron la adición de 300 mg/d de CBD a la profilaxis estándar para la EICH en 48 pacientes adultos sometidos a trasplantes, en su mayoría debido a leucemia aguda o síndrome mielodisplásico (NCT01385124 y NCT01596075).[31] La combinación del CBD con la profilaxis estándar para la EICH fue inocua. En comparación con 101 controles históricos que se trataron con profilaxis estándar, los pacientes que recibieron CBD presentaron una incidencia más baja de EICH de grado II a grado IV, lo cual indica la necesidad de realizar un ensayo controlado aleatorizado (ECA).
Los datos clínicos sobre el uso pediátrico de Cannabis como terapia contra el cáncer se limita a unos pocos informes de casos.[32,33]
Una revisión de la literatura médica muestra evidencia de un creciente interés en la investigación del uso de Cannabis en el tratamiento del cáncer.[34]
Efecto antiemético
Canabinoides
A pesar de los avances en el tratamiento farmacológico y no farmacológico, las náuseas y los vómitos (NyV) siguen siendo efectos secundarios angustiantes para los pacientes con cáncer y sus familias. En 1986 se aprobó en los Estados Unidos el dronabinol, un Δ-9-THC sintético como antiemético para su uso durante la administración de la quimioterapia para el cáncer. La nabilona, un derivado sintético de Δ-9-THC, se aprobó por primera vez en Canadá en 1982 y ahora también está disponible en los Estados Unidos.[35] La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el dronabinol y la nabilona para el tratamiento de las NyV inducidos por la quimioterapia administrada a los pacientes de cáncer que no respondieron a la terapia antiemética convencional. En numerosos ensayos clínicos y metanálisis se demostró que el dronabinol y la nabilona son eficaces en el tratamiento de las NyV causados por la quimioterapia.[36-39] En las National Comprehensive Cancer Network Guidelines se recomiendan los canabinoides como un avance muy importante en el tratamiento de las NyV relacionados con la quimioterapia.[40] En las pautas sobre el uso de antieméticos de la American Society for Clinical Oncology (ASCO), actualizadas en 2017, se recomienda el uso de los canabinoides aprobados por la FDA, dronabinol o nabilona, para tratar las NyV que no responden a la terapia con antieméticos.[41]
En una revisión sistemática, se estudiaron 30 estudios aleatorizados de comparaciones de Δ-9-THC con placebo u otros antieméticos de los que se disponía de datos sobre eficacia y perjuicios.[42] Se probaron la nabilona oral, el dronabinol oral y el levonantradol intramuscular (un análogo sintético del dronabinol). No se incluyeron ensayos de Cannabis inhalado. En los 1366 pacientes incluidos en la revisión, se observó que los canabinoides fueron más eficaces que los antieméticos convencionales proclorperazina, metoclopramida, clorpromazina, tietilperazina, haloperidol, domperidona y alizaprida. Sin embargo, los canabinoides no fueron más eficaces para los pacientes que recibían quimioterapia emetogénica muy baja o muy alta. Los efectos secundarios incluyeron efectos psicoactivos, euforia, sedación o somnolencia, mareos, disforia o depresión, alucinaciones, paranoia e hipotensión.[42]
En otro análisis de 15 estudios controlados se comparó la nabilona con placebo o con los fármacos antieméticos disponibles.[43] Entre 600 pacientes con cáncer, se observó que la nabilona era superior a la proclorperazina, domperidona y alizaprida, por lo que se apoyó el consumo continuo de nabilona.
En un metanálisis de Cochrane de 23 ECA, se analizaron estudios realizados entre 1975 y 1991 en los que se estudiaron el dronabinol o la nabilona como monoterapia o como medicamentos complementarios a los antagonistas de dopamina convencionales que eran los antieméticos estándar en ese momento.[44] Los regímenes quimioterapéuticos incluyeron fármacos con posibles efectos eméticos bajos, moderados o altos. En el metanálisis se clasificó la calidad de la evidencia como insuficiente para la mayoría de los resultados. En la revisión se concluyó que era más probable que las personas notificaran ausencia completa de NyV cuando recibían canabinoides, en comparación con placebo, aunque fue más probable que se retiraran del estudio debido a efectos adversos. Las personas notificaron una mayor preferencia por los canabinoides que por un placebo o la proclorperazina. No hubo ninguna diferencia en el efecto antiemético de los canabinoides, en comparación con la proclorperazina. Los autores concluyeron que es posible que los medicamentos a base de Cannabis resulten útiles para tratar las NyV inducidos por la quimioterapia que son resistentes al tratamiento; sin embargo, advirtieron que quizá su evaluación cambie según la disponibilidad de regímenes antieméticos nuevos.
Al menos el 50 % de los pacientes que reciben quimioterapia de riesgo emetógeno moderado sufren NyV tardíos inducidos por la quimioterapia. Aunque se aprobó el uso de los antagonistas selectivos de la neurocinina 1 que inhiben la sustancia P para las NyV tardíos, antes de que estuvieran disponibles se llevó a cabo un estudio para evaluar los efectos del dronabinol, el ondansetrón, o la combinación de ambos, para la prevención de las NyV tardíos provocados por la quimioterapia.[45] En la actualidad, el ondansetrón, un antagonista del receptor 5-hidroxitriptamina 3 (5-HT3) de la serotonina, es uno de los compuestos principales del arsenal terapéutico antiemético. En este ensayo, el objetivo principal fue evaluar la respuesta entre 2 y 5 días después de la quimioterapia de riesgo emetógeno moderado o alto. Se examinó la eficacia en 61 pacientes. La respuesta completa —un criterio de valoración combinado— que incluyó la intensidad de las náuseas, los vómitos o las arcadas y el uso de medicamentos de rescate fue similar con dronabinol (54 %), ondansetrón (58 %) y terapia combinada (47 %), en comparación con un placebo (20 %). La ausencia de náuseas fue más común en los grupos de tratamiento activo (71 % con dronabinol, 64 % con ondansetrón y 53 % con terapia combinada) que en el grupo de placebo (15 %; P < 0,05 vs. placebo para todos). Los pacientes que recibieron dronabinol presentaron tasas más bajas de intensidad de náuseas y episodios de vómitos o arcadas; esto indica que el dronabinol se compara de forma favorable con el ondansetrón cuando el inhibidor de la sustancia P es el medicamento de preferencia.
Para obtener más información, consultar la sección Cannabis en el resumen Náuseas y vómitos relacionados con el tratamiento del cáncer.
Cannabis
En 3 ensayos se evaluó la eficacia de Cannabis inhalado para las NyV causados por la quimioterapia.[46-49] En 2 de estos estudios se permitió la inhalación de Cannabis solo después del fracaso de la administración de dronabinol. En el primer ensayo, no se logró ningún efecto antiemético de la marihuana en pacientes tratados con ciclofosfamida o doxorrubicina,[46] pero en el segundo ensayo se halló un efecto antiemético superior y estadísticamente significativo de la inhalación de Cannabis versus placebo en pacientes que recibían dosis altas de metotrexato.[47] El tercero fue un ensayo aleatorizado con enmascaramiento doble y controlado con placebo que incluyó a 20 adultos en quienes se evaluaron la marihuana inhalada y el THC oral. Una cuarta parte de los pacientes notificaron una respuesta antiemética favorable con las terapias con canabinoides. Este último estudio fue publicado en 1984 en forma de resumen. Al parecer, no se publicó ningún informe completo con detalles de los métodos y los resultados; esto limita la interpretación minuciosa de la importancia de los hallazgos.[48]
Los antieméticos más nuevos (por ejemplo, los antagonistas del receptor 5-HT3) no se han comparado de manera directa con Cannabis ni canabinoides en pacientes con cáncer. No obstante, Cannabis en un pequeño estudio piloto, aleatorizado controlado con placebo y con enmascaramiento doble, llevado a cabo en España, se observó que el nabiximols, un aerosol de administración en la mucosa oral de extracto de Cannabis, formulado en una proporción 1:1 de THC:CBD, sirve para tratar las NyV relacionados con la quimioterapia.[50][Nivel de evidencia: 1iC]
En un ensayo de fase II/III llevado a cabo en Australia y Nueva Zelandia participaron pacientes con un tumor sólido o neoplasia maligna hematológica en cualquier estadio (n = 147). Los pacientes recibieron una cápsula de THC:CBD o placebo en los días -1 a 5 para la prevención secundaria de las NyV causados por la quimioterapia en combinación con antieméticos recomendados para la quimioterapia de riesgo emetogénico moderado o alto.[51] El criterio primario de valoración fue la respuesta completa, definida como ausencia de emesis o uso de medicamentos de rescate durante las horas 0–120. El grupo de THC:CBD tuvo una tasa de respuesta más alta (24 %) en comparación con el grupo de placebo (8 %). Los efectos secundarios de moderados a graves más frecuentes observados en el grupo de intervención fueron sedación, ansiedad transitoria y mareo.
En las pautas sobre el uso de antieméticos de la ASCO actualizadas en 2020, se menciona que la evidencia científica es insuficiente para recomendar el uso medicinal de la marihuana en la prevención o tratamiento de las NyV de los pacientes de cáncer que reciben quimioterapia o radioterapia.[41]
Estímulo del apetito
Los pacientes con cáncer en ocasiones presentan anorexia, saciedad precoz, pérdida de peso y caquexia. Estos pacientes se enfrentan no solo con la desfiguración relacionada con la consunción, sino que además no pueden participar en las interacciones sociales durante las comidas.
Canabinoides
En 4 ensayos controlados se evaluó el efecto del THC oral en las medidas de apetito, apreciación de alimentos, ingesta calórica y pérdida de peso en pacientes con neoplasias malignas en estadio avanzado. En 3 ensayos controlados con placebo relativamente pequeños (N = 52; N = 46; N = 65), se observó que el THC oral mejoró 1 o más de esos resultados.[52-54] En un estudio en el que se usó un control activo se evaluó la eficacia del dronabinol solo o con acetato de megestrol en comparación con el acetato de megestrol solo para el tratamiento de la anorexia relacionada con el cáncer.[55] En este estudio aleatorizado con enmascaramiento doble de 469 adultos con cáncer avanzado y pérdida de peso, los pacientes recibieron 2,5 mg de THC oral 2 veces por día, 800 mg de megestrol oral diario o ambos. Al cabo de 8 a 11 semanas, el apetito aumentó un 75 % en el grupo de megestrol y el peso se incrementó en un 11 %, en comparación con un aumento del 49 % en el apetito y del 3 % en peso en el grupo de THC oral. Estas diferencias entre los grupos fueron estadísticamente significativas a favor del acetato de megestrol. Además, la terapia combinada no ofreció ningún beneficio adicional a los proporcionados por el acetato de megestrol solo. Los autores llegaron a la conclusión de que el dronabinol, en comparación con el acetato de megestrol, no ayudó a aumentar el apetito ni el peso en pacientes con cáncer avanzado.
Cannabis
En ensayos realizados en la década de 1980 que incluyeron controles sanos, la inhalación de Cannabis llevo a un aumento en la ingesta calórica, sobre todo en forma de bocadillos entre comidas, con un aumento de la ingesta de alimentos grasos y dulces.[56,57]
A pesar del gran interés de los pacientes en las preparaciones orales de Cannabis para mejorar el apetito, solo hay un ensayo sobre el extracto de Cannabis para estimular el apetito. En un ECA, los investigadores compararon la inocuidad y eficacia de un extracto de Cannabis administrado por vía oral (2,5 mg de THC y 1 mg de CBD), THC (2,5 mg) o un placebo para el tratamiento de la anorexia o la caquexia relacionadas con el cáncer. Un total de 243 pacientes con cáncer avanzado recibieron tratamiento 2 veces por día durante 6 semanas. Aunque todos los extractos fueron bien tolerados, no se observaron diferencias en el apetito de los pacientes o la calidad de vida en los 3 grupos con estas dosis y esta duración de la intervención.[58]
No se ha publicado ningún estudio en el que se evalúen los efectos de Cannabis inhalado en el apetito de pacientes con cáncer.
Analgesia
Canabinoides
El tratamiento del dolor mejora la calidad de vida de un paciente durante todos los estadios del cáncer. Se han analizado los mecanismos de la analgesia ocasionada por canabinoides gracias al estudio de los receptores canabinoides, los endocanabinoides y los agonistas y antagonistas sintéticos.[59][Nivel de evidencia: 1iC] El receptor CB1 se encuentra en el sistema nervioso central (SNC) y en las terminaciones de los nervios periféricos.[60] Los receptores CB2 se encuentran sobre todo en el tejido periférico y se expresan solo en cantidades bajas en el SNC. Si bien solo los agonistas CB1 ejercen actividad analgésica en el SNC, tanto los agonistas CB1 como los CB2 tienen actividad analgésica en el tejido periférico.[61,62]
El dolor del cáncer es el resultado de la inflamación, la invasión en los huesos u otras estructuras sensibles al dolor, así como lesiones en los nervios. Cuando el dolor producido por el cáncer es intenso y persistente, a menudo es resistente al tratamiento con opioides.
En 2 estudios se examinó el efecto de Δ-9-THC en el dolor producido por el cáncer. En el primero, que fue un estudio controlado con placebo y con enmascaramiento doble que incluyó a 10 pacientes, se midieron la intensidad y el alivio del dolor.[63] Se notificó que se relacionaron dosis de 15 mg y 20 mg del canabinoide Δ-9-THC con efectos analgésicos, efectos antieméticos y estimulación del apetito.
En un estudio de seguimiento de dosis única con 36 pacientes, 10 mg de Δ-9-THC produjeron efectos analgésicos durante un período de observación de 7 horas que fueron comparables a los efectos de una dosis de 60 mg de codeína, y que la dosis de 20 mg de Δ-9-THC inducía efectos equivalentes a una dosis de 120 mg de codeína.[64] Se observó que las dosis más altas de THC eran más sedantes que la codeína.
En otro estudio se examinó el efecto de un extracto de la planta con un contenido controlado de canabinoides en un aerosol para administración en la mucosa oral. En un estudio multicéntrico con enmascaramiento doble controlado con placebo, se comparó el extracto de THC:CBD nabiximols con un extracto de THC solo para el tratamiento analgésico de pacientes con cáncer avanzado que presentaban dolor causado por cáncer de moderado a grave. Los pacientes se asignaron a 1 de los 3 grupos de tratamiento siguientes: extracto de THC:CBD, extracto de THC o placebo. Los investigadores concluyeron que el extracto de THC:CBD era eficaz para el alivio del dolor en pacientes con cáncer avanzado cuyo dolor no se había aliviado por completo con opioides potentes.[65] En un ensayo aleatorizado de dosis escalonadas y controlado con placebo en pacientes con cáncer que recibían tratamiento con opioides sin control adecuado del dolor crónico, se observó que las dosis bajas de THC:CBD (1–4 y 6–10 pulverizaciones por día) del aerosol para administración en la mucosa oral produjeron un control del dolor y de los trastornos en el sueño que resultó significativamente mejor que el del placebo. Los efectos adversos se relacionaron con la dosis y solo el grupo de dosis altas (11–16 pulverizaciones por día) tuvo una comparación desfavorable con el grupo de placebo. Estos estudios proporcionan evidencia alentadora sobre el efecto analgésico adyuvante de THC:CBD en esta población de pacientes con resistencia al tratamiento con opioides, y podría representar la oportunidad de abordar este importante problema clínico.[66] En un estudio de extensión sin anonimato de 43 pacientes que participaron en el estudio aleatorizado, se observó que algunos pacientes continuaron manifestando alivio del dolor causado por el cáncer mediante el uso a largo plazo del aerosol de THC:CBD para administración en la mucosa oral, sin que fuera necesario aumentar la dosis del aerosol o de otros analgésicos.[67]
En un estudio de observación, se evaluó la eficacia de la nabilona en pacientes con cáncer avanzado que experimentaban dolor y otros síntomas (anorexia, depresión y ansiedad). Los investigadores notificaron que los pacientes que usaron nabilona tuvieron un mejor control del dolor, las náuseas, la ansiedad y el sufrimiento, en comparación con los pacientes que no recibieron tratamiento. La nabilona también se relacionó con una disminución del consumo de opioides, fármacos antiinflamatorios no esteroideos, antidepresivos tricíclicos, gabapentina, dexametasona, metoclopramida y ondansetrón.[68]
Cannabis
En los estudios con animales se indicó un efecto analgésico sinérgico cuando se combinan canabinoides con opioides. Se notificaron los resultados de un estudio sobre interacción farmacocinética. En este estudio de 21 pacientes con dolor crónico se administró Cannabis vaporizado junto con morfina de liberación prolongada u oxicodona durante 5 días.[69] Los pacientes que recibieron Cannabis vaporizado y morfina de liberación prolongada presentaron una disminución estadísticamente significativa en su puntaje medio de dolor durante el período de 5 días; los que recibieron Cannabis vaporizado y oxicodona no presentaron dicha disminución. Estos hallazgos se deben verificar mediante otros estudios antes de que se justifiquen las recomendaciones a favor de este abordaje en la práctica clínica general.
Es posible que los pacientes con cáncer experimenten dolor neuropático, en particular, si se tratan con quimioterapia con derivados de platino o taxanos. En 2 ECA de Cannabis inhalado en pacientes con neuropatía periférica u otro dolor neuropático, se observó que el dolor se redujo en pacientes que recibieron Cannabis inhalado, en comparación con quienes recibieron un placebo.[70,71] En un análisis retrospectivo se evaluó el efecto de Cannabis sobre la neuropatía periférica causada por la quimioterapia (NPCQ) en pacientes con cáncer israelíes que recibieron regímenes a base de oxaliplatino para neoplasias malignas gastrointestinales.[72][Nivel de evidencia: 2Diii] Los pacientes se dividieron en 3 grupos según su exposición a Cannabis: el grupo que comenzó con Cannabis (recibió Cannabis antes de empezar con oxaliplatino), el grupo que comenzó con oxaliplatino (recibió oxaliplatino antes de empezar con Cannabis), y los grupos de control (no recibieron Cannabis). Se observó una diferencia significativa en la NPCQ de grado 2 a 3 entre los pacientes que recibieron Cannabis (15,3 %) y los controles (27,9 %) (P < 0,001). El efecto de ausencia de neuropatía fue más notable en aquellos que recibieron Cannabis primero (75 %) que en aquellos que recibieron oxaliplatino primero (46,2 %) (P < 0,001). Algunas de las limitaciones de este estudio fueron su diseño retrospectivo y que la documentación sobre el uso de Cannabis fue cualitativa, en lugar de cuantitativa.
En un estudio piloto, aleatorizado, controlado con placebo y de diseño cruzado sobre el uso de nabiximols en 16 pacientes con dolor neuropático causado por la quimioterapia, no se observó ninguna diferencia significativa entre los grupos de tratamiento y de placebo. En un análisis sobre la respuesta al tratamiento, se observó que 5 pacientes comunicaron disminución de por lo menos 2 puntos del dolor en una escala de 11 puntos, lo que indica que se justifica un estudio de seguimiento más grande.[73]
En un ensayo controlado aleatorizado en la vida real se estudió el uso de Cannabis en pacientes con cáncer avanzado que recibieron atención en un entorno de práctica oncológica comunitaria (148 examinados; 30 asignados al azar; 18 analizados).[74] Una vez certificados por los oncólogos, se asignó al azar a los participantes para recibir Cannabis temprana o retrasar la administración de Cannabis medicinal 3 meses como parte de un programa de Cannabis patrocinado por el estado. El grupo de Cannabis temprana presentó un uso estable de opioides, en comparación con el grupo en el que se retrasó el uso de Cannabis medicinal; este último presentó un aumento en el uso de opioides durante el período de estudio de 3 meses. En general, no hubo cambios significativos en la calidad de vida o en los puntajes de los síntomas entre los grupos, y no tuvieron efectos adversos relacionados con Cannabis. Las limitaciones fueron la variedad de tipos de cáncer y la ausencia de uso consistente de productos de Cannabis (se dispensaron 108 productos de Cannabis durante el período del estudio).
Ansiedad y sueño
Canabinoides
En un estudio piloto pequeño de analgesia, en el que participaron 10 pacientes con dolor causado por un cáncer, se observó entre los criterios de valoración secundarios que las dosis de 15 mg y 20 mg del canabinoide Δ-9-THC se relacionaron con efectos ansiolíticos.[63][Nivel de evidencia: 1iC]
En un estudio pequeño controlado con placebo de dronabinol en pacientes con cáncer con percepción quimiosensorial alterada también se señaló el aumento de la calidad del sueño y la relajación en pacientes tratados con THC.[53][Nivel de evidencia: 1iC]
Cannabis
A menudo, los pacientes experimentan mejora del estado de ánimo después de la exposición a Cannabis, según su experiencia previa. En una serie de casos de 5 pacientes que inhalaron Cannabis, se examinaron los efectos analgésicos respecto al dolor crónico y se notificó que los pacientes que consumieron Cannabis mejoraron su estado de ánimo, la sensación de bienestar y presentaron menos ansiedad.[75]
Otro efecto común de Cannabis es la somnolencia. En un estudio pequeño controlado con placebo de dronabinol en pacientes con cáncer con percepción quimiosensorial alterada, también se señaló el aumento de la calidad del sueño y la relajación en pacientes tratados con THC.[53]
En un estudio canadiense, en el que se investigó la calidad de vida mediante los instrumentos del EuroQol-5D y del Edmonton Symptom Assessment System, se emparejaron 74 pacientes de cáncer de cabeza y cuello recién diagnosticado, que se autodefinían como usuarios actuales de Cannabis, con 74 pacientes que no eran usuarios.[76] Los usuarios de Cannabis tuvieron puntajes significativamente más bajos en los dominios de ansiedad o depresión (diferencia, 0,74; IC 95 %, 0,557–0,930) y de dolor o malestar (diferencia, 0,29; IC 95 %, 0,037–1,541). Los usuarios de Cannabis estaban también menos cansados, tenían más apetito y un mejor bienestar general.
En un estudio de fase II con enmascaramiento doble y de un solo centro, de 2 proporciones (1:1 [THC:CBD] y 4:1 [THC:CBD]) de aceite de Cannabis medicinal administrado por vía oral, se inscribieron pacientes con glioma recidivante o inoperable de grado alto. Los investigadores evaluaron los efectos secundarios y la Functional Assessment of Cancer Therapy-Brain (FACT-Br) al inicio y a las 12 semanas como criterio principal de valoración.[77] No hubo ninguna diferencia en el criterio principal de valoración; sin embargo, se observaron algunas diferencias significativas en los subpuntajes de la FACT-Br (es decir, el bienestar físico, el funcional y el del sueño favorecieron la proporción 1:1) y estos criterios de valoración serían apropiados para futuras investigaciones.
Tratamiento de los síntomas con el canabidiol
En un ensayo aleatorizado con enmascaramiento doble y controlado por placebo (n = 144) se evaluó el efecto del aceite de canabidiol oral (50–200 mg 3 veces al día) sobre el puntaje total de sufrimiento por síntomas (PTSS), una medida de la carga total de los síntomas del cáncer.[78] Todos los pacientes recibieron atención inicial por especialistas en cuidados paliativos. No se observaron diferencias significativas en la mediana de PTSS entre los 2 grupos en ninguno de los momentos de evaluación (día 14 y día 28). Este estudio tuvo varias limitaciones, como la heterogeneidad de la población de pacientes, una carga baja de síntomas de los pacientes al inicio y un índice elevado de retirada de pacientes en ambos grupos de estudio.
Uso medicinal de Cannabis y canabinoides en población pediátrica
Un número creciente de pacientes pediátricos busca aliviar los síntomas mediante el tratamiento con Cannabis o canabinoides, aunque los estudios son limitados.[79] La American Academy of Pediatrics no ha avalado el uso de Cannabis ni canabinoides debido a preocupaciones sobre su efecto en el desarrollo del encéfalo.
En un estudio retrospectivo realizado en Israel con 50 pacientes oncológicos pediátricos a los que se les prescribió Cannabis medicinal durante un período de 8 años, se notificó que las indicaciones más frecuentes fueron las siguientes:[80]
- Náuseas y vómitos.
- Estado de ánimo deprimido.
- Alteraciones del sueño.
- Falta de apetito y pérdida de peso.
- Dolor.
La mayoría de los pacientes (n = 30) recibió Cannabis en forma de gotas de aceite oral y algunos de los niños mayores inhalaron Cannabis vaporizado o combinaron la inhalación con aceites orales. En entrevistas estructuradas con los progenitores y, cuando fue oportuno, con los hijos, se observó que 40 pacientes (80 %) notificaron una satisfacción general de grado alto con el uso de Cannabis; los efectos secundarios fueron poco frecuentes y de corta duración.[80] Los estudios de encuestas revelan que la mayoría de los pediatras que respondieron en los Estados Unidos y Canadá apoyaron el uso de Cannabis medicinal para el tratamiento de los síntomas en pacientes pediátricos con cáncer.[81,82]
Estudios clínicos de Cannabis y canabinoides
| Referencia | Diseño del ensayo | Afección o tipo de cáncer | Grupos de tratamiento (inscritos; tratados; placebo; control sin tratamiento)b | Resultadosc | Terapia simultánea utilizadad | Puntaje de nivel de evidencia científicae |
|---|---|---|---|---|---|---|
| 5-HT3 = 5-hidroxitriptamina 3; NVCQ = náuseas y vómitos causados por la quimioterapia; NyV = náuseas y vómitos; ECA = ensayo controlado aleatorizado. | ||||||
| aPara obtener más información y la definición de los términos, consultar el texto y el Diccionario de cáncer del NCI. | ||||||
| bEs posible que el número de pacientes tratados más el número de pacientes del grupo de control no sea igual al número de pacientes inscritos; el número de pacientes inscritos es igual al número de pacientes inicialmente registrados o considerados por los investigadores que realizaron un estudio; el número de pacientes tratados es igual al número de pacientes inscritos a los que se sometió al tratamiento en estudio y cuyos resultados se notificaron. | ||||||
| cLa evidencia más sólida respalda que el tratamiento en estudio es eficaz o que mejora de otra manera el bienestar de los pacientes con cáncer. | ||||||
| dTratamiento simultáneo de los síntomas tratados (no cancerosos). | ||||||
| ePara obtener más información sobre el análisis de los niveles de evidencia científica y los puntajes, consultar Niveles de evidencia de los estudios sobre las terapias integrales, alternativas y complementarias en seres humanos con cáncer. | ||||||
| [77] | ECA | Gliomas de grado alto | 88; 45 (1:1), 43 (4:1); ninguno | No se encontraron diferencias en el criterio principal de valoración | Dexametasona, temozolomida, bevacizumab, lomustina | 1iC |
| [46] | ECA | NVCQ | 8; 8; ninguno | No se notificó ningún efecto antiemético | No | 1iC |
| [47] | ECA | NVCQ | 15; 15; ninguno | Disminución de las NyV | No | 1iiC |
| [50] | ECA piloto | NVCQ | 16; 7; 9 | Disminución de NyV tardíos | Antagonistas del receptor 5-HT3 | 1iC |
| [69] | Ensayo no aleatorizado | Dolor crónico | 21;10 (morfina), 11 (oxicodona); ninguno | Disminución del dolor | Sí, morfina, oxicodona | 2C |
| [76] | Estudio prospectivo de cohorte | Ansiedad, dolor, depresión, pérdida del apetito | 148; 74; 74 | Disminución del dolor, ansiedad, depresión, aumento del apetito | Se desconoce | 2C |
| Referencia | Diseño del ensayo | Afección o tipo de cáncer | Grupos de tratamiento (inscritos; tratados; placebo; control sin tratamiento)b | Resultadosc | Terapia simultánea utilizadad | Puntaje de nivel de evidencia científicae |
|---|---|---|---|---|---|---|
| CBD = canabidiol; AINE = medicamento antiinflamatorio no esteroide; ECA = ensayo controlado aleatorizado; THC = Δ-9-tetrahidrocanabinol. | ||||||
| aPara obtener más información y la definición de los términos, consultar el texto y el Diccionario de cáncer del NCI. | ||||||
| bEs posible que el número de pacientes tratados más el número de pacientes del grupo de control no sea igual al número de pacientes inscritos; el número de pacientes inscritos es igual a número de pacientes inicialmente registrados o considerados por los investigadores que realizaron un estudio; el número de pacientes tratados es igual al número de pacientes inscritos a los que se sometió al tratamiento en estudio y cuyos resultados se notificaron. | ||||||
| cLa evidencia más sólida respalda que el tratamiento en estudio es eficaz o que mejora de otra manera el bienestar de los pacientes con cáncer. | ||||||
| dTratamiento simultáneo de los síntomas tratados (no cancerosos). | ||||||
| ePara obtener más información sobre el análisis de los niveles de evidencia científica y los puntajes, consultar Niveles de evidencia de los estudios sobre las terapias integrales, alternativas y complementarias en seres humanos con cáncer. | ||||||
| [55] | ECA | Anorexia relacionada con el cáncer | 469; dronabinol 152, acetato de megestrol 159, o ambos 158; ninguno | El acetato de megestrol indujo aumento del apetito y del peso corporal en los pacientes con cáncer avanzado, en comparación con el dronabinol solo | No | 1iC |
| [53] | ECA piloto | Apetito | 21; 11; 10 | El THC, comparado con placebo, mejoró y aumentó el gusto y el olfato | No | 1iC |
| [58] | ECA | Síndrome de caquexia y anorexia relacionado con el cáncer | 243; extracto de Cannabis: 95, THC: 100; 48 | No se encontraron diferencias en el apetito o en la calidad de vida de los pacientes | No | 1iC |
| [83] | ECA | Apetito | 139; 72; 67 | Aumento del apetito | No | 1iC |
| [54] | ECA | Anorexia | 47; 22; 25 | Aumento del aporte calórico | No | 1iC |
| [63] | ECA | Dolor | 10; 10; ninguno | Alivio del dolor | No | 1iC |
| [65] | ECA | Dolor | 177; 60 (THC:CBD), 58 (THC); 59 | THC: el grupo que recibió el extracto de CBD tuvo menos dolor | Sí, opioides | 1iC |
| [66] | ECA | Dolor | 360; 269; 91 | Disminución del dolor en el grupo que recibió una dosis baja | Sí, opioides | 1iC |
| [67] | Extensión sin anonimato | Dolor | 43; 39 (THC:CBD), 4 (THC), ninguno | Disminución del dolor | Sí, opioides | 2C |
| [68] | Estudio de observación | Dolor | 112; 47; 65 | Disminución del dolor | Sí, opioides, AINE, gabapentina | 2C |
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Adams IB, Martin BR: Cannabis: pharmacology and toxicology in animals and humans. Addiction 91 (11): 1585-614, 1996. [PUBMED Abstract]
- Agurell S, Halldin M, Lindgren JE, et al.: Pharmacokinetics and metabolism of delta 1-tetrahydrocannabinol and other cannabinoids with emphasis on man. Pharmacol Rev 38 (1): 21-43, 1986. [PUBMED Abstract]
- Yamamoto I, Watanabe K, Narimatsu S, et al.: Recent advances in the metabolism of cannabinoids. Int J Biochem Cell Biol 27 (8): 741-6, 1995. [PUBMED Abstract]
- Engels FK, de Jong FA, Sparreboom A, et al.: Medicinal cannabis does not influence the clinical pharmacokinetics of irinotecan and docetaxel. Oncologist 12 (3): 291-300, 2007. [PUBMED Abstract]
- FDA Warns Companies Marketing Unproven Products, Derived From Marijuana, That Claim to Treat or Cure Cancer [News Release]. Silver Spring, Md: Food and Drug Administration, 2017. Available online. Last accessed January 4, 2019.
- Yamaori S, Okamoto Y, Yamamoto I, et al.: Cannabidiol, a major phytocannabinoid, as a potent atypical inhibitor for CYP2D6. Drug Metab Dispos 39 (11): 2049-56, 2011. [PUBMED Abstract]
- Jiang R, Yamaori S, Okamoto Y, et al.: Cannabidiol is a potent inhibitor of the catalytic activity of cytochrome P450 2C19. Drug Metab Pharmacokinet 28 (4): 332-8, 2013. [PUBMED Abstract]
- Azwell T, Ciotti C, Adams A: Variation among hemp (Cannabis sativus L.) analytical testing laboratories evinces regulatory and quality control issues for the industry. J Appl Res Med Aromat Plants 31: 100434, 2022. Available online. Last accessed October 17, 2024.
- Berthiller J, Straif K, Boniol M, et al.: Cannabis smoking and risk of lung cancer in men: a pooled analysis of three studies in Maghreb. J Thorac Oncol 3 (12): 1398-403, 2008. [PUBMED Abstract]
- Sidney S, Quesenberry CP, Friedman GD, et al.: Marijuana use and cancer incidence (California, United States). Cancer Causes Control 8 (5): 722-8, 1997. [PUBMED Abstract]
- Hashibe M, Morgenstern H, Cui Y, et al.: Marijuana use and the risk of lung and upper aerodigestive tract cancers: results of a population-based case-control study. Cancer Epidemiol Biomarkers Prev 15 (10): 1829-34, 2006. [PUBMED Abstract]
- Mehra R, Moore BA, Crothers K, et al.: The association between marijuana smoking and lung cancer: a systematic review. Arch Intern Med 166 (13): 1359-67, 2006. [PUBMED Abstract]
- National Academies of Sciences, Engineering, and Medicine: The Health Effects of Cannabis and Cannabinoids: The Current State of Evidence and Recommendations for Research. The National Academies Press, 2017.
- Marks MA, Chaturvedi AK, Kelsey K, et al.: Association of marijuana smoking with oropharyngeal and oral tongue cancers: pooled analysis from the INHANCE consortium. Cancer Epidemiol Biomarkers Prev 23 (1): 160-71, 2014. [PUBMED Abstract]
- de Carvalho MF, Dourado MR, Fernandes IB, et al.: Head and neck cancer among marijuana users: a meta-analysis of matched case-control studies. Arch Oral Biol 60 (12): 1750-5, 2015. [PUBMED Abstract]
- Daling JR, Doody DR, Sun X, et al.: Association of marijuana use and the incidence of testicular germ cell tumors. Cancer 115 (6): 1215-23, 2009. [PUBMED Abstract]
- Trabert B, Sigurdson AJ, Sweeney AM, et al.: Marijuana use and testicular germ cell tumors. Cancer 117 (4): 848-53, 2011. [PUBMED Abstract]
- Lacson JC, Carroll JD, Tuazon E, et al.: Population-based case-control study of recreational drug use and testis cancer risk confirms an association between marijuana use and nonseminoma risk. Cancer 118 (21): 5374-83, 2012. [PUBMED Abstract]
- Callaghan RC, Allebeck P, Akre O, et al.: Cannabis Use and Incidence of Testicular Cancer: A 42-Year Follow-up of Swedish Men between 1970 and 2011. Cancer Epidemiol Biomarkers Prev 26 (11): 1644-1652, 2017. [PUBMED Abstract]
- Thomas AA, Wallner LP, Quinn VP, et al.: Association between cannabis use and the risk of bladder cancer: results from the California Men's Health Study. Urology 85 (2): 388-92, 2015. [PUBMED Abstract]
- Health Canada: Marihuana (Marijuana, Cannabis): Dried Plant for Administration by Ingestion or Other Means. Ottawa, Canada: Health Canada, 2010. Available online. Last accessed October 18, 2017.
- Pergam SA, Woodfield MC, Lee CM, et al.: Cannabis use among patients at a comprehensive cancer center in a state with legalized medicinal and recreational use. Cancer 123 (22): 4488-4497, 2017. [PUBMED Abstract]
- Bar-Lev Schleider L, Mechoulam R, Lederman V, et al.: Prospective analysis of safety and efficacy of medical cannabis in large unselected population of patients with cancer. Eur J Intern Med 49: 37-43, 2018. [PUBMED Abstract]
- Anderson SP, Zylla DM, McGriff DM, et al.: Impact of Medical Cannabis on Patient-Reported Symptoms for Patients With Cancer Enrolled in Minnesota's Medical Cannabis Program. J Oncol Pract 15 (4): e338-e345, 2019. [PUBMED Abstract]
- Weiss MC, Hibbs JE, Buckley ME, et al.: A Coala-T-Cannabis Survey Study of breast cancer patients' use of cannabis before, during, and after treatment. Cancer 128 (1): 160-168, 2022. [PUBMED Abstract]
- McClure EA, Walters KJ, Tomko RL, et al.: Cannabis use prevalence, patterns, and reasons for use among patients with cancer and survivors in a state without legal cannabis access. Support Care Cancer 31 (7): 429, 2023. [PUBMED Abstract]
- Guzmán M, Duarte MJ, Blázquez C, et al.: A pilot clinical study of Delta9-tetrahydrocannabinol in patients with recurrent glioblastoma multiforme. Br J Cancer 95 (2): 197-203, 2006. [PUBMED Abstract]
- Velasco G, Sánchez C, Guzmán M: Towards the use of cannabinoids as antitumour agents. Nat Rev Cancer 12 (6): 436-44, 2012. [PUBMED Abstract]
- Twelves C, Sabel M, Checketts D, et al.: A phase 1b randomised, placebo-controlled trial of nabiximols cannabinoid oromucosal spray with temozolomide in patients with recurrent glioblastoma. Br J Cancer 124 (8): 1379-1387, 2021. [PUBMED Abstract]
- Likar R, Koestenberger M, Stultschnig M, et al.: Concomitant Treatment of Malignant Brain Tumours With CBD - A Case Series and Review of the Literature. Anticancer Res 39 (10): 5797-5801, 2019. [PUBMED Abstract]
- Yeshurun M, Shpilberg O, Herscovici C, et al.: Cannabidiol for the Prevention of Graft-versus-Host-Disease after Allogeneic Hematopoietic Cell Transplantation: Results of a Phase II Study. Biol Blood Marrow Transplant 21 (10): 1770-5, 2015. [PUBMED Abstract]
- Singh Y, Bali C: Cannabis extract treatment for terminal acute lymphoblastic leukemia with a Philadelphia chromosome mutation. Case Rep Oncol 6 (3): 585-92, 2013. [PUBMED Abstract]
- Foroughi M, Hendson G, Sargent MA, et al.: Spontaneous regression of septum pellucidum/forniceal pilocytic astrocytomas--possible role of Cannabis inhalation. Childs Nerv Syst 27 (4): 671-9, 2011. [PUBMED Abstract]
- Goyal S, Kubendran S, Kogan M, et al.: High expectations: The landscape of clinical trials of medical marijuana in oncology. Complement Ther Med 49: 102336, 2020. [PUBMED Abstract]
- Sutton IR, Daeninck P: Cannabinoids in the management of intractable chemotherapy-induced nausea and vomiting and cancer-related pain. J Support Oncol 4 (10): 531-5, 2006 Nov-Dec. [PUBMED Abstract]
- Ahmedzai S, Carlyle DL, Calder IT, et al.: Anti-emetic efficacy and toxicity of nabilone, a synthetic cannabinoid, in lung cancer chemotherapy. Br J Cancer 48 (5): 657-63, 1983. [PUBMED Abstract]
- Chan HS, Correia JA, MacLeod SM: Nabilone versus prochlorperazine for control of cancer chemotherapy-induced emesis in children: a double-blind, crossover trial. Pediatrics 79 (6): 946-52, 1987. [PUBMED Abstract]
- Johansson R, Kilkku P, Groenroos M: A double-blind, controlled trial of nabilone vs. prochlorperazine for refractory emesis induced by cancer chemotherapy. Cancer Treat Rev 9 (Suppl B): 25-33, 1982. [PUBMED Abstract]
- Niiranen A, Mattson K: A cross-over comparison of nabilone and prochlorperazine for emesis induced by cancer chemotherapy. Am J Clin Oncol 8 (4): 336-40, 1985. [PUBMED Abstract]
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Antiemesis. Version 1.2021. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2021. Available online with free registration. Last accessed August 26, 2021..
- Hesketh PJ, Kris MG, Basch E, et al.: Antiemetics: ASCO Guideline Update. J Clin Oncol 38 (24): 2782-2797, 2020. [PUBMED Abstract]
- Tramèr MR, Carroll D, Campbell FA, et al.: Cannabinoids for control of chemotherapy induced nausea and vomiting: quantitative systematic review. BMJ 323 (7303): 16-21, 2001. [PUBMED Abstract]
- Ben Amar M: Cannabinoids in medicine: A review of their therapeutic potential. J Ethnopharmacol 105 (1-2): 1-25, 2006. [PUBMED Abstract]
- Smith LA, Azariah F, Lavender VT, et al.: Cannabinoids for nausea and vomiting in adults with cancer receiving chemotherapy. Cochrane Database Syst Rev (11): CD009464, 2015. [PUBMED Abstract]
- Meiri E, Jhangiani H, Vredenburgh JJ, et al.: Efficacy of dronabinol alone and in combination with ondansetron versus ondansetron alone for delayed chemotherapy-induced nausea and vomiting. Curr Med Res Opin 23 (3): 533-43, 2007. [PUBMED Abstract]
- Chang AE, Shiling DJ, Stillman RC, et al.: A prospective evaluation of delta-9-tetrahydrocannabinol as an antiemetic in patients receiving adriamycin and cytoxan chemotherapy. Cancer 47 (7): 1746-51, 1981. [PUBMED Abstract]
- Chang AE, Shiling DJ, Stillman RC, et al.: Delta-9-tetrahydrocannabinol as an antiemetic in cancer patients receiving high-dose methotrexate. A prospective, randomized evaluation. Ann Intern Med 91 (6): 819-24, 1979. [PUBMED Abstract]
- Levitt M, Faiman C, Hawks R, et al.: Randomized double blind comparison of delta-9-tetrahydrocannabinol and marijuana as chemotherapy antiemetics. [Abstract] Proceedings of the American Society of Clinical Oncology 3: A-C354, 91, 1984.
- Musty RE, Rossi R: Effects of smoked cannabis and oral delta-9-tetrahydrocannabinol on nausea and emesis after cancer chemotherapy: a review of state clinical trials. Journal of Cannabis Therapeutics 1 (1): 29-56, 2001. Also available online. Last accessed October 18, 2017.
- Duran M, Pérez E, Abanades S, et al.: Preliminary efficacy and safety of an oromucosal standardized cannabis extract in chemotherapy-induced nausea and vomiting. Br J Clin Pharmacol 70 (5): 656-63, 2010. [PUBMED Abstract]
- Grimison P, Mersiades A, Kirby A, et al.: Oral Cannabis Extract for Secondary Prevention of Chemotherapy-Induced Nausea and Vomiting: Final Results of a Randomized, Placebo-Controlled, Phase II/III Trial. J Clin Oncol 42 (34): 4040-4050, 2024. [PUBMED Abstract]
- Regelson W, Butler JR, Schulz J, et al.: Delta-9-tetrahydrocannabinol as an effective antidepressant and appetite-stimulating agent in advanced cancer patients. In: Braude MC, Szara S: The Pharmacology of Marihuana. Raven Press, 1976, pp 763-76.
- Brisbois TD, de Kock IH, Watanabe SM, et al.: Delta-9-tetrahydrocannabinol may palliate altered chemosensory perception in cancer patients: results of a randomized, double-blind, placebo-controlled pilot trial. Ann Oncol 22 (9): 2086-93, 2011. [PUBMED Abstract]
- Turcott JG, Del Rocío Guillen Núñez M, Flores-Estrada D, et al.: The effect of nabilone on appetite, nutritional status, and quality of life in lung cancer patients: a randomized, double-blind clinical trial. Support Care Cancer 26 (9): 3029-3038, 2018. [PUBMED Abstract]
- Jatoi A, Windschitl HE, Loprinzi CL, et al.: Dronabinol versus megestrol acetate versus combination therapy for cancer-associated anorexia: a North Central Cancer Treatment Group study. J Clin Oncol 20 (2): 567-73, 2002. [PUBMED Abstract]
- Foltin RW, Brady JV, Fischman MW: Behavioral analysis of marijuana effects on food intake in humans. Pharmacol Biochem Behav 25 (3): 577-82, 1986. [PUBMED Abstract]
- Foltin RW, Fischman MW, Byrne MF: Effects of smoked marijuana on food intake and body weight of humans living in a residential laboratory. Appetite 11 (1): 1-14, 1988. [PUBMED Abstract]
- Strasser F, Luftner D, Possinger K, et al.: Comparison of orally administered cannabis extract and delta-9-tetrahydrocannabinol in treating patients with cancer-related anorexia-cachexia syndrome: a multicenter, phase III, randomized, double-blind, placebo-controlled clinical trial from the Cannabis-In-Cachexia-Study-Group. J Clin Oncol 24 (21): 3394-400, 2006. [PUBMED Abstract]
- Aggarwal SK: Cannabinergic pain medicine: a concise clinical primer and survey of randomized-controlled trial results. Clin J Pain 29 (2): 162-71, 2013. [PUBMED Abstract]
- Walker JM, Hohmann AG, Martin WJ, et al.: The neurobiology of cannabinoid analgesia. Life Sci 65 (6-7): 665-73, 1999. [PUBMED Abstract]
- Calignano A, La Rana G, Giuffrida A, et al.: Control of pain initiation by endogenous cannabinoids. Nature 394 (6690): 277-81, 1998. [PUBMED Abstract]
- Fields HL, Meng ID: Watching the pot boil. Nat Med 4 (9): 1008-9, 1998. [PUBMED Abstract]
- Noyes R, Brunk SF, Baram DA, et al.: Analgesic effect of delta-9-tetrahydrocannabinol. J Clin Pharmacol 15 (2-3): 139-43, 1975 Feb-Mar. [PUBMED Abstract]
- Noyes R, Brunk SF, Avery DA, et al.: The analgesic properties of delta-9-tetrahydrocannabinol and codeine. Clin Pharmacol Ther 18 (1): 84-9, 1975. [PUBMED Abstract]
- Johnson JR, Burnell-Nugent M, Lossignol D, et al.: Multicenter, double-blind, randomized, placebo-controlled, parallel-group study of the efficacy, safety, and tolerability of THC:CBD extract and THC extract in patients with intractable cancer-related pain. J Pain Symptom Manage 39 (2): 167-79, 2010. [PUBMED Abstract]
- Portenoy RK, Ganae-Motan ED, Allende S, et al.: Nabiximols for opioid-treated cancer patients with poorly-controlled chronic pain: a randomized, placebo-controlled, graded-dose trial. J Pain 13 (5): 438-49, 2012. [PUBMED Abstract]
- Johnson JR, Lossignol D, Burnell-Nugent M, et al.: An open-label extension study to investigate the long-term safety and tolerability of THC/CBD oromucosal spray and oromucosal THC spray in patients with terminal cancer-related pain refractory to strong opioid analgesics. J Pain Symptom Manage 46 (2): 207-18, 2013. [PUBMED Abstract]
- Maida V, Ennis M, Irani S, et al.: Adjunctive nabilone in cancer pain and symptom management: a prospective observational study using propensity scoring. J Support Oncol 6 (3): 119-24, 2008. [PUBMED Abstract]
- Abrams DI, Couey P, Shade SB, et al.: Cannabinoid-opioid interaction in chronic pain. Clin Pharmacol Ther 90 (6): 844-51, 2011. [PUBMED Abstract]
- Wilsey B, Marcotte T, Deutsch R, et al.: Low-dose vaporized cannabis significantly improves neuropathic pain. J Pain 14 (2): 136-48, 2013. [PUBMED Abstract]
- Wilsey B, Marcotte T, Tsodikov A, et al.: A randomized, placebo-controlled, crossover trial of cannabis cigarettes in neuropathic pain. J Pain 9 (6): 506-21, 2008. [PUBMED Abstract]
- Waissengrin B, Mirelman D, Pelles S, et al.: Effect of cannabis on oxaliplatin-induced peripheral neuropathy among oncology patients: a retrospective analysis. Ther Adv Med Oncol 13: 1758835921990203, 2021. [PUBMED Abstract]
- Lynch ME, Cesar-Rittenberg P, Hohmann AG: A double-blind, placebo-controlled, crossover pilot trial with extension using an oral mucosal cannabinoid extract for treatment of chemotherapy-induced neuropathic pain. J Pain Symptom Manage 47 (1): 166-73, 2014. [PUBMED Abstract]
- Zylla DM, Eklund J, Gilmore G, et al.: A randomized trial of medical cannabis in patients with stage IV cancers to assess feasibility, dose requirements, impact on pain and opioid use, safety, and overall patient satisfaction. Support Care Cancer 29 (12): 7471-7478, 2021. [PUBMED Abstract]
- Noyes R, Baram DA: Cannabis analgesia. Compr Psychiatry 15 (6): 531-5, 1974 Nov-Dec. [PUBMED Abstract]
- Zhang H, Xie M, Archibald SD, et al.: Association of Marijuana Use With Psychosocial and Quality of Life Outcomes Among Patients With Head and Neck Cancer. JAMA Otolaryngol Head Neck Surg 144 (11): 1017-1022, 2018. [PUBMED Abstract]
- Schloss J, Lacey J, Sinclair J, et al.: A Phase 2 Randomised Clinical Trial Assessing the Tolerability of Two Different Ratios of Medicinal Cannabis in Patients With High Grade Gliomas. Front Oncol 11: 649555, 2021. [PUBMED Abstract]
- Hardy J, Greer R, Huggett G, et al.: Phase IIb Randomized, Placebo-Controlled, Dose-Escalating, Double-Blind Study of Cannabidiol Oil for the Relief of Symptoms in Advanced Cancer (MedCan1-CBD). J Clin Oncol 41 (7): 1444-1452, 2023. [PUBMED Abstract]
- Chhabra M, Ben-Eltriki M, Paul A, et al.: Cannabinoids for symptom management in children with cancer: A systematic review and meta-analysis. Cancer 129 (22): 3656-3670, 2023. [PUBMED Abstract]
- Ofir R, Bar-Sela G, Weyl Ben-Arush M, et al.: Medical marijuana use for pediatric oncology patients: single institution experience. Pediatr Hematol Oncol 36 (5): 255-266, 2019. [PUBMED Abstract]
- Oberoi S, Protudjer JLP, Rapoport A, et al.: Perspectives of pediatric oncologists and palliative care physicians on the therapeutic use of cannabis in children with cancer. Cancer Rep (Hoboken) 5 (9): e1551, 2022. [PUBMED Abstract]
- Ananth P, Ma C, Al-Sayegh H, et al.: Provider Perspectives on Use of Medical Marijuana in Children With Cancer. Pediatrics 141 (1): , 2018. [PUBMED Abstract]
- Beal JE, Olson R, Laubenstein L, et al.: Dronabinol as a treatment for anorexia associated with weight loss in patients with AIDS. J Pain Symptom Manage 10 (2): 89-97, 1995. [PUBMED Abstract]
Efectos adversos
Cannabis y canabinoides
Debido a que los receptores de canabinoides, a diferencia de los receptores de opioides, no se encuentran en las áreas del tronco cerebral que controlan la respiración, no se producen sobredosis mortales de Cannabis ni canabinoides.[1-4] Sin embargo, los receptores de canabinoides están presentes en otros tejidos de todo el cuerpo, no solo en el sistema nervioso central, y los efectos adversos son los siguientes:
- Taquicardia.
- Hipotensión.
- Congestión conjuntival.
- Broncodilatación.
- Relajación muscular.
- Disminución de la motilidad gastrointestinal.
Aunque algunos consideran que los canabinoides son drogas adictivas, su potencial adictivo es mucho más bajo que el de otros fármacos de venta con receta u otras drogas.[2,4] El encéfalo desarrolla tolerancia a los canabinoides.
Se han observado síntomas de abstinencia como irritabilidad, insomnio con perturbación de electroencefalograma durante el sueño, inquietud, sofocos y, con poca frecuencia, náuseas y calambres. Sin embargo, estos síntomas parecen ser leves en comparación con los síntomas de abstinencia relacionados con opiáceos o benzodiacepinas y, por lo general, los síntomas desaparecen después de pocos días.
A diferencia de otras drogas de uso común, los canabinoides se almacenan en el tejido adiposo y se excretan a una tasa baja (semivida de 1–3 días), por lo que incluso el cese abrupto de la ingesta de canabinoides no se relaciona con la rápida disminución en las concentraciones plasmáticas que precipitarían síntomas de abstinencia graves o repentinos o necesidades imperiosas de consumir la droga.
El canabidiol (CBD) es un inhibidor de las isoformas del citocromo P450 in vitro. Debido a que muchos tratamientos contra el cáncer se metabolizan mediante esas enzimas, el uso simultáneo de aceites de CBD muy concentrados podría aumentar la toxicidad o disminuir la efectividad de esos tratamientos.[5-7]
Dado que el humo de Cannabis contiene muchos de los mismos componentes que el humo del tabaco, hay preocupaciones válidas acerca de los efectos pulmonares adversos de Cannabis inhalado. En un estudio longitudinal de una población no oncológica se evaluaron las mediciones repetidas del funcionamiento pulmonar durante más de 20 años en 5115 hombres y mujeres cuyos antecedentes de consumo de cigarrillos de tabaco y de Cannabis, se conocían.[8] Mientras que la exposición al tabaco se relacionó con un funcionamiento pulmonar disminuido, los investigadores concluyeron que el consumo ocasional y la acumulación baja de Cannabis no se relacionó con efectos adversos sobre el funcionamiento de los pulmones (volumen espiratorio forzado en el primer segundo [VEF1] y capacidad vital forzada [CVF]).
Interacciones con las terapias convencionales contra el cáncer
Las interacciones potenciales del citocromo P450 con preparaciones de aceite de Δ-9-tetrahidrocanabinol y canabidiol muy concentradas son motivo de preocupación.[9] Se han realizado pocos estudios de interacción farmacocinética con Cannabis o canabinoides y terapias convencionales contra el cáncer. No hay evidencia clínica suficiente que respalde la creencia de que cantidades relativamente pequeñas de canabinoides activos afecten de manera sustancial el metabolismo de dosis relativamente grandes de fármacos quimioterapéuticos.
En un estudio de observación israelí se evaluó el efecto del consumo de Cannabis durante la inmunoterapia con nivolumab.[10] En el estudio, 140 pacientes con melanoma en estadio avanzado, cáncer de pulmón de células no pequeñas y carcinoma de células renales recibieron el inhibidor de puntos de control nivolumab (89 pacientes recibieron nivolumab solo y 51 pacientes recibieron nivolumab con Cannabis). En un modelo multivariante, Cannabis fue el único factor significativo que redujo la tasa de respuesta a la inmunoterapia (37,5 % en pacientes que recibieron nivolumab solo, en comparación con 15,9 % en pacientes que recibieron nivolumab con Cannabis [oportunidad relativa, 3,13; intervalo de confianza 95 %, 1,24–8,1; P = 0,016]). No se encontraron diferencias en la supervivencia sin progresión ni en la supervivencia global. En un estudio prospectivo de observación posterior de los mismos investigadores se hizo un seguimiento a 102 pacientes con cánceres metastáticos que iniciaban inmunoterapia.[11][Nivel de evidencia: 2Dii] De los pacientes, 68 recibieron inmunoterapia sola mientras que 34 pacientes consumieron Cannabis durante la inmunoterapia. Más de la mitad de los pacientes de cada grupo tenía cáncer de pulmón de células no pequeñas en estadio IV. Fue menos probable que los usuarios de Cannabis recibieran inmunoterapia como intervención de primera línea (24 %), en comparación con los que no la utilizaban (46 %) (P = 0,03). Los usuarios de Cannabis mostraron un porcentaje significativamente más bajo de beneficio clínico (39 % de los usuarios de Cannabis con respuesta parcial o completa, o enfermedad estable, en comparación con 59 % de los que no la utilizaban [P = 0,035]). En el análisis, la mediana de tiempo de progresión del tumor fue de 3,4 meses en los usuarios de Cannabis, en comparación con 13,1 meses en los que no la utilizaban y la tasa de supervivencia general fue de 6,4 meses para los usuarios de Cannabis, en comparación con 28,5 meses para los que no la utilizaban. Los investigadores también observaron que los usuarios de Cannabis notificaron una tasa más baja de experiencias adversas relacionadas con el tratamiento en general, en comparación con los que no la usaban, con menos efectos adversos relacionados con el sistema inmunitario (P = 0,057). Los investigadores sostuvieron que estos hallazgos quizás se relacionen con los posibles efectos inmunosupresores de Cannabis y concluyeron que el consumo de Cannabis se debe evaluar de forma minuciosa en pacientes con neoplasias malignas en estadio avanzado que se tratan con inmunoterapia. Las limitaciones señaladas por los autores que quizás sean factores de confusión en este análisis incluyen la naturaleza observacional del estudio, el tamaño relativamente pequeño de la muestra y la alta heterogeneidad de los participantes.
Bibliografía
- Adams IB, Martin BR: Cannabis: pharmacology and toxicology in animals and humans. Addiction 91 (11): 1585-614, 1996. [PUBMED Abstract]
- Grotenhermen F, Russo E, eds.: Cannabis and Cannabinoids: Pharmacology, Toxicology, and Therapeutic Potential. The Haworth Press, 2002.
- Sutton IR, Daeninck P: Cannabinoids in the management of intractable chemotherapy-induced nausea and vomiting and cancer-related pain. J Support Oncol 4 (10): 531-5, 2006 Nov-Dec. [PUBMED Abstract]
- Guzmán M: Cannabinoids: potential anticancer agents. Nat Rev Cancer 3 (10): 745-55, 2003. [PUBMED Abstract]
- Yamaori S, Okamoto Y, Yamamoto I, et al.: Cannabidiol, a major phytocannabinoid, as a potent atypical inhibitor for CYP2D6. Drug Metab Dispos 39 (11): 2049-56, 2011. [PUBMED Abstract]
- Jiang R, Yamaori S, Okamoto Y, et al.: Cannabidiol is a potent inhibitor of the catalytic activity of cytochrome P450 2C19. Drug Metab Pharmacokinet 28 (4): 332-8, 2013. [PUBMED Abstract]
- Guedon M, Le Bozec A, Brugel M, et al.: Cannabidiol-drug interaction in cancer patients: A retrospective study in a real-life setting. Br J Clin Pharmacol 89 (7): 2322-2328, 2023. [PUBMED Abstract]
- Pletcher MJ, Vittinghoff E, Kalhan R, et al.: Association between marijuana exposure and pulmonary function over 20 years. JAMA 307 (2): 173-81, 2012. [PUBMED Abstract]
- Kocis PT, Vrana KE: Delta-9-tetrahydrocannabinol and cannabidiol drug-drug interactions. Med Cannabis Cannabinoids 3 (1): 61-73, 2020.
- Taha T, Meiri D, Talhamy S, et al.: Cannabis Impacts Tumor Response Rate to Nivolumab in Patients with Advanced Malignancies. Oncologist 24 (4): 549-554, 2019. [PUBMED Abstract]
- Bar-Sela G, Cohen I, Campisi-Pinto S, et al.: Cannabis Consumption Used by Cancer Patients during Immunotherapy Correlates with Poor Clinical Outcome. Cancers (Basel) 12 (9): , 2020. [PUBMED Abstract]
Resumen de la evidencia sobre Cannabis y canabinoides
Para ayudar a los lectores a evaluar los resultados de los estudios con seres humanos de las terapias integrales, alternativas y complementarias del cáncer se informa, siempre que sea posible, sobre la solidez de los datos probatorios (es decir, los niveles de evidencia científica) relacionados con cada tipo de tratamiento. Para poder realizar un análisis del nivel de evidencia, el estudio debe cumplir los siguientes requisitos:
- Estar publicado en una revista científica con revisión externa.
- Informar sobre los resultados terapéuticos o desenlaces tales como la respuesta ante el tumor, una mejoría de la supervivencia, o una mejoría cuantificable en la calidad de vida.
- Describir los resultados clínicos con detalles suficientes que permitan llevar a cabo una evaluación valiosa.
Con el objeto de clasificar los estudios con seres humanos, se les asignan puntajes de niveles de evidencia científica por separado, según la solidez estadística del diseño del estudio y la solidez científica de los resultados del tratamiento (es decir, los criterios de valoración) analizados. Los 2 puntajes resultantes se combinan para calcular el puntaje total. Para obtener una explicación de los puntajes posibles e información adicional sobre el análisis de los niveles de evidencia científica de los tratamientos de medicina complementaria y alternativa (MCA) para las personas con cáncer, consultar Niveles de evidencia de los estudios sobre las terapias integrales, alternativas y complementarias en seres humanos con cáncer.
Canabinoides
- Se han llevado a cabo varios ensayos clínicos controlados y metanálisis en los que se sustenta un efecto beneficioso de los canabinoides (dronabinol y nabilona) en relación con las náuseas y los vómitos (NyV) causados por la quimioterapia en comparación con un placebo. La Administración de Alimentos y Medicamentos de los Estados Unidos aprobó el uso de dronabinol y nabilona para la prevención o el tratamiento de las NyV causados por la quimioterapia en pacientes con cáncer, pero no para otro tipo de tratamiento de los síntomas.
Cannabis
- Se realizaron 10 ensayos clínicos sobre el consumo de Cannabis inhalado en pacientes de cáncer que se pueden subdividir en 2 grupos. En 4 estudios pequeños de un grupo se evaluó la actividad antiemética, pero cada estudio exploró una población diferente de pacientes y el régimen de quimioterapia también fue distinto. En el primer estudio no se demostró ningún efecto; en el segundo estudio, no se observó ningún efecto positivo, en comparación con el placebo; el informe del tercer estudio no proporcionó información suficiente para caracterizar el resultado general como positivo o neutro. En consecuencia, no hay datos suficientes para proporcionar una evaluación del nivel de evidencia científica general sobre la utilidad de Cannabis en las NyV causados por la quimioterapia. Al parecer, no se han publicado ensayos clínicos controlados sobre el uso de Cannabis para otros síntomas relacionados con el cáncer o el tratamiento.
- Cada vez son más los ensayos en los que se evalúa la administración en la mucosa oral de extracto de planta de Cannabis con concentraciones fijas de componentes canabinoides, dado que las agencias nacionales de control de medicamentos en Canadá y algunos países europeos han emitido autorizaciones para el dolor del cáncer.
- En la actualidad, no hay evidencia suficiente para recomendar la inhalación de Cannabis como tratamiento para los síntomas relacionados con el cáncer, los síntomas relacionados con el tratamiento del cáncer o los efectos secundarios relacionados con el tratamiento del cáncer; sin embargo, se necesita más investigación.
Actualizaciones más recientes a este resumen (05/16/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se añadió texto sobre los resultados de una encuesta multicéntrica sobre percepciones, prevalencia y patrones de consumo de Cannabis entre 13 180 pacientes con varios tipos de cáncer tratados en 12 centros oncológicos designados por el Instituto Nacional del cáncer (se citó a Ellison et al. como referencia 4).
El Consejo editorial del PDQ® sobre las terapias integrales, alternativas y complementarias es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el uso de Cannabis y canabinoides en el tratamiento de personas con cáncer. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ® sobre las terapias integrales, alternativas y complementarias, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ® sobre las terapias integrales, alternativas y complementarias emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® . PDQ Cannabis y canabinoides. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/cancer/tratamiento/mca/pro/cannabis-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.