Tratamiento de los tumores extracraneales de células germinativas en la niñez (PDQ®)–Versión para profesionales de salud
Información general sobre los tumores extracraneales de células germinativas en la niñez
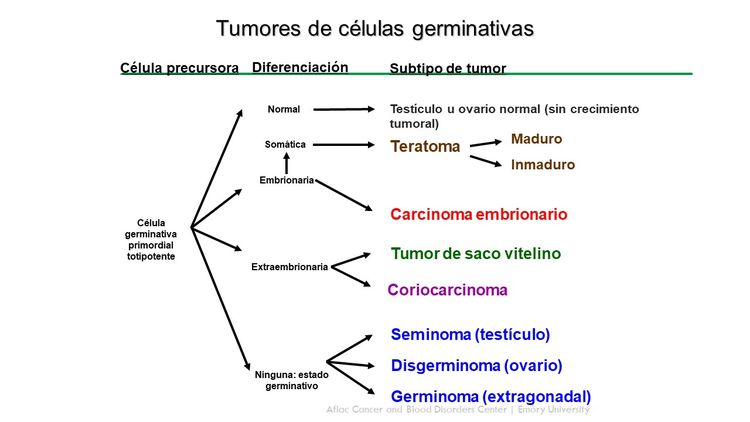
Los tumores de células germinativas surgen de células germinativas primordiales que migran durante la embriogénesis desde el saco vitelino por el mesenterio hasta las gónadas (consultar la Figura 1).[1,2] Los tumores extracraneales de células germinativas en la niñez por lo general se dividen en gonadales y extragonadales. Estos tumores también se pueden clasificar de modo amplio en teratomas, tumores malignos de células germinativas o tumores mixtos de células germinativas.
Incidencia
Los tumores de células germinativas son poco frecuentes en niños menores de 15 años; representan cerca del 3 % de los casos de cáncer en este grupo de edad.[3-6] Durante el periodo fetal o neonatal, la mayoría de los tumores extracraneales de células germinativas son teratomas benignos que se presentan en sitios de la línea media, como la cabeza y el cuello, la región sacrococcígea y el retroperitoneo.[7,8] A pesar del porcentaje pequeño de teratomas malignos que se presentan en este grupo de edad, los tumores perinatales tienen una tasa de morbilidad alta debido a hidropesía fetal y parto prematuro.[8-10]
La incidencia de los tumores malignos extracraneales de células germinativas aumenta al inicio de la pubertad. Estos tumores representan cerca del 15 % de los cánceres en los adolescentes varones de 15 a 19 años y el 4 % de los cánceres en mujeres adolescentes de 15 a 19 años.[3]
En la Figura 2 se muestra el perfil de edad-incidencia por sexo de los tumores malignos extracraneales/extragonadales de células germinales (panel izquierdo) y tumores malignos gonodales de células germinales (panel derecho) entre 2014 y 2018 de 23 registros de cáncer de EE. UU., que representan el 66 % de todos los niños, adolescentes y adultos jóvenes en este país (triángulos azules, mujeres; triángulos verdes, varones).[3] En el caso de los varones, se observa un punto máximo de incidencia en los niños menores de 2 años, tanto en los sitios extragonadales como gonadales, seguido de tasas bajas entre los 2 y los 12 años y, a continuación, tasas más altas en la adolescencia. En el caso de las mujeres, el punto máximo en las niñas pequeñas solo se observa en los tumores extragonadales, y las tasas aumentan después de la pubertad, tanto en los sitios extragonadales como en los gonadales. Sin embargo, durante la adolescencia la incidencia de cada tipo de tumor es menor en las mujeres que en los varones.
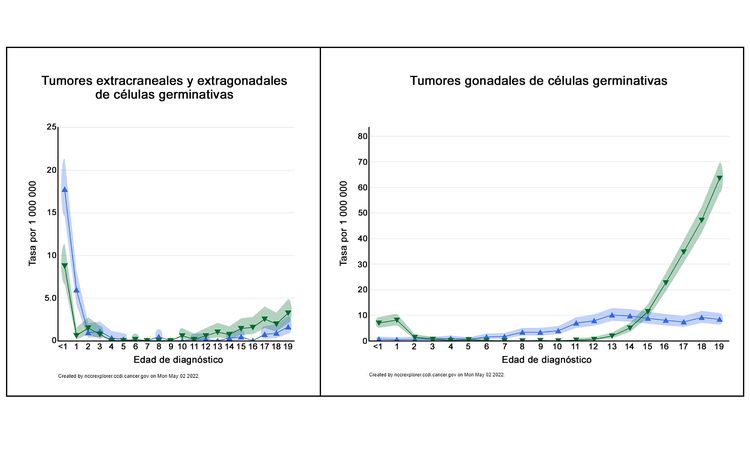
La incidencia de los tumores extracraneales de células germinativas por grupo de edad, sexo y sitio gonadal versus sitio primario extragonadal se presenta en el Cuadro 1.[3]
| Sitio del tumor | Sexo | Edad <1 año | Edades 1–4 años | Edades 5–9 años | Edades 10–14 años | Edades 15–19 años |
|---|---|---|---|---|---|---|
| aTasas por 1 millón de niños de 2014 a 2018 para los NCCR Registries, 23 registros de cáncer de EE. UU. que representan el 66 % de todos los niños, adolescentes y adultos jóvenes de EE. UU. | ||||||
| bDatos del Instituto Nacional del Cáncer; National Childhood Cancer Registry: NCCR*Explorer.[3] | ||||||
| Extragonadal | Mujer | 17,7 | 2,1 | 0,1 | 0,1 | 0,7 |
| Hombre | 8,8 | 0,7 | 0 | 0,6 | 2,2 | |
| Gonadal | Mujer | 0,6 | 0,7 | 2,1 | 7,6 | 8,3 |
| Hombre | 7 | 2,5 | 0,1 | 1,5 | 36,1 | |
Factores de riesgo
La criptorquidia (testículo abdominal que no desciende al escroto), se ha relacionado con un riesgo de presentar un tumor de células germinativas 10,8 veces mayor.[11] La disgenesia gonadal, así como la presencia de material del cromosoma Y en una gónada abdominal, también aumenta el riesgo de un tumor gonadal de células germinativas, en particular un gonadoblastoma. El gonadoblastoma es un tumor gonadal raro que está formado por una mezcla de células germinales y derivados del estroma de cordón sexual que se asemejan a células inmaduras granulosas y de Sertoli.[12,13]
Hay pocos datos acerca de los posibles factores de riesgo genéticos o ambientales relacionados con los tumores extragonadales y extracraneales de células germinativas en la niñez. Los pacientes con los síndromes siguientes tienen un aumento de riesgo de presentar este tipo de tumores:
- Síndrome de Klinefelter: aumento de riesgo de tumores mediastínicos de células germinativas.[14-17]
La mayoría de los tumores de células germinativas mediastínicos en adolescentes y adultos jóvenes se producen en varones, y entre el 22 % y el 50 % presentan cambios citogenéticos compatibles con el síndrome de Klinefelter.[17,18] La edad de presentación del tumor es más temprana en los pacientes con síndrome de Klinefelter, por lo que se debe considerar hacer pruebas de detección de este síndrome a todos los varones jóvenes.[15,18]
Se identificaron pacientes con tumores de células germinativas en la Childhood Cancer Research Network del Children's Oncology Group (COG). Entre los pacientes del estudio, 29 tenían tumores primarios mediastínicos, y 9 (31 %) presentaban síndrome de Klinefelter. En la gran base de datos WONDER 2013 de los Centros para el Control y la Prevención de Enfermedades, el 3 % de los pacientes con tumores de células germinativas tenían síndrome de Klinefelter (el 70 % eran mediastínicos). En comparación, el 0,2 % de los varones de la población general presentan síndrome de Klinefelter.[17]
- Síndrome de Swyer: aumento de riesgo de gonadoblastomas y seminomas.[19,20]
- Síndrome de Turner: aumento de riesgo de gonadoblastomas y disgerminomas.[21,22]
Clasificación histológica de los tumores extracraneales de células germinativas en la niñez
Los tumores extracraneales de células germinativas en la niñez abarcan una variedad de diagnósticos histopatológicos y se clasifican de forma general en los siguientes tipos:
Las características histológicas de los tumores extracraneales de células germinativas son heterogéneas y varían según el sitio del tumor primario, además del sexo y la edad del paciente.[23,24] Los tumores de células germinativas con características histológicas idénticas que se presentan en los niños más pequeños tienen características biológicas diferentes de los tumores que aparecen en los adolescentes y adultos jóvenes.[25]
Teratoma maduro
Los teratomas maduros se pueden presentar en sitios gonadales o extragonadales. Son el subtipo histológico más común de tumores de células germinativas en la niñez.[10,26-28] Estos teratomas suelen contener tejidos bien diferenciados de las capas de células germinativas ectodérmica, mesodérmica y endodérmica, y es posible encontrar cualquier tipo de tejido dentro del tumor.
Los teratomas maduros son benignos, sin embargo algunos teratomas maduros secretan enzimas u hormonas, como insulina, hormona del crecimiento, andrógenos y prolactina.[29,30]
Teratoma inmaduro
Los teratomas inmaduros contienen tejidos de las capas de células germinativas ectodérmica, mesodérmica y endodérmica, pero también tienen tejidos inmaduros; sobre todo neuroepiteliales. Los teratomas inmaduros se clasifican en grados de 0 a 3 según la cantidad de tejido nervioso inmaduro en la muestra tumoral.[31,32] Los tumores de grado más alto son más propensos a tener focos de tumor de saco vitelino.[33] Los teratomas inmaduros pueden exhibir comportamiento maligno y metastatizar.
Los teratomas inmaduros suelen aparecer en sitios extragonadales en niños de corta edad y en los ovarios de las niñas alrededor de la pubertad. Sin embargo, no hay correlación entre el grado del tumor y la edad del paciente.[33,34] Algunos teratomas inmaduros secretan enzimas u hormonas, como la vasopresina.[35]
Tumores malignos de células germinativas
La mayoría de los tumores extragonadales de células germinativas en la niñez surgen en sitios de la línea media (es decir, la cabeza y el cuello, la región sacrococcígea, el mediastino y el retroperitoneo). Es posible que la ubicación en la línea media represente una migración embrionaria anómala de las células germinativas primordiales.
Los tumores de células germinativas contienen tejidos malignos que se originan en las células germinativas y, con poca frecuencia, en tejidos de origen somático. A veces hay elementos malignos aislados que corresponden a una pequeña fracción de un teratoma que es, en su mayor parte, maduro o inmaduro.[34,36]
Los elementos de células germinativas malignas en niños, adolescentes y adultos jóvenes se agrupan en términos generales según su localización (consultar el Cuadro 2).
| Elementos de células germinativas malignas | Localización | |
|---|---|---|
| E = extragonadal; O = ovárica; T = testicular. | ||
| aModificado de Perlman et al.[37] | ||
| Elementos seminomatosos | ||
| Seminoma | T | |
| Disgerminoma | O | |
| Germinoma | E | |
| Elementos no seminomatosos | ||
| Tumor de saco vitelino (tumor de seno endodérmico) | E, O, T | |
| Coriocarcinoma | E, O, T | |
| Carcinoma embrionario | E, T | |
| Gonadoblastoma | O | |
| Tumores mixtos de células germinativas | ||
| Tumores mixtos de células germinativas | E, O, T | |
Características biológicas de los tumores de células germinativas
Los tumores extracraneales de células germinativas en la niñez surgen en muchos sitios, como los testículos, los ovarios, el mediastino, el retroperitoneo, el sacro, el cóccix, y la cabeza y el cuello (consultar la Figura 3).[7] Las características clínicas en el momento de la presentación son específicas para cada sitio.

Los subtipos biológicos de tumores de células germinativas que se distinguen en niños y adolescentes son los siguientes:
Las diferencias biológicas entre los tumores de células germinativas en niños y adultos quizás no sean absolutas; además, no se observó que los factores biológicos predijeran el riesgo.[38-40]
Tumores de células germinativas de testículo
- Niños (<11 años): durante la niñez temprana se han identificado teratomas de testículo y tumores malignos de células germinativas de testículo. Los tumores malignos se suelen componer de un tumor de saco vitelino puro (también conocido como tumor de seno endodérmico); por lo general, son diploides o tetraploides. Cerca del 44 % de estos tumores malignos contienen el isocromosoma del brazo corto del cromosoma 12 (i12p) que caracteriza el cáncer de testículo en los adultos jóvenes.[38,41-45] Se notifica que las deleciones de los cromosomas 1p, 4q y 6q, y las ganancias de los cromosomas 1q, 3 y 20q son anomalías cromosómicas recurrentes en este grupo de tumores.[43-46]
- Adolescentes y adultos jóvenes (≥11 años): los tumores de células germinativas de testículo en la población de adolescentes y adultos jóvenes casi siempre poseen una anomalía cromosómica i12p [47-50] y son aneuploides.[41,50]
Tumores de células germinativas de ovario
Los tumores de células germinativas de ovario por lo general se presentan en mujeres adolescentes y adultas jóvenes. Si bien la mayoría de los tumores de células germinativas de ovario son teratomas maduros benignos (quistes dermoides), las mujeres presentan un grupo heterogéneo de tumores malignos de células germinativas, como los teratomas inmaduros, los disgerminomas, los tumores de saco vitelino y los tumores mixtos de células germinativas. El tumor maligno de células germinativas de ovario suele exhibir un aumento de copias del brazo corto del cromosoma 12.[51]
Tumores extragonadales y extracraneales de células germinativas
Estos tumores de células germinativas se presentan fuera del encéfalo y fuera de las gónadas.
- Niños (<11 años): estos tumores se suelen presentar en el momento del nacimiento o durante la niñez temprana. La mayoría de estos tumores son teratomas benignos que surgen en la región sacrococcígea y, por lo tanto, no se incluyen en los datos del Surveillance, Epidemiology, and End Results (SEER) Program.[52,53] El tipo histológico maligno del tumor de saco vitelino se presenta en una minoría de estos tumores; sin embargo, es posible que exhiban anomalías citogenéticas similares a las observadas en los tumores que surgen en los testículos de varones jóvenes.[42-44,46] Los tumores mediastínicos de células germinativas en niños menores de 8 años comparten las mismas ganancias y pérdidas genéticas que los tumores sacrococcígeos y testiculares en niños pequeños.[18,54,55]
- Niños mayores, adolescentes y adultos jóvenes (≥11 años): el mediastino es el sitio primario más común de los tumores extragonadales de células germinativas en los niños mayores y los adolescentes.[27]
Para obtener más información sobre el tratamiento de los tumores intracraneales de células germinativas, consultar Tratamiento de los tumores de células germinativas del sistema nervioso central infantil.
Evaluación para el diagnóstico y la estadificación
La evaluación diagnóstica de los tumores de células germinativas incluye la medición de marcadores tumorales séricos y estudios con imágenes. En casos presuntos, los marcadores tumorales son indicadores del diagnóstico antes de la cirugía o la biopsia. El equipo multidisciplinario utiliza esta información para tomar decisiones adecuadas de tratamiento.
Marcadores tumorales
Los marcadores tumorales se miden en cada ciclo de quimioterapia administrada a todos los pacientes con tumores malignos de células germinativas en el ámbito pediátrico. Luego de la quimioterapia inicial, los marcadores tumorales a veces se elevan de manera pasajera.[56]
Los siguientes son marcadores tumorales comunes:
-
Alfafetoproteína.
El hígado fetal produce alfafetoproteína (AFP), y las concentraciones séricas de AFP permanecen elevadas durante el primer año de vida en lactantes sin que esto indique la presencia de un tumor de células germinativas. Se describieron variaciones normales.[57,58] La semivida de la AFP en suero es de 5 a 7 días.
Los tumores de saco vitelino elaboran AFP. La mayoría de los niños con tumores malignos de células germinativas tendrán un componente de tumor de saco vitelino y aumento de las concentraciones de AFP,[59,60] que se vigilan en forma seriada durante el tratamiento para ayudar a evaluar la respuesta a la terapia.[34,36,59] Los teratomas benignos y los teratomas inmaduros en ocasiones producen pequeñas elevaciones de la AFP y la gonadotropina coriónica humana ß (GCH-ß).
En un estudio del COG se midieron las concentraciones de la AFP en niños que recibieron quimioterapia para tumores de células germinativas. La disminución de la AFP se definió como satisfactoria de manera automática cuando la concentración se normalizaba después de 2 ciclos de quimioterapia, y como satisfactoria mediante cálculo si la semivida de la AFP era menor o igual a 7 días desde del comienzo de la quimioterapia. Cualquier otra disminución de la AFP se definió como insatisfactoria.[61][Nivel de evidencia C1]
- La incidencia acumulada de recaída fue de 11 % en los pacientes con una disminución satisfactoria de la AFP (n = 117) y de 38 % en aquellos con una disminución insatisfactoria de la AFP (n = 14).
-
Gonadotropina coriónica humana ß.
Todos los coriocarcinomas y algunos germinomas (seminomas y disgerminomas), así como los carcinomas embrionarios producen gonadotropina coriónica humana ß (GCH-ß), lo que conlleva concentraciones séricas elevadas de esta sustancia. La semivida de la GCH-ß en suero es de 1 a 2 días.
-
MicroRNA.
En un estudio prospectivo multicéntrico, se observó que la concentración sérica de microRNA-371a-3p servía como biomarcador sensible y específico para los tumores de células germinativas de testículo en adultos.[62] En el estudio se incluyeron 616 pacientes con tumores de células germinativas de diferentes tipos histológicos y 258 controles sin este tipo de tumores. La elevación de la concentración de microRNA-371a-3p se observó en todas los tipos histológicos malignos, incluso en los seminomas. No se encontró elevación del biomarcador en los controles normales ni en los pacientes con teratomas benignos. La concentración de MicroRNA-371a-3p se relacionó con el volumen tumoral, y las concentraciones disminuyeron en respuesta a la quimioterapia. Son necesarios más estudios sobre el microRNA-371a-3p para evaluar su utilidad en pacientes con tumores de células germinativas en la niñez.
Pruebas con imágenes
Las pruebas con imágenes son las siguientes:
- Tomografía computarizada del tórax.
- Tomografía computarizada o imágenes por resonancia magnética del sitio primario.
- Gammagrafía ósea con radionúclido, si hay indicación clínica.
- Imágenes por resonancia magnética del encéfalo, si están clínicamente indicadas.
Factores pronósticos
Los factores pronósticos de los tumores extracraneales de células germinativas dependen de muchas características del paciente y del tumor, como las siguientes (información obtenida de ensayos históricos nacionales sobre tumores de células germinativas):[59,63-65]
- Edad (niños pequeños vs. adolescentes).
- Estadio de la enfermedad.
- Sitio primario de la enfermedad.
- Tipo histológico (seminomatosos vs. no seminomatosos).
- Disminución de los marcadores tumorales (AFP y GCH-ß) en respuesta al tratamiento.
- Presencia de disgenesia gonadal.
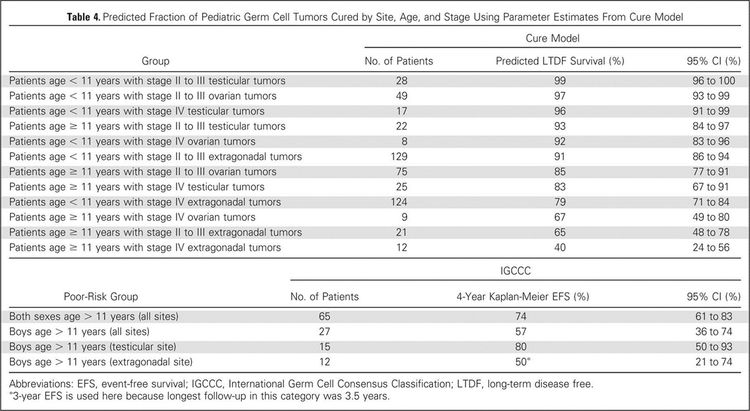
Para una correcta identificación de los factores pronósticos, el grupo Malignant Germ Cell Tumor International Collaborative combinó los datos de 5 ensayos de los Estados Unidos y 2 ensayos del Reino Unido sobre tumores malignos extracraneales de células germinativas en niños y adolescentes. El objetivo fue determinar los factores pronósticos importantes en 519 jóvenes que recibieron quimioterapia, teniendo en cuenta la edad en el momento del diagnóstico, el estadio y el sitio del tumor primario, además de la concentración de AFP previa al tratamiento y el tipo histológico.[66][Nivel de evidencia C2] En esta investigación centrada en la edad sobre estos factores en niños pequeños y adolescentes, los desenlaces fueron los siguientes (consultar la Figura 4):[66]
- Los pacientes de 11 años y más, con enfermedad extragonadal en estadio III o IV, o enfermedad ovárica en estadio IV tuvieron una verosimilitud inferior a 70 % de supervivencia sin enfermedad a largo plazo, que osciló entre 40 % (extragonadal en estadio IV) y 67 % (ovárica en estadio IV).
- Los varones (11 años y más) con características de riesgo intermedio o riesgo alto según la International Germ Cell Consensus Classification [67] también tuvieron peores desenlaces.
- Se observó un desenlace más favorable en los tumores de saco vitelino, pero no alcanzó significación estadística al nivel de 0,05.
- Las concentraciones preoperatorias de AFP no fueron pronósticas. Las concentraciones posoperatorias de AFP fueron pronósticas en los hombres adultos.[67]
En un estudio posterior se usó una base de datos de 11 ensayos sobre tumores de células germinativas en 593 pacientes con tumores de células germinativas metastásicos en sitios testiculares, mediastínicos o retroperitoneales. La distribución de los pacientes por grupo de edad incluyó 90 niños (0 a <11 años), 109 adolescentes (11 a <18 años) y 394 adultos jóvenes (18 a ≤30 años).[67];[68][Nivel de evidencia C1]
- La tasa de supervivencia sin complicaciones (SSC) a 5 años fue más baja en los adolescentes (72 %; intervalo de confianza [IC] 95 %, 62–79 %) que en los niños (90 %; IC 95 %, 81–95 %; P = 0,003) o los adultos jóvenes (88 %; IC 95 %, 84–91 %; P = 0,0002).
- Después del ajuste según el grupo de riesgo de la International Germ Cell Consensus Classification,[67] solo la diferencia en la SSC entre adolescentes y niños siguió siendo significativa (cociente de riesgos instantáneos, 0,30; P = 0,001).
Aunque se dispone de pocos datos del entorno pediátrico, en los estudios de adultos se observó que una disminución insatisfactoria de las concentraciones elevadas de los marcadores tumorales después del primer ciclo de quimioterapia es un hallazgo de pronóstico precario.[69,70]
La presencia de disgenesia gonadal en pacientes con tumores de ovario no disgerminomatosos se relaciona con peores desenlaces. En un informe del estudio del COG AGCT0132, 7 pacientes con disgenesia gonadal y tumores de ovario no disgerminomatosos tuvieron una tasa estimada de SSC a 3 años de 67 %, en comparación con una tasa de 89 % en 100 pacientes con tumores de ovario no disgerminomatosos que no tenían disgenesia gonadal.[13] Estas gónadas con disgenesia contienen material del cromosoma Y, y las gónadas intrabdominales con material del cromosoma Y presentan un aumento del riesgo de tumor.[12,71] A diferencia de los tumores no disgerminomatosos, la disgenesia gonadal se identificó en 7 de 48 pacientes con disgerminomas de ovario en un informe de la French Society of Pediatric Oncology. Al cabo de una mediana de seguimiento de 14 años, todos los pacientes sobrevivieron.[72]
Para obtener más información sobre el pronóstico y los factores pronósticos de los tumores extracraneales de células germinativas en la niñez, consultar las secciones Tratamiento de los teratomas maduros e inmaduros en la niñez, Tratamiento de los tumores gonadales malignos de células germinativas en la niñez y Tratamiento de los tumores malignos extragonadales y extracraneales de células germinativas en la niñez.
Seguimiento después del tratamiento
En ocasiones el médico solicita las siguientes pruebas y procedimientos para hacer el seguimiento de los niños con tumores extracraneales de células germinativas:
- Alfafetoproteína y gonadotropina coriónica humana ß. Vigilancia mensual de las concentraciones de AFP y GCH-ß durante 6 meses (período de riesgo más alto) y, luego, cada 3 meses durante 2 años en total (3 años para el teratoma sacrococcígeo).
En un ensayo del COG de pacientes con tumores de células germinativas de riesgo bajo e intermedio se informaron los siguientes resultados:[73][Nivel de evidencia C2]
- 48 pacientes con marcadores tumorales elevados en el momento del diagnóstico recayeron durante la fase de vigilancia.
- En el momento de la recaída (después de revisión central), 47 de 48 (98 %) recaídas se detectaron mediante elevación de marcadores tumorales.
-
Pruebas con imágenes.
- Se suelen realizar imágenes por resonancia magnética (IRM) o tomografía computarizada (TC) al completar el tratamiento.
- En ocasiones se obtienen imágenes guiadas del sitio primario cada 3 meses durante el primer año y cada 6 meses durante el segundo año. Como es posible que los seminomas y los disgerminomas recidiven más tarde, tal vez sea necesario prolongar el cronograma de las pruebas con imágenes.
- Radiografías de tórax anuales.
- Cuando los marcadores tumorales son normales en el momento del diagnóstico, es posible realizar ecografía, TC o IRM cada 3 meses durante 2 años; luego, una vez al año durante 5 años.
Se han logrado mejoras notables en la supervivencia de niños y adolescentes con cáncer.[74] Entre 1975 y 2020, la mortalidad por cáncer infantil disminuyó en más del 50 %.[3,74,75] Durante el período de 2002 a 2010, la mortalidad por cáncer siguió disminuyendo en el 2,4 % cada año en niños y adolescentes con tumores gonadales, en comparación con el período de 1975 a 1998 (permaneció estable de 1998 a 2001).[74] Los niños y adolescentes sobrevivientes de cáncer necesitan un seguimiento minucioso ya que los efectos secundarios del tratamiento del cáncer pueden persistir o presentarse meses o años después del mismo. Para obtener información sobre la incidencia, el tipo y la vigilancia de los efectos tardíos en los niños y adolescentes sobrevivientes de cáncer, consultar Efectos tardíos del tratamiento anticanceroso en la niñez.
Bibliografía
- Dehner LP: Gonadal and extragonadal germ cell neoplasia of childhood. Hum Pathol 14 (6): 493-511, 1983. [PUBMED Abstract]
- McIntyre A, Gilbert D, Goddard N, et al.: Genes, chromosomes and the development of testicular germ cell tumors of adolescents and adults. Genes Chromosomes Cancer 47 (7): 547-57, 2008. [PUBMED Abstract]
- National Cancer Institute: NCCR*Explorer: An interactive website for NCCR cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed February 25, 2025.
- Poynter JN, Amatruda JF, Ross JA: Trends in incidence and survival of pediatric and adolescent patients with germ cell tumors in the United States, 1975 to 2006. Cancer 116 (20): 4882-91, 2010. [PUBMED Abstract]
- Kaatsch P, Häfner C, Calaminus G, et al.: Pediatric germ cell tumors from 1987 to 2011: incidence rates, time trends, and survival. Pediatrics 135 (1): e136-43, 2015. [PUBMED Abstract]
- Ward E, DeSantis C, Robbins A, et al.: Childhood and adolescent cancer statistics, 2014. CA Cancer J Clin 64 (2): 83-103, 2014 Mar-Apr. [PUBMED Abstract]
- Dharmarajan H, Rouillard-Bazinet N, Chandy BM: Mature and immature pediatric head and neck teratomas: A 15-year review at a large tertiary center. Int J Pediatr Otorhinolaryngol 105: 43-47, 2018. [PUBMED Abstract]
- Isaacs H: Perinatal (fetal and neonatal) germ cell tumors. J Pediatr Surg 39 (7): 1003-13, 2004. [PUBMED Abstract]
- Heerema-McKenney A, Harrison MR, Bratton B, et al.: Congenital teratoma: a clinicopathologic study of 22 fetal and neonatal tumors. Am J Surg Pathol 29 (1): 29-38, 2005. [PUBMED Abstract]
- Alexander VR, Manjaly JG, Pepper CM, et al.: Head and neck teratomas in children--A series of 23 cases at Great Ormond Street Hospital. Int J Pediatr Otorhinolaryngol 79 (12): 2008-14, 2015. [PUBMED Abstract]
- Johnson KJ, Ross JA, Poynter JN, et al.: Paediatric germ cell tumours and congenital abnormalities: a Children's Oncology Group study. Br J Cancer 101 (3): 518-21, 2009. [PUBMED Abstract]
- Huang H, Wang C, Tian Q: Gonadal tumour risk in 292 phenotypic female patients with disorders of sex development containing Y chromosome or Y-derived sequence. Clin Endocrinol (Oxf) 86 (4): 621-627, 2017. [PUBMED Abstract]
- Dicken BJ, Billmire DF, Krailo M, et al.: Gonadal dysgenesis is associated with worse outcomes in patients with ovarian nondysgerminomatous tumors: A report of the Children's Oncology Group AGCT 0132 study. Pediatr Blood Cancer 65 (4): , 2018. [PUBMED Abstract]
- Dexeus FH, Logothetis CJ, Chong C, et al.: Genetic abnormalities in men with germ cell tumors. J Urol 140 (1): 80-4, 1988. [PUBMED Abstract]
- Nichols CR, Heerema NA, Palmer C, et al.: Klinefelter's syndrome associated with mediastinal germ cell neoplasms. J Clin Oncol 5 (8): 1290-4, 1987. [PUBMED Abstract]
- Lachman MF, Kim K, Koo BC: Mediastinal teratoma associated with Klinefelter's syndrome. Arch Pathol Lab Med 110 (11): 1067-71, 1986. [PUBMED Abstract]
- Williams LA, Pankratz N, Lane J, et al.: Klinefelter syndrome in males with germ cell tumors: A report from the Children's Oncology Group. Cancer 124 (19): 3900-3908, 2018. [PUBMED Abstract]
- Schneider DT, Schuster AE, Fritsch MK, et al.: Genetic analysis of mediastinal nonseminomatous germ cell tumors in children and adolescents. Genes Chromosomes Cancer 34 (1): 115-25, 2002. [PUBMED Abstract]
- Coutin AS, Hamy A, Fondevilla M, et al.: [Pure 46XY gonadal dysgenesis] J Gynecol Obstet Biol Reprod (Paris) 25 (8): 792-6, 1996. [PUBMED Abstract]
- Amice V, Amice J, Bercovici JP, et al.: Gonadal tumor and H-Y antigen in 46,XY pure gonadal dysgenesis. Cancer 57 (7): 1313-7, 1986. [PUBMED Abstract]
- Tanaka Y, Sasaki Y, Tachibana K, et al.: Gonadal mixed germ cell tumor combined with a large hemangiomatous lesion in a patient with Turner's syndrome and 45,X/46,X, +mar karyotype. Arch Pathol Lab Med 118 (11): 1135-8, 1994. [PUBMED Abstract]
- Kota SK, Gayatri K, Pani JP, et al.: Dysgerminoma in a female with turner syndrome and Y chromosome material: A case-based review of literature. Indian J Endocrinol Metab 16 (3): 436-40, 2012. [PUBMED Abstract]
- Hawkins EP: Germ cell tumors. Am J Clin Pathol 109 (4 Suppl 1): S82-8, 1998. [PUBMED Abstract]
- Schneider DT, Calaminus G, Koch S, et al.: Epidemiologic analysis of 1,442 children and adolescents registered in the German germ cell tumor protocols. Pediatr Blood Cancer 42 (2): 169-75, 2004. [PUBMED Abstract]
- Horton Z, Schlatter M, Schultz S: Pediatric germ cell tumors. Surg Oncol 16 (3): 205-13, 2007. [PUBMED Abstract]
- Göbel U, Calaminus G, Engert J, et al.: Teratomas in infancy and childhood. Med Pediatr Oncol 31 (1): 8-15, 1998. [PUBMED Abstract]
- Rescorla FJ: Pediatric germ cell tumors. Semin Surg Oncol 16 (2): 144-58, 1999. [PUBMED Abstract]
- Harms D, Zahn S, Göbel U, et al.: Pathology and molecular biology of teratomas in childhood and adolescence. Klin Padiatr 218 (6): 296-302, 2006 Nov-Dec. [PUBMED Abstract]
- Tomlinson MW, Alaverdian AA, Alaverdian V: Testosterone-producing benign cystic teratoma with virilism. A case report. J Reprod Med 41 (12): 924-6, 1996. [PUBMED Abstract]
- Kallis P, Treasure T, Holmes SJ, et al.: Exocrine pancreatic function in mediastinal teratomata: an aid to preoperative diagnosis? Ann Thorac Surg 54 (4): 741-3, 1992. [PUBMED Abstract]
- Norris HJ, Zirkin HJ, Benson WL: Immature (malignant) teratoma of the ovary: a clinical and pathologic study of 58 cases. Cancer 37 (5): 2359-72, 1976. [PUBMED Abstract]
- O'Connor DM, Norris HJ: The influence of grade on the outcome of stage I ovarian immature (malignant) teratomas and the reproducibility of grading. Int J Gynecol Pathol 13 (4): 283-9, 1994. [PUBMED Abstract]
- Heifetz SA, Cushing B, Giller R, et al.: Immature teratomas in children: pathologic considerations: a report from the combined Pediatric Oncology Group/Children's Cancer Group. Am J Surg Pathol 22 (9): 1115-24, 1998. [PUBMED Abstract]
- Marina NM, Cushing B, Giller R, et al.: Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology Group/Children's Cancer Group Intergroup Study. J Clin Oncol 17 (7): 2137-43, 1999. [PUBMED Abstract]
- Lam SK, Cheung LP: Inappropriate ADH secretion due to immature ovarian teratoma. Aust N Z J Obstet Gynaecol 36 (1): 104-5, 1996. [PUBMED Abstract]
- Göbel U, Calaminus G, Schneider DT, et al.: The malignant potential of teratomas in infancy and childhood: the MAKEI experiences in non-testicular teratoma and implications for a new protocol. Klin Padiatr 218 (6): 309-14, 2006 Nov-Dec. [PUBMED Abstract]
- Perlman EJ, Hawkins EP: Pediatric germ cell tumors: protocol update for pathologists. Pediatr Dev Pathol 1 (4): 328-35, 1998 Jul-Aug. [PUBMED Abstract]
- Palmer RD, Foster NA, Vowler SL, et al.: Malignant germ cell tumours of childhood: new associations of genomic imbalance. Br J Cancer 96 (4): 667-76, 2007. [PUBMED Abstract]
- Palmer RD, Barbosa-Morais NL, Gooding EL, et al.: Pediatric malignant germ cell tumors show characteristic transcriptome profiles. Cancer Res 68 (11): 4239-47, 2008. [PUBMED Abstract]
- Poynter JN, Hooten AJ, Frazier AL, et al.: Associations between variants in KITLG, SPRY4, BAK1, and DMRT1 and pediatric germ cell tumors. Genes Chromosomes Cancer 51 (3): 266-71, 2012. [PUBMED Abstract]
- Oosterhuis JW, Castedo SM, de Jong B, et al.: Ploidy of primary germ cell tumors of the testis. Pathogenetic and clinical relevance. Lab Invest 60 (1): 14-21, 1989. [PUBMED Abstract]
- Silver SA, Wiley JM, Perlman EJ: DNA ploidy analysis of pediatric germ cell tumors. Mod Pathol 7 (9): 951-6, 1994. [PUBMED Abstract]
- Perlman EJ, Cushing B, Hawkins E, et al.: Cytogenetic analysis of childhood endodermal sinus tumors: a Pediatric Oncology Group study. Pediatr Pathol 14 (4): 695-708, 1994 Jul-Aug. [PUBMED Abstract]
- Schneider DT, Schuster AE, Fritsch MK, et al.: Genetic analysis of childhood germ cell tumors with comparative genomic hybridization. Klin Padiatr 213 (4): 204-11, 2001 Jul-Aug. [PUBMED Abstract]
- Bussey KJ, Lawce HJ, Olson SB, et al.: Chromosome abnormalities of eighty-one pediatric germ cell tumors: sex-, age-, site-, and histopathology-related differences--a Children's Cancer Group study. Genes Chromosomes Cancer 25 (2): 134-46, 1999. [PUBMED Abstract]
- Perlman EJ, Valentine MB, Griffin CA, et al.: Deletion of 1p36 in childhood endodermal sinus tumors by two-color fluorescence in situ hybridization: a pediatric oncology group study. Genes Chromosomes Cancer 16 (1): 15-20, 1996. [PUBMED Abstract]
- Rodriguez E, Houldsworth J, Reuter VE, et al.: Molecular cytogenetic analysis of i(12p)-negative human male germ cell tumors. Genes Chromosomes Cancer 8 (4): 230-6, 1993. [PUBMED Abstract]
- Bosl GJ, Ilson DH, Rodriguez E, et al.: Clinical relevance of the i(12p) marker chromosome in germ cell tumors. J Natl Cancer Inst 86 (5): 349-55, 1994. [PUBMED Abstract]
- Mostert MC, Verkerk AJ, van de Pol M, et al.: Identification of the critical region of 12p over-representation in testicular germ cell tumors of adolescents and adults. Oncogene 16 (20): 2617-27, 1998. [PUBMED Abstract]
- van Echten J, Oosterhuis JW, Looijenga LH, et al.: No recurrent structural abnormalities apart from i(12p) in primary germ cell tumors of the adult testis. Genes Chromosomes Cancer 14 (2): 133-44, 1995. [PUBMED Abstract]
- Riopel MA, Spellerberg A, Griffin CA, et al.: Genetic analysis of ovarian germ cell tumors by comparative genomic hybridization. Cancer Res 58 (14): 3105-10, 1998. [PUBMED Abstract]
- Malogolowkin MH, Mahour GH, Krailo M, et al.: Germ cell tumors in infancy and childhood: a 45-year experience. Pediatr Pathol 10 (1-2): 231-41, 1990. [PUBMED Abstract]
- Marsden HB, Birch JM, Swindell R: Germ cell tumours of childhood: a review of 137 cases. J Clin Pathol 34 (8): 879-83, 1981. [PUBMED Abstract]
- Dal Cin P, Drochmans A, Moerman P, et al.: Isochromosome 12p in mediastinal germ cell tumor. Cancer Genet Cytogenet 42 (2): 243-51, 1989. [PUBMED Abstract]
- Aly MS, Dal Cin P, Jiskoot P, et al.: Competitive in situ hybridization in a mediastinal germ cell tumor. Cancer Genet Cytogenet 73 (1): 53-6, 1994. [PUBMED Abstract]
- Vogelzang NJ, Lange PH, Goldman A, et al.: Acute changes of alpha-fetoprotein and human chorionic gonadotropin during induction chemotherapy of germ cell tumors. Cancer Res 42 (11): 4855-61, 1982. [PUBMED Abstract]
- Wu JT, Book L, Sudar K: Serum alpha fetoprotein (AFP) levels in normal infants. Pediatr Res 15 (1): 50-2, 1981. [PUBMED Abstract]
- Blohm ME, Vesterling-Hörner D, Calaminus G, et al.: Alpha 1-fetoprotein (AFP) reference values in infants up to 2 years of age. Pediatr Hematol Oncol 15 (2): 135-42, 1998 Mar-Apr. [PUBMED Abstract]
- Mann JR, Raafat F, Robinson K, et al.: The United Kingdom Children's Cancer Study Group's second germ cell tumor study: carboplatin, etoposide, and bleomycin are effective treatment for children with malignant extracranial germ cell tumors, with acceptable toxicity. J Clin Oncol 18 (22): 3809-18, 2000. [PUBMED Abstract]
- Marina N, Fontanesi J, Kun L, et al.: Treatment of childhood germ cell tumors. Review of the St. Jude experience from 1979 to 1988. Cancer 70 (10): 2568-75, 1992. [PUBMED Abstract]
- O'Neill AF, Xia C, Krailo MD, et al.: α-Fetoprotein as a predictor of outcome for children with germ cell tumors: A report from the Malignant Germ Cell International Consortium. Cancer 125 (20): 3649-3656, 2019. [PUBMED Abstract]
- Dieckmann KP, Radtke A, Geczi L, et al.: Serum Levels of MicroRNA-371a-3p (M371 Test) as a New Biomarker of Testicular Germ Cell Tumors: Results of a Prospective Multicentric Study. J Clin Oncol 37 (16): 1412-1423, 2019. [PUBMED Abstract]
- Rogers PC, Olson TA, Cullen JW, et al.: Treatment of children and adolescents with stage II testicular and stages I and II ovarian malignant germ cell tumors: A Pediatric Intergroup Study--Pediatric Oncology Group 9048 and Children's Cancer Group 8891. J Clin Oncol 22 (17): 3563-9, 2004. [PUBMED Abstract]
- Cushing B, Giller R, Cullen JW, et al.: Randomized comparison of combination chemotherapy with etoposide, bleomycin, and either high-dose or standard-dose cisplatin in children and adolescents with high-risk malignant germ cell tumors: a pediatric intergroup study--Pediatric Oncology Group 9049 and Children's Cancer Group 8882. J Clin Oncol 22 (13): 2691-700, 2004. [PUBMED Abstract]
- Göbel U, Schneider DT, Calaminus G, et al.: Multimodal treatment of malignant sacrococcygeal germ cell tumors: a prospective analysis of 66 patients of the German cooperative protocols MAKEI 83/86 and 89. J Clin Oncol 19 (7): 1943-50, 2001. [PUBMED Abstract]
- Frazier AL, Hale JP, Rodriguez-Galindo C, et al.: Revised risk classification for pediatric extracranial germ cell tumors based on 25 years of clinical trial data from the United Kingdom and United States. J Clin Oncol 33 (2): 195-201, 2015. [PUBMED Abstract]
- International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group. J Clin Oncol 15 (2): 594-603, 1997. [PUBMED Abstract]
- Shaikh F, Stark D, Fonseca A, et al.: Outcomes of adolescent males with extracranial metastatic germ cell tumors: A report from the Malignant Germ Cell Tumor International Consortium. Cancer 127 (2): 193-202, 2021. [PUBMED Abstract]
- Motzer RJ, Nichols CJ, Margolin KA, et al.: Phase III randomized trial of conventional-dose chemotherapy with or without high-dose chemotherapy and autologous hematopoietic stem-cell rescue as first-line treatment for patients with poor-prognosis metastatic germ cell tumors. J Clin Oncol 25 (3): 247-56, 2007. [PUBMED Abstract]
- Fizazi K, Pagliaro L, Laplanche A, et al.: Personalised chemotherapy based on tumour marker decline in poor prognosis germ-cell tumours (GETUG 13): a phase 3, multicentre, randomised trial. Lancet Oncol 15 (13): 1442-50, 2014. [PUBMED Abstract]
- Thorup J, McLachlan R, Cortes D, et al.: What is new in cryptorchidism and hypospadias--a critical review on the testicular dysgenesis hypothesis. J Pediatr Surg 45 (10): 2074-86, 2010. [PUBMED Abstract]
- Duhil de Bénazé G, Pacquement H, Faure-Conter C, et al.: Paediatric dysgerminoma: Results of three consecutive French germ cell tumours clinical studies (TGM-85/90/95) with late effects study. Eur J Cancer 91: 30-37, 2018. [PUBMED Abstract]
- Fonseca A, Xia C, Lorenzo AJ, et al.: Detection of Relapse by Tumor Markers Versus Imaging in Children and Adolescents With Nongerminomatous Malignant Germ Cell Tumors: A Report From the Children's Oncology Group. J Clin Oncol 37 (5): 396-402, 2019. [PUBMED Abstract]
- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014. [PUBMED Abstract]
- Surveillance Research Program, National Cancer Institute: SEER*Explorer: An interactive website for SEER cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed December 30, 2024.
Información sobre los estadios de los tumores de células germinativas extracraneales en la niñez
Al igual que con otros tumores sólidos infantiles, el estadio de la enfermedad en el momento del diagnóstico afecta directamente el desenlace de los pacientes con tumores malignos de células germinativas.[1-3] Los sistemas de estadificación más utilizados en los Estados Unidos son los siguientes:[4]
- Estadificación de los tumores de células germinativas de testículo del Children's Oncology Group.
- Estadificación de los tumores de células germinativas de ovario del Children's Oncology Group.
- Estadificación de los tumores de células germinativas de ovario de la International Federation of Gynecology and Obstetrics.
- Estadificación de los tumores extragonadales y extracraneales de células germinativas del Children's Oncology Group.
Estadificación de los tumores de células germinativas de testículo del Children's Oncology Group (pacientes <11 años)
En el Cuadro 3 se describe la estadificación de los tumores de células germinativas de testículo del ensayo AGCT1531 (NCT03067181) del Children's Oncology Group (COG) para varones menores de 11 años.
| Estadio | Extensión de la enfermedad |
|---|---|
| COG = Children's Oncology Group; TC = tomografía computarizada. | |
| aLos hombres menores de 50 años son aptos para participar en el ensayo AGCT1531. | |
| bEn los ensayos del COG se incluyen pacientes menores de 15 años con tumores de células germinativas de testículo. Aunque los datos son escasos, los pacientes entre 11 y 15 años se estadificarían de modo más adecuado de acuerdo con las directrices de tumores testiculares en adultos. Para obtener más información sobre la estadificación de los tumores de células germinativas de testículo en adultos, consultar Tratamiento del cáncer de testículo. | |
| I | 1) Tumor que se limita al testículo (testículos) con márgenes microscópicos negativos para compromiso tumoral y que se extirpó por completo mediante orquiectomía inguinal alta. |
| 2) Cápsula tumoral intacta que no se ha dañado mediante biopsia con aguja, biopsia por incisión o ruptura del tumor. Los pacientes sometidos a orquiectomía escrotal sin daño de la cápsula tumoral, con extirpación del cordón espermático a nivel del anillo interno se clasifican en estadio I. Los pacientes sometidos a biopsia por escisión para análisis de sección congelada, acompañada de orquiectomía completa con resección del cordón durante la misma operación se clasifican en estadio I. | |
| 3) No hay indicios clínicos, radiográficos o histológicos de enfermedad fuera de los testículos. | |
| 4) Todos los ganglios linfáticos miden <1 cm de diámetro máximo en el eje corto o en imágenes de planos múltiples. (Nota: Para los ganglios de 1–2 cm es necesario un seguimiento en un intervalo corto de 4–6 semanas. Si no hay cambios en los ganglios a las 4–6 semanas [1–2 cm], se considera obtener una biopsia o transferir el paciente al grupo de quimioterapia. Si los ganglios están creciendo, el paciente se transfiere al grupo de quimioterapia). | |
| II | 1) Orquiectomía completa sin daño in situ de la capsula tumoral (incluye biopsia con aguja y biopsia por incisión preoperatorias, o ruptura intraoperatoria de la cápsula tumoral). |
| 2) Enfermedad microscópica en el escroto o en la parte alta del cordón espermático alto (<5 cm desde el extremo proximal). Los marcadores tumorales no se normalizan ni disminuyen teniendo en cuenta la semivida de cada marcador. | |
| 3) Ganglios linfáticos negativos para compromiso tumoral. | |
| III | 1) Compromiso de ganglio linfático retroperitoneal, pero ausencia de compromiso visceral o extraabdominal. |
| 2) Ganglios linfáticos ≥2 cm o ganglios linfáticos >1 cm, pero <2 cm en el eje corto en la TC de planos múltiples y que no se resuelve en las imágenes de seguimiento a las 4–6 semanas. | |
| IV | 1) Metástasis a distancia, incluso en el hígado, el pulmón, el hueso y el encéfalo. |
Estadificación de los tumores de células germinativas de testículo (pacientes ≥11 años)
En los ensayos pediátricos sobre tumores de células germinativas, no se ha exigido la disección de ganglios linfáticos retroperitoneales para estadificar la enfermedad en varones menores de 15 años. Los datos sobre los adolescentes con tumores de células germinativas de testículo son limitados. La disección de los ganglios linfáticos retroperitoneales se utiliza para la estadificación y para el tratamiento en los ensayos de tumores de células germinativas de testículo en adultos.[5]
En varones mayores de 15 años, solo se presentan tumores en estadio I y tumores metastásicos. El riesgo de los tumores metastásicos se asigna según la International Germ Cell Consensus Classification.[6]
Para obtener más información sobre los criterios de estadificación del American Joint Committee on Cancer para los tumores de células germinativas de testículo en varones de 11 años y más, consultar Tratamiento del cáncer de testículo.
Estadificación de los tumores de células germinativas de ovario del Children’s Oncology Group
En el Cuadro 4 se describe la estadificación de los tumores de células germinativas de ovario del ensayo AGCT1531 (NCT03067181) del Children's Oncology Group (COG) para mujeres menores de 11 años.
| Estadio | Extensión de la enfermedad | |
|---|---|---|
| COG = Children's Oncology Group; TC = tomografía computarizada. | ||
| aEs posible asignar cualquier estadio a los tumores de ovario bilaterales si se cumplen los otros criterios. El tumor se estadifica según el ovario con las características más avanzadas. | ||
| I | 1) Resección del tumor de ovario sin daño de la cápsula tumoral. | |
| 2) No hay indicios de penetración parcial o completa de la cápsula. | ||
| 3) Resultado negativo para células malignas en el análisis citológico de muestras peritoneales. | ||
| 4) Ausencia de enfermedad en las superficies peritoneales o en el epiplón que se documentó en la nota operatoria o, si el aspecto es anómalo, biopsia con resultados histológicos negativos para compromiso tumoral. | ||
| 5) Todos los ganglios linfáticos miden <1 cm de diámetro en el eje corto o en imágenes de planos múltiples, o los resultados de la biopsia son negativos para compromiso tumoral. (Nota: Para los ganglios de 1–2 cm es necesario un seguimiento en un intervalo corto de 4–6 semanas. Si no hay cambios en los ganglios a las 4–6 semanas [1–2 cm], se considera obtener una biopsia o transferir el paciente al grupo de quimioterapia. Si los ganglios están creciendo, el paciente se transfiere al grupo de quimioterapia). | ||
| II | 1) Resección completa del tumor de ovario pero, en la biopsia preoperatoria se identificó daño in situ de la cápsula tumoral, o penetración parcial o completa de la cápsula en las pruebas histológicas. | |
| 2) Tumor que mide >10 cm y se extirpó mediante laparoscopia. | ||
| 3) Fragmentación tumoral durante la extirpación de modo que no se puede evaluar la penetración en la cápsula. | ||
| 4) Resultado negativo para células malignas en el análisis citológico de muestras peritoneales. | ||
| 5) Ganglios linfáticos, superficies del peritoneo y epiplón sin compromiso tumoral que se documentó en la nota operatoria o, si el aspecto es anómalo, biopsia con resultados histológicos negativos para compromiso tumoral. | ||
| III | 1) Ganglios linfáticos ≥2 cm o ganglios linfáticos >1 cm, pero <2 cm en el eje corto en la TC de planos múltiples y que no se resuelve en las imágenes de seguimiento a las 4–6 semanas. | |
| 2) Biopsia del tumor de ovario o extirpación con residuos macroscópicos. | ||
| 3) Resultado positivo para células malignas en el análisis citológico del líquido peritoneal, incluso de un teratoma inmaduro. | ||
| 4) Ganglios linfáticos con células malignas, incluso de un teratoma inmaduro. | ||
| 5) Implantes peritoneales de células malignas, incluso de un teratoma inmaduro. | ||
| III–X | Pacientes que cumplen con los criterios del COG para una enfermedad en estadio I o II, pero que presentan las siguientes situaciones: | |
| 1) Imposibilidad de obtener muestras peritoneales para análisis citológico. | ||
| 2) Imposibilidad de obtener una biopsia de los ganglios linfáticos de >1 cm en el eje corto según las imágenes de planos múltiples. | ||
| 3) Imposibilidad de obtener muestras de las superficies peritoneales anormales o del epiplón. | ||
| 4) Demora en completar la estadificación quirúrgica durante un segundo procedimiento en pacientes sometidos solo a ooforectomía como primer procedimiento. | ||
| IV | 1) Enfermedad metastásica en el parénquima del hígado (los implantes en la superficie corresponden al estadio III) o metástasis fuera de la cavidad peritoneal a cualquier otra víscera (hueso, pulmón o encéfalo) y resultado positivo para compromiso tumoral en el análisis citológico del líquido peritoneal. | |
Estadificación de los tumores de células germinativas de ovario de la International Federation of Gynecologic Oncologists
Otro sistema de estadificación que usan con frecuencia los ginecólogos oncólogos es el de la International Federation of Gynecologic Oncologists (FIGO), que se fundamenta en una estadificación quirúrgica adecuada en el momento del diagnóstico.[7]. Este sistema también se ha usado en algunos centros pediátricos,[2] es más apropiado para las mujeres mayores de 11 años y se describe en el Cuadro 5. Para obtener más información sobre el sistema de estadificación FIGO, consultar Tratamiento de los tumores de células germinativas del ovario.
| Estadio | Descripción | |
|---|---|---|
| FIGO = International Federation of Gynecology and Obstetrics. | ||
| aAdaptado de Berek et al.[8] | ||
| I | Tumor confinado en el ovario. | |
| IA | Tumor limitado a un ovario (cápsula intacta); sin tumor en la superficie del ovario, sin células malignas en el líquido de la ascitis o en las muestras de lavados peritoneales. | |
| IB | Tumor limitado a ambos ovarios (cápsula intacta); sin tumor en la superficie del ovario, sin células malignas en el líquido de la ascitis o en las muestras de lavados peritoneales. | |
| IC | Tumor limitado a uno o ambos ovarios, y cualquiera de las siguientes situaciones: | |
| IC1 | Derrame quirúrgico. | |
| IC2 | Ruptura de la cápsula antes de la cirugía o tumor en la superficie del ovario. | |
| IC3 | Células malignas en el líquido de la ascitis o en las muestras de lavados peritoneales. | |
| II | Tumor con compromiso de uno o ambos ovarios y diseminación pélvica (debajo del borde de la pelvis) o cáncer primario de peritoneo. | |
| IIA | Diseminación o implantación en el útero o las trompas de Falopio. | |
| IIB | Diseminación a otros tejidos pélvicos intraperitoneales. | |
| III | Tumor con compromiso de uno o ambos ovarios, o cáncer primario de peritoneo y confirmación citológica o histológica de diseminación al peritoneo fuera de la pelvis, o metástasis en los ganglios linfáticos retroperitoneales. | |
| IIIA1 | Solo compromiso tumoral de ganglios linfáticos retroperitoneales (confirmación citológica o histológica): | |
| IIIA1(i) | Ganglios linfáticos ≤10 mm en su dimensión mayor. | |
| IIIA1(ii) | Ganglios linfáticos >10 mm en su dimensión mayor. | |
| IIIA2 | Compromiso peritoneal microscópico extrapélvico (encima del borde de la pelvis), con compromiso de los ganglios linfáticos retroperitoneales o sin este. | |
| IIIB | Metástasis peritoneales macroscópicas fuera de la pelvis, de ≤2 cm en su dimensión mayor, con metástasis en los ganglios linfáticos retroperitoneales o sin estas. | |
| IIIC | Metástasis peritoneales macroscópicas fuera de la pelvis, de >2 cm en su dimensión mayor, con metástasis en los ganglios linfáticos retroperitoneales o sin estas (incluye diseminación del tumor a la cápsula del hígado o el bazo, sin compromiso parenquimatoso de ninguno de estos órganos). | |
| IV | Metástasis a distancia con exclusión de metástasis peritoneales. | |
| IVA | Derrame pleural con resultado positivo para compromiso tumoral en el análisis citológico. | |
| IVB | Metástasis parenquimatosas y metástasis en órganos extraabdominales (incluso en los ganglios linfáticos inguinales y los ganglios linfáticos fuera de la cavidad abdominal). | |
Los sistemas de estadificación de los tumores de ovario descritos antes exigen el cumplimiento de directrices quirúrgicas específicas. Sin embargo, en un ensayo pediátrico intergrupal, se cumplió con las directrices en solo 2 de 131 pacientes con tumores de ovario.[9] En un estudio retrospectivo de una sola institución, se cumplió con las directrices en solo 2 de 44 pacientes con tumores de ovario.[10]
Estadificación de los tumores extragonadales y extracraneales de células germinativas del Children's Oncology Group
En el Cuadro 6 se describe la estadificación de los tumores extragonadales y extracraneales de células germinativas del ensayo AGCT1531 (NCT03067181) del Children's Oncology Group (COG).
| Estadio | Extensión de la enfermedad |
|---|---|
| COG = Children's Oncology Group; TC = tomografía computarizada. | |
| I | 1) Resección completa en cualquier sitio, incluso coccigectomía en un sitio sacrococcígeo. |
| 2) Márgenes tumorales negativos para compromiso tumoral y cápsula intacta. | |
| 3) En caso de uno o más tumores con compromiso de la cavidad abdominal o el retroperitoneo, se debe obtener líquido peritoneal o muestras de los lavados peritoneales para análisis citológico y el resultado debe ser negativo para células malignas. | |
| 4) Ganglios linfáticos ≤1 cm en imágenes del abdomen, la pelvis o el tórax. (Nota: Para los ganglios de 1–2 cm es necesario un seguimiento en un intervalo corto de 4–6 semanas. Si no hay cambios en los ganglios a las 4–6 semanas [1–2 cm], se considera obtener una biopsia o transferir el paciente al grupo de quimioterapia. Si los ganglios están creciendo, el paciente se transfiere al grupo de quimioterapia. En caso de uno o más tumores con compromiso de la cavidad abdominal o el retroperitoneo, se debe obtener líquido peritoneal o muestras de los lavados peritoneales para análisis citológico y el resultado debe ser negativo para células malignas). | |
| II | 1) Enfermedad residual microscópica. |
| 2) Resección macroscópica total con biopsia preoperatoria, biopsia intraoperatoria, enfermedad residual microscópica o hallazgos anatomopatológicos de ruptura capsular. | |
| 3) Ganglios linfáticos negativos para compromiso tumoral en las imágenes del abdomen, la pelvis o el tórax. Resultado negativo para células malignas en el líquido peritoneal. | |
| III | 1) Enfermedad residual macroscópica o biopsia sola. |
| 2) Ganglios linfáticos positivos para compromiso tumoral y resección del tumor. Ganglios linfáticos ≥2 cm o ganglios linfáticos >1 cm, pero <2 cm en el eje corto en la TC de planos múltiples y que no se resuelve en las imágenes de seguimiento a las 4–6 semanas. | |
| IV | Metástasis a distancia, incluso en el hígado, el pulmón, el hueso y el encéfalo. |
Bibliografía
- Ablin AR, Krailo MD, Ramsay NK, et al.: Results of treatment of malignant germ cell tumors in 93 children: a report from the Childrens Cancer Study Group. J Clin Oncol 9 (10): 1782-92, 1991. [PUBMED Abstract]
- Mann JR, Pearson D, Barrett A, et al.: Results of the United Kingdom Children's Cancer Study Group's malignant germ cell tumor studies. Cancer 63 (9): 1657-67, 1989. [PUBMED Abstract]
- Marina N, Fontanesi J, Kun L, et al.: Treatment of childhood germ cell tumors. Review of the St. Jude experience from 1979 to 1988. Cancer 70 (10): 2568-75, 1992. [PUBMED Abstract]
- Brodeur GM, Howarth CB, Pratt CB, et al.: Malignant germ cell tumors in 57 children and adolescents. Cancer 48 (8): 1890-8, 1981. [PUBMED Abstract]
- de Wit R, Fizazi K: Controversies in the management of clinical stage I testis cancer. J Clin Oncol 24 (35): 5482-92, 2006. [PUBMED Abstract]
- International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group. J Clin Oncol 15 (2): 594-603, 1997. [PUBMED Abstract]
- Cannistra SA: Cancer of the ovary. N Engl J Med 329 (21): 1550-9, 1993. [PUBMED Abstract]
- Berek JS, Renz M, Kehoe S, et al.: Cancer of the ovary, fallopian tube, and peritoneum: 2021 update. Int J Gynaecol Obstet 155 (Suppl 1): 61-85, 2021. [PUBMED Abstract]
- Billmire D, Vinocur C, Rescorla F, et al.: Outcome and staging evaluation in malignant germ cell tumors of the ovary in children and adolescents: an intergroup study. J Pediatr Surg 39 (3): 424-9; discussion 424-9, 2004. [PUBMED Abstract]
- Madenci AL, Levine BS, Laufer MR, et al.: Poor adherence to staging guidelines for children with malignant ovarian tumors. J Pediatr Surg 51 (9): 1513-7, 2016. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento de los tumores extracraneales de células germinativas en la niñez
Los tumores extracraneales de células germinativas en la niñez son muy heterogéneos.
De acuerdo con los factores clínicos y el tipo histológico del tumor, el tratamiento apropiado para los tumores extracraneales de células germinativas incluye una de las siguientes opciones:
- Resección quirúrgica seguida de seguimiento minucioso para detectar una recidiva de la enfermedad.
- Resección quirúrgica inicial seguida de quimioterapia a base de derivados del platino.
- Biopsia diagnóstica del tumor y quimioterapia preoperatoria a base de derivados del platino, seguida de resección definitiva del tumor.[1]
Para aumentar al máximo la supervivencia a largo plazo y reducir al mínimo las secuelas relacionadas con el tratamiento a largo plazo (por ejemplo, leucemias secundarias, esterilidad, hipoacusia y disfunción renal), los niños con tumores extracraneales malignos de células germinativas deben recibir atención en centros oncológicos pediátricos con experiencia en el tratamiento de estos tumores raros.
Opciones de tratamiento de los tumores extracraneales de células germinativas en la niñez según el tipo histológico
En el Cuadro 7 se ofrece una descripción general de las opciones de tratamiento para los niños con tumores extracraneales de células germinativas. Los detalles específicos del tratamiento por sitio primario y afección clínica se describen en las secciones siguientes.
| Tipo histológico | Opciones de tratamiento | ||
|---|---|---|---|
| BEP = bleomicina (semanal), etopósido y cisplatino; JEb = carboplatino, etopósido y bleomicina; PEb = cisplatino, etopósido y bleomicina (bleomicina solo en el día 1 de cada ciclo). | |||
| aNo se ha observado eficacia de la quimioterapia para el tratamiento de niños con teratomas inmaduros en estadios II–IV. Sin embargo, la función de la quimioterapia para estos pacientes no se ha estudiado de forma sistemática. La quimioterapia sigue siendo el tratamiento estándar en pacientes pospúberes, aunque los estudios son escasos.[2] | |||
| bLa quimioterapia (PEb) se puede considerar el tratamiento estándar en mujeres prepúberes con enfermedad en estadio I, en quienes no se cumplieron de manera estricta con las directrices quirúrgicas de estadificación.[3] | |||
| cEn mujeres pospúberes con enfermedad en estadio I, no se ha establecido la estrategia de observación posterior a la cirugía. Esta estrategia terapéutica está en investigación en un ensayo clínico (AGCT1531 [NCT03067181]). | |||
| Teratoma maduro | |||
| Sitio sacrococcígeo | Cirugía y observación | ||
| Sitio no sacrococcígeo | Cirugía y observación | ||
| Teratoma inmaduro | Cirugía y observación (estadio I) | ||
| Cirugía, y observación o quimioterapia (estadios I–IV) a | |||
| Tumores gonadales malignos de células germinativas en la niñez: | |||
| Tumores malignos de células germinativas de testículo en la niñez: | |||
| Tumores malignos de células germinativas de testículo en varones prepúberes | Cirugía y observación (estadio I) | ||
| Cirugía y quimioterapia (PEb) (estadios II–IV) | |||
| Tumores malignos de células germinativas de testículo en varones pospúberes | Para obtener más información, consultar Tratamiento del cáncer de testículo. | ||
| Tumores malignos de células germinativas de ovario en la niñez: | |||
| Disgerminomas de ovario | Cirugía y observación (estadio I) | ||
| Cirugía y quimioterapia (PEb) (estadios II–IV) | |||
| Tumores malignos de células germinativas de ovario no germinomatosos (tumores de saco vitelino y tumores mixtos de células germinativas) en mujeres prepúberes | Cirugía y observación en mujeres prepúberes (estadio I con cumplimiento estricto de las directrices quirúrgicas de estadificación) b. Para obtener información sobre el tratamiento del teratoma inmaduro de ovario, consultar la sección Tumores malignos de células germinativas de ovario en la niñez. | ||
| Cirugía y quimioterapia (PEb) para mujeres prepúberes y pospúberes (presunto estadio I y estadios II–IV) | |||
| Tumores malignos de células germinativas de ovario no germinomatosos (tumores de saco vitelino y tumores mixtos de células germinativas) en mujeres pospúberes | Cirugía y quimioterapia (BEP) para mujeres prepúberes y pospúberes (presunto estadio I y estadios II–IV) c | ||
| Tumores malignos de células germinativas de ovario no germinomatosos (tumores de saco vitelino y tumores mixtos de células germinativas) irresecables al inicio | Biopsia seguida de quimioterapia y cirugía (tumores de células germinativas de ovario irresecables al inicio). | ||
| Tumores malignos extragonadales y extracraneales de células germinativas en la niñez: | |||
| Tumores malignos extragonadales y extracraneales de células germinativas en niños prepúberes | Cirugía y quimioterapia (PEb o JEb) (estadios I–IV) | ||
| Biopsia seguida de quimioterapia con cirugía o sin esta (estadios III y IV) | |||
| Tumores malignos extragonadales y extracraneales de células germinativas en niños pospúberes | Cirugía | ||
| Quimioterapia (BEP) | |||
| Quimioterapia seguida de cirugía para extirpar el tumor residual | |||
| Participación en un ensayo clínico | |||
| Tumores malignos de células germinativas recidivantes en la niñez | Cirugía sola | ||
| Cirugía con quimioterapia neoadyuvante o adyuvante | |||
Tumores de células germinativas con elementos no germinativos (teratoma con transformación maligna)
El tratamiento de los tumores de células germinativas que tienen otros elementos somáticos distintos a los de origen germinativo es complejo y hay pocos datos para guiarlo. En los adolescentes, se han encontrado tumores neuroectodérmicos primitivos y sarcomas dentro de teratomas.[4,5] El grupo Italian Pediatric Germ Cell Tumor identificó a 14 pacientes con tumores malignos de células germinativas que contenían una neoplasia maligna somática, como neuroblastoma o rabdomiosarcoma, embebidos en los teratomas (<2 % de los tumores extracraneales de células germinativas).[6]
La estrategia de tratamiento óptima para tumores de células germinativas con elementos no germinativos no se ha determinado. Es posible que sean necesarios tratamientos separados para los elementos de los tumores malignos de células germinativas y los elementos no germinativos.
Cirugía
La cirugía es un componente esencial del tratamiento. Se describen los tratamientos específicos para cada tipo de tumor.
Cirugía y observación
Es posible que no se necesite tratamiento adicional para los pacientes sometidos a resección completa de teratomas inmaduros de todos los grados y en cualquier localización, y para aquellos sometidos a resección completa de tumores de células germinativas seminomatosos y no seminomatosos (testiculares u ováricos) localizados (estadio I). Sin embargo, es importante una vigilancia estrecha.[7,8] El abordaje de conducta expectante exige exámenes físicos seriados programados, la determinación de marcadores tumorales y las imágenes del tumor primario para asegurar la detección oportuna de un tumor recidivante.
Quimioterapia
En los Estados Unidos, el régimen estándar de quimioterapia para adultos y niños con tumores malignos de células germinativas no seminomatosos incluye cisplatino, etopósido y bleomicina. Los adultos reciben bleomicina semanal durante todo el tratamiento (bleomicina, etopósido y cisplatino [BEP]).[9-12] En los ensayos pediátricos realizados en los Estados Unidos, se incluyó a pacientes de 15 años y menos, con tumores de células germinativas de testículo, y a pacientes de 21 años y menos, con tumores de células germinativas de ovario y tumores extragonadales. Los pacientes pediátricos solo recibieron bleomicina el día 1 de cada ciclo (cisplatino, etopósido y bleomicina [PEb]).[3,13] La combinación de carboplatino, etopósido y bleomicina (JEb) se sometió a investigación clínica en el Reino Unido en niños menores de 16 años. El tratamiento con este régimen produjo tasas de supervivencia sin complicaciones (SSC) por sitio y estadio similares a las del tratamiento con PEb.[14,15]; [16][Nivel de evidencia C1] Para obtener información sobre los esquemas de dosificación de quimioterapia BEP en adultos, además de PEb y JEb en niños, consultar el Cuadro 8.[3,9-11,13] En los ensayos clínicos con adultos y niños, el número de adolescentes fue pequeño. No está claro el tratamiento ideal para los adolescentes (11 años y más).[17]
El uso de JEb se relaciona con menos efectos tóxicos otológicos y renales que el uso de PEb.[14] En un metanálisis retrospectivo de datos de los estudios de células germinativas del Children’s Oncology Group (COG) y el Children’s Cancer and Leukaemia Group que se llevaron a cabo al mismo tiempo, el modelo de curación multivariante no mostró diferencia en las tasas SSC a 4 años. La tasa de SSC a 4 años fue de 86 % (intervalo de confianza [IC] 95 %, 83–89 %) para los pacientes que recibieron el régimen con cisplatino (n = 620) y de 86 % (IC 95 %, 79–90 %) para aquellos que recibieron el régimen con carboplatino (n = 163) (P = 0,87).[18][Nivel de evidencia C1] Sin embargo, los regímenes PEb y JEb no se han comparado en un ensayo aleatorizado sobre tumores de células germinativas en niños.
| Régimen | Bleomicina | Etopósido | Cisplatino | Carboplatino |
|---|---|---|---|---|
| BEP = bleomicina, etopósido y cisplatino; ; TFG = tasa de filtración glomerular; JEb = carboplatino, etopósido y bleomicina; PEb = cisplatino, etopósido y bleomicina. | ||||
| BEP en adultos (cada 21 días) [11,19] | 30 unidades/m2, día 1, 8 y 15 (máximo de 30 unidades) | 100 mg/m2, días 1–5 | 20 mg/m2, días 1–5 | |
| PEb en niños (cada 21 días) [3,13] | 15 unidades/m2, día 1 (máximo de 30 unidades) | 100 mg/m2, días 1–5 | 20 mg/m2, días 1–5 | |
| JEb en niños (cada 21–28 días) [14] | 15 unidades/m2, día 3 (máximo de 30 unidades) | 120 mg/m2, días 1–3 | 600 mg/m2 o dosificación según la TFG, día 2 | |
El COG (antes Children's Cancer Group y Pediatric Oncology Group) condujo varios ensayos.[3,7,13] En estos ensayos se exploró el uso de PEb para el tratamiento de los tumores gonadales de células germinativas localizados [3] y el uso de regímenes intensificados para pacientes con características de riesgo alto. En las estrategias, se incluyeron dosis altas de cisplatino (200 mg/m2) y ciclofosfamida o el fármaco protector amifostina.[13,20] Ninguna de estas estrategias tuvo un efecto significativo en la supervivencia ni disminuyó la toxicidad.
El COG realizó un ensayo de quimioterapia PEb comprimida y reducida (3 ciclos en 3 días) para pacientes con tumores malignos de células germinativas de riesgo bajo o intermedio. Este estudio se diseñó como un ensayo de ausencia de inferioridad con un valor P de 0,1. La tasa de SSC a 4 años de 89 % fue significativamente más baja que la tasa del modelo de control histórico (92 %, P = 0,08).[21] Sin embargo, el número de pacientes en cada estrato fue pequeño y quizás se justifique más investigación en pacientes con enfermedad en un estadio inferior.
Radioterapia
Aunque los seminomas testiculares y mediastínicos en los varones, y los disgerminomas ováricos en las mujeres son sensibles a la radiación, pocas veces se recomienda la radioterapia debido a sus conocidos efectos tardíos.
Bibliografía
- Rescorla FJ: Pediatric germ cell tumors. Semin Surg Oncol 16 (2): 144-58, 1999. [PUBMED Abstract]
- Norris HJ, Zirkin HJ, Benson WL: Immature (malignant) teratoma of the ovary: a clinical and pathologic study of 58 cases. Cancer 37 (5): 2359-72, 1976. [PUBMED Abstract]
- Rogers PC, Olson TA, Cullen JW, et al.: Treatment of children and adolescents with stage II testicular and stages I and II ovarian malignant germ cell tumors: A Pediatric Intergroup Study--Pediatric Oncology Group 9048 and Children's Cancer Group 8891. J Clin Oncol 22 (17): 3563-9, 2004. [PUBMED Abstract]
- Ehrlich Y, Beck SD, Ulbright TM, et al.: Outcome analysis of patients with transformed teratoma to primitive neuroectodermal tumor. Ann Oncol 21 (9): 1846-50, 2010. [PUBMED Abstract]
- Rice KR, Magers MJ, Beck SD, et al.: Management of germ cell tumors with somatic type malignancy: pathological features, prognostic factors and survival outcomes. J Urol 192 (5): 1403-9, 2014. [PUBMED Abstract]
- Terenziani M, D'Angelo P, Bisogno G, et al.: Teratoma with a malignant somatic component in pediatric patients: the Associazione Italiana Ematologia Oncologia Pediatrica (AIEOP) experience. Pediatr Blood Cancer 54 (4): 532-7, 2010. [PUBMED Abstract]
- Marina NM, Cushing B, Giller R, et al.: Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology Group/Children's Cancer Group Intergroup Study. J Clin Oncol 17 (7): 2137-43, 1999. [PUBMED Abstract]
- Schlatter M, Rescorla F, Giller R, et al.: Excellent outcome in patients with stage I germ cell tumors of the testes: a study of the Children's Cancer Group/Pediatric Oncology Group. J Pediatr Surg 38 (3): 319-24; discussion 319-24, 2003. [PUBMED Abstract]
- de Wit R, Roberts JT, Wilkinson PM, et al.: Equivalence of three or four cycles of bleomycin, etoposide, and cisplatin chemotherapy and of a 3- or 5-day schedule in good-prognosis germ cell cancer: a randomized study of the European Organization for Research and Treatment of Cancer Genitourinary Tract Cancer Cooperative Group and the Medical Research Council. J Clin Oncol 19 (6): 1629-40, 2001. [PUBMED Abstract]
- Gershenson DM, Morris M, Cangir A, et al.: Treatment of malignant germ cell tumors of the ovary with bleomycin, etoposide, and cisplatin. J Clin Oncol 8 (4): 715-20, 1990. [PUBMED Abstract]
- Williams SD, Birch R, Einhorn LH, et al.: Treatment of disseminated germ-cell tumors with cisplatin, bleomycin, and either vinblastine or etoposide. N Engl J Med 316 (23): 1435-40, 1987. [PUBMED Abstract]
- International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group. J Clin Oncol 15 (2): 594-603, 1997. [PUBMED Abstract]
- Cushing B, Giller R, Cullen JW, et al.: Randomized comparison of combination chemotherapy with etoposide, bleomycin, and either high-dose or standard-dose cisplatin in children and adolescents with high-risk malignant germ cell tumors: a pediatric intergroup study--Pediatric Oncology Group 9049 and Children's Cancer Group 8882. J Clin Oncol 22 (13): 2691-700, 2004. [PUBMED Abstract]
- Mann JR, Raafat F, Robinson K, et al.: The United Kingdom Children's Cancer Study Group's second germ cell tumor study: carboplatin, etoposide, and bleomycin are effective treatment for children with malignant extracranial germ cell tumors, with acceptable toxicity. J Clin Oncol 18 (22): 3809-18, 2000. [PUBMED Abstract]
- Stern JW, Bunin N: Prospective study of carboplatin-based chemotherapy for pediatric germ cell tumors. Med Pediatr Oncol 39 (3): 163-7, 2002. [PUBMED Abstract]
- Depani S, Stoneham S, Krailo M, et al.: Results from the UK Children's Cancer and Leukaemia Group study of extracranial germ cell tumours in children and adolescents (GCIII). Eur J Cancer 118: 49-57, 2019. [PUBMED Abstract]
- Frazier AL, Hale JP, Rodriguez-Galindo C, et al.: Revised risk classification for pediatric extracranial germ cell tumors based on 25 years of clinical trial data from the United Kingdom and United States. J Clin Oncol 33 (2): 195-201, 2015. [PUBMED Abstract]
- Frazier AL, Stoneham S, Rodriguez-Galindo C, et al.: Comparison of carboplatin versus cisplatin in the treatment of paediatric extracranial malignant germ cell tumours: A report of the Malignant Germ Cell International Consortium. Eur J Cancer 98: 30-37, 2018. [PUBMED Abstract]
- Einhorn LH, Williams SD, Loehrer PJ, et al.: Evaluation of optimal duration of chemotherapy in favorable-prognosis disseminated germ cell tumors: a Southeastern Cancer Study Group protocol. J Clin Oncol 7 (3): 387-91, 1989. [PUBMED Abstract]
- Marina N, Chang KW, Malogolowkin M, et al.: Amifostine does not protect against the ototoxicity of high-dose cisplatin combined with etoposide and bleomycin in pediatric germ-cell tumors: a Children's Oncology Group study. Cancer 104 (4): 841-7, 2005. [PUBMED Abstract]
- Shaikh F, Cullen JW, Olson TA, et al.: Reduced and Compressed Cisplatin-Based Chemotherapy in Children and Adolescents With Intermediate-Risk Extracranial Malignant Germ Cell Tumors: A Report From the Children's Oncology Group. J Clin Oncol 35 (11): 1203-1210, 2017. [PUBMED Abstract]
Consideraciones especiales para el tratamiento de niños con cáncer
El cáncer en niños y adolescentes es raro, aunque desde 1975 se ha observado un aumento gradual de la incidencia general.[1] Los niños y adolescentes con cáncer se deben derivar a centros médicos que cuenten con equipos multidisciplinarios de especialistas en oncología con experiencia en el tratamiento de los cánceres que se presentan en la niñez y la adolescencia. Este equipo multidisciplinario incorpora la pericia de los siguientes profesionales de atención de la salud y otros para asegurar que los niños reciban el tratamiento, los cuidados médicos de apoyo y la rehabilitación que les permitan lograr una supervivencia y calidad de vida óptimas:
- Médicos de atención primaria.
- Cirujanos pediatra.
- Cirujanos de trasplante.
- Patólogos.
- Radioncólogos pediatras.
- Oncólogos y hematólogos pediatras.
- Oftalmólogos.
- Especialistas en rehabilitación.
- Enfermeros especializados en oncología pediátrica.
- Trabajadores o asistentes sociales.
- Profesionales de la vida infantil.
- Psicólogos.
- Nutricionistas y dietistas.
Para obtener información específica sobre los cuidados médicos de apoyo para niños y adolescentes con cáncer, consultar los resúmenes de Cuidados médicos de apoyo y cuidados paliativos.
La American Academy of Pediatrics estableció pautas para los centros de oncología pediátrica y su función en el tratamiento de los pacientes con cáncer infantil.[2] En estos centros de oncología pediátrica, se dispone de ensayos clínicos para la mayoría de los tipos de cáncer que se presentan en niños y adolescentes, y se ofrece la oportunidad de participar a la mayoría de los pacientes y familiares. Por lo general, los ensayos clínicos para los niños y adolescentes con cáncer se diseñan a fin de comparar un tratamiento que parece mejor con el tratamiento estándar actual. La mayoría de los avances en la identificación de tratamientos curativos para los cánceres infantiles se lograron mediante ensayos clínicos. Para obtener información sobre los ensayos clínicos en curso, consultar el portal de Internet del NCI.
Bibliografía
- Smith MA, Seibel NL, Altekruse SF, et al.: Outcomes for children and adolescents with cancer: challenges for the twenty-first century. J Clin Oncol 28 (15): 2625-34, 2010. [PUBMED Abstract]
- American Academy of Pediatrics: Standards for pediatric cancer centers. Pediatrics 134 (2): 410-4, 2014. Also available online. Last accessed February 25, 2025.
Tratamiento de los teratomas maduros e inmaduros en la niñez
Los teratomas maduros e inmaduros por lo general surgen en la región sacrococcígea en los recién nacidos y niños pequeños, y en los ovarios de las niñas durante la pubertad. Con menos frecuencia, estos tumores se encuentran en la región testicular de niños menores de 4 años, en el mediastino de los adolescentes y en otros sitios.[1-3] El tratamiento principal para los teratomas es la cirugía con resección completa. Las opciones quirúrgicas para los teratomas sacrococcígeos son complejas.
Los teratomas benignos de cabeza y cuello y los teratomas inmaduros a veces causan morbilidad y mortalidad por obstrucción. En recién nacidos y lactantes prematuros, es posible que los teratomas de cabeza y cuello y los teratomas inmaduros afecten las vías respiratorias de forma importante. En un informe de una sola institución, se indica que la obstrucción de las vías aéreas se superó mediante el procedimiento de tratamiento extrauterino intraparto (EXIT).[4] Se puede lograr la resección completa de un teratoma.
Tratamiento de los teratomas maduros
Opciones de tratamiento estándar de los teratomas maduros (sitios sacrococcígeos)
La región sacrococcígea es el sitio primario del tumor de la mayoría de los tumores benignos y malignos de células germinativas diagnosticados en recién nacidos, lactantes y niños menores de 4 años. Estos tumores son más frecuentes en niñas que en niños; se notificaron proporciones de 3:1 a 4:1.[5]
Los tumores sacrococcígeos siguen los siguientes dos modelos clínicos relacionados con la edad del niño, la localización del tumor y la probabilidad de que el tumor sea maligno:[1]
- Neonatos. Tumores neonatales presentes en el momento del nacimiento que sobresalen del sacro. Sin embargo, los tumores sacrococcígeos a veces se diseminan al espacio retroperitoneal sin protrusión hacia el exterior. Por lo general son teratomas maduros o inmaduros.
- Lactantes y niños pequeños. En lactantes y niños pequeños los tumores se presentan como una masa palpable en la región sacropélvica que comprime la vejiga o el recto. Es más probable que estos tumores pélvicos sean malignos.
Cuanto mayor es el niño en el momento de la presentación, es más probable que tenga un componente maligno además del teratoma. En una encuesta temprana, se encontró que la tasa de tumores malignos fue del 48 % en niñas y del 67 % en niños mayores de 2 meses en el momento del diagnóstico del tumor sacrococcígeo, en comparación con una incidencia de tumor maligno del 7 % en niñas y el 10 % en niños menores de 2 meses en el momento del diagnóstico.[6] Se notificó que el sitio pélvico del tumor primario es un factor de pronóstico adverso. Esto quizás se deba a un diagnóstico tardío porque no se descubrió en el momento del nacimiento o se realizó una resección incompleta en el momento de la cirugía inicial.[6-9]
La opción de tratamiento estándar de los teratomas maduros en un sitio sacrococcígeo es la siguiente:
- Cirugía y observación.
La cirugía es un componente esencial del tratamiento. La resección completa del cóccix es vital para reducir al mínimo la probabilidad de recidiva del tumor.[2]
Opciones de tratamiento estándar de los teratomas maduros (sitios no sacrococcígeos)
La opción de tratamiento estándar de los teratomas maduros en un sitio no sacrococcígeo es la siguiente:
- Cirugía y observación.
Los niños con teratomas maduros, como los teratomas maduros del mediastino, se pueden tratar con cirugía y observación y tienen un pronóstico excelente.[1,10]
En una revisión de 153 niños con teratomas maduros extratesticulares, la tasa de supervivencia sin recaída a los 6 años fue del 96 % para los pacientes con enfermedad completamente resecada y del 55 % para los pacientes con enfermedad con resección incompleta.[2] En otra serie, se incluyó a 57 niñas con teratomas de ovario maduros. De estas pacientes, 2 presentaron recidivas tumorales (entre 8 y 12 meses después de la cirugía con conservación de los ovarios), y 7 presentaron tumores metacrónicos (hasta 79 meses después del diagnóstico inicial).[11][Nivel de evidencia C1]
Un equipo multidisciplinario debe tratar y hacer el seguimiento de los neonatos con tumores de células germinativas de cabeza y cuello. Si bien la mayoría de los tumores de células germinativas de cabeza y cuello son benignos, son potencialmente mortales y pueden presentar retos importantes para los cirujanos; en particular, en los recién nacidos.[4] Algunos tumores presentan elementos malignos que quizás alteren la estrategia de tratamiento.[12,13]
Los teratomas maduros en los testículos de prepúberes son lesiones benignas relativamente comunes y es posible que sean susceptibles a la cirugía con conservación de los testículos.[14]
Tratamiento de los teratomas inmaduros
Opciones de tratamiento de los teratomas inmaduros
Las opciones de tratamiento de los teratomas inmaduros son las siguientes:
- Cirugía y observación (estadio I).
- Cirugía, y observación o quimioterapia (estadios I–IV). El uso de quimioterapia es objeto de polémica. Para obtener más información, consultar Evidencia de la función de la quimioterapia para el tratamiento de teratomas inmaduros.
Cirugía y observación (estadio I)
Los teratomas inmaduros en niños se tratan principalmente con cirugía y observación.
Evidencia (cirugía y observación para la enfermedad en estadio I):
- El Pediatric Oncology Group y el Children's Cancer Group investigaron en un estudio un abordaje con cirugía sola. Se usó resección quirúrgica seguida de observación minuciosa para tratar a pacientes con teratomas inmaduros.[15]
- La cirugía sola resultó curativa para la mayoría de las niñas y adolescentes con teratomas inmaduros de ovario de cualquier grado sometidos a resección, incluso cuando se encontraron concentraciones elevadas de alfafetoproteína (AFP) sérica o focos microscópicos de tumor de saco vitelino.
- Se demostró una tasa de supervivencia sin complicaciones (SSC) a 3 años del 97,8 % en pacientes con tumores de ovario, del 100 % en pacientes con tumores de testículo y del 80 % en pacientes con tumores extragonadales.
Cirugía, y observación o quimioterapia (estadios I–IV)
El uso de quimioterapia para el tratamiento de teratomas inmaduros es objeto de polémica y no hay ensayos clínicos que apoyen el uso de quimioterapia en niños. En mujeres adultas con tumores de ovario, la cirugía seguida de quimioterapia ha sido el abordaje de tratamiento estándar desde 1976.[16] Al igual que para los niños, no hay ensayos clínicos con adultos que sustenten el uso de quimioterapia.
Evidencia (función de la quimioterapia para teratomas inmaduros):
- En un artículo fundamental publicado en 1976, se notificó que la mayoría de las mujeres con teratomas inmaduros se trataban con cirugía y quimioterapia. Este enfoque ha seguido siendo la práctica estándar en mujeres pospúberes.[16]
- En un informe de pacientes pediátricos de 15 años de edad y menos del Reino Unido, los teratomas inmaduros no respondieron a la quimioterapia.[17]
- En un informe del Malignant Germ Cell Tumor International Collaborative (MaGIC), se analizaron datos de 98 pacientes pediátricas y 81 pacientes adultas con teratomas inmaduros de ovario. De las pacientes pediátricas, 90 se sometieron a cirugía sola. Las 81 pacientes adultas recibieron quimioterapia adyuvante.[18][Nivel de evidencia C1]
- La tasa de SSC a 5 años fue del 91 % en las pacientes pediátricas y del 98 % en las pacientes adultas.
- La tasa de supervivencia general (SG) fue del 83 % para pacientes pediátricas y del 93 % para pacientes adultas.
- Las pacientes con tumores de grado I no presentaron recaída. Una paciente adulta con un tumor de grado II recayó después de la quimioterapia.
- Para las pacientes con tumores pediátricos de grado III en estadios I o II, la SSC a 5 años fue del 92 %. Para las pacientes con tumores de grado III en estadio III, la SSC a 5 años fue del 52 %.
- Para las pacientes adultas con tumores de grado III, estadio I/II, la tasa de SSC a 5 años fue del 91 %. Para las pacientes con tumores de grado III, estadio III/IV, la tasa de SSC a 5 años fue del 65 %.
Se necesitan estudios adicionales sobre el tratamiento de los teratomas inmaduros con quimioterapia. Para obtener más información sobre del tratamiento de teratomas inmaduros de ovario en mujeres pospúberes, consultar Tratamiento de los tumores de células germinativas del ovario.
Opciones de tratamiento en evaluación clínica para los teratomas inmaduros
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de ensayo clínico nacional o institucional en curso:
- AGCT1531 (NCT03067181) (Active Surveillance, Bleomycin, Carboplatin, Etoposide, or Cisplatin in Treating Pediatric and Adult Patients with GCTs): los pacientes con teratomas inmaduros de células puras de ovario en estadio I del Children's Oncology Group (estadios IA y IB de la International Federation of Gynecology and Obstetrics [FIGO]), de grados 2 o 3, y que tienen una concentración de AFP inferior a 1000 ng/ml son aptos para someterse a cirugía y observación en este ensayo.
Seguimiento posterior al tratamiento de los teratomas maduros e inmaduros
Después de una resección realizada con éxito, los neonatos con teratomas benignos maduros e inmaduros se observan de cerca con exámenes de seguimiento y determinaciones seriadas de alfafetoproteína (AFP) sérica. Estas pruebas se realizan durante varios años para asegurar que las mediciones de AFP se normalicen hasta lograr las concentraciones fisiológicas esperadas y facilitar la detección temprana de una recaída tumoral.[19,20] Varios grupos oncológicos notificaron tasas significativas de recaída de estos tumores benignos que oscilaron entre el 10 % y el 21 %. La mayoría de las recaídas se presentaron dentro de los 3 años de la resección.[5,19,21,22]
Si bien no hay un cronograma de seguimiento estándar, los marcadores tumorales se miden con frecuencia durante 3 años en todos los niños. Con la detección temprana, estos tumores malignos de células germinativas recidivantes se pueden tratar de manera satisfactoria mediante cirugía y quimioterapia (tasa de SG, 92 %)[23] Los sobrevivientes a largo plazo se deben controlar para detectar complicaciones de una cirugía extensa, que incluyen estreñimiento, incontinencia fecal y urinaria, además de cicatrices con repercusiones cosméticas inadmisibles desde el punto de vista psicológico.[24]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Rescorla FJ: Pediatric germ cell tumors. Semin Surg Oncol 16 (2): 144-58, 1999. [PUBMED Abstract]
- Göbel U, Calaminus G, Engert J, et al.: Teratomas in infancy and childhood. Med Pediatr Oncol 31 (1): 8-15, 1998. [PUBMED Abstract]
- Pinkerton CR: Malignant germ cell tumours in childhood. Eur J Cancer 33 (6): 895-901; discussion 901-2, 1997. [PUBMED Abstract]
- Dharmarajan H, Rouillard-Bazinet N, Chandy BM: Mature and immature pediatric head and neck teratomas: A 15-year review at a large tertiary center. Int J Pediatr Otorhinolaryngol 105: 43-47, 2018. [PUBMED Abstract]
- Rescorla FJ, Sawin RS, Coran AG, et al.: Long-term outcome for infants and children with sacrococcygeal teratoma: a report from the Childrens Cancer Group. J Pediatr Surg 33 (2): 171-6, 1998. [PUBMED Abstract]
- Altman RP, Randolph JG, Lilly JR: Sacrococcygeal teratoma: American Academy of Pediatrics Surgical Section Survey-1973. J Pediatr Surg 9 (3): 389-98, 1974. [PUBMED Abstract]
- Ablin AR, Krailo MD, Ramsay NK, et al.: Results of treatment of malignant germ cell tumors in 93 children: a report from the Childrens Cancer Study Group. J Clin Oncol 9 (10): 1782-92, 1991. [PUBMED Abstract]
- Marina N, Fontanesi J, Kun L, et al.: Treatment of childhood germ cell tumors. Review of the St. Jude experience from 1979 to 1988. Cancer 70 (10): 2568-75, 1992. [PUBMED Abstract]
- Baranzelli MC, Kramar A, Bouffet E, et al.: Prognostic factors in children with localized malignant nonseminomatous germ cell tumors. J Clin Oncol 17 (4): 1212, 1999. [PUBMED Abstract]
- Schneider DT, Calaminus G, Reinhard H, et al.: Primary mediastinal germ cell tumors in children and adolescents: results of the German cooperative protocols MAKEI 83/86, 89, and 96. J Clin Oncol 18 (4): 832-9, 2000. [PUBMED Abstract]
- Braungart S, Craigie RJ, Farrelly P, et al.: Ovarian tumors in children: how common are lesion recurrence and metachronous disease? A UK CCLG Surgeons Cancer Group nationwide study. J Pediatr Surg 55 (10): 2026-2029, 2020. [PUBMED Abstract]
- Bernbeck B, Schneider DT, Bernbeck B, et al.: Germ cell tumors of the head and neck: report from the MAKEI Study Group. Pediatr Blood Cancer 52 (2): 223-6, 2009. [PUBMED Abstract]
- Alexander VR, Manjaly JG, Pepper CM, et al.: Head and neck teratomas in children--A series of 23 cases at Great Ormond Street Hospital. Int J Pediatr Otorhinolaryngol 79 (12): 2008-14, 2015. [PUBMED Abstract]
- Metcalfe PD, Farivar-Mohseni H, Farhat W, et al.: Pediatric testicular tumors: contemporary incidence and efficacy of testicular preserving surgery. J Urol 170 (6 Pt 1): 2412-5; discussion 2415-6, 2003. [PUBMED Abstract]
- Marina NM, Cushing B, Giller R, et al.: Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology Group/Children's Cancer Group Intergroup Study. J Clin Oncol 17 (7): 2137-43, 1999. [PUBMED Abstract]
- Norris HJ, Zirkin HJ, Benson WL: Immature (malignant) teratoma of the ovary: a clinical and pathologic study of 58 cases. Cancer 37 (5): 2359-72, 1976. [PUBMED Abstract]
- Mann JR, Gray ES, Thornton C, et al.: Mature and immature extracranial teratomas in children: the UK Children's Cancer Study Group Experience. J Clin Oncol 26 (21): 3590-7, 2008. [PUBMED Abstract]
- Pashankar F, Hale JP, Dang H, et al.: Is adjuvant chemotherapy indicated in ovarian immature teratomas? A combined data analysis from the Malignant Germ Cell Tumor International Collaborative. Cancer 122 (2): 230-7, 2016. [PUBMED Abstract]
- Huddart SN, Mann JR, Robinson K, et al.: Sacrococcygeal teratomas: the UK Children's Cancer Study Group's experience. I. Neonatal. Pediatr Surg Int 19 (1-2): 47-51, 2003. [PUBMED Abstract]
- Egler RA, Gosiengfiao Y, Russell H, et al.: Is surgical resection and observation sufficient for stage I and II sacrococcygeal germ cell tumors? A case series and review. Pediatr Blood Cancer 64 (5): , 2017. [PUBMED Abstract]
- Gonzalez-Crussi F, Winkler RF, Mirkin DL: Sacrococcygeal teratomas in infants and children: relationship of histology and prognosis in 40 cases. Arch Pathol Lab Med 102 (8): 420-5, 1978. [PUBMED Abstract]
- Gabra HO, Jesudason EC, McDowell HP, et al.: Sacrococcygeal teratoma--a 25-year experience in a UK regional center. J Pediatr Surg 41 (9): 1513-6, 2006. [PUBMED Abstract]
- De Corti F, Sarnacki S, Patte C, et al.: Prognosis of malignant sacrococcygeal germ cell tumours according to their natural history and surgical management. Surg Oncol 21 (2): e31-7, 2012. [PUBMED Abstract]
- Derikx JP, De Backer A, van de Schoot L, et al.: Long-term functional sequelae of sacrococcygeal teratoma: a national study in The Netherlands. J Pediatr Surg 42 (6): 1122-6, 2007. [PUBMED Abstract]
Tratamiento de los tumores gonadales malignos de células germinativas en la niñez
Tumores malignos de células germinativas de testículo en la niñez
Tumores malignos de células germinativas de testículo en varones prepúberes
La función de la cirugía en el momento del diagnóstico de los tumores de células germinativas depende del sitio tumoral y la edad del paciente, y se debe individualizar el tratamiento. Todos los tumores malignos de células germinativas de testículo se deben resecar. Después de la resección a veces sigue la escisión de masas residuales tras la quimioterapia.
Los tumores de células germinativas de testículo en la niñez se presentan casi exclusivamente en varones menores de 5 años.[1,2] El abordaje quirúrgico inicial para evaluar una masa testicular en un niño pequeño es importante porque una biopsia transescrotal quizás acarree un riesgo de metástasis en los ganglios inguinales.[3,4] La orquiectomía inguinal radical con ligadura inicial alta del cordón espermático es el procedimiento de elección.[5]
La evaluación mediante tomografía computarizada o imágenes por resonancia magnética, con la información adicional que ofrecen los marcadores tumorales elevados, es adecuada para la estadificación. La disección retroperitoneal de los ganglios linfáticos no es beneficiosa para la estadificación de los tumores de células germinativas de testículo en niños pequeños.[3,4] Por lo tanto, tal vez no hay razón para arriesgar la aparición de complicaciones mórbidas (por ejemplo, impotencia y eyaculación retrógrada) relacionada con la disección de ganglios linfáticos.[6,7]
El grupo Malignant Germ Cell Tumor International Consortium formuló una estratificación del riesgo revisada (consultar la Figura 4).[8]
Opciones de tratamiento estándar de los tumores malignos de células germinativas en varones prepúberes
Las opciones de tratamiento estándar de los tumores malignos de células germinativas en varones prepúberes (edad <11 años) son las siguientes:
Las opciones de tratamiento de los tumores malignos de células germinativas en varones prepúberes son diferentes según el estadio de la enfermedad.
Cirugía y observación (estadio I)
Se indican la cirugía y la observación con un seguimiento minucioso para asegurarse de que las concentraciones de los marcadores tumorales se normalizan después de la resección.[3,9]
Evidencia (cirugía y observación para la enfermedad en estadio I en varones prepúberes):
- En un ensayo del Children’s Cancer Group (CCG)/Pediatric Oncology Group (POG), se evaluó la cirugía seguida de observación en varones de 10 años o menos con tumores de testículo en estadio I.[3,4]
- Esta estrategia de tratamiento produjo una tasa de supervivencia sin complicaciones (SSC) a 6 años del 82 %.
- Los niños que presentaron enfermedad recidivante recibieron terapia de rescate con 4 ciclos de cisplatino en dosis estándar, etopósido y bleomicina (PEb), con una supervivencia a 6 años del 100 %.
- En un estudio posterior del Children’s Oncology Group (COG) de 80 niños menores de 15 años con enfermedad en estadio I, se incluyó a 15 niños de 11 a 15 años que se trataron con cirugía y observación.[10][Nivel de evidencia C1]
- La tasa de SSC a 4 años fue del 80 % en los 65 niños que tenían menos de 11 años en el momento del diagnóstico y del 48 % en los 15 niños de 11 años y más (P< 0,01). En última instancia, todos los pacientes se recuperaron con una tasa de supervivencia general (SG) a 4 años del 100 %.
- Los factores de pronóstico favorable fueron la edad más joven, la presencia de un tumor puro de saco vitelino y la ausencia de invasión linfovascular del tumor primario.
- En los sistemas de estadificación de adultos con tumores de testículo, a los pacientes con invasión linfovascular se los clasifica en estadio IB. En toda la cohorte, aquellos con invasión linfovascular tuvieron una tasa de SSC a 4 años más baja (62 vs. 84 %).
- Un análisis conjunto (de los estudios anteriores) proporcionó datos de resultados más completos sobre los pacientes con enfermedad en estadio I tratados con cirugía y observación.[11][Nivel de evidencia C2]
- La mayoría de los pacientes eran prepúberes, pero el 13,2 % eran adolescentes (de 13 a 15 años).
- Al cabo de una mediana de seguimiento de 56 meses, todos los pacientes estaban vivos.
- Hubo 25 eventos.
- En el análisis multivariante, los factores pronósticos independientes fueron la edad inferior a 12 años (cociente de riesgos instantáneos [CRI], 8,87; P < 0,0001) y un estadio pT más alto (pT2: CRI, 7,31; P = 0,0017 y pT3: CRI, 13,5; P = 0,0047).
- En un estudio alemán (MAHO 98) de 128 niños menores de 10 años con tumores de células germinativas de testículo, la mayoría en estadio I, también se evaluó la cirugía seguida de observación.[12][Nivel de evidencia C1]
- Después de la orquiectomía inguinal, 49 pacientes con tumores de saco vitelino se clasificaron en el estadio IA. En el estadio IA no hay indicios de invasión linfovascular. La tasa de SSC a 5 años fue del 95 % y la tasa de SG fue del 100 % para este grupo. Dos pacientes recayeron y luego se curaron después de la quimioterapia.
- En 12 pacientes inicialmente sometidos a orquiectomía transescrotal se confirmó, mediante pruebas anatomopatológicas, que no presentaban invasión linfovascular (en ausencia de cirugía se clasificarían en estadio IA). Se observó a 10 pacientes que no presentaron efectos adversos. Dos pacientes recayeron (17 %) y permanecieron en remisión continua después de la quimioterapia. Ningún paciente se sometió a hemiescrotectomía. Una pregunta de larga data ha sido si la orquiectomía transescrotal exige la administración de quimioterapia o una hemiescrotectomía.
Cirugía y quimioterapia (estadios II–IV)
La cirugía y la quimioterapia con cuatro ciclos de PEb estándar es un tratamiento común para los varones prepúberes con enfermedad es estadio II a IV. Los pacientes tratados con este régimen tienen tasas de SG superiores al 90 %, lo que indica que se puede considerar la reducción del tratamiento.[13,14]
La cirugía y el tratamiento con 4 a 6 ciclos de carboplatino, etopósido y bleomicina (JEb) es una alternativa de régimen de tratamiento.[9]
Evidencia (cirugía y observación para la enfermedad en estadios II–IV en varones prepúberes):
- En un ensayo clínico del CCG/POG, se evaluó a niños menores de 10 años con tumores en estadio II que se trataron después del diagnóstico con cuatro ciclos de PEb.[13]
- Las tasas de SSC y SG a 6 años fueron del 100 %.
- En el mismo ensayo clínico del CCG/POG, los niños y adolescentes (14 años o menos) con tumores de testículo en estadio III y estadio IV se trataron con resección quirúrgica seguida de 4 ciclos de dosis estándar de PEb o dosis altas de PEb (DA-PEb).[14]
- Las tasas de supervivencia a 6 años en los varones menores de 15 años con tumores en estadio III y estadio IV fueron del 100 %.
- La tasa de SSC a 6 años en los varones menores de 15 años con tumores en estadio III fue del 100 % y del 94 % para quienes tenían tumores en estadio IV.
- El uso de la terapia de DA-PEb no mejoró el desenlace de estos niños, pero sí aumentó la incidencia de efectos tóxicos otológicos.
- Investigadores europeos también dieron cuenta de desenlaces excelentes en niños con tumores de células germinativas de testículo sometidos a cirugía y observación por tumores en estadio I; así como en aquellos con tumores en estadios II, III y IV que recibieron JEb y otros regímenes de quimioterapia con cisplatino.[6,9]
- En un ensayo del COG de fase III de un solo grupo (AGCT0132 [NCT00053352]), participaron 210 pacientes con tumores de riesgo intermedio (testicular en estadio II–IV, ovárico en estadio II–III, extragonadal en estadios I–II o gonadal en estadio I con recidiva posterior). Estos pacientes recibieron 3 ciclos de PEb en lugar de 4, y el cronograma se comprimió de 5 a 3 días por ciclo. En un modelo paramétrico de comparación, se especificó que la tasa de SSC observada no sería significativamente inferior a 92 %.[15][Nivel de evidencia B4]
- La tasa de SSC a 4 años del 89 % (intervalo de confianza 95 %, 83–92 %) fue significativamente más baja que el umbral del 92 % del modelo de comparación (P = 0,08).
- En un análisis posterior, la tasa de SSC se comparó con la de pacientes similares tratados con 4 ciclos de PEb en 2 estudios previos. Entre los 181 pacientes con diagnóstico reciente, la tasa de SSC a 4 años fue del 87 % en comparación con el 92 % en 92 niños equiparables de la cohorte histórica (P = 0,15).
- La tasa de SSC a 4 años exhibió una asociación significativa con el estadio (estadio I, 100 %; estadio II, 92 %; estadio III, 85 %; y estadio IV, 54 %; P < 0,001).
- Los datos no apoyan una reducción en el número de ciclos de PEb de 4 a 3.
Tumores malignos de células germinativas de testículo en varones pospúberes
Las opciones de tratamiento descritas para los varones prepúberes a veces no se aplican de modo estricto a los varones pospúberes. En particular, la disección de ganglio linfático retroperitoneal es una opción de tratamiento y quizás cumpla una función fundamental [16] en el tratamiento inicial o subsiguiente de pacientes con enfermedad residual después de la quimioterapia para el tumor de células germinativas de testículo metastásico.[17,18] En un metanálisis, se observó que los pacientes mayores de 11 años tenían un riesgo más alto de recidiva.[8] El número de varones de 11 a 15 años con tumores de células germinativas es pequeño; es posible que estos pacientes deban ser tratados de acuerdo con los estándares para adultos. Para obtener más información sobre el tratamiento de los tumores de células germinativas de testículo malignos en varones pospúberes, consultar Tratamiento del cáncer de testículo.
Opciones de tratamiento estándar de los tumores malignos de células germinativas de testículo en varones pospúberes
Para obtener información sobre el tratamiento de los tumores malignos de células germinativas de testículo en varones pospúberes, consultar Tratamiento del cáncer de testículo.
Opciones de tratamiento en evaluación clínica de los tumores malignos de células germinativas de testículo
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de ensayo clínico nacional o institucional en curso:
- AGCT1531 (NCT03067181) (Active Surveillance, Bleomycin, Carboplatin, Etoposide, or Cisplatin in Treating Pediatric and Adult Patients with GCTs): el objetivo de este ensayo consiste en disminuir la toxicidad y conservar la eficacia terapéutica en pacientes con tumores de células germinativas de riesgo estándar. Los pacientes con tumores malignos de células germinativas en estadio I (riesgo bajo, 0–50 años) se tratarán con cirugía y observación. Los pacientes con tumores de células germinativas de riesgo intermedio se asignarán al azar a recibir cisplatino o carboplatino, y bleomicina y etopósido. Los niños menores de 11 años recibirán bleomicina en cada ciclo y aquellos de 11 años y más recibirán bleomicina semanal. Se excluyen de este ensayo los pacientes con seminoma puro o disgerminoma.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Tumores malignos de células germinativas de ovario en la niñez
La mayoría de las neoplasias de ovario en niñas y adolescentes se originan en células germinativas.[19] Los tumores de células germinativas de ovario son muy poco frecuentes en niñas de corta edad, pero su incidencia comienza a aumentar entre los 8 y 9 años, y continúa en aumento durante toda la edad adulta.[1]
Los tumores malignos de células germinativas de ovario en la niñez se dividen en germinomatosos (disgerminomas) y no germinomatosos (es decir, carcinomas de saco vitelino, tumores mixtos de células germinativas, coriocarcinomas y carcinomas embrionarios).
Para obtener más información sobre los teratomas infantiles maduros e inmaduros que surgen en el ovario, consultar la sección Tratamiento de los teratomas maduros. Para obtener más información sobre el tratamiento de tumores de células germinativas de ovario en mujeres pospúberes, consultar Tratamiento de los tumores de células germinativas del ovario.
Disgerminomas de ovario
Opciones estándares de tratamiento de los disgerminomas de ovario
Las opciones de tratamiento estándar de los disgerminomas de ovario son las siguientes:
Las opciones de tratamiento de los disgerminomas de ovario son diferentes según el estadio de la enfermedad.
Cirugía y observación (estadio I)
En el caso de los disgerminomas de ovario en estadio I, la cura se suele lograr mediante salpingooforectomía unilateral, que permite conservar el útero y el ovario opuesto, y se acompaña de seguimiento con observación minuciosa.[9,20-23]
Evidencia (cirugía y observación para la enfermedad en estadio I):
- En tres estudios consecutivos de la French Society of Pediatric Oncology (TGM-85, TGM-90 y TGM-95), se notificó lo siguiente:[24][Nivel de evidencia C1]
- Se identificaron 15 pacientes en estadio I y todos los pacientes sobrevivieron.
- Antes de 1998, 8 pacientes se trataron con radiación adyuvante o quimioterapia. Después de que cambiara la práctica en 1998, 7 pacientes se sometieron a cirugía y observación.
- De los 7 pacientes, 1 (14 %) tuvo un episodio tumoral y respondió al tratamiento con quimioterapia.
Cirugía y quimioterapia (estadios II–IV)
Aunque los disgerminomas de ovario en estadio avanzado, como los seminomas de testículo, son sumamente curables con cirugía y radioterapia, los efectos sobre el crecimiento, la fertilidad y el riesgo de una segunda neoplasia maligna inducida por el tratamiento en estas pacientes jóvenes [25,26] hacen que la quimioterapia sea preferible como complemento de la cirugía.[27,28] En el caso de los disgerminomas avanzados, la meta es la resección completa del tumor. La quimioterapia a base de derivados del platino se administra antes de la cirugía para facilitar la resección o de manera posoperatoria (después de la cirugía citorreductora) para evitar procedimientos quirúrgicos mutilantes.[23]
Evidencia (cirugía y quimioterapia para disgerminomas en estadio II–IV):
- En un informe de la French Society of Pediatric Oncology, se registraron 48 niñas menores de 19 años (mediana de edad, 12,8 años); 20 pacientes tenían enfermedad localizada, 28 pacientes tenían enfermedad locorregional y ninguna paciente tenía metástasis. De las pacientes, 7 tenían compromiso de ganglios paraaórticos y 47 pacientes se sometieron a cirugía primaria. Antes de 1998, todas las pacientes con enfermedad avanzada se sometían a radioterapia. Después del cambio de práctica en 1998, las pacientes recibieron quimioterapia a base de derivados del platino.[24][Nivel de evidencia C1]
- La tasa de SSC a 5 años fue de 91 % y la tasa de SG a 5 años fue de 100 %.
- Los efectos secundarios no fueron graves, y varias pacientes se embarazaron en los siguientes años.
- En un metanálisis de pacientes con disgerminoma del Malignant Germ Cell Tumor International Consortium, se notificó lo siguiente:[29]
- No se observaron diferencias entre las pacientes que se trataron con cisplatino (n = 70) (tasa de SSC a 5 años, 93 %; tasa de SG, 96 %) y las que recibieron carboplatino (n = 56) (tasa de SSC a 5 años, 96 %; tasa de SG, 96 %).
Este abordaje produce una tasa alta de curación, y preserva la función menstrual y la fertilidad en la mayoría de las pacientes con disgerminomas.[27,30]
Tumores malignos de células germinativas de ovario no germinomatosos
Para el tratamiento de los tumores malignos de células germinativas de ovario, es esencial un abordaje multidisciplinario. Diversos subespecialistas en cirugía y oncología pediátrica deben participar en la toma de decisiones clínicas. El abordaje quirúrgico de un tumor de células germinativas de ovario infantil se guía a menudo por la esperanza de conservar la capacidad reproductiva.
El tratamiento de los tumores malignos de células germinativas de ovario que no son disgerminomas ni teratomas inmaduros suele constar de resección quirúrgica y quimioterapia adyuvante.[31,32]
La función de un procedimiento quirúrgico en el momento del diagnóstico depende de la edad del paciente y el sitio del tumor, y se debe individualizar el tratamiento. El uso de laparoscopia en niñas con tumores de células germinativas de ovario todavía no se ha estudiado bien.
Se ha cuestionado el uso de la biopsia congelada intraoperatoria en pacientes pediátricas y adolescentes para determinar la presencia de malignidad con el fin de realizar un procedimiento de preservación de los ovarios. En un análisis retrospectivo del estudio del COG AGCT0132 (NCT00053352), 60 de 131 pacientes elegibles con tumores ováricos tenían diagnósticos de sección congelada intraoperatoria y de sección de parafina final.[33] La biopsia por congelación intraoperatoria fue incorrecta en el 38 % de las ocasiones (23 pacientes), y confirmó el diagnóstico final en el 76 % de los casos. Además, la revisión patológica central detectó componentes adicionales de células germinales en el 23,7 % de las pacientes.
Se publicaron directrices quirúrgicas pediátricas para determinar la enfermedad en estadio I.[34] Las directrices quirúrgicas para determinar el estadio en adultos son más extensas. Para obtener más información sobre la estadificación de los tumores de células germinativas de ovario en mujeres pospúberes, consultar la sección Información sobre los estadios de los tumores de células germinativas de ovario en Tratamiento de los tumores de células germinativas del ovario.
Se deben cumplir de manera estricta las directrices quirúrgicas de estadificación para determinar una enfermedad en estadio I verdadera. Tradicionalmente no se siguieron las directrices completas de estadificación en los estudios en niños y adultos. Cuando no hay un cumplimiento estricto de las directrices quirúrgicas de estadificación, el tratamiento estándar es la cirugía seguida de quimioterapia en lugar de cirugía seguida de observación.[9,13,35]
La meta del tratamiento quirúrgico para los tumores de células germinativas en la niñez es conservar la capacidad reproductiva. Si se opta por la cirugía conservadora, es posible obtener una tasa alta de cura con quimioterapia adyuvante y no es necesario el cumplimiento estricto de las directrices quirúrgicas.[36]
Opciones de tratamiento estándar de los tumores malignos de células germinativas de ovario no germinomatosos
Las opciones de tratamiento estándar de los tumores malignos de células germinativas de ovario no germinomatosos en mujeres prepúberes son las siguientes:
Las opciones estándar de tratamiento de los tumores malignos de células germinativas de ovario no germinomatosos en mujeres pospúberes son las siguientes:
Las opciones de tratamiento estándar de los tumores malignos de células germinativas de ovario no germinomatosos que no se pueden resecar al inicio son las siguientes:
Cirugía y observación en mujeres prepúberes (estadio I con cumplimiento estricto de las directrices quirúrgicas de estadificación)
Cuando se cumple de manera estricta con las directrices quirúrgicas de estadificación, es posible que la cirugía seguida de observación sea una opción apropiada de tratamiento para mujeres prepúberes con enfermedad en estadio I.
Evidencia (cirugía y observación para mujeres prepúberes con enfermedad en estadio I):
- En un ensayo del COG, se trató a 25 niñas con tumores malignos de células germinativas de ovario con cirugía y observación.[34]
- La tasa de SSC a 4 años fue de 52 %.
- Se detectó recaída en 12 pacientes por elevación del marcador tumoral (media de tiempo, 2 meses). Todas las pacientes después recibieron terapia de rescate con 3 ciclos de PEb. La tasa de SG a 4 años fue de 96 %; en 1 paciente la terapia de rescate no fue eficaz para su enfermedad.
- Se notificaron resultados similares en otros ensayos pediátricos internacionales, pero el número de pacientes fue pequeño.[9]
Cirugía y quimioterapia para mujeres prepúberes y pospúberes (presunto estadio I y estadios II–IV)
El grupo Malignant Germ Cell Tumor International Consortium formuló una estratificación del riesgo revisada (consultar la Figura 4).[8]
Los regímenes de quimioterapia con cisplatino (PEb) o carboplatino (JEb) se han usado con éxito en niños.[9,13,14,20] El BEP es un régimen común para mujeres jóvenes con tumores de células germinativas de ovario.[37,38] El BEP se diferencia del PEb por la adición de bleomicina semanal. Este abordaje produce una tasa alta de curación, y conserva la función menstrual y la fertilidad en la mayoría de las pacientes con tumores no disgerminomatosos.[32,35] Consultar el Cuadro 8 para obtener más información sobre los esquemas de dosificación de BEP, PEb y JEb.
En mujeres prepúberes con presuntos tumores de ovario en estadio I (cuando no se cumple de manera estricta con las directrices quirúrgicas de estadificación), la cirugía seguida de quimioterapia (4 ciclos de PEb) es una opción de tratamiento apropiada que produce tasas de SSC y SG de 95 %.[13,14]
En mujeres pospúberes con presuntos tumores de ovario en estadio I, la quimioterapia después de la resección sigue siendo el tratamiento estándar. No se ha establecido la utilidad de la observación después de la cirugía en las mujeres pospúberes; este tratamiento está en investigación en el ensayo AGCT1531 (NCT03067181).
En mujeres prepúberes y pospúberes con tumores de ovario en estadios II, III o IV, la cirugía y la quimioterapia se consideran tratamientos estándar. La cirugía y quimioterapia con 4 a 6 ciclos de PEb estándar se usan para el tratamiento de niñas más pequeñas (prepúberes)[13,14] y BEP se usa para el tratamiento de niñas pospúberes.[37,38] En las pacientes con marcadores tumorales normalizados se obtienen imágenes después de 4 ciclos de PEb y se extirpa cualquier tumor residual. Las pacientes con un tumor viable después de la cirugía se consideran resistentes al tratamiento.
Otra opción de tratamiento consta de cirugía y quimioterapia con 4 a 6 ciclos de JEb (como se demostró en un estudio en el que todas las pacientes eran menores de 15 años).[9]
Tumores de células germinativas de ovario irresecables al inicio
Por lo habitual, se intenta la resección primaria de todo tumor de células germinativas de ovario. Sin embargo, en casos excepcionales, la resección primaria del ovario no es posible sin riesgo excesivo de daño a las estructuras adyacentes. En estos casos, una estrategia apropiada es una biopsia diagnóstica seguida de quimioterapia y después cirugía para pacientes con masas residuales después de someterse a la quimioterapia.
Opciones de tratamiento en evaluación clínica para los tumores malignos de células germinativas de ovario
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de ensayo clínico nacional o institucional en curso:
- AGCT1531 (NCT03067181) (Active Surveillance, Bleomycin, Carboplatin, Etoposide, or Cisplatin in Treating Pediatric and Adult Patients with GCTs): el objetivo de este ensayo consiste en disminuir la toxicidad y conservar la eficacia terapéutica en pacientes con tumores de células germinativas de riesgo estándar. Los pacientes con tumores malignos de células germinativas en estadio I (riesgo bajo, 0–50 años) se tratarán con cirugía y observación. Los pacientes con tumores de células germinativas de riesgo intermedio se asignarán al azar a recibir cisplatino o carboplatino, y bleomicina y etopósido. Los niños menores de 11 años recibirán bleomicina en cada ciclo y aquellos de 11 años y más recibirán bleomicina semanal. Se excluyen de este ensayo los pacientes con seminoma puro o disgerminoma.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- National Cancer Institute: NCCR*Explorer: An interactive website for NCCR cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed February 25, 2025.
- Walsh TJ, Grady RW, Porter MP, et al.: Incidence of testicular germ cell cancers in U.S. children: SEER program experience 1973 to 2000. Urology 68 (2): 402-5; discussion 405, 2006. [PUBMED Abstract]
- Schlatter M, Rescorla F, Giller R, et al.: Excellent outcome in patients with stage I germ cell tumors of the testes: a study of the Children's Cancer Group/Pediatric Oncology Group. J Pediatr Surg 38 (3): 319-24; discussion 319-24, 2003. [PUBMED Abstract]
- Canning DA: Excellent outcome in patients with stage I germ cell tumors of the testes: a study of the Children's Cancer Group/Pediatric Oncology Group [Editorial Comment on Schlatter]. J Urol 174 (1): 310, 2005.
- Rescorla FJ: Pediatric germ cell tumors. Semin Surg Oncol 16 (2): 144-58, 1999. [PUBMED Abstract]
- Haas RJ, Schmidt P, Göbel U, et al.: Treatment of malignant testicular tumors in childhood: results of the German National Study 1982-1992. Med Pediatr Oncol 23 (5): 400-5, 1994. [PUBMED Abstract]
- Pinkerton CR: Malignant germ cell tumours in childhood. Eur J Cancer 33 (6): 895-901; discussion 901-2, 1997. [PUBMED Abstract]
- Frazier AL, Hale JP, Rodriguez-Galindo C, et al.: Revised risk classification for pediatric extracranial germ cell tumors based on 25 years of clinical trial data from the United Kingdom and United States. J Clin Oncol 33 (2): 195-201, 2015. [PUBMED Abstract]
- Mann JR, Raafat F, Robinson K, et al.: The United Kingdom Children's Cancer Study Group's second germ cell tumor study: carboplatin, etoposide, and bleomycin are effective treatment for children with malignant extracranial germ cell tumors, with acceptable toxicity. J Clin Oncol 18 (22): 3809-18, 2000. [PUBMED Abstract]
- Rescorla FJ, Ross JH, Billmire DF, et al.: Surveillance after initial surgery for Stage I pediatric and adolescent boys with malignant testicular germ cell tumors: Report from the Children's Oncology Group. J Pediatr Surg 50 (6): 1000-3, 2015. [PUBMED Abstract]
- Singla N, Wong J, Singla S, et al.: Clinicopathologic predictors of outcomes in children with stage I testicular germ cell tumors: A pooled post hoc analysis of trials from the Children's Oncology Group. J Pediatr Urol 18 (4): 505-511, 2022. [PUBMED Abstract]
- Göbel U, Haas R, Calaminus G, et al.: Testicular germ cell tumors in boys <10 years: results of the protocol MAHO 98 in respect to surgery and watch & wait strategy. Klin Padiatr 225 (6): 296-302, 2013. [PUBMED Abstract]
- Rogers PC, Olson TA, Cullen JW, et al.: Treatment of children and adolescents with stage II testicular and stages I and II ovarian malignant germ cell tumors: A Pediatric Intergroup Study--Pediatric Oncology Group 9048 and Children's Cancer Group 8891. J Clin Oncol 22 (17): 3563-9, 2004. [PUBMED Abstract]
- Cushing B, Giller R, Cullen JW, et al.: Randomized comparison of combination chemotherapy with etoposide, bleomycin, and either high-dose or standard-dose cisplatin in children and adolescents with high-risk malignant germ cell tumors: a pediatric intergroup study--Pediatric Oncology Group 9049 and Children's Cancer Group 8882. J Clin Oncol 22 (13): 2691-700, 2004. [PUBMED Abstract]
- Shaikh F, Cullen JW, Olson TA, et al.: Reduced and Compressed Cisplatin-Based Chemotherapy in Children and Adolescents With Intermediate-Risk Extracranial Malignant Germ Cell Tumors: A Report From the Children's Oncology Group. J Clin Oncol 35 (11): 1203-1210, 2017. [PUBMED Abstract]
- de Wit R, Fizazi K: Controversies in the management of clinical stage I testis cancer. J Clin Oncol 24 (35): 5482-92, 2006. [PUBMED Abstract]
- Carver BS, Shayegan B, Serio A, et al.: Long-term clinical outcome after postchemotherapy retroperitoneal lymph node dissection in men with residual teratoma. J Clin Oncol 25 (9): 1033-7, 2007. [PUBMED Abstract]
- Carver BS, Shayegan B, Eggener S, et al.: Incidence of metastatic nonseminomatous germ cell tumor outside the boundaries of a modified postchemotherapy retroperitoneal lymph node dissection. J Clin Oncol 25 (28): 4365-9, 2007. [PUBMED Abstract]
- Ries LA, Smith MA, Gurney JG, et al., eds.: Cancer incidence and survival among children and adolescents: United States SEER Program 1975-1995. National Cancer Institute, SEER Program, 1999. NIH Pub.No. 99-4649. Also available online. Last accessed December 22, 2023.
- Baranzelli MC, Bouffet E, Quintana E, et al.: Non-seminomatous ovarian germ cell tumours in children. Eur J Cancer 36 (3): 376-83, 2000. [PUBMED Abstract]
- Dark GG, Bower M, Newlands ES, et al.: Surveillance policy for stage I ovarian germ cell tumors. J Clin Oncol 15 (2): 620-4, 1997. [PUBMED Abstract]
- Marina NM, Cushing B, Giller R, et al.: Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology Group/Children's Cancer Group Intergroup Study. J Clin Oncol 17 (7): 2137-43, 1999. [PUBMED Abstract]
- Gershenson DM: Chemotherapy of ovarian germ cell tumors and sex cord stromal tumors. Semin Surg Oncol 10 (4): 290-8, 1994 Jul-Aug. [PUBMED Abstract]
- Duhil de Bénazé G, Pacquement H, Faure-Conter C, et al.: Paediatric dysgerminoma: Results of three consecutive French germ cell tumours clinical studies (TGM-85/90/95) with late effects study. Eur J Cancer 91: 30-37, 2018. [PUBMED Abstract]
- Teinturier C, Gelez J, Flamant F, et al.: Pure dysgerminoma of the ovary in childhood: treatment results and sequelae. Med Pediatr Oncol 23 (1): 1-7, 1994. [PUBMED Abstract]
- Mitchell MF, Gershenson DM, Soeters RP, et al.: The long-term effects of radiation therapy on patients with ovarian dysgerminoma. Cancer 67 (4): 1084-90, 1991. [PUBMED Abstract]
- Brewer M, Gershenson DM, Herzog CE, et al.: Outcome and reproductive function after chemotherapy for ovarian dysgerminoma. J Clin Oncol 17 (9): 2670-75, 1999. [PUBMED Abstract]
- Williams SD, Blessing JA, Hatch KD, et al.: Chemotherapy of advanced dysgerminoma: trials of the Gynecologic Oncology Group. J Clin Oncol 9 (11): 1950-5, 1991. [PUBMED Abstract]
- Shah R, Xia C, Krailo M, et al.: Is carboplatin-based chemotherapy as effective as cisplatin-based chemotherapy in the treatment of advanced-stage dysgerminoma in children, adolescents and young adults? Gynecol Oncol 150 (2): 253-260, 2018. [PUBMED Abstract]
- Gershenson DM: Menstrual and reproductive function after treatment with combination chemotherapy for malignant ovarian germ cell tumors. J Clin Oncol 6 (2): 270-5, 1988. [PUBMED Abstract]
- Gershenson DM, Morris M, Cangir A, et al.: Treatment of malignant germ cell tumors of the ovary with bleomycin, etoposide, and cisplatin. J Clin Oncol 8 (4): 715-20, 1990. [PUBMED Abstract]
- Mitchell PL, Al-Nasiri N, A'Hern R, et al.: Treatment of nondysgerminomatous ovarian germ cell tumors: an analysis of 69 cases. Cancer 85 (10): 2232-44, 1999. [PUBMED Abstract]
- Dicken BJ, Billmire DF, Rich B, et al.: Utility of frozen section in pediatric and adolescent malignant ovarian nonseminomatous germ cell tumors: A report from the children's oncology group. Gynecol Oncol 166 (3): 476-480, 2022. [PUBMED Abstract]
- Billmire DF, Cullen JW, Rescorla FJ, et al.: Surveillance after initial surgery for pediatric and adolescent girls with stage I ovarian germ cell tumors: report from the Children's Oncology Group. J Clin Oncol 32 (5): 465-70, 2014. [PUBMED Abstract]
- Palenzuela G, Martin E, Meunier A, et al.: Comprehensive staging allows for excellent outcome in patients with localized malignant germ cell tumor of the ovary. Ann Surg 248 (5): 836-41, 2008. [PUBMED Abstract]
- Billmire D, Vinocur C, Rescorla F, et al.: Outcome and staging evaluation in malignant germ cell tumors of the ovary in children and adolescents: an intergroup study. J Pediatr Surg 39 (3): 424-9; discussion 424-9, 2004. [PUBMED Abstract]
- Williams SD: Ovarian germ cell tumors: an update. Semin Oncol 25 (3): 407-13, 1998. [PUBMED Abstract]
- Williams S, Blessing JA, Liao SY, et al.: Adjuvant therapy of ovarian germ cell tumors with cisplatin, etoposide, and bleomycin: a trial of the Gynecologic Oncology Group. J Clin Oncol 12 (4): 701-6, 1994. [PUBMED Abstract]
Tratamiento de los tumores malignos extragonadales y extracraneales de células germinativas en la niñez
En informes iniciales, los niños con tumores malignos extragonadales de células germinativas, en particular aquellos con enfermedad en estadio avanzado (estadio III o estadio IV), presentaron el riesgo más alto de fracaso de tratamiento para cualquier presentación de un tumor de células germinativas.[1,2] Posteriormente, en un análisis de datos de los estudios de tumores extragonadales de células germinativas realizados durante 25 años en los Estados Unidos y el Reino Unido se notificó que los niños menores de 11 años con este tipo de tumores en estadio III y estadio IV tuvieron una tasa de supervivencia sin complicaciones (SSC) del 85 %; los adolescentes con enfermedad extragonadal en estadio III y estadio IV presentaron desenlaces más precarios (tasa de SSC esperada, <70 %).[3]
La función de la cirugía en el momento del diagnóstico de los tumores extragonadales depende del sitio del tumor y la edad del paciente, y se debe individualizar el tratamiento. Según el entorno clínico, es posible que el abordaje quirúrgico apropiado sea la resección primaria, la biopsia antes de la quimioterapia o no administrar cirugía (por ejemplo, para un tumor mediastínico primario en un paciente con compromiso de vías respiratorias y marcadores tumorales elevados). En ocasiones, una estrategia adecuada es una biopsia en el momento del diagnóstico seguida de quimioterapia y cirugía posterior para determinados pacientes que tienen masas residuales después de la quimioterapia.
Opciones de tratamiento estándar de los tumores malignos extragonadales y extracraneales de células germinativas en niños prepúberes
Las opciones de tratamiento estándar de los tumores malignos extragonadales y extracraneales de células germinativas en niños prepúberes son las siguientes:
El tratamiento de los tumores malignos extragonadales y extracraneales de células germinativas también depende del sitio de la enfermedad. Para obtener más información, consultar la sección Consideraciones para los tumores malignos extragonadales y extracraneales de células germinativas según el sitio específico.
Cirugía y quimioterapia (estadios I–IV)
La cirugía y la quimioterapia con 4 a 6 ciclos de cisplatino, etopósido, y bleomicina (PEb) estándar es una opción de tratamiento. Los pacientes con enfermedad en estadio I y en estadio II tratados con este régimen tienen una tasa de supervivencia general (SG) superior a 90 %; esto indica que es posible tener en cuenta una reducción de la terapia.[1,4] Los pacientes con enfermedad en estadio III y estadio IV tuvieron tasas de SG superiores a 80 %.[1]
Una opción alternativa de tratamiento es la cirugía y la quimioterapia con carboplatino, etopósido y bleomicina (JEb).[5] Los pacientes en estadio III y estadio IV tratados con JEb tuvieron tasas de SG similares a las del régimen PEb.[5]
En 2 ensayos intergrupales pediátricos de pacientes con enfermedad de riesgo alto se investigó el uso de dosis altas de cisplatino (200 mg/m2), el primero fue un estudio aleatorizado y en el estudio posterior se agregó amifostina al cisplatino en dosis altas.[1] No se observó un beneficio de SG, y 75 % de los pacientes necesitaron audífonos. En un ensayo del Children's Oncology Group (COG) de pacientes con enfermedad de riesgo alto, se investigó la adición de ciclofosfamida a la dosis estándar de PEb. Se comprobó la viabilidad y tolerabilidad de la adición de ciclofosfamida en todas las dosis, pero no se comprobó mejora de la eficacia.[6]
Biopsia seguida de quimioterapia con cirugía o sin esta (estadios III y IV)
El desenlace ha mejorado de modo notable desde el advenimiento de la quimioterapia a base de derivados del platino y el uso de un abordaje multidisciplinario de tratamiento; la resección completa antes de la quimioterapia a veces es posible en algunos pacientes sin que resulte en morbilidad grave.[1,5]
Sin embargo, en los pacientes con tumores sacrococcígeos localmente avanzados, tumores mediastínicos o tumores pélvicos grandes, la biopsia del tumor seguida de quimioterapia preoperatoria puede facilitar la resección tumoral completa posterior y mejorar el desenlace del paciente. No se ha observado una disminución de la supervivencia general (SG) en pacientes con tumor maligno extragonadal de células germinativas para quienes se atrasa la resección hasta recibir quimioterapia.[5,7-9]
Consideraciones para los tumores malignos extragonadales y extracraneales de células germinativas según el sitio específico
El tratamiento de los tumores malignos extragonadales y extracraneales de células germinativas también depende, en parte, del sitio de la enfermedad.
Sitio sacrococcígeo
Los tumores de células germinativas de sitio sacrococcígeo son tumores extragonadales comunes que se presentan en niños muy pequeños; en particular, en niñas pequeñas.[10] Los tumores se suelen diagnosticar en el momento del nacimiento, cuando predominan lesiones externas grandes (por lo común, teratomas maduros o inmaduros), o más tarde en los primeros años de vida, cuando predominan lesiones presacrales con tasas más altas de tumores malignos.[10]
Los tumores sacrococcígeos malignos suelen estar muy avanzados en el momento del diagnóstico. Dos tercios de los pacientes tienen enfermedad locorregional y el 50 % de los pacientes presentan metástasis.[8,11,12] Debido a su estadio avanzado en el momento de la presentación inicial, el tratamiento de los tumores sacrococcígeos exige un abordaje multimodal de quimioterapia a base de derivados del platino seguida de resección tumoral diferida.
Las terapias a base de derivados del platino, ya sea cisplatino o carboplatino, constituyen la piedra angular del tratamiento. El régimen PEb o el régimen JEb producen tasas de supervivencia sin complicaciones (SSC) del 85 %.[8,9] La cirugía a veces se facilita mediante quimioterapia preoperatoria. En cualquier paciente con tumor de células germinativas de sitio sacrococcígeo, es obligatoria la resección del cóccix.[8,9]
La integridad de la resección quirúrgica es un factor pronóstico importante, como se ejemplifica en las siguientes circunstancias:[8,9,13]
- Tumores resecados con márgenes microscópicos negativos para compromiso tumoral: tasas de SSC mayores del 90 %.
- Tumores resecados con márgenes microscópicos positivos para compromiso tumoral: tasas de SSC del 75 al 85 %.
- Tumores resecados con enfermedad residual macroscópica: tasas de SSC de menos del 40 %.
Sitio mediastínico
Los tumores malignos extragonadales y extracraneales de células germinativas situados en el mediastino comprenden del 15 al 20 % de los tumores malignos extracraneales y extragonadales de células germinativas en niños.[5] Las características histológicas de los tumores mediastínicos de células germinativas dependen de la edad: los teratomas predominan en los lactantes; los tumores del saco vitelino predominan en niños de 1 a 4 años.[7]
Los niños prepúberes con teratomas mediastínicos se tratan con resección del tumor, que es curativa en casi todos los pacientes.[7] Los niños con tumores malignos mediastínicos de células germinativas no metastásicos en estadio I a estadio III que reciben quimioterapia con cisplatino tienen tasas de SSC a 5 años y tasas de SG a 5 años del 90 %. Sin embargo, los pacientes con tumores mediastínicos en estadio IV tienen tasas de SSC cercanas al 80 %.[3,5,7]; [14][Nivel de evidencia C1]
Sitio retroperitoneal
Los tumores malignos de células germinativas localizados en el retroperitoneo o el abdomen se suelen presentar en niños menores de 5 años. La mayoría de los tumores están en estadio avanzado y son localmente irresecables en el momento del diagnóstico.[15] Una biopsia limitada seguida de quimioterapia a base de derivados del platino para reducir la masa tumoral puede facilitar la resección completa del tumor en la mayoría de los pacientes. A pesar de la enfermedad en estadio avanzado en la mayoría de los pacientes, la tasa de SSC a 6 años con la administración de PEb fue del 83 % en el estudio intergrupal del Pediatric Oncology Group/Children's Cancer Group.[15]
Sitio en la cabeza y el cuello
Aunque poco frecuentes, los tumores de células germinativas, benignos y malignos, se pueden presentar en la región de la cabeza y el cuello, en especial, en lactantes. Con frecuencia, afectan la vías respiratorias. La cirugía para tumores no malignos y la cirugía seguida de quimioterapia para los tumores malignos pueden ser curativas.[16][Nivel de evidencia C2]
Opciones de tratamiento estándar de los tumores malignos extragonadales y extracraneales de células germinativas en niños pospúberes
En un estudio de los factores pronósticos de los tumores malignos extragonadales de células germinativas en niños, la edad mayor de 12 años fue el factor pronóstico más importante. En un análisis multivariante, los niños de 12 años y más con tumores torácicos tuvieron un riesgo de muerte 6 veces mayor que los niños menores de 12 años con tumores primarios no torácicos.[17] En un metanálisis posterior, los adolescentes con enfermedad extragonadal en estadio III y estadio IV tuvieron desenlaces precarios (tasa de SSC esperada, <70 %).[3] La enfermedad extragonadal en cualquier estadio se considera un factor de riesgo alto en los adolescentes y adultos jóvenes.[18]
Las opciones de tratamiento estándar de los tumores malignos extragonadales y extracraneales de células germinativas en niños pospúberes son las siguientes:
- Cirugía.
- Quimioterapia (4 ciclos de bleomicina, etopósido y cisplatino [BEP]).
- Quimioterapia seguida de cirugía para extirpar el tumor residual.
- Participación en un ensayo clínico.
Al igual que con los tumores sacrococcígeos, la quimioterapia primaria suele ser necesaria para facilitar la resección quirúrgica de los tumores mediastínicos de células germinativas; el carácter integral de la resección es un indicador pronóstico muy importante.[7,19] Las tasas de supervivencia para la población de adolescentes y adultos jóvenes con tumores mediastínicos son por lo general de menos del 60 %.[3,17,20-22]; [23][Nivel de evidencia C1]
Los pacientes con un tumor maligno primario en el mediastino y metástasis extracraneales tienen el riesgo más alto de metástasis encefálicas y se les hace seguimiento minucioso en busca de signos y síntomas de compromiso del sistema nervioso central.[24][Nivel de evidencia C1] Para obtener más información sobre el tratamiento de adultos, consultar Tratamiento de los tumores extragonadales de células germinativas.
Opciones de tratamiento en evaluación clínica para los tumores malignos extragonadales y extracraneales de células germinativas
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de ensayo clínico nacional o institucional en curso:
- AGCT1531 (NCT03067181) (Active Surveillance, Bleomycin, Carboplatin, Etoposide, or Cisplatin in Treating Pediatric and Adult Patients with GCTs): el objetivo de este ensayo consiste en disminuir la toxicidad y conservar la eficacia terapéutica en pacientes con tumores de células germinativas de riesgo estándar. Los pacientes con tumores malignos de células germinativas en estadio I (riesgo bajo, 0–50 años) se tratarán con cirugía y observación. Los pacientes con tumores de células germinativas de riesgo intermedio se asignarán al azar a recibir cisplatino o carboplatino, y bleomicina y etopósido. Los niños menores de 11 años recibirán bleomicina en cada ciclo y aquellos de 11 años y más recibirán bleomicina semanal. Se excluyen de este ensayo los pacientes con seminoma puro o disgerminoma.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Cushing B, Giller R, Cullen JW, et al.: Randomized comparison of combination chemotherapy with etoposide, bleomycin, and either high-dose or standard-dose cisplatin in children and adolescents with high-risk malignant germ cell tumors: a pediatric intergroup study--Pediatric Oncology Group 9049 and Children's Cancer Group 8882. J Clin Oncol 22 (13): 2691-700, 2004. [PUBMED Abstract]
- Baranzelli MC, Kramar A, Bouffet E, et al.: Prognostic factors in children with localized malignant nonseminomatous germ cell tumors. J Clin Oncol 17 (4): 1212, 1999. [PUBMED Abstract]
- Frazier AL, Hale JP, Rodriguez-Galindo C, et al.: Revised risk classification for pediatric extracranial germ cell tumors based on 25 years of clinical trial data from the United Kingdom and United States. J Clin Oncol 33 (2): 195-201, 2015. [PUBMED Abstract]
- Rogers PC, Olson TA, Cullen JW, et al.: Treatment of children and adolescents with stage II testicular and stages I and II ovarian malignant germ cell tumors: A Pediatric Intergroup Study--Pediatric Oncology Group 9048 and Children's Cancer Group 8891. J Clin Oncol 22 (17): 3563-9, 2004. [PUBMED Abstract]
- Mann JR, Raafat F, Robinson K, et al.: The United Kingdom Children's Cancer Study Group's second germ cell tumor study: carboplatin, etoposide, and bleomycin are effective treatment for children with malignant extracranial germ cell tumors, with acceptable toxicity. J Clin Oncol 18 (22): 3809-18, 2000. [PUBMED Abstract]
- Malogolowkin MH, Krailo M, Marina N, et al.: Pilot study of cisplatin, etoposide, bleomycin, and escalating dose cyclophosphamide therapy for children with high risk germ cell tumors: a report of the children's oncology group (COG). Pediatr Blood Cancer 60 (10): 1602-5, 2013. [PUBMED Abstract]
- Schneider DT, Calaminus G, Reinhard H, et al.: Primary mediastinal germ cell tumors in children and adolescents: results of the German cooperative protocols MAKEI 83/86, 89, and 96. J Clin Oncol 18 (4): 832-9, 2000. [PUBMED Abstract]
- Göbel U, Schneider DT, Calaminus G, et al.: Multimodal treatment of malignant sacrococcygeal germ cell tumors: a prospective analysis of 66 patients of the German cooperative protocols MAKEI 83/86 and 89. J Clin Oncol 19 (7): 1943-50, 2001. [PUBMED Abstract]
- Rescorla F, Billmire D, Stolar C, et al.: The effect of cisplatin dose and surgical resection in children with malignant germ cell tumors at the sacrococcygeal region: a pediatric intergroup trial (POG 9049/CCG 8882). J Pediatr Surg 36 (1): 12-7, 2001. [PUBMED Abstract]
- Altman RP, Randolph JG, Lilly JR: Sacrococcygeal teratoma: American Academy of Pediatrics Surgical Section Survey-1973. J Pediatr Surg 9 (3): 389-98, 1974. [PUBMED Abstract]
- Rescorla FJ, Sawin RS, Coran AG, et al.: Long-term outcome for infants and children with sacrococcygeal teratoma: a report from the Childrens Cancer Group. J Pediatr Surg 33 (2): 171-6, 1998. [PUBMED Abstract]
- Calaminus G, Schneider DT, Bökkerink JP, et al.: Prognostic value of tumor size, metastases, extension into bone, and increased tumor marker in children with malignant sacrococcygeal germ cell tumors: a prospective evaluation of 71 patients treated in the German cooperative protocols Maligne Keimzelltumoren (MAKEI) 83/86 and MAKEI 89. J Clin Oncol 21 (5): 781-6, 2003. [PUBMED Abstract]
- Egler RA, Gosiengfiao Y, Russell H, et al.: Is surgical resection and observation sufficient for stage I and II sacrococcygeal germ cell tumors? A case series and review. Pediatr Blood Cancer 64 (5): , 2017. [PUBMED Abstract]
- De Pasquale MD, Crocoli A, Conte M, et al.: Mediastinal Germ Cell Tumors in Pediatric Patients: A Report From the Italian Association of Pediatric Hematology and Oncology. Pediatr Blood Cancer 63 (5): 808-12, 2016. [PUBMED Abstract]
- Billmire D, Vinocur C, Rescorla F, et al.: Malignant retroperitoneal and abdominal germ cell tumors: an intergroup study. J Pediatr Surg 38 (3): 315-8; discussion 315-8, 2003. [PUBMED Abstract]
- Bernbeck B, Schneider DT, Bernbeck B, et al.: Germ cell tumors of the head and neck: report from the MAKEI Study Group. Pediatr Blood Cancer 52 (2): 223-6, 2009. [PUBMED Abstract]
- Marina N, London WB, Frazier AL, et al.: Prognostic factors in children with extragonadal malignant germ cell tumors: a pediatric intergroup study. J Clin Oncol 24 (16): 2544-8, 2006. [PUBMED Abstract]
- International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group. J Clin Oncol 15 (2): 594-603, 1997. [PUBMED Abstract]
- Billmire D, Vinocur C, Rescorla F, et al.: Malignant mediastinal germ cell tumors: an intergroup study. J Pediatr Surg 36 (1): 18-24, 2001. [PUBMED Abstract]
- Vuky J, Bains M, Bacik J, et al.: Role of postchemotherapy adjunctive surgery in the management of patients with nonseminoma arising from the mediastinum. J Clin Oncol 19 (3): 682-8, 2001. [PUBMED Abstract]
- Ganjoo KN, Rieger KM, Kesler KA, et al.: Results of modern therapy for patients with mediastinal nonseminomatous germ cell tumors. Cancer 88 (5): 1051-6, 2000. [PUBMED Abstract]
- Bokemeyer C, Nichols CR, Droz JP, et al.: Extragonadal germ cell tumors of the mediastinum and retroperitoneum: results from an international analysis. J Clin Oncol 20 (7): 1864-73, 2002. [PUBMED Abstract]
- Kang CH, Kim YT, Jheon SH, et al.: Surgical treatment of malignant mediastinal nonseminomatous germ cell tumor. Ann Thorac Surg 85 (2): 379-84, 2008. [PUBMED Abstract]
- Göbel U, von Kries R, Teske C, et al.: Brain metastases during follow-up of children and adolescents with extracranial malignant germ cell tumors: risk adapted management decision tree analysis based on data of the MAHO/MAKEI-registry. Pediatr Blood Cancer 60 (2): 217-23, 2013. [PUBMED Abstract]
Tratamiento de los tumores malignos de células germinativas recidivantes en la niñez
Solo un pequeño número de niños y adolescentes con tumores extracraneales de células germinativas sufren una recidiva.[1,2] Los informes sobre el tratamiento y desenlace de estos niños se basan en estudios pequeños.[3]
Las opciones de tratamiento de los tumores de células germinativas infantiles recidivantes se modelan de acuerdo con las opciones de tratamiento de los ensayos clínicos con adultos. La información en inglés sobre los ensayos clínicos en curso patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI.
Opciones de tratamiento de los tumores malignos de células germinativas recidivantes en la niñez
Las opciones de tratamiento de los tumores malignos de células germinativas recidivantes en la niñez son las siguientes:
- Cirugía sola.
- Cirugía con quimioterapia neoadyuvante o adyuvante.
Para obtener información sobre la terapia de rescate posterior a la observación en pacientes con enfermedad en estadio I, consultar las siguientes secciones:
- Subsección sobre Cirugía y observación en la sección Aspectos generales de las opciones de tratamiento de los tumores extracraneales de células germinativas en la niñez.
- Subsección sobre Cirugía y observación (estadio I) en la sección Tumores malignos de células germinativas de testículo en varones prepúberes.
- Subsección sobre Cirugía y observación en mujeres prepúberes (estadio I con cumplimiento estricto de las directrices quirúrgicas) en la sección Tumores malignos de células germinativas de ovario no germinomatosos.
Cirugía con quimioterapia neoadyuvante o adyuvante
Los informes sobre las estrategias de tratamiento de rescate que se utilizan en los adultos con tumores de células germinativas recidivantes incluyen un número mayor de pacientes, pero las diferencias entre los niños y los adultos en cuanto al sitio del tumor de células germinativas primario, el patrón de recaída y las características biológicas de estos tumores a veces limitan la aplicabilidad de los abordajes de adultos en los niños. Para los adultos con tumor de células germinativas recidivante, varias quimioterapias combinadas (la mayoría incluyen la adición de paclitaxel e ifosfamida a un compuesto derivado del platino) han logrado un estado relativamente libre de enfermedad.[4-9] Se demostró que una combinación de paclitaxel y gemcitabina tiene efecto en adultos con tumores de células germinativas de testículo que recayeron después de dosis altas de quimioterapia y trasplante de células madre hematopoyéticas (TCMH).[10]
En niños con tumores sacrococcígeos benignos que recaen, es posible que esté presente un componente maligno en el sitio primario del tumor. Para estos niños, la resección quirúrgica completa del tumor recidivante y el cóccix (si no se realizó en un principio) es la base del tratamiento de rescate. La quimioterapia preoperatoria con cisplatino, etopósido y bleomicina (PEb) quizás ayude a la resección quirúrgica. En pacientes con un tumor sacrococcígeo maligno que recidivó después del tratamiento con PEb, es posible que se justifique una cirugía y quimioterapia adicional.[3]
En un ensayo de fase II del Children's Oncology Group (COG) (AGCT0521 [NCT00467051]), 20 pacientes menores de 21 años que recayeron después del tratamiento con PEb recibieron 2 ciclos de paclitaxel, ifosfamida y carboplatino. Las respuestas se evaluaron mediante una combinación de los criterios Response Evaluation Criteria In Solid Tumors (RECIST) y la disminución de los marcadores. Ocho pacientes obtuvieron respuestas parciales, en 10 pacientes la enfermedad se mantuvo estable, y en 2 pacientes la enfermedad progresó. Este régimen de quimioterapia produjo una tasa de respuesta combinada del 44 %.[11]
Opciones de tratamiento no estándar de los tumores malignos de células germinativas recidivantes en la niñez
Dosis altas de quimioterapia y rescate de células madre hematopoyéticas
No se ha definido la función de las dosis altas de quimioterapia y el rescate con células madre hematopoyéticas para los tumores de células germinativas recidivantes en la niñez. En una serie europea, 10 de 23 niños con tumores extragonadales de células germinativas que recayeron lograron una supervivencia sin enfermedad a largo plazo (mediana de seguimiento, 66 meses) después de recibir dosis altas de quimioterapia con apoyo de células madre.[12] Se necesitan realizar más estudios con niños y adolescentes. Para obtener más información sobre trasplantes, consultar Trasplante autógeno de células madre hematopoyéticas en pediatría y Trasplante de células madre hematopoyéticas y terapia celular para el cáncer en pediatría.
Las dosis altas de quimioterapia con rescate autógeno de células madre se han explorado como tratamiento para adultos con tumores de células germinativas de testículo recidivantes. Se notificó que las dosis altas de quimioterapia junto con el rescate con células madre hematopoyéticas curan a pacientes adultos con tumores de células germinativas de testículo recidivantes, incluso como tratamiento de tercera línea y en pacientes con resistencia al cisplatino.[10,13-15] En un estudio pequeño, también se demostró eficacia en adolescentes y mujeres con tumores de células germinativas de ovario.[16][Nivel de evidencia C1] Si bien algunos estudios apoyan este abordaje,[10,14,15,17,18] otros no lo sustentan.[19,20] Los intentos de tratamiento de rescate mediante regímenes de dosis altas de quimioterapia quizás no sean beneficiosos si el paciente no está libre de enfermedad desde el punto de vista clínico en el momento del TCMH.[13,21]
Radioterapia seguida de cirugía (para metástasis encefálicas)
En un estudio pediátrico muy pequeño, los pacientes con metástasis encefálicas no germinomatosas respondieron a la radioterapia. En los estudios German Maligne Keimzelltümoren (MAKEI), la radioterapia y la cirugía para pacientes con metástasis encefálicas produjeron paliación y, en ocasiones, supervivencia a largo plazo.[22,23][Nivel de evidencia C1] En un metanálisis, se observó que la radioterapia no mejoró el desenlace en comparación con la cirugía y la radiación. Sin embargo, el número de pacientes tratados con radioterapia fue muy pequeño como para evaluar el desenlace de manera exacta.[24]
Opciones de tratamiento en evaluación clínica para los tumores malignos de células germinativas recidivantes en niños y adolescentes
La información en inglés sobre los ensayos clínicos patrocinados por el NCI se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Mann JR, Raafat F, Robinson K, et al.: The United Kingdom Children's Cancer Study Group's second germ cell tumor study: carboplatin, etoposide, and bleomycin are effective treatment for children with malignant extracranial germ cell tumors, with acceptable toxicity. J Clin Oncol 18 (22): 3809-18, 2000. [PUBMED Abstract]
- Cushing B, Giller R, Cullen JW, et al.: Randomized comparison of combination chemotherapy with etoposide, bleomycin, and either high-dose or standard-dose cisplatin in children and adolescents with high-risk malignant germ cell tumors: a pediatric intergroup study--Pediatric Oncology Group 9049 and Children's Cancer Group 8882. J Clin Oncol 22 (13): 2691-700, 2004. [PUBMED Abstract]
- Schneider DT, Wessalowski R, Calaminus G, et al.: Treatment of recurrent malignant sacrococcygeal germ cell tumors: analysis of 22 patients registered in the German protocols MAKEI 83/86, 89, and 96. J Clin Oncol 19 (7): 1951-60, 2001. [PUBMED Abstract]
- Loehrer PJ, Gonin R, Nichols CR, et al.: Vinblastine plus ifosfamide plus cisplatin as initial salvage therapy in recurrent germ cell tumor. J Clin Oncol 16 (7): 2500-4, 1998. [PUBMED Abstract]
- Motzer RJ, Sheinfeld J, Mazumdar M, et al.: Paclitaxel, ifosfamide, and cisplatin second-line therapy for patients with relapsed testicular germ cell cancer. J Clin Oncol 18 (12): 2413-8, 2000. [PUBMED Abstract]
- Hartmann JT, Einhorn L, Nichols CR, et al.: Second-line chemotherapy in patients with relapsed extragonadal nonseminomatous germ cell tumors: results of an international multicenter analysis. J Clin Oncol 19 (6): 1641-8, 2001. [PUBMED Abstract]
- Kondagunta GV, Bacik J, Sheinfeld J, et al.: Paclitaxel plus Ifosfamide followed by high-dose carboplatin plus etoposide in previously treated germ cell tumors. J Clin Oncol 25 (1): 85-90, 2007. [PUBMED Abstract]
- Schmoll HJ, Kollmannsberger C, Metzner B, et al.: Long-term results of first-line sequential high-dose etoposide, ifosfamide, and cisplatin chemotherapy plus autologous stem cell support for patients with advanced metastatic germ cell cancer: an extended phase I/II study of the German Testicular Cancer Study Group. J Clin Oncol 21 (22): 4083-91, 2003. [PUBMED Abstract]
- Kondagunta GV, Bacik J, Bajorin D, et al.: Etoposide and cisplatin chemotherapy for metastatic good-risk germ cell tumors. J Clin Oncol 23 (36): 9290-4, 2005. [PUBMED Abstract]
- Einhorn LH, Brames MJ, Juliar B, et al.: Phase II study of paclitaxel plus gemcitabine salvage chemotherapy for germ cell tumors after progression following high-dose chemotherapy with tandem transplant. J Clin Oncol 25 (5): 513-6, 2007. [PUBMED Abstract]
- Pashankar F, Frazier AL, Krailo M, et al.: Treatment of refractory germ cell tumors in children with paclitaxel, ifosfamide, and carboplatin: A report from the Children's Oncology Group AGCT0521 study. Pediatr Blood Cancer 65 (8): e27111, 2018. [PUBMED Abstract]
- De Giorgi U, Rosti G, Slavin S, et al.: Salvage high-dose chemotherapy for children with extragonadal germ-cell tumours. Br J Cancer 93 (4): 412-7, 2005. [PUBMED Abstract]
- Einhorn LH, Williams SD, Chamness A, et al.: High-dose chemotherapy and stem-cell rescue for metastatic germ-cell tumors. N Engl J Med 357 (4): 340-8, 2007. [PUBMED Abstract]
- Motzer RJ, Mazumdar M, Sheinfeld J, et al.: Sequential dose-intensive paclitaxel, ifosfamide, carboplatin, and etoposide salvage therapy for germ cell tumor patients. J Clin Oncol 18 (6): 1173-80, 2000. [PUBMED Abstract]
- Rick O, Bokemeyer C, Beyer J, et al.: Salvage treatment with paclitaxel, ifosfamide, and cisplatin plus high-dose carboplatin, etoposide, and thiotepa followed by autologous stem-cell rescue in patients with relapsed or refractory germ cell cancer. J Clin Oncol 19 (1): 81-8, 2001. [PUBMED Abstract]
- Meisel JL, Woo KM, Sudarsan N, et al.: Development of a risk stratification system to guide treatment for female germ cell tumors. Gynecol Oncol 138 (3): 566-72, 2015. [PUBMED Abstract]
- Bhatia S, Abonour R, Porcu P, et al.: High-dose chemotherapy as initial salvage chemotherapy in patients with relapsed testicular cancer. J Clin Oncol 18 (19): 3346-51, 2000. [PUBMED Abstract]
- Feldman DR, Sheinfeld J, Bajorin DF, et al.: TI-CE high-dose chemotherapy for patients with previously treated germ cell tumors: results and prognostic factor analysis. J Clin Oncol 28 (10): 1706-13, 2010. [PUBMED Abstract]
- Beyer J, Rick O, Siegert W, et al.: Salvage chemotherapy in relapsed germ cell tumors. World J Urol 19 (2): 90-3, 2001. [PUBMED Abstract]
- Beyer J, Kramar A, Mandanas R, et al.: High-dose chemotherapy as salvage treatment in germ cell tumors: a multivariate analysis of prognostic variables. J Clin Oncol 14 (10): 2638-45, 1996. [PUBMED Abstract]
- Rick O, Bokemeyer C, Weinknecht S, et al.: Residual tumor resection after high-dose chemotherapy in patients with relapsed or refractory germ cell cancer. J Clin Oncol 22 (18): 3713-9, 2004. [PUBMED Abstract]
- Göbel U, von Kries R, Teske C, et al.: Brain metastases during follow-up of children and adolescents with extracranial malignant germ cell tumors: risk adapted management decision tree analysis based on data of the MAHO/MAKEI-registry. Pediatr Blood Cancer 60 (2): 217-23, 2013. [PUBMED Abstract]
- Göbel U, Schneider DT, Teske C, et al.: Brain metastases in children and adolescents with extracranial germ cell tumor - data of the MAHO/MAKEI-registry. Klin Padiatr 222 (3): 140-4, 2010. [PUBMED Abstract]
- Feldman DR, Lorch A, Kramar A, et al.: Brain Metastases in Patients With Germ Cell Tumors: Prognostic Factors and Treatment Options--An Analysis From the Global Germ Cell Cancer Group. J Clin Oncol 34 (4): 345-51, 2016. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (01/17/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre el tratamiento pediátrico es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento de los tumores extracraneales de células germinativas en la niñez. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento pediátrico, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento de los tumores extracraneales de células germinativas en la niñez son:
- Thomas A. Olson, MD (Aflac Cancer and Blood Disorders Center of Children's Healthcare of Atlanta - Egleston Campus)
- D. Williams Parsons, MD, PhD (Texas Children's Hospital)
- Stephen J. Shochat, MD (St. Jude Children's Research Hospital)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento pediátrico emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento pediátrico. PDQ Tratamiento de los tumores extracraneales de células germinativas en la niñez. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/extracraneal-celulas-germinativas/pro/tratamiento-celulas-germinativas-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.