Tratamiento del linfoma relacionado con el SIDA (PDQ®)–Versión para profesionales de salud
Información general sobre el linfoma relacionado con el SIDA
Antecedentes y definiciones
El síndrome de inmunodeficiencia adquirida (SIDA) se describió por primera vez en 1981. Las primeras definiciones incluían ciertas infecciones oportunistas, el sarcoma de Kaposi y los linfomas del sistema nervioso central (SNC). En 1984, en un estudio multicéntrico se describió la variabilidad clínica de los linfomas no Hodgkin (LNH) en las poblaciones con riesgo de SIDA.[1] La incidencia del LNH aumentó de forma casi paralela a la epidemia del SIDA y representa de 2 a 3 % de los casos de SIDA recién diagnosticados.[2] Desde que se comenzó a utilizar la terapia antirretrovírica de gran actividad (TARGA) a mediados de la década de 1990, disminuyó la incidencia de linfomas y mejoraron los desenlaces.[3] En la era de TARGA, los valores más altos de linfocitos T positivos para CD4 (CD4+) se relacionan con un cambio en el diagnóstico histológico. Se observa una disminución en los linfomas que se presentan con los recuentos más bajos de CD4, como los linfomas de efusión primarios y los linfomas primarios de SNC, y un aumento en los linfomas que se presentan con las cifras más altas de CD4, como el linfoma de Burkitt y el linfoma de Hodgkin (LH).[4-6] A diferencia de la incidencia de los trastornos linfoproliferativos, que en la era del TARGA es menos frecuente, la incidencia del cáncer de ano no ha cambiado.[7]
Características histológicas
Desde el punto de vista patológico, los linfomas relacionados con el SIDA abarcan un grupo pequeño de tipos histológicos que comprenden de manera casi exclusiva los tumores de células B de crecimiento rápido (de gran malignidad). Entre ellos, se encuentran los siguientes:
- Linfoma difuso de células B grandes (incluso el linfoma inmunoblástico de células B).
- Linfoma de células pequeñas no hendidas, linfoma de Burkitt o linfoma de tipo Burkitt.
Los linfomas relacionados con el virus de la inmunodeficiencia humana (VIH) se dividen en las siguientes categorías:
- Linfoma de células B de crecimiento rápido (ver arriba).
- Linfoma primario del SNC.
- Linfoma de efusión primaria.
- Enfermedad de Castleman multicéntrica plasmoblástica.
- Linfoma de Hodgkin.
Linfoma de Hodgkin relacionado con el virus de la inmunodeficiencia humana
Se han llevado a cabo múltiples revisiones de casos de LH en pacientes con riesgo de SIDA;[8,9] sin embargo, el LH todavía no forma parte de la definición del SIDA según los Centros para el Control y la Prevención de Enfermedades (CDC) porque no se demostró una incidencia más alta de este linfoma en combinación con la infección por el VIH, como en el caso del LNH de crecimiento rápido. Los CDC, junto con el Departamento de Salud Pública de San Francisco, informaron sobre un estudio de cohortes de hombres con VIH que tuvieron un riesgo excesivo de linfoma atribuible a la infección por el VIH, la tasa fue de 19,3 casos de LH por 100 000 años-persona y 224,9 casos de LNH por 100 000 años-persona. Aunque en este informe se encontró una incidencia excesiva de LH en hombres homosexuales infectados por el VIH, será necesario realizar estudios epidemiológicos adicionales antes de que los CDC vuelvan a considerar el LH como una neoplasia maligna relacionada con el VIH.[10]
El LH relacionado con el VIH se manifiesta de forma muy maligna, a menudo con compromiso extraganglionar o de médula ósea.[8,9,11] Una característica propia del LH relacionado con el VIH es la menor frecuencia de adenopatía mediastínica en comparación con el LH no relacionado con el VIH. La mayoría de los pacientes en estas series tenían un LH de celularidad mixta o un LH con reducción de linfocitos, expresión de proteínas relacionadas con el virus de Epstein-Barr (VEB) en las células de Reed-Sternberg, síntomas B y una mediana de recuento de linfocitos CD4 de 300/dl o menos.[12]En una revisión retrospectiva multicéntrica, 62 pacientes que recibieron TARGA con quimioterapia presentaron una tasa de supervivencia general (SG) a 2 años de 74 % en comparación con una tasa de SG de 30 % en los pacientes que no recibieron TARGA (P < 0,001).[13][Nivel de evidencia C1] Entre 201 pacientes de LH clásico con infección por el VIH, la SG a los 2 años y a los 5 años fue de 88 a 90 % después de TARGA y regímenes como el de doxorrubicina, bleomicina, vinblastina y dacarbazina (ABVD); en dos comparaciones no controladas, la supervivencia no fue significativamente diferente a la SG de los pacientes sin infección por el VIH con diagnóstico reciente de LH.[14,15][Nivel de evidencia C3] En estos estudios se confirma que los pacientes de LH tratados con regímenes estándar y TARGA tienen desenlaces similares a la población no infectada.[16] Además, el funcionamiento inmunitario se recupera en el transcurso de 6 a 9 meses tras completar la quimioterapia.[15]
Linfoma de efusión primaria
El linfoma de efusión primaria se vinculó con el sarcoma de Kaposi relacionado con el virus del herpes (SKVH) humano de tipo 8 (VHH-8).[17,18] El linfoma de efusión primaria se presenta en una fase líquida con diseminación por las membranas serosas sin masas o adenopatías.[17] Además del VHH-8, muchos casos también se relacionan con el VEB. Es posible que el linfoma se extienda desde la efusión hasta el tejido subyacente. En una serie de 20 pacientes, 19 de los cuales se trataron con una infusión modificada de etopósido, vincristina y doxorrubicina junto con ciclofosfamida y prednisona (modEPOCH), se observó una tasa de supervivencia específica de cáncer a 3 años de 47 % y una mediana de SG de 22 meses.[19][Nivel de evidencia C3]
Enfermedad de Castleman multicéntrica
El tipo plasmoblástico de la enfermedad de Castleman multicéntrica también se relaciona con la coinfección por el SKVH/VHH-8 y el VIH.[20] De manera característica, los pacientes presentan fiebre, sudoración nocturna, pérdida de peso, linfadenopatías y hepatoesplenomegalia. Es posible que se presente progresión a un linfoma de efusión primaria, un linfoma plasmoblástico o un linfoma anaplásico de células grandes. Hay notificaciones anecdóticas de respuestas al anticuerpo monoclonal anti-CD20, rituximab (junto con TARGA).[21-24][Nivel de evidencia C3] En una cohorte prospectiva de 84 pacientes con enfermedad de Castleman multicéntrica con infecciones por el VIH y VHH-8 tratados con rituximab, la tasa de supervivencia sin recaída a 5 años fue de 82 % (intervalo de confianza [IC] 95 %, 72 %–92 %); todos los pacientes respondieron de nuevo al rituximab tras la recaída.[24][Nivel de evidencia C2]
Incidencia y prevención
En una base de datos internacional de los Estados Unidos, Europa y Australia con información de 48 000 personas seropositivas para el VIH, se encontró una disminución de 42 % en la incidencia de los LNH de 1997 a 1999 en comparación con incidencias similares de 1992 a 1996 para el LPSNC y el linfoma sistémico.[25] Se argumenta que la disponibilidad de TARGA es la razón de esta disminución.[26] El diagnóstico del SIDA precede el inicio del LNH en alrededor de 50 % de los pacientes; sin embargo en la otra mitad de los pacientes, el diagnóstico del SIDA se establece en el momento del diagnóstico del LNH y la detección de la positividad al VIH.[3] La distribución geográfica de estos linfomas también es similar a la diseminación geográfica del SIDA. A diferencia del sarcoma de Kaposi (SK), que es más frecuente en hombres homosexuales y cuya incidencia parece estar en disminución, todos los grupos de riesgo presentan un número excesivo de LNH; estos grupos de riesgo incluyen los usuarios de drogas intravenosas y los hijos de personas infectadas por el VIH.
Cuadro clínico inicial
En general, el entorno clínico y la respuesta al tratamiento de los pacientes con linfoma relacionado con el SIDA son muy diferentes al de los pacientes con linfoma que no están infectados por el VIH. Una persona infectada por el VIH que tiene un linfoma de crecimiento rápido por lo general exhibe una enfermedad en estadio avanzado, a menudo extraganglionar.[27]
Los sitios extraganglionares comunes son los siguientes:
- Médula ósea.
- Hígado.
- Meninges.
- Tubo gastrointestinal.
Otros sitios muy infrecuentes, aunque característicos, son los siguientes:
- Ano.
- Corazón.
- Vías biliares.
- Encías.
- Músculos.
El curso clínico es más maligno, la enfermedad es más extensa y es menos sensible a la quimioterapia. La inmunodeficiencia y las citopenias, comunes en estos pacientes durante el cuadro clínico inicial, empeoran con la administración de quimioterapia. El tratamiento de las neoplasias malignas aumenta el riesgo de infecciones oportunistas que, a su vez, dificultan aún más la administración del tratamiento adecuado.
Pronóstico y supervivencia
El pronóstico de los pacientes con linfoma relacionado con el SIDA se relaciona con los siguientes aspectos:[28]
- Estadio (es decir, la extensión de la enfermedad, el compromiso extraganglionar, la concentración de lactato-deshidrogenasa y el compromiso de la médula ósea).
- Edad.
- Gravedad de la inmunodeficiencia subyacente (medida por el recuento de linfocitos CD4 en sangre periférica).
- Estado funcional.
- Diagnóstico previo de SIDA (por ejemplo, antecedentes de infecciones oportunistas o SK).
Los pacientes con LPSNC relacionado con el SIDA tienen una enfermedad subyacente relacionada con el VIH más grave que los pacientes con un linfoma sistémico. En un informe, esta gravedad se observó en pacientes con LPSNC que tenían una incidencia más alta de diagnóstico previo de SIDA (73 vs. 37 %), una mediana más baja de recuento de linfocitos CD4 (30/dl vs. 189/dl) y una mediana más precaria del tiempo de supervivencia (2,5 meses versus 6,0 meses).[29] En este informe también se describió que los pacientes con factores de riesgo alto (definidos por un estado funcional de Karnofsky inferior a 70 %, antecedentes de diagnóstico de SIDA y compromiso de la médula ósea) lograron una mediana de supervivencia de 4,0 meses en comparación con los pacientes de pronóstico favorable que no tenían ninguno de estos factores de riesgo, que presentaron una mediana de supervivencia de 11,3 meses.
En otro informe (NIAID-ACTG-142), se evaluaron los factores pronósticos en un grupo de 192 pacientes con linfoma relacionado con el SIDA recién diagnosticado asignados al azar para recibir dosis bajas de metotrexato, bleomicina, doxorrubicina, ciclofosfamida, vincristina y dexametasona (m-BACOD), o dosis estándar de m-BACOD con un factor estimulante de colonias de granulocitos y macrófagos.[30] No hubo diferencia entre estos dos tratamientos en términos de su eficacia en relación con la supervivencia sin enfermedad, la mediana de supervivencia ni el cociente de riesgos de muerte.[30][Nivel de evidencia A1] En un análisis multivariante, los factores relacionados con una disminución de la supervivencia fueron edad mayor de 35 años, antecedente de abuso de drogas intravenosas, enfermedad en estadio III o IV y recuento de CD4 menor de 100 células por mm3. Es posible que el Internacional Prognostic Index permita predecir la supervivencia.[31-33]En un modelo multivariante de Cox de un estudio de cohortes multicéntrico con 203 pacientes, la respuesta al TARGA se relacionó de forma independiente con una supervivencia prolongada (coeficiente de riesgos instantáneos, 0,32; IC 95 % 0,16–0,62).[34][Nivel de evidencia C2]
Bibliografía
- Ziegler JL, Beckstead JA, Volberding PA, et al.: Non-Hodgkin's lymphoma in 90 homosexual men. Relation to generalized lymphadenopathy and the acquired immunodeficiency syndrome. N Engl J Med 311 (9): 565-70, 1984. [PUBMED Abstract]
- Rabkin CS, Yellin F: Cancer incidence in a population with a high prevalence of infection with human immunodeficiency virus type 1. J Natl Cancer Inst 86 (22): 1711-6, 1994. [PUBMED Abstract]
- Noy A: Optimizing treatment of HIV-associated lymphoma. Blood 134 (17): 1385-1394, 2019. [PUBMED Abstract]
- Little RF, Wilson WH: Update on the Pathogenesis, Diagnosis, and Therapy of AIDS-related Lymphoma. Curr Infect Dis Rep 5 (2): 176-184, 2003. [PUBMED Abstract]
- Carbone A, Gloghini A: AIDS-related lymphomas: from pathogenesis to pathology. Br J Haematol 130 (5): 662-70, 2005. [PUBMED Abstract]
- Gopal S, Patel MR, Yanik EL, et al.: Temporal trends in presentation and survival for HIV-associated lymphoma in the antiretroviral therapy era. J Natl Cancer Inst 105 (16): 1221-9, 2013. [PUBMED Abstract]
- Piketty C, Selinger-Leneman H, Bouvier AM, et al.: Incidence of HIV-related anal cancer remains increased despite long-term combined antiretroviral treatment: results from the french hospital database on HIV. J Clin Oncol 30 (35): 4360-6, 2012. [PUBMED Abstract]
- Spina M, Vaccher E, Nasti G, et al.: Human immunodeficiency virus-associated Hodgkin's disease. Semin Oncol 27 (4): 480-8, 2000. [PUBMED Abstract]
- Thompson LD, Fisher SI, Chu WS, et al.: HIV-associated Hodgkin lymphoma: a clinicopathologic and immunophenotypic study of 45 cases. Am J Clin Pathol 121 (5): 727-38, 2004. [PUBMED Abstract]
- Hessol NA, Katz MH, Liu JY, et al.: Increased incidence of Hodgkin disease in homosexual men with HIV infection. Ann Intern Med 117 (4): 309-11, 1992. [PUBMED Abstract]
- Re A, Casari S, Cattaneo C, et al.: Hodgkin disease developing in patients infected by human immunodeficiency virus results in clinical features and a prognosis similar to those in patients with human immunodeficiency virus-related non-Hodgkin lymphoma. Cancer 92 (11): 2739-45, 2001. [PUBMED Abstract]
- Dolcetti R, Boiocchi M, Gloghini A, et al.: Pathogenetic and histogenetic features of HIV-associated Hodgkin's disease. Eur J Cancer 37 (10): 1276-87, 2001. [PUBMED Abstract]
- Hentrich M, Maretta L, Chow KU, et al.: Highly active antiretroviral therapy (HAART) improves survival in HIV-associated Hodgkin's disease: results of a multicenter study. Ann Oncol 17 (6): 914-9, 2006. [PUBMED Abstract]
- Montoto S, Shaw K, Okosun J, et al.: HIV status does not influence outcome in patients with classical Hodgkin lymphoma treated with chemotherapy using doxorubicin, bleomycin, vinblastine, and dacarbazine in the highly active antiretroviral therapy era. J Clin Oncol 30 (33): 4111-6, 2012. [PUBMED Abstract]
- Hentrich M, Berger M, Wyen C, et al.: Stage-adapted treatment of HIV-associated Hodgkin lymphoma: results of a prospective multicenter study. J Clin Oncol 30 (33): 4117-23, 2012. [PUBMED Abstract]
- Kaplan LD: Management of HIV-associated Hodgkin lymphoma: how far we have come. J Clin Oncol 30 (33): 4056-8, 2012. [PUBMED Abstract]
- Simonelli C, Spina M, Cinelli R, et al.: Clinical features and outcome of primary effusion lymphoma in HIV-infected patients: a single-institution study. J Clin Oncol 21 (21): 3948-54, 2003. [PUBMED Abstract]
- Nador RG, Cesarman E, Chadburn A, et al.: Primary effusion lymphoma: a distinct clinicopathologic entity associated with the Kaposi's sarcoma-associated herpes virus. Blood 88 (2): 645-56, 1996. [PUBMED Abstract]
- Lurain K, Polizzotto MN, Aleman K, et al.: Viral, immunologic, and clinical features of primary effusion lymphoma. Blood 133 (16): 1753-1761, 2019. [PUBMED Abstract]
- Bower M, Newsom-Davis T, Naresh K, et al.: Clinical Features and Outcome in HIV-Associated Multicentric Castleman's Disease. J Clin Oncol 29 (18): 2481-6, 2011. [PUBMED Abstract]
- Goedert JJ: Multicentric Castleman disease: viral and cellular targets for intervention. Blood 102 (8): 2710-11, 2003.
- Uldrick TS, Polizzotto MN, Aleman K, et al.: Rituximab plus liposomal doxorubicin in HIV-infected patients with KSHV-associated multicentric Castleman disease. Blood 124 (24): 3544-52, 2014. [PUBMED Abstract]
- Marcelin AG, Aaron L, Mateus C, et al.: Rituximab therapy for HIV-associated Castleman disease. Blood 102 (8): 2786-8, 2003. [PUBMED Abstract]
- Pria AD, Pinato D, Roe J, et al.: Relapse of HHV8-positive multicentric Castleman disease following rituximab-based therapy in HIV-positive patients. Blood 129 (15): 2143-2147, 2017. [PUBMED Abstract]
- International Collaboration on HIV and Cancer: Highly active antiretroviral therapy and incidence of cancer in human immunodeficiency virus-infected adults. J Natl Cancer Inst 92 (22): 1823-30, 2000. [PUBMED Abstract]
- Stebbing J, Gazzard B, Mandalia S, et al.: Antiretroviral treatment regimens and immune parameters in the prevention of systemic AIDS-related non-Hodgkin's lymphoma. J Clin Oncol 22 (11): 2177-83, 2004. [PUBMED Abstract]
- Sparano JA: Clinical aspects and management of AIDS-related lymphoma. Eur J Cancer 37 (10): 1296-305, 2001. [PUBMED Abstract]
- Bower M, Gazzard B, Mandalia S, et al.: A prognostic index for systemic AIDS-related non-Hodgkin lymphoma treated in the era of highly active antiretroviral therapy. Ann Intern Med 143 (4): 265-73, 2005. [PUBMED Abstract]
- Levine AM, Sullivan-Halley J, Pike MC, et al.: Human immunodeficiency virus-related lymphoma. Prognostic factors predictive of survival. Cancer 68 (11): 2466-72, 1991. [PUBMED Abstract]
- Kaplan LD, Straus DJ, Testa MA, et al.: Low-dose compared with standard-dose m-BACOD chemotherapy for non-Hodgkin's lymphoma associated with human immunodeficiency virus infection. National Institute of Allergy and Infectious Diseases AIDS Clinical Trials Group. N Engl J Med 336 (23): 1641-8, 1997. [PUBMED Abstract]
- Navarro JT, Ribera JM, Oriol A, et al.: International prognostic index is the best prognostic factor for survival in patients with AIDS-related non-Hodgkin's lymphoma treated with CHOP. A multivariate study of 46 patients. Haematologica 83 (6): 508-13, 1998. [PUBMED Abstract]
- Rossi G, Donisi A, Casari S, et al.: The International Prognostic Index can be used as a guide to treatment decisions regarding patients with human immunodeficiency virus-related systemic non-Hodgkin lymphoma. Cancer 86 (11): 2391-7, 1999. [PUBMED Abstract]
- Straus DJ, Huang J, Testa MA, et al.: Prognostic factors in the treatment of human immunodeficiency virus-associated non-Hodgkin's lymphoma: analysis of AIDS Clinical Trials Group protocol 142--low-dose versus standard-dose m-BACOD plus granulocyte-macrophage colony-stimulating factor. National Institute of Allergy and Infectious Diseases. J Clin Oncol 16 (11): 3601-6, 1998. [PUBMED Abstract]
- Hoffmann C, Wolf E, Fätkenheuer G, et al.: Response to highly active antiretroviral therapy strongly predicts outcome in patients with AIDS-related lymphoma. AIDS 17 (10): 1521-9, 2003. [PUBMED Abstract]
Clasificación celular del linfoma relacionado con el SIDA
Desde el punto de vista patológico, los linfomas relacionados con el SIDA abarcan un grupo pequeño de tipos histológicos que comprenden de manera casi exclusiva los tumores de células B de crecimiento rápido (de gran malignidad). Entre ellos, se encuentran los siguientes:
- Linfoma difuso de células B grandes (linfoma inmunoblástico de células B).
- Linfoma de células pequeñas no hendidas, linfoma de Burkitt o linfoma de tipo Burkitt.
También se observó que los linfomas relacionados con el SIDA pueden ser de origen oligoclonal, policlonal y monoclonal, aunque por lo general se originan en las células B, según se demostró en estudios de reordenamientos de los genes de la cadena pesada de las inmunoglobulinas. A pesar de que el VIH no parece cumplir una función etiológica directa, la infección por este virus produce un medio inmunológico alterado. El VIH por lo general infecta los linfocitos T y se pierde la función reguladora, lo que lleva a una hipergammaglobulinemia e hiperplasia policlonal de las células B. La infección por el VIH no se dirige a la células B. En cambio, se piensa que el virus de Epstein-Barr (VEB) es, por lo menos, un cofactor etiológico de algunos de estos linfomas. Se detectó el genoma del VEB en la mayoría de pacientes con linfomas relacionados con el SIDA; el análisis molecular indica que las células se infectaron antes de que empezara la proliferación clonal.[1] El linfoma de efusión primaria, que es muy infrecuente, siempre alberga el virus del herpes humano de tipo 8 y, con frecuencia contiene el VEB.[2] También se han identificado linfomas de células T relacionados con el VIH vinculados con una infección por el VEB.[3]
Bibliografía
- Thorley-Lawson DA, Gross A: Persistence of the Epstein-Barr virus and the origins of associated lymphomas. N Engl J Med 350 (13): 1328-37, 2004. [PUBMED Abstract]
- Simonelli C, Spina M, Cinelli R, et al.: Clinical features and outcome of primary effusion lymphoma in HIV-infected patients: a single-institution study. J Clin Oncol 21 (21): 3948-54, 2003. [PUBMED Abstract]
- Thomas JA, Cotter F, Hanby AM, et al.: Epstein-Barr virus-related oral T-cell lymphoma associated with human immunodeficiency virus immunosuppression. Blood 81 (12): 3350-6, 1993. [PUBMED Abstract]
Información sobre los estadios del linfoma relacionado con el SIDA
Aunque el estadio es importante para seleccionar el tratamiento de los pacientes con linfoma no Hodgkin (LNH) que no tienen el síndrome de inmunodeficiencia adquirida (SIDA), la mayoría de los pacientes con linfomas relacionados con el SIDA tienen una enfermedad muy avanzada.
Sistema de estadificación en subtipos
Clasificación de Lugano
El American Joint Committee on Cancer (AJCC) adoptó la clasificación de Lugano para evaluar y estadificar el linfoma.[1] El sistema de clasificación de Lugano reemplaza el sistema de clasificación de Ann Arbor, que se adoptó en 1971 durante la conferencia de Ann Arbor,[2] con algunas modificaciones que se introdujeron 18 años después en la reunión de Cotswolds.[3,4]
| Estadio | Descripción del estadio | Imagen |
|---|---|---|
| LCR = líquido cefalorraquídeo; LDCBG = linfoma difuso de células B grandes; LNH = linfoma no Hodgkin; TC = tomografía computarizada. | ||
| aHodgkin and Non-Hodgkin Lymphomas. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 937–58. | ||
| bEs posible que el estadio II con masa tumoral voluminosa antes se considerara un estadio temprano o avanzado de acuerdo con las características histológicas del linfoma y los factores pronósticos. | ||
| cLa definición de una masa tumoral voluminosa varía de acuerdo con el tipo histológico del linfoma. En la clasificación de Lugano, una masa tumoral voluminosa en el linfoma de Hodgkin se define como una masa que mide más de un tercio del diámetro torácico en la TC del tórax, o una masa que mide >10 cm. Las definiciones recomendadas para la masa tumoral voluminosa en el LNH varían de acuerdo con el tipo histológico del linfoma. En el linfoma folicular, se sugirió la medida de 6 cm a partir de la validación del Follicular Lymphoma International Prognostic Index-2. En el LDCBG, se han usado límites que oscilan entre 5 y 10 cm, si bien se recomienda el límite de 10 cm. | ||
| Estadio limitado | ||
| I | Compromiso en un solo sitio linfático (es decir, región ganglionar, anillo de Waldeyer, timo o bazo). |
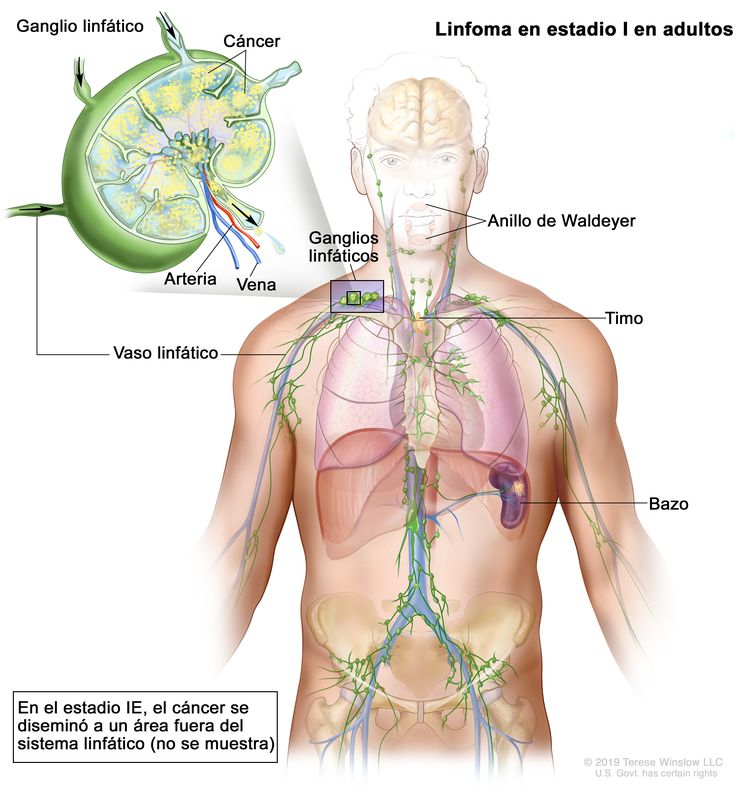 |
| IE | Compromiso de 1 solo sitio extralinfático sin compromiso ganglionar (infrecuente en el linfoma de Hodgkin). | |
| II | Compromiso de 2 o más regiones ganglionares en el mismo lado del diafragma. |
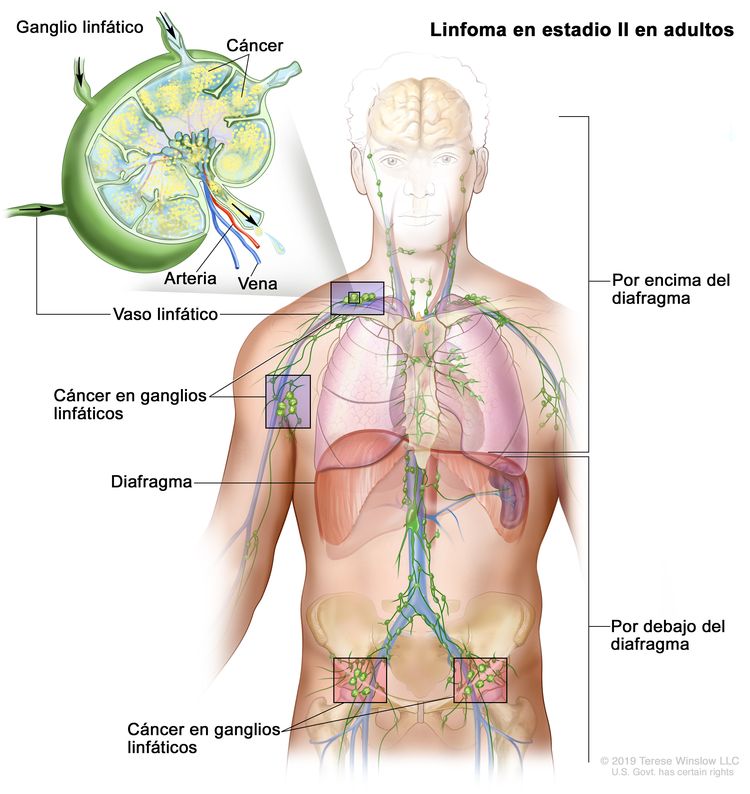 |
| IIE | Diseminación contigua extralinfática desde un sitio ganglionar, con compromiso de otras regiones ganglionares en el mismo lado del diafragma, o sin esta. |
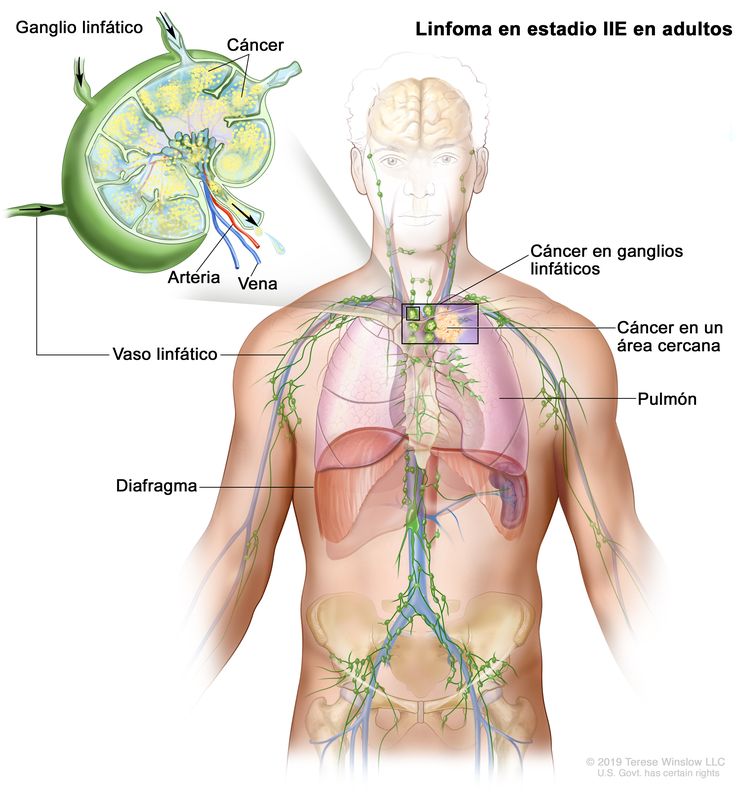 |
| II con masa voluminosab | Estadio II con una gran masa tumoral.c | |
| Estadio avanzado | ||
| III | Compromiso de regiones ganglionares en ambos lados del diafragma; ganglios supradiafragmáticos y compromiso esplénico. |
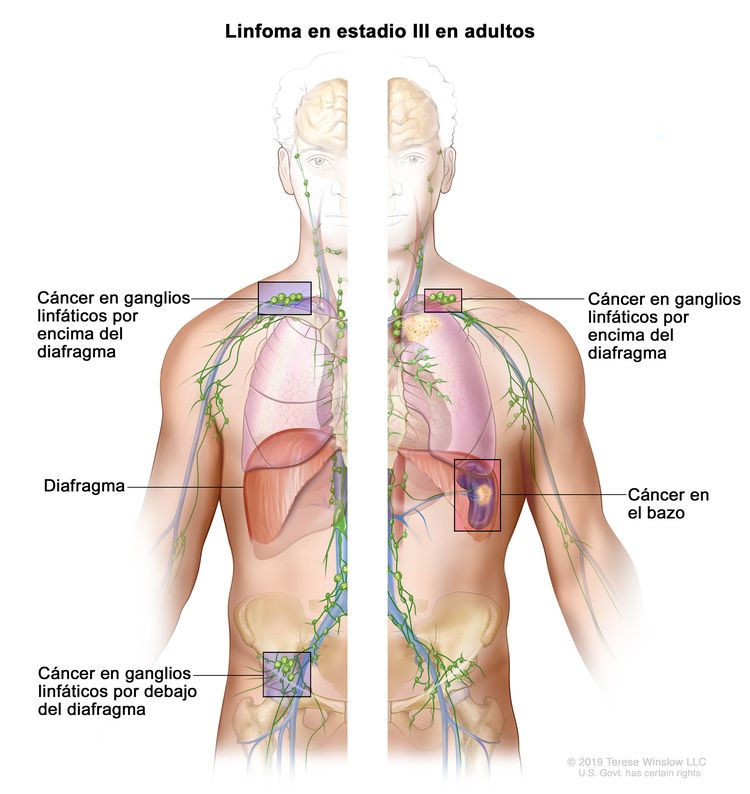 |
| IV | Compromiso difuso o diseminado de uno o más órganos extralinfáticos con compromiso ganglionar relacionado o sin este; compromiso de órgano extralinfático no contiguo con enfermedad ganglionar en estadio II; o compromiso de cualquier órgano extralinfático con enfermedad ganglionar en estadio III. El estadio IV incluye cualquier compromiso del LCR, la médula ósea, el hígado o los pulmones (diferentes a las lesiones por diseminación directa en una enfermedad en estadio IIE). |
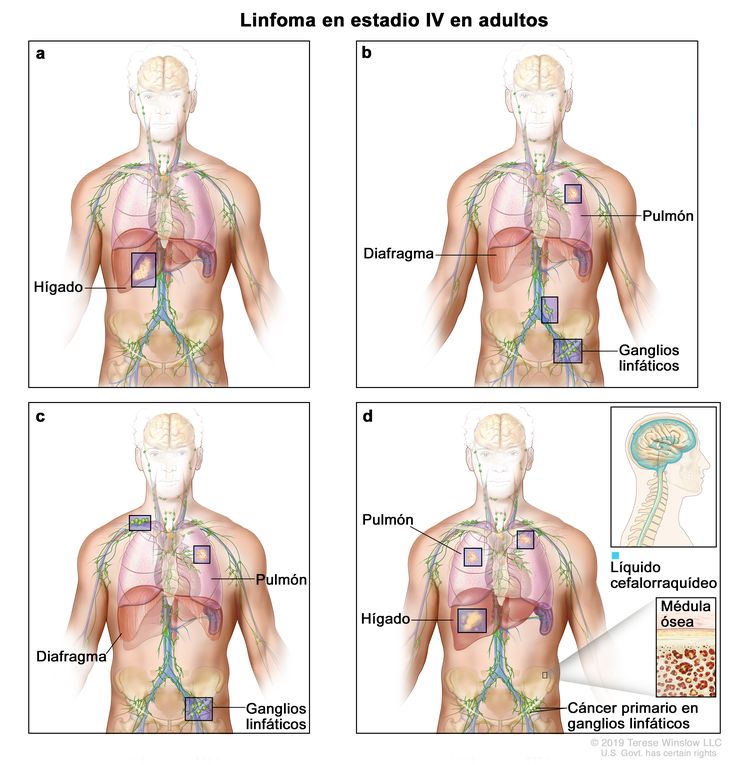 |
| Nota: Se utiliza la designación A o B junto con el grupo de estadio para el linfoma de Hodgkin. Ya no se utiliza la designación A o B para el LNH. | ||
En ocasiones, se usan sistemas de estadificación especializados. El médico debe estar al tanto del sistema que se usa en el informe.
La designación E se usa cuando aparecen neoplasias linfoides extraganglionares malignas en tejidos separados de los conglomerados linfáticos principales pero cercanos a estos. El estadio IV se refiere a la enfermedad con diseminación difusa por todo un sitio extraganglionar, como el hígado. Si el compromiso de uno o más sitios extralinfáticos se documentó mediante estudio patológico, se usa el símbolo del sitio comprometido seguido por el signo +.
| N = ganglios | H = hígado | L = pulmón | M = médula |
| S = bazo | P = pleura | O = hueso | D = piel |
En la práctica actual se asigna un estadio clínico (CS) a partir de los hallazgos de la evaluación clínica y un estadio patológico (PS) a partir de los hallazgos de los procedimientos invasores adicionales a la biopsia inicial.
Por ejemplo, es posible que se encuentre un compromiso del hígado y la médula ósea mediante una biopsia percutánea en un paciente con adenopatía inguinal sin síntomas sistémicos que tiene un resultado positivo en el linfangiograma. El estadio preciso para dicho paciente sería CS IIA, PS IVA(H+)(M+).
Hay otros factores que no se incluyen en el sistema de estadificación anterior, pero que son importantes para la estadificación y el pronóstico de los pacientes con LNH. Estos factores son los siguientes:
- Edad.
- Estado funcional (EF).
- Tamaño del tumor.
- Concentraciones de deshidrogenasa láctica (LDH).
- Número de sitios con compromiso extraganglionar.
Bibliografía
- Hodgkin and non-Hodgkin lymphoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 937–58.
- Carbone PP, Kaplan HS, Musshoff K, et al.: Report of the Committee on Hodgkin's Disease Staging Classification. Cancer Res 31 (11): 1860-1, 1971. [PUBMED Abstract]
- Lister TA, Crowther D, Sutcliffe SB, et al.: Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin's disease: Cotswolds meeting. J Clin Oncol 7 (11): 1630-6, 1989. [PUBMED Abstract]
- National Cancer Institute sponsored study of classifications of non-Hodgkin's lymphomas: summary and description of a working formulation for clinical usage. The Non-Hodgkin's Lymphoma Pathologic Classification Project. Cancer 49 (10): 2112-35, 1982. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento del linfoma relacionado con el SIDA
El tratamiento de los pacientes con linfomas relacionados con el SIDA implica el desafío de integrar la terapia adecuada para el estadio y el subtipo histológico de linfoma maligno con las limitaciones impuestas por la infección por el VIH.[1] Además de la terapia antitumoral, los elementos esenciales de una estrategia terapéutica óptima para el linfoma no Hodgkin son los siguientes:[2,3]
- Terapia antirretrovírica de gran actividad.
- Profilaxis para infecciones oportunistas.
- Reconocimiento y tratamiento rápidos de las infecciones intercurrentes.
Los pacientes infectados por el VIH con inmunodeficiencia subyacente tienen una reserva limitada de médula ósea, lo que afecta el potencial aumento de la intensidad de las dosis farmacológica. Es posible que el riesgo de una infección oportunista intercurrente también lleve a una disminución en la administración de medicamentos. Además, la quimioterapia por sí sola afecta el sistema inmunitario y aumenta la probabilidad de una infección oportunista.
Bibliografía
- Levine AM: Acquired immunodeficiency syndrome-related lymphoma: clinical aspects. Semin Oncol 27 (4): 442-53, 2000. [PUBMED Abstract]
- Tirelli U, Bernardi D: Impact of HAART on the clinical management of AIDS-related cancers. Eur J Cancer 37 (10): 1320-4, 2001. [PUBMED Abstract]
- Noy A: Optimizing treatment of HIV-associated lymphoma. Blood 134 (17): 1385-1394, 2019. [PUBMED Abstract]
Tratamiento del linfoma periférico o linfoma sistémico relacionado con el SIDA
El tratamiento de los linfomas relacionados con el SIDA implica superar varios problemas. Todos estos son linfomas de crecimiento rápido, que por definición son linfomas difusos de células grandes, linfomas inmunoblásticos o linfomas de células pequeñas no hendidas (linfoma de Burkitt). Estos linfomas a menudo comprometen la médula ósea y el sistema nervioso central (SNC) y, por lo tanto, suelen estar en un estadio avanzado. Asimismo, la inmunodeficiencia y la leucopenia que se observan con frecuencia a causa de la infección por el VIH dificultan el uso de quimioterapia inmunodepresora.
El empleo de la terapia antirretrovírica de gran actividad (TARGA) llevó a una disminución marcada de las enfermedades oportunistas, prolongó la supervivencia de los pacientes infectados por el VIH, y mejoró la mediana de supervivencia general (SG) para los pacientes de linfoma relacionado con el SIDA hasta un grado comparable al desenlace de la población sin inmunocompromiso.[1-7][Nivel de evidencia C3] El uso de TARGA también ha permitido la administración de regímenes quimioterapéuticos intensivos de dosis estándar con una inocuidad aceptable para los pacientes con linfomas relacionados con el SIDA, con resultados comparables a los de los pacientes sin infección por el VIH.[1-10]
En varios ensayos prospectivos no aleatorizados y en datos individuales agrupados de 19 ensayos prospectivos con 1546 pacientes, se observó que la adición de rituximab a la quimioterapia combinada mejora la tasa de respuesta completa, la supervivencia sin progresión y la SG.[3-6][Nivel de evidencia C3] En muchos otros ensayos prospectivos no aleatorizados y en los datos individuales agrupados de los mismos 1546 pacientes, también se observó que un tratamiento de etopósido en infusión, vincristina en infusión, doxorrubicina en infusión, ciclofosfamida y prednisona (EPOCH en infusión) produjo mejores resultados que ciclofosfamida, doxorrubicina, vincristina y prednisona (CHOP) (cociente de riesgos instantáneo de la SG, 0,33; P = 0,03).[3,6,7][Nivel de evidencia C3] El uso simultáneo de TARGA y el régimen EPOCH en infusión es polémico; un grupo recomendó usar TARGA después de completar la quimioterapia,[7] mientras que otros sugieren un tratamiento simultáneo.[6]
Se han obtenido buenos resultados en pacientes de linfoma de Burkitt cuando de administra TARGA de manera simultánea o secuencial con regímenes de dosis modificadas de ciclofosfamida, doxorrubicina, vincristina, metotrexato, citarabina y rituximab (R-CODOX); ifosfamida, etopósido y dosis altas de citarabina (M/IVAC), o etopósido, prednisona, vincristina y clorhidrato de doxorrubicina en combinación con rituximab) (R-EPOCH).[7,11,12]
Los pacientes con riesgo de compromiso posterior en el SNC incluyen a aquellos con compromiso de la médula ósea o en quienes se identificó el VEB en el tumor primario o en el líquido cefalorraquídeo (es decir, mediante reacción en cadena de la polimerasa).[13,14] Por lo general, se considera el uso de quimioterapia intratecal en los pacientes que tienen un riesgo alto de compromiso del SNC.
Algunos pacientes muy seleccionados con linfoma resistente al tratamiento o recaída después de la quimioterapia de primera línea, que seguían respondiendo a TARGA, se sometieron a quimioterapia de segunda línea seguida de tratamiento con dosis altas y trasplante autógeno de células madre periféricas. Hay informes anecdóticos de supervivencia a largo plazo en estos pacientes muy seleccionados que tuvieron recaídas.[15-18][Nivel de evidencia C3]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Mounier N, Spina M, Gabarre J, et al.: AIDS-related non-Hodgkin lymphoma: final analysis of 485 patients treated with risk-adapted intensive chemotherapy. Blood 107 (10): 3832-40, 2006. [PUBMED Abstract]
- Weiss R, Mitrou P, Arasteh K, et al.: Acquired immunodeficiency syndrome-related lymphoma: simultaneous treatment with combined cyclophosphamide, doxorubicin, vincristine, and prednisone chemotherapy and highly active antiretroviral therapy is safe and improves survival--results of the German Multicenter Trial. Cancer 106 (7): 1560-8, 2006. [PUBMED Abstract]
- Barta SK, Xue X, Wang D, et al.: Treatment factors affecting outcomes in HIV-associated non-Hodgkin lymphomas: a pooled analysis of 1546 patients. Blood 122 (19): 3251-62, 2013. [PUBMED Abstract]
- Wyen C, Jensen B, Hentrich M, et al.: Treatment of AIDS-related lymphomas: rituximab is beneficial even in severely immunosuppressed patients. AIDS 26 (4): 457-64, 2012. [PUBMED Abstract]
- Levine AM, Noy A, Lee JY, et al.: Pegylated liposomal doxorubicin, rituximab, cyclophosphamide, vincristine, and prednisone in AIDS-related lymphoma: AIDS Malignancy Consortium Study 047. J Clin Oncol 31 (1): 58-64, 2013. [PUBMED Abstract]
- Sparano JA, Lee JY, Kaplan LD, et al.: Rituximab plus concurrent infusional EPOCH chemotherapy is highly effective in HIV-associated B-cell non-Hodgkin lymphoma. Blood 115 (15): 3008-16, 2010. [PUBMED Abstract]
- Dunleavy K, Little RF, Pittaluga S, et al.: The role of tumor histogenesis, FDG-PET, and short-course EPOCH with dose-dense rituximab (SC-EPOCH-RR) in HIV-associated diffuse large B-cell lymphoma. Blood 115 (15): 3017-24, 2010. [PUBMED Abstract]
- Ratner L, Lee J, Tang S, et al.: Chemotherapy for human immunodeficiency virus-associated non-Hodgkin's lymphoma in combination with highly active antiretroviral therapy. J Clin Oncol 19 (8): 2171-8, 2001. [PUBMED Abstract]
- Wang ES, Straus DJ, Teruya-Feldstein J, et al.: Intensive chemotherapy with cyclophosphamide, doxorubicin, high-dose methotrexate/ifosfamide, etoposide, and high-dose cytarabine (CODOX-M/IVAC) for human immunodeficiency virus-associated Burkitt lymphoma. Cancer 98 (6): 1196-205, 2003. [PUBMED Abstract]
- Cortes J, Thomas D, Rios A, et al.: Hyperfractionated cyclophosphamide, vincristine, doxorubicin, and dexamethasone and highly active antiretroviral therapy for patients with acquired immunodeficiency syndrome-related Burkitt lymphoma/leukemia. Cancer 94 (5): 1492-9, 2002. [PUBMED Abstract]
- Noy A: Optimizing treatment of HIV-associated lymphoma. Blood 134 (17): 1385-1394, 2019. [PUBMED Abstract]
- Noy A, Kaplan L, Lee J: Feasibility and toxicity of a modified dose intensive R-CODOX-M/IVAC for HIV-associated Burkitt and atypical Burkitt lymphoma (BL): preliminary results of a prospective multicenter phase II trial of the AIDS Malignancy Consortium (AMC). [Abstract] Blood 114 (22): A-3673, 2009.
- Cingolani A, Gastaldi R, Fassone L, et al.: Epstein-Barr virus infection is predictive of CNS involvement in systemic AIDS-related non-Hodgkin's lymphomas. J Clin Oncol 18 (19): 3325-30, 2000. [PUBMED Abstract]
- Scadden DT: Epstein-Barr virus, the CNS, and AIDS-related lymphomas: as close as flame to smoke. J Clin Oncol 18 (19): 3323-4, 2000. [PUBMED Abstract]
- Re A, Michieli M, Casari S, et al.: High-dose therapy and autologous peripheral blood stem cell transplantation as salvage treatment for AIDS-related lymphoma: long-term results of the Italian Cooperative Group on AIDS and Tumors (GICAT) study with analysis of prognostic factors. Blood 114 (7): 1306-13, 2009. [PUBMED Abstract]
- Krishnan A, Molina A, Zaia J, et al.: Durable remissions with autologous stem cell transplantation for high-risk HIV-associated lymphomas. Blood 105 (2): 874-8, 2005. [PUBMED Abstract]
- Costello RT, Zerazhi H, Charbonnier A, et al.: Intensive sequential chemotherapy with hematopoietic growth factor support for non-Hodgkin lymphoma in patients infected with the human immunodeficiency virus. Cancer 100 (4): 667-76, 2004. [PUBMED Abstract]
- Balsalobre P, Díez-Martín JL, Re A, et al.: Autologous stem-cell transplantation in patients with HIV-related lymphoma. J Clin Oncol 27 (13): 2192-8, 2009. [PUBMED Abstract]
Linfoma primario del sistema nervioso central relacionado con el SIDA
El linfoma primario del sistema nervioso central (LPSNC), al igual que otros linfomas relacionados con el SIDA, es una neoplasia de células B de crecimiento rápido de tipo linfoma difuso de células B grandes o de tipo linfoma no Hodgkin difuso inmunoblástico (subtipo de linfoma difuso de células B grandes). Se notificó que el LPSNC relacionado con el SIDA se asocia con el virus de Epstein-Barr (VEB) en el 100 % de los casos.[1] Por lo general, estos pacientes tienen recuentos bajos de linfocitos T CD4+, carga vírica del VIH alta, debilidad intensa y síntomas neurológicos focales como convulsiones, cambios del estado mental y parálisis.
En las tomografías computarizadas se observan masas de contraste alto que no siempre se diferencian de otras enfermedades del SNC que ocurren en pacientes con SIDA, como la toxoplasmosis.[2] Las resonancias magnéticas con contraste de gadolinio quizás sean un instrumento diagnóstico inicial más útil para diferenciar el linfoma de la toxoplasmosis cerebral y de la leucoencefalopatía multifocal progresiva. El linfoma tiende a presentarse con lesiones grandes realzadas por el gadolinio. En la toxoplasmosis cerebral, el realce anular es muy común, se observan lesiones múltiples y las lesiones suelen ser más pequeñas.[3-5] El uso de imágenes por emisión de positrones demostró mejor capacidad para diferenciar el LPSNC de la toxoplasmosis.[6,7] La captación del LPSNC es más alta, mientras que las lesiones de toxoplasmosis son metabólicamente inactivas. Es posible que los anticuerpos contra la toxoplasmosis también sean muy útiles porque casi todos los casos de toxoplasmosis cerebral son consecuencia de la reactivación de una infección previa. Si la concentración de la inmunoglobulina G es menos de 1:4 es improbable que la enfermedad sea toxoplasmosis. Una punción lumbar tal vez sirva para detectar hasta 23 % de los pacientes con células malignas en el líquido cefalorraquídeo (LCR). La evaluación del LCR para determinar si contiene ADN del VEB quizás sea útil como instrumento específico para el linfoma porque el VEB está presente en todos los pacientes con LPSNC. A pesar de todas las evaluaciones, la mayoría de los pacientes con LPSNC requieren un diagnóstico patológico.[8-10] El diagnóstico se establece mediante biopsia. A veces solo se intenta obtener una biopsia después del fracaso del tratamiento antibiótico para la toxoplasmosis que suele producir mejoría clínica y radiográfica dentro de 1 a 3 semanas de iniciar el tratamiento en los pacientes con toxoplasmosis cerebral.[11]
Por lo general, se emplea la radioterapia sola en este grupo de pacientes. La mediana de supervivencia solo fue de 72 a 119 días con dosis que oscilan entre 35 Gy y 40 Gy.[2,12,13] La supervivencia es más larga en los pacientes más jóvenes con mejor estado funcional y sin infecciones oportunistas.[14] En la era de la terapia antirretrovírica de gran actividad (TARGA), el uso de radioterapia sola produce una mediana de supervivencia de 18 meses.[15] En un informe anecdótico sobre el uso de TARGA y dosis altas de metotrexato en pacientes con LPSNC relacionado con el SIDA, se observó que no se alcanzó la mediana de supervivencia al cabo de una mediana de seguimiento de 27 meses.[16] La respuesta al tratamiento de la mayoría de los pacientes implica una mejoría parcial de los síntomas neurológicos. Se reveló en autopsias que estos pacientes mueren por las infecciones oportunistas y por la progresión tumoral. El tratamiento de estos pacientes también se complica debido a otras infecciones del SNC relacionadas con el SIDA, entre ellas, la encefalitis subaguda, la encefalitis por citomegalovirus y la encefalitis por toxoplasma. Se informó sobre remisiones espontáneas después de recibir TARGA.[17]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- MacMahon EM, Glass JD, Hayward SD, et al.: Epstein-Barr virus in AIDS-related primary central nervous system lymphoma. Lancet 338 (8773): 969-73, 1991. [PUBMED Abstract]
- Goldstein JD, Dickson DW, Moser FG, et al.: Primary central nervous system lymphoma in acquired immune deficiency syndrome. A clinical and pathologic study with results of treatment with radiation. Cancer 67 (11): 2756-65, 1991. [PUBMED Abstract]
- Nyberg DA, Federle MP: AIDS-related Kaposi sarcoma and lymphomas. Semin Roentgenol 22 (1): 54-65, 1987. [PUBMED Abstract]
- Fine HA, Mayer RJ: Primary central nervous system lymphoma. Ann Intern Med 119 (11): 1093-104, 1993. [PUBMED Abstract]
- Ciricillo SF, Rosenblum ML: Use of CT and MR imaging to distinguish intracranial lesions and to define the need for biopsy in AIDS patients. J Neurosurg 73 (5): 720-4, 1990. [PUBMED Abstract]
- Hoffman JM, Waskin HA, Schifter T, et al.: FDG-PET in differentiating lymphoma from nonmalignant central nervous system lesions in patients with AIDS. J Nucl Med 34 (4): 567-75, 1993. [PUBMED Abstract]
- Pierce MA, Johnson MD, Maciunas RJ, et al.: Evaluating contrast-enhancing brain lesions in patients with AIDS by using positron emission tomography. Ann Intern Med 123 (8): 594-8, 1995. [PUBMED Abstract]
- Cinque P, Brytting M, Vago L, et al.: Epstein-Barr virus DNA in cerebrospinal fluid from patients with AIDS-related primary lymphoma of the central nervous system. Lancet 342 (8868): 398-401, 1993. [PUBMED Abstract]
- Cingolani A, De Luca A, Larocca LM, et al.: Minimally invasive diagnosis of acquired immunodeficiency syndrome-related primary central nervous system lymphoma. J Natl Cancer Inst 90 (5): 364-9, 1998. [PUBMED Abstract]
- Yarchoan R, Jaffe ES, Little R: Diagnosing central nervous system lymphoma in the setting of AIDS: a step forward. J Natl Cancer Inst 90 (5): 346-7, 1998. [PUBMED Abstract]
- Mathews C, Barba D, Fullerton SC: Early biopsy versus empiric treatment with delayed biopsy of non-responders in suspected HIV-associated cerebral toxoplasmosis: a decision analysis. AIDS 9 (11): 1243-50, 1995. [PUBMED Abstract]
- Baumgartner JE, Rachlin JR, Beckstead JH, et al.: Primary central nervous system lymphomas: natural history and response to radiation therapy in 55 patients with acquired immunodeficiency syndrome. J Neurosurg 73 (2): 206-11, 1990. [PUBMED Abstract]
- Remick SC, Diamond C, Migliozzi JA, et al.: Primary central nervous system lymphoma in patients with and without the acquired immune deficiency syndrome. A retrospective analysis and review of the literature. Medicine (Baltimore) 69 (6): 345-60, 1990. [PUBMED Abstract]
- Corn BW, Donahue BR, Rosenstock JG, et al.: Performance status and age as independent predictors of survival among AIDS patients with primary CNS lymphoma: a multivariate analysis of a multi-institutional experience. Cancer J Sci Am 3 (1): 52-6, 1997 Jan-Feb. [PUBMED Abstract]
- Hoffmann C, Tabrizian S, Wolf E, et al.: Survival of AIDS patients with primary central nervous system lymphoma is dramatically improved by HAART-induced immune recovery. AIDS 15 (16): 2119-27, 2001. [PUBMED Abstract]
- Gupta NK, Nolan A, Omuro A, et al.: Long-term survival in AIDS-related primary central nervous system lymphoma. Neuro Oncol 19 (1): 99-108, 2017. [PUBMED Abstract]
- McGowan JP, Shah S: Long-term remission of AIDS-related primary central nervous system lymphoma associated with highly active antiretroviral therapy. AIDS 12 (8): 952-4, 1998. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (11/14/2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del linfoma relacionado con el SIDA. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del linfoma relacionado con el SIDA son:
- Eric J. Seifter, MD (Johns Hopkins University)
- Minh Tam Truong, MD (Boston University Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del linfoma relacionado con el SIDA. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/linfoma/pro/tratamiento-relacionado-sida-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.