Tratamiento de los tumores de células germinativas del sistema nervioso central infantil (PDQ®)–Versión para profesionales de salud
Información general sobre los tumores de células germinativas del sistema nervioso central infantil
Los tumores primarios de encéfalo, como los tumores de células germinativas (TCG), son un grupo diverso de enfermedades que, juntas, constituyen el tumor sólido más frecuente de la niñez. En la clasificación más reciente de la Organización Mundial de la Salud (OMS) de los tumores del sistema nervioso central se adoptaron algunos parámetros moleculares, además de las características histológicas, para definir las entidades de los tumores de encéfalo.[1,2] Algunos tipos de tumores del SNC, como los tumores embrionarios y los gliomas, se organizan de acuerdo con la caracterización molecular. Sin embargo, este esquema de clasificación actualizado aún no categoriza los TCG intracraneales utilizando parámetros moleculares. La localización del tumor y la extensión de la enfermedad (invasión encefálica y diseminación tumoral), así como el tipo histológico de los TCG del SNC, siguen siendo factores importantes que afectan el tratamiento y el pronóstico.
A grandes rasgos, los TCG del SNC se clasifican en tumores de células germinativas germinomatosos (comúnmente denominados germinomas) y no germinomatosos (TCGNG) de acuerdo con las características clinicopatológicas y de laboratorio, como los marcadores tumorales.[2,3] En otra clasificación terapéutica en Japón se diferencian 3 grupos a partir del pronóstico: pronóstico favorable (por ejemplo, germinoma), pronóstico intermedio (por ejemplo, teratoma inmaduro con transformación maligna) y pronóstico precario (por ejemplo, tumor del saco vitelino, coriocarcinoma, carcinoma embrionario y tumores con mezcla de estas entidades).[3]
Los resúmenes de tratamiento del PDQ sobre los tumores de encéfalo infantiles se organizan principalmente de acuerdo con la clasificación de tumores del sistema nervioso central establecida por la OMS.[1-3] Para obtener una descripción completa de la clasificación de los tumores del SNC y un enlace al resumen de tratamiento correspondiente de cada tipo de tumor de encéfalo, consultar el Resumen de la clasificación de los tumores de encéfalo y médula espinal infantiles.
Incidencia
En los países occidentales, los TCG representan entre el 3 % y el 4 % de los tumores cerebrales primarios en niños, con una incidencia máxima de los 10 y los 19 años.[4,5] En una serie realizada en Japón y otros países asiáticos, se notificó que la incidencia de los TCG del SNC era de alrededor el 15 % de todos los tumores pediátricos del SNC.[5-9] Se desconocen las causas genéticas o ambientales de estas diferencias.
En general, los hombres tienen una mayor incidencia de TCG que las mujeres. Los pacientes varones presentan un predominio de tumores primarios de la región pineal.[10,11] Sin embargo, no se observa que haya un predominio de varones entre los pacientes de 10 años o menos en el momento del diagnóstico.[12]
Características anatómicas
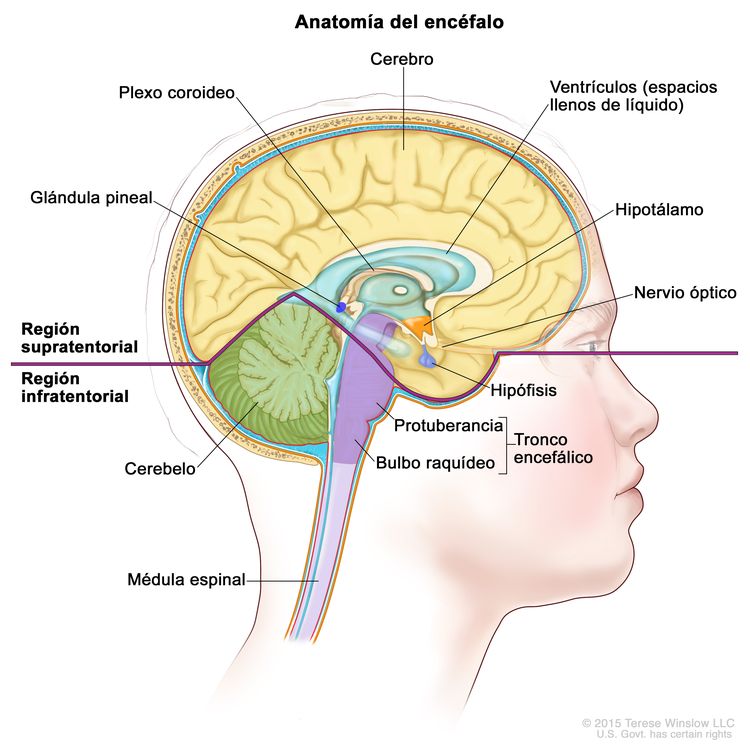
Por lo general, los TCG del SNC aparecen en las regiones pineal o supraselar del encéfalo como lesiones solitarias o múltiples (consultar la Figura 1). El sitio más común de origen es la región pineal (45 %), y el segundo es la región supraselar (30 %) dentro del infundíbulo o el tallo hipofisario. Ambos sitios se consideran localizaciones del SNC extraxiales o no parenquimatosas. Alrededor del 5 % al 10 % de los pacientes presentan tumores sincrónicos que surgen en ambas ubicaciones, supraselar y pineal. El germinoma es el tipo histológico que se observa con más frecuencia.[8] Es posible que otros sitios comprometidos sean los núcleos basales, el tálamo y, con menor frecuencia, los ventrículos, los hemisferios cerebrales y el tronco encefálico.[10,11,13] Los tumores supraselares son más comunes en los pacientes jóvenes, mientras que los de presentación pineal o bifocal son más frecuentes en pacientes de más edad.[12]
Características clínicas
Los signos y síntomas de los TCG del SNC dependen de la localización del tumor en el encéfalo, según se describe a continuación:
- Región supraselar. Los pacientes con tumores que surgen en la región supraselar a menudo presentan deficiencias hormonales sutiles o manifiestas, y es posible que tengan pródromos prolongados que duran meses o años. La diabetes insípida provocada por la deficiencia de la hormona antidiurética se presenta en entre el 70 % y el 90 % de los pacientes y es el síntoma centinela más común. Los pacientes suelen compensar esta deficiencia bebiendo cantidades excesivas de líquido durante meses o años. Con el tiempo, surgen otros síntomas hormonales y defectos visuales a medida que el tumor se expande a nivel dorsal y comprime o invade el quiasma óptico, u ocupa el tercer ventrículo y produce hidrocefalia.[14-16]
- Región pineal. Por lo general, los pacientes con tumores en la región pineal tienen antecedentes de síntomas de menor duración que los pacientes con tumores de la región supraselar o la región ganglionar basal: semanas a meses de síntomas como aumento de la presión intracraneal y diplopía relacionada con compresión del techo y del acueducto. Los síntomas y signos distintivos de masas ubicadas en la región pineal y la región posterior del tercer ventrículo incluyen el síndrome de Parinaud (deterioro de la visión vertical, nistagmo de convergencia y disociación pupilar luz-proximidad), cefalea, náuseas y vómitos.
- Tumores bifocales. Los pacientes con tumores primarios bifocales presentan lesiones metasincrónicas en las regiones supraselar y pineal.[15] La lesión secundaria suele ser asintomática y se encuentra mediante imágenes por resonancia magnética (IRM). En los niños con tumores primarios pineales, la lesión supraselar quizás también se relacione con una pubertad precoz inexplicable.
Los síntomas inespecíficos, como la enuresis, la anorexia y las alteraciones psiquiátricas,[17] tal vez causen retrasos en el diagnóstico. Sin embargo, los signos de aumento de la presión intracraneal o los cambios visuales casi siempre resultan en un diagnóstico más temprano.[18]
Evaluación diagnóstica y factores pronósticos
Las características radiográficas de los TCG del SNC no permiten diferenciar de manera confiable los germinomas de los TCGNG u otros tumores del SNC. El diagnóstico de los TCG se basa en los siguientes aspectos:
- Signos y síntomas clínicos característicos confirmados con neuroimágenes.
- Análisis de marcadores de TCG en el suero y el líquido cefalorraquídeo (LCR).
- Características histológicas, si fuera necesario.
El diagnóstico de un presunto TCG del SNC, así como la evaluación de las alteraciones clínicas y la extensión de las metástasis por lo general se confirman mediante las siguientes pruebas:
- IRM del encéfalo y la columna vertebral con y sin gadolinio.
- Medición en el suero y el LCR de la alfafetoproteína (AFP) y la subunidad β de la gonadotropina coriónica humana (GCH-ß), y citología, si es necesario. Si es posible obtener de manera inocua LCR antes de la cirugía y los marcadores tumorales están elevados, entonces es posible que no se necesite una confirmación histológica. Antes de comenzar el tratamiento definitivo, se debe hacer una evaluación citológica y de marcadores tumorales en el LCR lumbar, siempre y cuando sea inocua, con el fin de confirmar el diagnóstico y ayudar a vigilar la respuesta y el control del tratamiento. La utilidad diagnóstica del LCR lumbar está mejor validada y es más confiable que la obtenida de los ventrículos (consultar el Cuadro 1).[18,19]
- Evaluación del funcionamiento hipofisario e hipotalámico.
- Exámenes del campo y agudeza visual para tumores supraselares o hipotalámicos.
Si es posible, se debe hacer un examen neuropsicológico inicial después de que se resuelvan los síntomas de insuficiencia endocrina y el aumento de la presión intracraneal.
El diagnóstico y la clasificación de los TCG del SNC se establece de acuerdo con las características histológicas solas, los marcadores tumorales solos o una combinación de ambos.[19-21] El diagnóstico de los TCG a menudo exige una biopsia tumoral, excepto cuando hay características de imagen presente y un aumento de los marcadores tumorales (por lo común AFP y GCH-ß) en el suero o el LCR. Los marcadores tumorales AFP y GCH-β son los más útiles, aunque se están investigando otros marcadores, como la fosfatasa alcalina placentaria y el c-kit (consultar el Cuadro 1). Es necesario hacer una biopsia endoscópica o abierta para obtener un diagnóstico definitivo cuando los marcadores tumorales son negativos o están un poco elevados, pero por debajo de los criterios diagnósticos, o si se observa algún hallazgo anormal.
La diferenciación entre los diferentes tipos de TCG solo mediante el uso de las concentraciones de los marcadores de proteínas en el LCR es algo arbitraria y los estándares varían entre continentes. Los pacientes con germinomas y teratomas puros por lo general no tienen alteraciones en los marcadores durante la presentación inicial, pero se pueden detectar concentraciones bajas de GCH-β en los pacientes con germinomas.[22] En la actualidad, los esfuerzos internacionales se dirigen a determinar un umbral de marcadores para los germinomas secretores de GCH-ß porque los datos indican que las concentraciones de GCH-ß que se utilizan para distinguir los germinomas de los TCGNG (50 UI/l en Europa y 100 UI/l en América del Norte) son cuestionables.
El uso de marcadores tumorales y características histológicas en los ensayos clínicos de TCG está en desarrollo. Por ejemplo, en el ensayo COG-ACNS1123 (NCT01602666), los pacientes que presentaban alguna de las siguientes características eran aptos para la asignación al régimen de germinoma sin confirmación por biopsia:
- Tumores primarios en las regiones pineal o supraselar, concentraciones normales de AFP y concentraciones de GCH-β entre 5 UI/l y 50 UI/l en el suero o el LCR.
- Compromiso bifocal (pineal y supraselar) o lesiones pineales con diabetes insípida, concentraciones normales de AFP y concentraciones de GCH-ß de 100 UI/l o inferiores en el suero o el LCR.
| Tipo de tumor | GCH-β | AFP | FAP | c-kit | |
|---|---|---|---|---|---|
| AFP = alfafetoproteína; GCH = gonadotropina coriónica humana; FAP = fosfatasa alcalina placentaria; + = positivo; +++ = muy elevado (positivo); - = negativo; ± = equívoco. | |||||
| Germinoma | ± | - | ± | + | |
| Germinoma (sincitiotrofoblástico) | + | - | ± | + | |
| Carcinoma embrionario | ± | + | ± | - | |
| Tumor de saco vitelino | - | +++ | ± | - | |
| Coriocarcinoma | +++ | - | ± | - | |
| Teratoma | |||||
| Teratoma inmaduro | ± | ± | - | ± | |
| Teratoma inmaduro con componentes malignos | ± | + | + | ± | |
| Teratoma maduro | - | - | - | - | |
| Tumor mixto de células germinativas | ± | ± | ± | ± | |
También existe una iniciativa que defiende el uso de los marcadores tumorales para determinar el pronóstico a partir de la presencia y grado de elevación de la AFP y la GCH-β. Este proceso está en desarrollo; grupos cooperativos de América del Norte, Europa y Japón han adoptado criterios algo diferentes.[23]
Grupos como el Japanese Pediatric Brain Tumor Study Group han propuesto esquemas de clasificación alternativos para los TCG del SNC. Tal y como se muestra en el Cuadro 2, este grupo fundamentó su estratificación en el agrupamiento pronóstico de las diferentes variantes histológicas.[9]
| Grupo pronóstico | Tipo de tumor |
|---|---|
| Favorable | Germinoma, puro |
| Teratoma maduro | |
| Intermedio | Germinoma con células gigantes sincitiotrofoblásticas |
| Teratoma inmaduro | |
| Tumores mixtos, compuestos sobre todo por germinoma o teratoma | |
| Teratoma con transformación maligna | |
| Precario | Coriocarcinoma |
| Carcinoma embrionario | |
| Tumores mixtos compuestos sobre todo por coriocarcinoma, tumor de saco vitelino o carcinoma embrionario | |
| Tumor de saco vitelino |
Es muy importante hacer una estadificación adecuada y diferenciar los germinomas de los TCGNG. Los planes de quimioterapia y radioterapia difieren de modo importante según la categoría de TCG y la extensión de la enfermedad.
Clasificación celular y molecular
Se desconoce la etiopatogenia de los TCG intracraneales. En la teoría de las células germinativas, se argumenta que los TCG del SNC surgen de las células germinativas primordiales que migraron de forma anormal y sufrieron una transformación maligna. Un estudio con identificación de la metilación de genoma completo de 61 TCG refuerza esta hipótesis.[24] En estudios moleculares anteriores, en los que se compararon las alteraciones genómicas de los TCG, se observaron alteraciones similares en el número de copias en los TCG del SNC y en los TCG de origen sistémico.[25]
En otra hipótesis, la teoría de las células embrionarias, se propone que los TCG surgen de una célula embrionaria pluripotente que escapa a las señales de desarrollo normales y progresa hasta convertirse en un TCG del SNC.[26,27]
La OMS clasificó los TCG del SNC en los siguientes grupos:[1,2]
- Germinoma.
- TCG no germinomatosos.
- Carcinoma embrionario.
- Tumor de saco vitelino.
- Coriocarcinoma.
- Teratoma.
- Teratoma maduro.
- Teratoma inmaduro.
- Teratoma con malignidad de tipo somático.
- TCG mixto.
Es posible que los TCGNG consistan en un tipo de TCGNG maligno o que contengan múltiples elementos de componentes de TCG, como constituyentes teratomatosos o germinomatosos.
Se identificaron variantes recurrentes de KIT, genes de la vía MAPK y genes de la vía de señalización PI3K/mTOR en los TCG del SNC.[28-30]
En un análisis retrospectivo de 82 niños y adultos con TCG del SNC, la alteración cromosómica de número de copias más frecuente fue la ganancia del cromosoma 12p. Esta alteración fue más común en los pacientes con TCGNG (20 de 40, 50 %) que en los que presentaban germinomas (5 de 42, 12 %). La ganancia del cromosoma 12p se asoció a una supervivencia peor en los pacientes con TCGNG (tasa de supervivencia general a 10 años, 47 % para los pacientes con ganancia del cromosoma 12p vs. 90 % para los pacientes sin ganancia del cromosoma 12p; P = 0,02).[31]
La hipometilación global que refleja las células germinativas primordiales en la presentación temprana también se ha observado en los TCG del SNC.[30]
En una evaluación de 21 casos de germinomas del SNC, diagnosticados entre los años 2000 y 2016, se evaluó la expresión del ligando de la proteína de muerte programada 1 (PD-L1) y de la proteína de muerte programada 1 (PD-1) mediante una prueba inmunohistoquímica. El 90 % de los germinomas tenían componentes de células germinativas positivas para PD-L1. Además, los linfocitos relacionados con el tumor resultaron positivos para PD-L1 en más del 75 % de los casos.[32]
Bibliografía
- Louis DN, Perry A, Wesseling P, et al.: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 23 (8): 1231-1251, 2021. [PUBMED Abstract]
- WHO Classification of Tumours Editorial Board, ed.: WHO Classification of Tumours: Central Nervous System Tumours. Vol. 6. 5th ed. IARC Press; 2021.
- Louis DN, Ohgaki H, Wiestler OD: WHO Classification of Tumours of the Central Nervous System. 4th rev.ed. IARC Press, 2016.
- Matsutani M, Sano K, Takakura K, et al.: Primary intracranial germ cell tumors: a clinical analysis of 153 histologically verified cases. J Neurosurg 86 (3): 446-55, 1997. [PUBMED Abstract]
- Ostrom QT, Gittleman H, Liao P, et al.: CBTRUS Statistical Report: Primary brain and other central nervous system tumors diagnosed in the United States in 2010-2014. Neuro Oncol 19 (suppl_5): v1-v88, 2017. [PUBMED Abstract]
- Committee of Brain Tumor Registry of Japan: Report of Brain Tumor Registry of Japan (1969-1996). Neurol Med Chir (Tokyo) 43 (Suppl): i-vii, 1-111, 2003. [PUBMED Abstract]
- The Committee of Brain Tumor Registry of Japan: Brain Tumor Registry of Japan (2001–2004). Neurol Med Chir (Tokyo) 54 (Suppl): 1-102, 2014. Also available online. Last accessed August 21, 2023.
- Weksberg DC, Shibamoto Y, Paulino AC: Bifocal intracranial germinoma: a retrospective analysis of treatment outcomes in 20 patients and review of the literature. Int J Radiat Oncol Biol Phys 82 (4): 1341-51, 2012. [PUBMED Abstract]
- Matsutani M; Japanese Pediatric Brain Tumor Study Group: Combined chemotherapy and radiation therapy for CNS germ cell tumors--the Japanese experience. J Neurooncol 54 (3): 311-6, 2001. [PUBMED Abstract]
- Goodwin TL, Sainani K, Fisher PG: Incidence patterns of central nervous system germ cell tumors: a SEER Study. J Pediatr Hematol Oncol 31 (8): 541-4, 2009. [PUBMED Abstract]
- Villano JL, Propp JM, Porter KR, et al.: Malignant pineal germ-cell tumors: an analysis of cases from three tumor registries. Neuro Oncol 10 (2): 121-30, 2008. [PUBMED Abstract]
- Koh KN, Wong RX, Lee DE, et al.: Outcomes of intracranial germinoma-A retrospective multinational Asian study on effect of clinical presentation and differential treatment strategies. Neuro Oncol 24 (8): 1389-1399, 2022. [PUBMED Abstract]
- Graham RT, Abu-Arja MH, Stanek JR, et al.: Multi-institutional analysis of treatment modalities in basal ganglia and thalamic germinoma. Pediatr Blood Cancer 68 (10): e29172, 2021. [PUBMED Abstract]
- Kilday JP, Laughlin S, Urbach S, et al.: Diabetes insipidus in pediatric germinomas of the suprasellar region: characteristic features and significance of the pituitary bright spot. J Neurooncol 121 (1): 167-75, 2015. [PUBMED Abstract]
- Hoffman HJ, Otsubo H, Hendrick EB, et al.: Intracranial germ-cell tumors in children. J Neurosurg 74 (4): 545-51, 1991. [PUBMED Abstract]
- Sethi RV, Marino R, Niemierko A, et al.: Delayed diagnosis in children with intracranial germ cell tumors. J Pediatr 163 (5): 1448-53, 2013. [PUBMED Abstract]
- Malbari F, Gershon TR, Garvin JH, et al.: Psychiatric manifestations as initial presentation for pediatric CNS germ cell tumors, a case series. Childs Nerv Syst 32 (8): 1359-62, 2016. [PUBMED Abstract]
- Crawford JR, Santi MR, Vezina G, et al.: CNS germ cell tumor (CNSGCT) of childhood: presentation and delayed diagnosis. Neurology 68 (20): 1668-73, 2007. [PUBMED Abstract]
- Allen J, Chacko J, Donahue B, et al.: Diagnostic sensitivity of serum and lumbar CSF bHCG in newly diagnosed CNS germinoma. Pediatr Blood Cancer 59 (7): 1180-2, 2012. [PUBMED Abstract]
- Rosenblum MK, Nakazato Y, Matsutani M: Germ cell tumours. In: Louis DN, Ohgaki H, Wiestler OD: WHO Classification of Tumours of the Central Nervous System. 4th rev.ed. IARC Press, 2016, pp 286-91.
- Murray MJ, Bartels U, Nishikawa R, et al.: Consensus on the management of intracranial germ-cell tumours. Lancet Oncol 16 (9): e470-e477, 2015. [PUBMED Abstract]
- Frazier AL, Olson TA, Schneider DT, et al.: Germ cell tumors. In: Pizzo PA, Poplack DG, eds.: Principles and Practice of Pediatric Oncology. 7th ed. Lippincott Williams and Wilkins, 2015, pp 899-918.
- Calaminus G, Bamberg M, Harms D, et al.: AFP/beta-HCG secreting CNS germ cell tumors: long-term outcome with respect to initial symptoms and primary tumor resection. Results of the cooperative trial MAKEI 89. Neuropediatrics 36 (2): 71-7, 2005. [PUBMED Abstract]
- Fukushima S, Yamashita S, Kobayashi H, et al.: Genome-wide methylation profiles in primary intracranial germ cell tumors indicate a primordial germ cell origin for germinomas. Acta Neuropathol 133 (3): 445-462, 2017. [PUBMED Abstract]
- Schneider DT, Zahn S, Sievers S, et al.: Molecular genetic analysis of central nervous system germ cell tumors with comparative genomic hybridization. Mod Pathol 19 (6): 864-73, 2006. [PUBMED Abstract]
- Sano K, Matsutani M, Seto T: So-called intracranial germ cell tumours: personal experiences and a theory of their pathogenesis. Neurol Res 11 (2): 118-26, 1989. [PUBMED Abstract]
- Teilum G: Embryology of ovary, testis, and genital ducts. In: Teilum G: Special Tumors of Ovary and Testis and Related Extragonadal Lesions: Comparative Pathology and Histological Identification. J. B. Lippincott, 1976, pp 15-30.
- Wang L, Yamaguchi S, Burstein MD, et al.: Novel somatic and germline mutations in intracranial germ cell tumours. Nature 511 (7508): 241-5, 2014. [PUBMED Abstract]
- Takami H, Fukuoka K, Fukushima S, et al.: Integrated clinical, histopathological, and molecular data analysis of 190 central nervous system germ cell tumors from the iGCT Consortium. Neuro Oncol 21 (12): 1565-1577, 2019. [PUBMED Abstract]
- Schulte SL, Waha A, Steiger B, et al.: CNS germinomas are characterized by global demethylation, chromosomal instability and mutational activation of the Kit-, Ras/Raf/Erk- and Akt-pathways. Oncotarget 7 (34): 55026-55042, 2016. [PUBMED Abstract]
- Satomi K, Takami H, Fukushima S, et al.: 12p gain is predominantly observed in non-germinomatous germ cell tumors and identifies an unfavorable subgroup of central nervous system germ cell tumors. Neuro Oncol 24 (5): 834-846, 2022. [PUBMED Abstract]
- Wildeman ME, Shepard MJ, Oldfield EH, et al.: Central Nervous System Germinomas Express Programmed Death Ligand 1. J Neuropathol Exp Neurol 77 (4): 312-316, 2018. [PUBMED Abstract]
Información sobre los estadios de los tumores de células germinativas del sistema nervioso central infantil
Si bien no existe ningún sistema de estadificación aceptado en todo el mundo para los tumores de células germinativas (TCG), tradicionalmente se ha utilizado un sistema de estadificación de Chang modificado.[1] La evaluación para la estadificación de los TCG del sistema nervioso central (SNC) incluye los siguientes procedimientos:
- Imágenes por resonancia magnética (IRM). Además de las IRM de todo el encéfalo, se necesitan IRM de la columna vertebral.
- Líquido cefalorraquídeo (LCR) lumbar. Siempre que sea admisible desde el punto de vista médico, se debe obtener LCR lumbar para medir los marcadores tumorales (alfafetoproteína [AFP] y subunidad β de la gonadotropina coriónica humana [GCH-β]) y para la revisión citopatológica.
Se obtienen marcadores tumorales ventriculares para la AFP y la GCH-ß si hay una hidrocefalia obstructiva y es necesaria una derivación de LCR. Sin embargo, el LCR ventricular no sustituye la estadificación del tumor mediante LCR lumbar ni la revisión citopatológica. Deben obtenerse marcadores tumorales en el suero y en el LCR para la evaluación diagnóstica y la estadificación exhaustiva.[2]
Los pacientes con enfermedad localizada y citología de LCR negativa se clasifican como M0 (sin metástasis). Los pacientes con citología de LCR positiva o los pacientes con metástasis en gota (metástasis subaracnoideas espinales o craneales) se clasifican como M+ (metastásicos). Una estadificación adecuada es crucial porque los pacientes con enfermedad metastásica requieren campos de radiación ampliados.
Es posible que los TCG ya se hayan diseminado por todo el neuroeje en el momento del diagnóstico o en cualquier estadio de la enfermedad. Los germinomas en ocasiones presentan varios patrones de diseminación, como la diseminación subependimaria en los ventrículos laterales o en el tercer ventrículo, y la infiltración parenquimatosa. La diseminación extracraneal a pulmones o huesos es rara, pero se ha notificado.[3,4]
Bibliografía
- Calaminus G, Kortmann R, Worch J, et al.: SIOP CNS GCT 96: final report of outcome of a prospective, multinational nonrandomized trial for children and adults with intracranial germinoma, comparing craniospinal irradiation alone with chemotherapy followed by focal primary site irradiation for patients with localized disease. Neuro Oncol 15 (6): 788-96, 2013. [PUBMED Abstract]
- Fujimaki T, Mishima K, Asai A, et al.: Levels of beta-human chorionic gonadotropin in cerebrospinal fluid of patients with malignant germ cell tumor can be used to detect early recurrence and monitor the response to treatment. Jpn J Clin Oncol 30 (7): 291-4, 2000. [PUBMED Abstract]
- Jennings MT, Gelman R, Hochberg F: Intracranial germ-cell tumors: natural history and pathogenesis. J Neurosurg 63 (2): 155-67, 1985. [PUBMED Abstract]
- Gay JC, Janco RL, Lukens JN: Systemic metastases in primary intracranial germinoma. Case report and literature review. Cancer 55 (11): 2688-90, 1985. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento de los tumores de células germinativas del sistema nervioso central infantil
Los teratomas, germinomas y otros tumores de células germinativas no germinomatosos (TCGNG) tienen pronósticos diferentes y requieren distintos regímenes de tratamiento. En los estudios, se observaron los siguientes aspectos:[1-5]
- Para los niños mayores de 3 años y los adultos, la radioterapia ha sido un componente importante del tratamiento para los germinomas y los TCGNG, si bien se debaten las dosis y los campos de irradiación óptimos.
- Los tumores de células germinativas (TCG) del sistema nervioso central (SNC), similares a los TCG gonadales y extragonadales, han mostrado sensibilidad a la quimioterapia.
- Los germinomas son tumores muy quimiosensibles y radiosensibles. Son curables con irradiación craneoespinal y refuerzo de radioterapia dirigida al sitio local solo. Sin embargo, el uso de quimioterapia neoadyuvante o previa a la irradiación permite reducir las dosis y los volúmenes de radioterapia y, como consecuencia, disminuyen los efectos a largo plazo relacionados con la radioterapia.
- En América del Norte y Europa, los pacientes con germinomas localizados se tratan de manera eficaz con irradiación dirigida a todo el ventrículo complementada con refuerzo de radioterapia en el sitio tumoral. La irradiación focal dirigida al lecho tumoral, con independencia de la respuesta a la quimioterapia, se considera un tratamiento inadecuado.[6]
- El uso combinado de quimioterapia neoadyuvante más intensiva seguida de irradiación craneoespinal o localizada para los TCGNG se ha traducido en tasas de supervivencia excelentes durante la última década.[5,7,8]
- Los pacientes con TCG intracraneales bifocales limitados a las regiones supraselar y pineal se trataron de la misma manera que los pacientes con tumores localizados no metastásicos en estudios en América del Norte y Europa.[8]
En el Cuadro 3 se describen las opciones de tratamiento para pacientes con TCG del SNC infantil recién diagnosticados y recidivantes.
| Grupo de tratamiento | Opciones de tratamiento | |
|---|---|---|
| Germinomas del sistema nervioso central infantil recién diagnosticados | Quimioterapia neoadyuvante seguida de radioterapia según la respuesta | |
| Radioterapia | ||
| Tumores de células germinativas no germinomatosos del sistema nervioso central infantil recién diagnosticados | Quimioterapia seguida de radioterapia | |
| Cirugía, si la respuesta a la quimioterapia es incompleta antes de la irradiación | ||
| Teratomas del sistema nervioso central infantil recién diagnosticados | Resección macroscópica total | |
| Tumores de células germinativas del sistema nervioso central infantil recidivantes | Quimioterapia seguida de radioterapia adicional | |
| Quimioterapia de dosis alta con rescate de células madre y con radioterapia adicional o sin esta | ||
Se han logrado mejoras notables en la supervivencia de niños y adolescentes con cáncer. Entre 1975 y 2010, la mortalidad por cáncer infantil disminuyó en más de un 50 %.[9] Los niños y adolescentes sobrevivientes de cáncer necesitan un seguimiento minucioso, ya que es posible que los efectos secundarios del tratamiento del cáncer persistan o se presenten meses o años después de este. Para obtener información sobre la incidencia, el tipo y la vigilancia de los efectos tardíos en los niños y adolescentes sobrevivientes de cáncer, consultar Efectos tardíos del tratamiento anticanceroso en la niñez.
Bibliografía
- Osuka S, Tsuboi K, Takano S, et al.: Long-term outcome of patients with intracranial germinoma. J Neurooncol 83 (1): 71-9, 2007. [PUBMED Abstract]
- Allen JC, Kim JH, Packer RJ: Neoadjuvant chemotherapy for newly diagnosed germ-cell tumors of the central nervous system. J Neurosurg 67 (1): 65-70, 1987. [PUBMED Abstract]
- Kellie SJ, Boyce H, Dunkel IJ, et al.: Primary chemotherapy for intracranial nongerminomatous germ cell tumors: results of the second international CNS germ cell study group protocol. J Clin Oncol 22 (5): 846-53, 2004. [PUBMED Abstract]
- Calaminus G, Kortmann R, Worch J, et al.: SIOP CNS GCT 96: final report of outcome of a prospective, multinational nonrandomized trial for children and adults with intracranial germinoma, comparing craniospinal irradiation alone with chemotherapy followed by focal primary site irradiation for patients with localized disease. Neuro Oncol 15 (6): 788-96, 2013. [PUBMED Abstract]
- Fangusaro J, Wu S, MacDonald S, et al.: Phase II Trial of Response-Based Radiation Therapy for Patients With Localized CNS Nongerminomatous Germ Cell Tumors: A Children's Oncology Group Study. J Clin Oncol 37 (34): 3283-3290, 2019. [PUBMED Abstract]
- Joo JH, Park JH, Ra YS, et al.: Treatment outcome of radiation therapy for intracranial germinoma: adaptive radiation field in relation to response to chemotherapy. Anticancer Res 34 (10): 5715-21, 2014. [PUBMED Abstract]
- Goldman S, Bouffet E, Fisher PG, et al.: Phase II Trial Assessing the Ability of Neoadjuvant Chemotherapy With or Without Second-Look Surgery to Eliminate Measurable Disease for Nongerminomatous Germ Cell Tumors: A Children's Oncology Group Study. J Clin Oncol 33 (22): 2464-71, 2015. [PUBMED Abstract]
- Calaminus G, Frappaz D, Kortmann RD, et al.: Outcome of patients with intracranial non-germinomatous germ cell tumors-lessons from the SIOP-CNS-GCT-96 trial. Neuro Oncol 19 (12): 1661-1672, 2017. [PUBMED Abstract]
- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014. [PUBMED Abstract]
Tratamiento de los germinomas del sistema nervioso central infantil recién diagnosticados
Las opciones de tratamiento de los germinomas del sistema nervioso central (SNC) infantil recién diagnosticados son las siguientes:
Quimioterapia neoadyuvante seguida de radioterapia según la respuesta
Se analizó la quimioterapia para reducir las dosis de radioterapia y la morbilidad relacionada con el desarrollo neurológico. En varios estudios se confirmó la viabilidad de este abordaje para mantener tasas de supervivencia excelentes.[1-4][Nivel de evidencia B4]; [5-8][Nivel de evidencia C1]
Los fármacos quimioterapéuticos, como ciclofosfamida, ifosfamida, etopósido, cisplatino y carboplatino, son muy activos ante los germinomas del SNC. Es posible que el tratamiento de los pacientes que reciben fármacos quimioterapéuticos para los que se necesita hiperhidratación (por ejemplo, ciclofosfamida, ifosfamida y cisplatino) sea complicado debido a la posibilidad de que los pacientes con tumores primarios en la región supraselar presenten diabetes insípida.[9]
Un grupo internacional de investigadores analizó un abordaje con quimioterapia sola, sobre todo para niños más pequeños. Se logró una respuesta completa en el 84 % de los pacientes con germinomas que recibieron quimioterapia sola. Sin embargo, el 50 % de estos pacientes presentaron recaída o progresión tumoral. Muchas recidivas fueron locales, locales y ventriculares, y ventriculares solas, o con diseminación leptomeníngea en todo el SNC, por lo que se necesitó tratamiento adicional, incluso radiación.[10]
En estudios posteriores, se continuó respaldando la necesidad de administrar radioterapia después de la quimioterapia y la probable necesidad de irradiación dirigida a todo el ventrículo (24 Gy) con radioterapia local de refuerzo dirigida al sitio del tumor (dosis total, 40 Gy).[11][Nivel de evidencia B4]; [12][Nivel de evidencia C1] También se notificaron resultados excelentes en pacientes con germinomas metastásicos que se sometieron a irradiación craneoespinal con 24 Gy y radioterapia local de refuerzo dirigida al sitio del tumor (dosis total, 40 Gy).[1][Nivel de evidencia B4]; [13]
El tratamiento óptimo de las lesiones bifocales no está tan claro, aunque la mayoría de los investigadores considera que este tipo de cuadro clínico inicial es una forma de enfermedad primaria metacrónica que se debe estadificar como M0. En un metanálisis con 60 pacientes, se demostró una supervivencia sin progresión excelente después de irradiación craneoespinal sola. La administración de quimioterapia y radioterapia localizada, incluso la irradiación dirigida a todo al ventrículo, también produjo un control excelente de la enfermedad.[14][Nivel de evidencia C2] Para los germinomas que surgen fuera de la región pineal o supraselar, la eficacia del tratamiento, tal como se utiliza para las lesiones pineales o supraselares, no está bien delimitada. Sin embargo, una revisión retrospectiva de 47 pacientes con tumores de los ganglios basales y talámicos notificó tasas de supervivencia sin progresión (SSP) y de supervivencia general (SG) similares a las notificadas en pacientes con tumores que surgieron en zonas más comunes del encéfalo.[15]
Se notificaron los resultados del ensayo de fase II (estrato 2) ACNS1123 (NCT01602666) en el que se investigó el uso de radioterapia según la respuesta para los germinomas localizados. Los pacientes tenían entre 3 y 21 años. Los pacientes que presentaron una respuesta completa a la quimioterapia con carboplatino y etopósido recibieron 18 Gy de irradiación en todo el ventrículo y un refuerzo de 12 Gy en el lecho del tumor. Los pacientes que tuvieron una respuesta parcial recibieron 24 Gy de irradiación en todo el ventrículo y un refuerzo de 12 Gy en el lecho del tumor. El funcionamiento cognitivo longitudinal se evaluó de manera prospectiva. Hubo 137 pacientes aptos. De 90 pacientes que se pudieron evaluar, 74 se trataron con 18 Gy de irradiación, y 16 se trataron con 24 Gy de irradiación dirigida a todo el ventrículo.[16]
- En el estudio no se logró demostrar la ausencia de inferioridad del régimen de 18 Gy de irradiación dirigida a todo el ventrículo, en comparación con el umbral especificado para el estudio de una tasa de SSP a 3 años del 95 %. Se dificultó la interpretación del análisis al incluir a cualquier paciente que no se pudiera evaluar por progresión a los 3 años como fracaso del tratamiento, lo que produjo una tasa de SSP del 86 %. Si se hubiese excluido a estos pacientes que no se podían evaluar, el cálculo de la SSP a 3 años en la cohorte de 18 Gy, según Kaplan-Meier, hubiera sido del 94,5 % (± 2,7 %).
- En conjunto, la media estimada de coeficiente intelectual, atención y concentración estaban dentro del intervalo normal. Se observó una media más baja para el puntaje de atención a los 9 meses en los pacientes que se trataron con 24 Gy de radiación. Se observaron efectos graves sobre la velocidad de procesamiento a los 9 meses en pacientes que se trataron con 18 Gy; esto mejoró en la evaluación de los 30 meses. Sin embargo, el tamaño de la muestra fue pequeño y no tuvo en cuenta las variables que dificultaban la interpretación como complicaciones quirúrgicas, hidrocefalia y escasos datos de seguimiento a largo plazo.
- Ninguno de los pacientes evaluables tuvo una recaída dentro del campo ventricular ni en la región del tumor primario. Los 4 casos de progresión de la enfermedad ocurrieron fuera del campo de radiación, al cabo de una mediana de tiempo de 8,91 meses después de la radioterapia.
- De las 8 recaídas, 3 se presentaron en el recorrido de la biopsia.
- La enfermedad residual al final del tratamiento no se relacionó con un pronóstico más precario.
En otros estudios se ha apoyado este abordaje y se han notificado desenlaces excelentes en niños con germinomas del SNC.[17,18]
Radioterapia
Los germinomas del SNC son muy radiosensibles y tradicionalmente se han tratado de manera eficaz con radioterapia sola. Se suele tratar a los pacientes con enfermedad no diseminada mediante irradiación craneoespinal y un refuerzo dirigido a la región del tumor primario. La dosis de irradiación craneoespinal ha oscilado entre 24 Gy y 36 Gy, si bien en los estudios se han usado dosis más bajas. La dosis de radioterapia dirigida al tumor local ha oscilado entre 40 Gy y 50 Gy. En los estudios se observaron desenlaces excelentes con dosis bajas de irradiación craneoespinal.[19] Esta modificación produjo tasas de SG a 5 años superiores al 90 %.[20]; [21][Nivel de evidencia B4]; [22,23][Nivel de evidencia C1] Estas tasas de supervivencia excelentes permiten que los investigadores se concentren en la reducción del volumen y la dosis de la radioterapia en un intento por disminuir los efectos tardíos.[21,24,25]
Los patrones de recaída después de la irradiación craneoespinal versus la radioterapia de volumen reducido (radioterapia dirigida a todo el encéfalo o todo el ventrículo) apoyan la omisión de la irradiación craneoespinal para los germinomas localizados.[26-28] A partir de estos resultados, el tratamiento de los pacientes con germinomas localizados se modificó para cubrir todo el sistema ventricular (24 Gy), seguido por un refuerzo dirigido al sitio primario (30-40 Gy), en lugar de administrar radioterapia dirigida a todo el eje craneoespinal o incluso a todo el encéfalo. Este cambio no empeoró los desenlaces y se espera que reduzca al mínimo la toxicidad aguda y a largo plazo de la radioterapia. La radioterapia focal dirigida solo al volumen tumoral, incluso después de quimioterapia neoadyuvante, produce recaídas ventriculares; por lo tanto, no se recomienda la radioterapia focal.[25]
Opciones de tratamiento en evaluación clínica para los germinomas del sistema nervioso central infantil recién diagnosticados
Tal vez haya ensayos clínicos terapéuticos de fase inicial para pacientes seleccionados. Es posible que estos ensayos estén disponibles a través del Children’s Oncology Group, el Pediatric Brain Tumor Consortium u otras entidades. La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Bibliografía
- Calaminus G, Kortmann R, Worch J, et al.: SIOP CNS GCT 96: final report of outcome of a prospective, multinational nonrandomized trial for children and adults with intracranial germinoma, comparing craniospinal irradiation alone with chemotherapy followed by focal primary site irradiation for patients with localized disease. Neuro Oncol 15 (6): 788-96, 2013. [PUBMED Abstract]
- Kretschmar C, Kleinberg L, Greenberg M, et al.: Pre-radiation chemotherapy with response-based radiation therapy in children with central nervous system germ cell tumors: a report from the Children's Oncology Group. Pediatr Blood Cancer 48 (3): 285-91, 2007. [PUBMED Abstract]
- Allen JC, DaRosso RC, Donahue B, et al.: A phase II trial of preirradiation carboplatin in newly diagnosed germinoma of the central nervous system. Cancer 74 (3): 940-4, 1994. [PUBMED Abstract]
- Buckner JC, Peethambaram PP, Smithson WA, et al.: Phase II trial of primary chemotherapy followed by reduced-dose radiation for CNS germ cell tumors. J Clin Oncol 17 (3): 933-40, 1999. [PUBMED Abstract]
- Khatua S, Dhall G, O'Neil S, et al.: Treatment of primary CNS germinomatous germ cell tumors with chemotherapy prior to reduced dose whole ventricular and local boost irradiation. Pediatr Blood Cancer 55 (1): 42-6, 2010. [PUBMED Abstract]
- Cheng S, Kilday JP, Laperriere N, et al.: Outcomes of children with central nervous system germinoma treated with multi-agent chemotherapy followed by reduced radiation. J Neurooncol 127 (1): 173-80, 2016. [PUBMED Abstract]
- O'Neil S, Ji L, Buranahirun C, et al.: Neurocognitive outcomes in pediatric and adolescent patients with central nervous system germinoma treated with a strategy of chemotherapy followed by reduced-dose and volume irradiation. Pediatr Blood Cancer 57 (4): 669-73, 2011. [PUBMED Abstract]
- Lee DS, Lim DH, Kim IH, et al.: Upfront chemotherapy followed by response adaptive radiotherapy for intracranial germinoma: Prospective multicenter cohort study. Radiother Oncol 138: 180-186, 2019. [PUBMED Abstract]
- Afzal S, Wherrett D, Bartels U, et al.: Challenges in management of patients with intracranial germ cell tumor and diabetes insipidus treated with cisplatin and/or ifosfamide based chemotherapy. J Neurooncol 97 (3): 393-9, 2010. [PUBMED Abstract]
- Balmaceda C, Heller G, Rosenblum M, et al.: Chemotherapy without irradiation--a novel approach for newly diagnosed CNS germ cell tumors: results of an international cooperative trial. The First International Central Nervous System Germ Cell Tumor Study. J Clin Oncol 14 (11): 2908-15, 1996. [PUBMED Abstract]
- da Silva NS, Cappellano AM, Diez B, et al.: Primary chemotherapy for intracranial germ cell tumors: results of the third international CNS germ cell tumor study. Pediatr Blood Cancer 54 (3): 377-83, 2010. [PUBMED Abstract]
- Alapetite C, Brisse H, Patte C, et al.: Pattern of relapse and outcome of non-metastatic germinoma patients treated with chemotherapy and limited field radiation: the SFOP experience. Neuro Oncol 12 (12): 1318-25, 2010. [PUBMED Abstract]
- Abu-Arja MH, Shatara MS, Okcu MF, et al.: The role of neoadjuvant chemotherapy in the management of metastatic central nervous system germinoma: A meta-analysis. Pediatr Blood Cancer 70 (10): e30601, 2023. [PUBMED Abstract]
- Weksberg DC, Shibamoto Y, Paulino AC: Bifocal intracranial germinoma: a retrospective analysis of treatment outcomes in 20 patients and review of the literature. Int J Radiat Oncol Biol Phys 82 (4): 1341-51, 2012. [PUBMED Abstract]
- Graham RT, Abu-Arja MH, Stanek JR, et al.: Multi-institutional analysis of treatment modalities in basal ganglia and thalamic germinoma. Pediatr Blood Cancer 68 (10): e29172, 2021. [PUBMED Abstract]
- Bartels U, Onar-Thomas A, Patel SK, et al.: Phase II trial of response-based radiation therapy for patients with localized germinoma: a Children's Oncology Group study. Neuro Oncol 24 (6): 974-983, 2022. [PUBMED Abstract]
- Cappellano AM, Dassi N, Mançano B, et al.: Outcome of Children and Adolescents With Primary Intracranial Germinoma Treated With Chemotherapy and Reduced Dose-Field Irradiation: A Prospective Brazilian Experience. JCO Glob Oncol 9: e2200257, 2023. [PUBMED Abstract]
- Li B, Feng J, Chen L, et al.: Relapse pattern and quality of life in patients with localized basal ganglia germinoma receiving focal radiotherapy, whole-brain radiotherapy, or craniospinal irradiation. Radiother Oncol 158: 90-96, 2021. [PUBMED Abstract]
- Bamberg M, Kortmann RD, Calaminus G, et al.: Radiation therapy for intracranial germinoma: results of the German cooperative prospective trials MAKEI 83/86/89. J Clin Oncol 17 (8): 2585-92, 1999. [PUBMED Abstract]
- Shibamoto Y, Abe M, Yamashita J, et al.: Treatment results of intracranial germinoma as a function of the irradiated volume. Int J Radiat Oncol Biol Phys 15 (2): 285-90, 1988. [PUBMED Abstract]
- Cho J, Choi JU, Kim DS, et al.: Low-dose craniospinal irradiation as a definitive treatment for intracranial germinoma. Radiother Oncol 91 (1): 75-9, 2009. [PUBMED Abstract]
- Huang PI, Chen YW, Wong TT, et al.: Extended focal radiotherapy of 30 Gy alone for intracranial synchronous bifocal germinoma: a single institute experience. Childs Nerv Syst 24 (11): 1315-21, 2008. [PUBMED Abstract]
- Eom KY, Kim IH, Park CI, et al.: Upfront chemotherapy and involved-field radiotherapy results in more relapses than extended radiotherapy for intracranial germinomas: modification in radiotherapy volume might be needed. Int J Radiat Oncol Biol Phys 71 (3): 667-71, 2008. [PUBMED Abstract]
- Chen MJ, Santos Ada S, Sakuraba RK, et al.: Intensity-modulated and 3D-conformal radiotherapy for whole-ventricular irradiation as compared with conventional whole-brain irradiation in the management of localized central nervous system germ cell tumors. Int J Radiat Oncol Biol Phys 76 (2): 608-14, 2010. [PUBMED Abstract]
- Joo JH, Park JH, Ra YS, et al.: Treatment outcome of radiation therapy for intracranial germinoma: adaptive radiation field in relation to response to chemotherapy. Anticancer Res 34 (10): 5715-21, 2014. [PUBMED Abstract]
- Rogers SJ, Mosleh-Shirazi MA, Saran FH: Radiotherapy of localised intracranial germinoma: time to sever historical ties? Lancet Oncol 6 (7): 509-19, 2005. [PUBMED Abstract]
- Shikama N, Ogawa K, Tanaka S, et al.: Lack of benefit of spinal irradiation in the primary treatment of intracranial germinoma: a multiinstitutional, retrospective review of 180 patients. Cancer 104 (1): 126-34, 2005. [PUBMED Abstract]
- Hardenbergh PH, Golden J, Billet A, et al.: Intracranial germinoma: the case for lower dose radiation therapy. Int J Radiat Oncol Biol Phys 39 (2): 419-26, 1997. [PUBMED Abstract]
Tratamiento de los tumores de células germinativas no germinomatosos del sistema nervioso central infantil recién diagnosticados
Las opciones de tratamiento de los tumores de células germinativas no germinomatosos (TCGNG) del sistema nervioso central (SNC) infantil recién diagnosticados son las siguientes:
- Quimioterapia seguida de radioterapia.
- Cirugía, para los tumores que responden de manera parcial a la quimioterapia o para los tumores que aumentan de tamaño durante el tratamiento o después (presunto síndrome de teratoma en crecimiento).
El régimen de tratamiento óptimo de los TCGNG del SNC aún no está claro.
El pronóstico para los niños con TCGNG del SNC es más precario que el de los niños con germinomas, pero la diferencia está disminuyendo debido a la incorporación del tratamiento multimodal. Los TCGNG son radiosensibles, pero las tasas de supervivencia de los pacientes después de la irradiación craneoespinal estándar sola han sido precarias: oscilan entre el 20 % y el 45 % a los 5 años.[1] Con los regímenes de tratamiento actuales, las tasas de supervivencia general (SG) de 3 a 5 años para los pacientes con TCGNG oscilan entre el 75 % y el 90 %.[2-4] En los pacientes con TCGNG que sufren recaídas tumorales, la mayoría de estas se presentan en el transcurso de 3 años desde el diagnóstico.[2]
Quimioterapia seguida de radioterapia
El uso de quimioterapia antes de la radioterapia ha aumentado las tasas de supervivencia. Sin embargo, el régimen de quimioterapia específico; la duración de la terapia; y el campo de radiación, el momento y la dosis óptimas siguen siendo objeto de investigación.[1,5,6] Los antineoplásicos que se han usado son el carboplatino, el etopósido, la bleomicina, la ifosfamida y la vinblastina en diferentes combinaciones. Algunos investigadores propusieron el uso de campos de radioterapia más pequeños que los de la irradiación craneoespinal (por ejemplo, irradiación dirigida a todo el ventrículo con un refuerzo dirigido al sitio tumoral local) para los pacientes con TCGNG no diseminados. Hay polémica sobre el patrón de recaída tumoral en los pacientes tratados con quimioterapia y radioterapia focal o dirigida a todo el ventrículo.[1,7-9]
Evidencia (quimioterapia seguida de radioterapia):
- En un estudio del Children's Oncology Group (COG) (ACNS0122 [NCT00047320]) se evaluó la quimioterapia neoadyuvante seguida de radioterapia para los niños con TCGNG localizados.[2] La quimioterapia neoadyuvante se administró en 6 cursos de carboplatino y etopósido alternados con ifosfamida y etopósido. Después de terminar la quimioterapia, los pacientes que respondieron recibieron 36 Gy de radioterapia craneoespinal y 54 Gy dirigidos al lecho tumoral.
- En la revisión central se observó que un 87 % de los pacientes presentó una respuesta parcial (RP) o una respuesta completa (RC).
- En los 102 pacientes que cumplían las condiciones del estudio, la tasa de supervivencia sin complicaciones (SSC) a 5 años fue del 84 % (± 4 %), y la tasa de SG fue del 93 % (± 3%).
- A los 3 años, la tasa de SSC fue del 92 % y la tasa de SG fue del 98 % para todos los pacientes que lograron una RC o RP después de la quimioterapia de inducción o si no se documentaron elementos malignos durante la revisión quirúrgica.
- En el ensayo SIOP-CNS-GCT-96 (NCT00293358) se evaluó la quimioterapia neoadyuvante de 4 cursos con cisplatino, etopósido e ifosfamida seguida de radioterapia focal (54 Gy) para pacientes con enfermedad no metastásica.[3]
- Los pacientes con tumores localizados (n = 116) presentaron unas tasas de supervivencia sin progresión (SSP) a 5 años del 72 % (± 4 %) y tasas de SG del 82 % (± 4 %).
- En el estrato 1 del estudio del COG ACNS1123 (NCT01602666) se evaluó la eficacia de la radioterapia con reducción de la dosis y el volumen en niños y adolescentes con TCGNG localizados que lograron RP, RC y normalización de marcadores después de 6 ciclos de quimioterapia. El objetivo principal de este estudio fue evaluar el impacto de la reducción de la radioterapia en la SSP, con el objetivo de preservar el funcionamiento neurocognitivo. En el 10 % de los pacientes de este ensayo se presentaron recaídas espinales aisladas, lo que provocó la interrupción temprana del protocolo. Esto se compara con el 8 % de los pacientes que presentaron un patrón de recaída similar en el ensayo ACNS0122 (NCT00047320).
Los pacientes de este estudio recibieron 6 ciclos de quimioterapia con carboplatino y etopósido alternados con ifosfamida y etopósido. Si se lograba una RC o una RP con revisión quirúrgica o sin esta, el paciente era elegible para una radioterapia reducida, definida como 30,6 Gy en todo el campo ventricular y un refuerzo de 54 Gy en el lecho tumoral, en comparación con los 36 Gy de irradiación craneoespinal con un refuerzo de 54 Gy en el lecho tumoral utilizados en el ensayo ACNS0122.[4,10]
- De los 107 pacientes inscritos, 66 (61,7 %) lograron una RC o RP y se sometieron a una radioterapia reducida. La tasa de SSP a 3 años fue del 87,8 % (± 4,04 %) y la tasa de SG fue del 92,4 % (± 3,3 %).
- Se documentaron 8 recidivas; 6 pacientes presentaron recaída espinal a distancia sola y 2 tuvieron una recaída combinada local y a distancia.
- Los pacientes con NGGCT localizados que lograron una RC o RP con quimioterapia y se sometieron a radioterapia reducida tuvieron una tasa de SSP favorable, similar a la de los pacientes del ensayo ACNS0122 que se sometieron a irradiación craneoespinal.
- No hubo diferencias significativas en las tasas de supervivencia de los pacientes con TCGNG con enfermedad localizada en los 2 estudios del COG. El sitio predominante de recaída de los pacientes del ensayo ACNS1123 fue la columna vertebral, lo que fue único.[2,4]
- En un análisis de subgrupos se comparó la radioterapia de protones con la de fotones dirigidas a todo el ventrículo para el tratamiento de pacientes con NGGCT.[11] Las dosis medias de radiación y las dosis dirigidas al 40 % de los volúmenes, incluso al encéfalo supratentorial, al cerebelo, y a los lóbulos temporal bilateral, parietal y frontal, fueron significativamente más bajas entre los pacientes que se trataron con protones que en los que se trataron con fotones. No se dispone de datos sobre los efectos tardíos que confirmen el beneficio clínico.
La controversia actual y predominante en el tratamiento de los pacientes con TCGNG recién diagnosticados y localizados, que no tienen indicios de diseminación ni una respuesta radiográfica completa a la quimioterapia ni indicios de enfermedad antes y después del inicio de la quimioterapia, es el volumen de radiación. En el ensayo SIOP-CNS-GCT-96 (NCT00293358) se emplearon campos de radiación afectados solo para estos pacientes sin indicios radiográficos de enfermedad residual o diseminada. Se utilizaron campos de radiación craneoespinal o dirigida a todo el ventrículo con un refuerzo al tumor primario en 2 protocolos del COG. La incidencia de recaídas espinales aisladas fue similar en todos estos estudios y osciló entre un 8 % y un 11 %.
Los pacientes con TCGNG recidivantes son difíciles de tratar con intención curativa y su pronóstico es reservado. Si se debe incluir o no la irradiación craneoespinal o la radiación dirigida a todo el ventrículo y la columna vertebral para todos los pacientes de TCGNG recién diagnosticados representa una controversia sin resolver y es una cuestión importante para tener en cuenta en futuros ensayos clínicos.
Cirugía
A veces, se normalizan los marcadores tumorales en un porcentaje pequeño de los pacientes tratados con quimioterapia y se observa una respuesta radiográfica incompleta. En ocasiones, continúa creciendo una masa aunque los marcadores tumorales se normalicen. Esta afección, llamada síndrome de teratoma creciente, representa un crecimiento acelerado de los componentes del teratoma maduro durante o después del tratamiento.[2,12-14] En tales circunstancias, la resección quirúrgica completa es el tratamiento habitual, ya que proporciona confirmación histológica y exclusión de los componentes del tumor mixto de células germinativas.
En un ensayo de la SIOP se identificó un beneficio significativo en la SG para los pacientes sin enfermedad residual (tasa de SSP a 5 años, 85 % ± 0,04 % vs. 48 % ± 0,07 %), lo que destaca la importante función de la revisión quirúrgica después de la quimioterapia y antes de la irradiación.[3]
Una revisión quirúrgica quizás ayude a determinar si la masa residual contiene teratoma, fibrosis o un TCGNG residual.[7,15] Si en la revisión quirúrgica se encuentra un teratoma maduro o fibrosis después de la quimioterapia, el abordaje general es proceder con radioterapia como si el paciente hubiera logrado una RC a la quimioterapia. No obstante, si se observa un tumor activo, por lo general se consideran otros abordajes terapéuticos.[2]
Opciones de tratamiento en evaluación clínica de los tumores de células germinativas no germinomatosos del sistema nervioso central infantil recién diagnosticados
Tal vez haya ensayos clínicos terapéuticos de fase inicial para pacientes seleccionados. Es posible que estos ensayos estén disponibles a través del COG, el Pediatric Brain Tumor Consortium u otras entidades. La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
A continuación, se presenta un ejemplo de un ensayo clínico nacional o institucional en curso:
- ACNS2021 (NCT04684368) (A Study of a New Way to Treat Children and Young Adults With a Brain Tumor Called NGGCT): en este ensayo de fase II se estudia el efecto de la quimioterapia combinada con radioterapia en el tratamiento de pacientes con TCGNG localizados. El propósito de este estudio es examinar la respuesta del tumor a la quimioterapia de inducción. La respuesta del tumor determinará las opciones de tratamiento adicionales, como radioterapia o quimioterapia de dosis alta y trasplante de células madre seguido de radioterapia.
Bibliografía
- Robertson PL, DaRosso RC, Allen JC: Improved prognosis of intracranial non-germinoma germ cell tumors with multimodality therapy. J Neurooncol 32 (1): 71-80, 1997. [PUBMED Abstract]
- Goldman S, Bouffet E, Fisher PG, et al.: Phase II Trial Assessing the Ability of Neoadjuvant Chemotherapy With or Without Second-Look Surgery to Eliminate Measurable Disease for Nongerminomatous Germ Cell Tumors: A Children's Oncology Group Study. J Clin Oncol 33 (22): 2464-71, 2015. [PUBMED Abstract]
- Calaminus G, Frappaz D, Kortmann RD, et al.: Outcome of patients with intracranial non-germinomatous germ cell tumors-lessons from the SIOP-CNS-GCT-96 trial. Neuro Oncol 19 (12): 1661-1672, 2017. [PUBMED Abstract]
- Fangusaro J, Wu S, MacDonald S, et al.: Phase II Trial of Response-Based Radiation Therapy for Patients With Localized CNS Nongerminomatous Germ Cell Tumors: A Children's Oncology Group Study. J Clin Oncol 37 (34): 3283-3290, 2019. [PUBMED Abstract]
- Matsutani M; Japanese Pediatric Brain Tumor Study Group: Combined chemotherapy and radiation therapy for CNS germ cell tumors--the Japanese experience. J Neurooncol 54 (3): 311-6, 2001. [PUBMED Abstract]
- Calaminus G, Bamberg M, Jürgens H, et al.: Impact of surgery, chemotherapy and irradiation on long term outcome of intracranial malignant non-germinomatous germ cell tumors: results of the German Cooperative Trial MAKEI 89. Klin Padiatr 216 (3): 141-9, 2004 May-Jun. [PUBMED Abstract]
- Baranzelli M, Patte C, Bouffet E, et al.: Carboplatin-based chemotherapy (CT) and focal irradiation (RT) in primary germ cell tumors (GCT): A French Society of Pediatric Oncology (SFOP) experience (meeting abstract). [Abstract] Proceedings of the American Society of Clinical Oncology 18: A-538, 140A, 1999.
- Aoyama H, Shirato H, Ikeda J, et al.: Induction chemotherapy followed by low-dose involved-field radiotherapy for intracranial germ cell tumors. J Clin Oncol 20 (3): 857-65, 2002. [PUBMED Abstract]
- Kim JW, Kim WC, Cho JH, et al.: A multimodal approach including craniospinal irradiation improves the treatment outcome of high-risk intracranial nongerminomatous germ cell tumors. Int J Radiat Oncol Biol Phys 84 (3): 625-31, 2012. [PUBMED Abstract]
- Murphy ES, Dhall G, Fangusaro J, et al.: A Phase 2 Trial of Response-Based Radiation Therapy for Localized Central Nervous System Germ Cell Tumors: Patterns of Failure and Radiation Dosimetry for Nongerminomatous Germ Cell Tumors. Int J Radiat Oncol Biol Phys 113 (1): 143-151, 2022. [PUBMED Abstract]
- Mak DY, Siddiqui Z, Liu ZA, et al.: Photon versus proton whole ventricular radiotherapy for non-germinomatous germ cell tumors: A report from the Children's Oncology Group. Pediatr Blood Cancer 69 (9): e29697, 2022. [PUBMED Abstract]
- Kim CY, Choi JW, Lee JY, et al.: Intracranial growing teratoma syndrome: clinical characteristics and treatment strategy. J Neurooncol 101 (1): 109-15, 2011. [PUBMED Abstract]
- Kong DS, Nam DH, Lee JI, et al.: Intracranial growing teratoma syndrome mimicking tumor relapse: a diagnostic dilemma. J Neurosurg Pediatr 3 (5): 392-6, 2009. [PUBMED Abstract]
- Michaiel G, Strother D, Gottardo N, et al.: Intracranial growing teratoma syndrome (iGTS): an international case series and review of the literature. J Neurooncol 147 (3): 721-730, 2020. [PUBMED Abstract]
- Oya S, Saito A, Okano A, et al.: The pathogenesis of intracranial growing teratoma syndrome: proliferation of tumor cells or formation of multiple expanding cysts? Two case reports and review of the literature. Childs Nerv Syst 30 (8): 1455-61, 2014. [PUBMED Abstract]
Tratamiento de los teratomas del sistema nervioso central infantil recién diagnosticados
Los teratomas se designan como maduros o inmaduros según la ausencia o la presencia de tejidos diferenciados. El Japanese Pediatric Brain Tumor Study Group estratifica los teratomas para definir la clasificación y la intensidad del tratamiento (quimioterapia y radiación) en un grupo de pronóstico favorable (teratomas maduros) y un grupo de pronóstico intermedio (teratomas inmaduros) (consultar el Cuadro 2); por el contrario, el Children’s Oncology Group incluye los teratomas inmaduros con los otros tumores de células germinativas no germinomatosos.
Las opciones de tratamiento de los teratomas del sistema nervioso central (SNC) infantil recién diagnosticados son las siguientes:
Resección macroscópica total
El tratamiento primario de los teratomas es la resección macroscópica total.[1,2][Nivel de evidencia C1]
El tratamiento adyuvante en forma de radioterapia focal o quimioterapia adyuvante para pacientes con tumores resecados de manera parcial es controversial. En series institucionales pequeñas se indicó una posible utilidad de la radiocirugía estereotáctica.[1,2][Nivel de evidencia C1]
Bibliografía
- Huang X, Zhang R, Zhou LF: Diagnosis and treatment of intracranial immature teratoma. Pediatr Neurosurg 45 (5): 354-60, 2009. [PUBMED Abstract]
- Lee YH, Park EK, Park YS, et al.: Treatment and outcomes of primary intracranial teratoma. Childs Nerv Syst 25 (12): 1581-7, 2009. [PUBMED Abstract]
Tratamiento de los tumores de células germinativas del sistema nervioso central infantil recidivantes
Las opciones de tratamiento para los tumores de células germinativas (TCG) del sistema nervioso central (SNC) infantil recidivantes incluyen las siguientes:
Para los pacientes que tenían germinomas localizados en el momento del diagnóstico y se sometieron a tratamiento con radioterapia craneoespinal y de refuerzo local, la recaída se produce por lo general en el sitio primario.[1] Por el contrario, el sitio de recaída varía más en los pacientes que recaen después de someterse a quimioterapia y radioterapia focal con radiación dirigida a todo el ventrículo en el sitio primario de la enfermedad o sin esta. Estos pacientes presentan diferentes combinaciones de recaída local, ventricular diseminada, cerebral, leptomeníngea y espinal.[1,2]
Es posible que los pacientes con germinomas diseminados y tumores de células germinativas no germinomatosos (TCGNG) también presenten patrones complejos de recaída, incluso recaída local o diseminada intracraneal o intraespinal después del tratamiento con radioterapia craneoespinal sola o quimioterapia previa a la irradiación con diversos volúmenes y dosis de radioterapia.[1-3]
Se debe considerar la inscripción en ensayos clínicos para todos los pacientes con enfermedad recidivante. La información en inglés sobre los ensayos clínicos en curso patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI.
Quimioterapia seguida de radioterapia adicional
Es posible que los pacientes con germinomas que se trataron al inicio con quimioterapia sola se beneficien de la quimioterapia seguida de radioterapia en el momento de la recaída.[4,5] Se ha usado reirradiación, incluso radiocirugía, después de quimioterapia en el momento de la recidiva.[5-9]
Quimioterapia de dosis alta con rescate de células madre y con radioterapia adicional o sin esta
Para los pacientes con germinomas puros que ya recibieron radioterapia, se ha empleado quimioterapia mielosupresora con rescate de células madre. Es posible que la quimioterapia de dosis alta y el rescate autógeno de células madre también tengan potencial curativo para algunos pacientes con TCGNG sistémicos recidivantes.[7,9-13]
Opciones de tratamiento en evaluación clínica de los tumores de células germinativas del sistema nervioso central infantil recidivantes
Los ensayos clínicos disponibles para pacientes con TCGNG recidivantes son escasos. Tal vez haya ensayos clínicos terapéuticos de fase inicial para pacientes seleccionados. Es posible que estos ensayos estén disponibles a través del Children’s Oncology Group (COG), el Pediatric Brain Tumor Consortium u otras entidades. La información en inglés sobre los ensayos clínicos patrocinados por el NCI se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Bibliografía
- Calaminus G, Kortmann R, Worch J, et al.: SIOP CNS GCT 96: final report of outcome of a prospective, multinational nonrandomized trial for children and adults with intracranial germinoma, comparing craniospinal irradiation alone with chemotherapy followed by focal primary site irradiation for patients with localized disease. Neuro Oncol 15 (6): 788-96, 2013. [PUBMED Abstract]
- Calaminus G, Frappaz D, Kortmann RD, et al.: Outcome of patients with intracranial non-germinomatous germ cell tumors-lessons from the SIOP-CNS-GCT-96 trial. Neuro Oncol 19 (12): 1661-1672, 2017. [PUBMED Abstract]
- Goldman S, Bouffet E, Fisher PG, et al.: Phase II Trial Assessing the Ability of Neoadjuvant Chemotherapy With or Without Second-Look Surgery to Eliminate Measurable Disease for Nongerminomatous Germ Cell Tumors: A Children's Oncology Group Study. J Clin Oncol 33 (22): 2464-71, 2015. [PUBMED Abstract]
- Merchant TE, Sherwood SH, Mulhern RK, et al.: CNS germinoma: disease control and long-term functional outcome for 12 children treated with craniospinal irradiation. Int J Radiat Oncol Biol Phys 46 (5): 1171-6, 2000. [PUBMED Abstract]
- Sawamura Y, Ikeda JL, Tada M, et al.: Salvage therapy for recurrent germinomas in the central nervous system. Br J Neurosurg 13 (4): 376-81, 1999. [PUBMED Abstract]
- Hu YW, Huang PI, Wong TT, et al.: Salvage treatment for recurrent intracranial germinoma after reduced-volume radiotherapy: a single-institution experience and review of the literature. Int J Radiat Oncol Biol Phys 84 (3): 639-47, 2012. [PUBMED Abstract]
- Murray MJ, Bailey S, Heinemann K, et al.: Treatment and outcomes of UK and German patients with relapsed intracranial germ cell tumors following uniform first-line therapy. Int J Cancer 141 (3): 621-635, 2017. [PUBMED Abstract]
- Wong K, Opimo AB, Olch AJ, et al.: Re-irradiation of Recurrent Pineal Germ Cell Tumors with Radiosurgery: Report of Two Cases and Review of Literature. Cureus 8 (4): e585, 2016. [PUBMED Abstract]
- Callec L, Lardy-Cleaud A, Guerrini-Rousseau L, et al.: Relapsing intracranial germ cell tumours warrant retreatment. Eur J Cancer 136: 186-194, 2020. [PUBMED Abstract]
- Beyer J, Kramar A, Mandanas R, et al.: High-dose chemotherapy as salvage treatment in germ cell tumors: a multivariate analysis of prognostic variables. J Clin Oncol 14 (10): 2638-45, 1996. [PUBMED Abstract]
- Motzer RJ, Mazumdar M, Bosl GJ, et al.: High-dose carboplatin, etoposide, and cyclophosphamide for patients with refractory germ cell tumors: treatment results and prognostic factors for survival and toxicity. J Clin Oncol 14 (4): 1098-105, 1996. [PUBMED Abstract]
- Mabbott DJ, Monsalves E, Spiegler BJ, et al.: Longitudinal evaluation of neurocognitive function after treatment for central nervous system germ cell tumors in childhood. Cancer 117 (23): 5402-11, 2011. [PUBMED Abstract]
- Acharya S, DeWees T, Shinohara ET, et al.: Long-term outcomes and late effects for childhood and young adulthood intracranial germinomas. Neuro Oncol 17 (5): 741-6, 2015. [PUBMED Abstract]
Efectos a largo plazo de los tumores de células germinativas del sistema nervioso central infantil
Una proporción significativa de los niños con tumores de células germinativas (TCG) del sistema nervioso central (SNC) presentan endocrinopatías, como diabetes insípida y panhipopituitarismo. En la mayoría de los casos, estas endocrinopatías son permanentes a pesar del control tumoral y los pacientes necesitarán terapia de reemplazo hormonal continua.[1,2]
Si bien se han logrado mejoras considerables en la supervivencia general de los pacientes con TCG del SNC, los pacientes se enfrentan con efectos tardíos importantes de acuerdo con la localización del tumor primario y su tratamiento. Estas secuelas no se limitan a los niños, sino que quizás también se presenten en adolescentes y adultos jóvenes. Los efectos tardíos relacionados con el tratamiento son los siguientes:
- Cada fármaco quimioterapéutico tiene sus propios efectos secundarios a largo plazo característicos.
- Se sabe que la radioterapia dirigida a las zonas que los TCG afectan con mayor frecuencia provoca debilitamiento del estado funcional del paciente, deterioro del campo visual, desequilibrios endocrinos, dificultades de aprendizaje, accidentes cerebrovasculares y afecciones psiquiátricas.[3-9]
- En esta población se han encontrado tumores secundarios y se piensa que algunos están relacionados con la irradiación previa.[8,10,11]
Los ensayos clínicos en curso y los abordajes terapéuticos se dirigen a reducir al mínimo las secuelas a largo plazo del tratamiento de los TCG del SNC.
Para obtener información sobre la incidencia, el tipo y la vigilancia de los efectos tardíos en los niños y adolescentes sobrevivientes de cáncer, consultar Efectos tardíos del tratamiento anticanceroso en la niñez.
Bibliografía
- Rosenblum MK, Matsutani M, Van Meir EG: CNS germ cell tumours. In: Kleihues P, Cavenee WK, eds.: Pathology and Genetics of Tumours of the Nervous System. International Agency for Research on Cancer, 2000, pp 208-14.
- Hoffman HJ, Otsubo H, Hendrick EB, et al.: Intracranial germ-cell tumors in children. J Neurosurg 74 (4): 545-51, 1991. [PUBMED Abstract]
- Osuka S, Tsuboi K, Takano S, et al.: Long-term outcome of patients with intracranial germinoma. J Neurooncol 83 (1): 71-9, 2007. [PUBMED Abstract]
- Balmaceda C, Finlay J: Current advances in the diagnosis and management of intracranial germ cell tumors. Curr Neurol Neurosci Rep 4 (3): 253-62, 2004. [PUBMED Abstract]
- Odagiri K, Omura M, Hata M, et al.: Treatment outcomes, growth height, and neuroendocrine functions in patients with intracranial germ cell tumors treated with chemoradiation therapy. Int J Radiat Oncol Biol Phys 84 (3): 632-8, 2012. [PUBMED Abstract]
- Liang SY, Yang TF, Chen YW, et al.: Neuropsychological functions and quality of life in survived patients with intracranial germ cell tumors after treatment. Neuro Oncol 15 (11): 1543-51, 2013. [PUBMED Abstract]
- Mabbott DJ, Monsalves E, Spiegler BJ, et al.: Longitudinal evaluation of neurocognitive function after treatment for central nervous system germ cell tumors in childhood. Cancer 117 (23): 5402-11, 2011. [PUBMED Abstract]
- Acharya S, DeWees T, Shinohara ET, et al.: Long-term outcomes and late effects for childhood and young adulthood intracranial germinomas. Neuro Oncol 17 (5): 741-6, 2015. [PUBMED Abstract]
- Wong J, Goddard K, Laperriere N, et al.: Long term toxicity of intracranial germ cell tumor treatment in adolescents and young adults. J Neurooncol 149 (3): 523-532, 2020. [PUBMED Abstract]
- Jabbour SK, Zhang Z, Arnold D, et al.: Risk of second tumor in intracranial germinoma patients treated with radiation therapy: the Johns Hopkins experience. J Neurooncol 91 (2): 227-32, 2009. [PUBMED Abstract]
- Sands SA, Kellie SJ, Davidow AL, et al.: Long-term quality of life and neuropsychologic functioning for patients with CNS germ-cell tumors: from the First International CNS Germ-Cell Tumor Study. Neuro Oncol 3 (3): 174-83, 2001. [PUBMED Abstract]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Actualizaciones más recientes a este resumen (11/08/2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Tratamiento de los germinomas del sistema nervioso central infantil recién diagnosticados
Se añadió texto para indicar que en otros estudios se ha apoyado el abordaje de tratamiento con quimioterapia y radioterapia según la respuesta, y se han notificado desenlaces excelentes en niños con germinomas del sistema nervioso central (se citó a Cappellano et al. como referencia 17).
El Consejo editorial del PDQ sobre el tratamiento pediátrico es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento de los tumores de células germinativas del sistema nervioso central infantil. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento pediátrico, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento de los tumores de células germinativas del sistema nervioso central infantil son:
- Kenneth J. Cohen, MD, MBA (Sidney Kimmel Comprehensive Cancer Center at Johns Hopkins Hospital)
- Karen J. Marcus, MD, FACR (Dana-Farber of Boston Children's Cancer Center and Blood Disorders Harvard Medical School)
- Roger J. Packer, MD (Children's National Hospital)
- D. Williams Parsons, MD, PhD (Texas Children's Hospital)
- Malcolm A. Smith, MD, PhD (National Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento pediátrico emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento pediátrico. PDQ Tratamiento de los tumores de células germinativas del sistema nervioso central infantil. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/cerebro/pro/tratamiento-celulas-germinativas-snc-infantil-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.