Linfedema (PDQ®)–Versión para profesionales de salud
Aspectos generales
El linfedema o edema linfático se presenta cuando la interrupción del drenaje linfático normal produce la acumulación de líquido linfático rico en proteínas en el espacio intersticial. Los sobrevivientes de cáncer que experimentan linfedema notifican funcionamiento físico deficiente, alteración de la capacidad para realizar actividades normales de la vida diaria y aumento del sufrimiento psicológico.[1-5]
Los cálculos de la prevalencia del linfedema varían mucho debido a las diferencias en el tipo de cáncer, los métodos de medición, los criterios diagnósticos y el momento de las evaluaciones en relación con el diagnóstico y el tratamiento del cáncer. En una encuesta realizada en 2006 y 2010, se solicitó a 6593 sobrevivientes de cáncer que identificaran sus preocupaciones. Alrededor del 20 % de las personas encuestadas notificaron preocupaciones relacionadas con el linfedema. De estas personas, del 50 % al 60 % notificaron que recibían atención para linfedema.[6] Estos resultados se alinean de manera razonable con un estudio de encuestas de mujeres sobrevivientes de cáncer de ovario, endometrio y colorrectal que cumplieron los criterios de linfedema, según una encuesta validada que demostró una prevalencia puntual del 37 %, el 33 % y el 31 %, respectivamente.[3] De manera similar, en un estudio de intervención aleatorizado de mujeres con cáncer de mama, se demostró, mediante mediciones del volumen de los miembros o diagnóstico médico, que el 42 % de las pacientes tenía linfedema 18 meses después de la cirugía.[7][Nivel de evidencia: I]
El linfedema es un efecto diferido común del tratamiento del cáncer que afecta de forma negativa la calidad de vida de los sobrevivientes. En este resumen se revisan las características anatómicas del sistema linfático, las características fisiopatológicas y epidemiológicas del linfedema secundario al cáncer. También se proporciona a los profesionales clínicos información relacionada con los factores de riesgo y el diagnóstico, así como la prevención y el tratamiento; no se aborda el linfedema congénito ni el linfedema no relacionado con el cáncer.
En este resumen, a menos que se indique lo contrario, se tratan temas relacionados con la evidencia científica y las prácticas referidas a los adultos. La evidencia y la aplicación a la práctica referida a los niños a veces difieren bastante de la información pertinente a los adultos. Cuando la información específica sobre la atención de los niños esté disponible, se resumirá bajo su propio encabezado.
Anatomía del sistema linfático
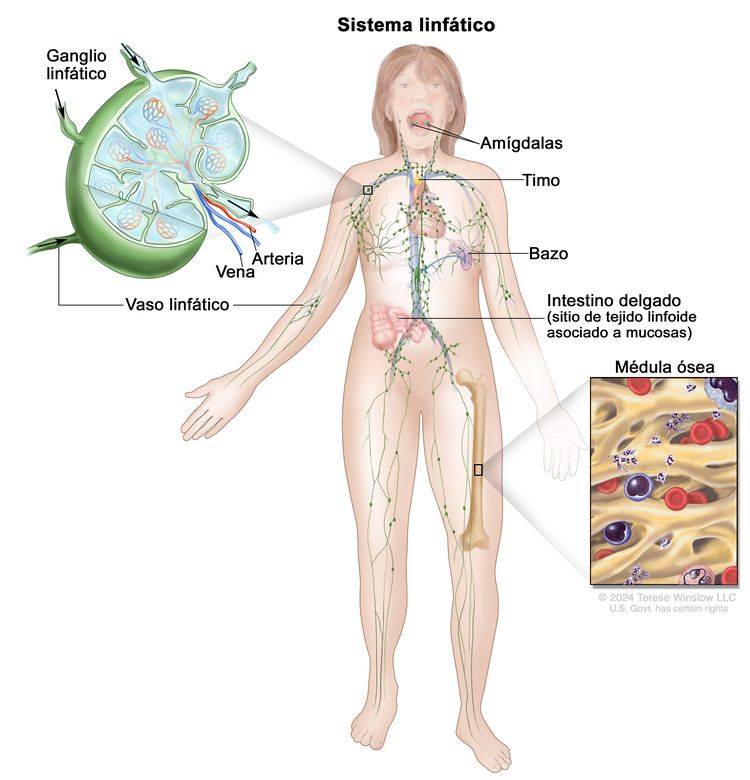
Por lo general, el sistema linfático humano incluye vasos linfáticos superficiales o primarios que forman una red dérmica compleja de canales parecidos a capilares. Los vasos linfáticos primarios no tienen paredes musculares ni válvulas. Estos drenan hacia los vasos linfáticos secundarios más grandes ubicados en el espacio subdérmico. Los vasos linfáticos secundarios corren paralelos a las venas superficiales y drenan hacia los vasos linfáticos más profundos ubicados en la grasa subcutánea adyacente a la fascia. A diferencia de los vasos primarios, los vasos linfáticos secundarios y más profundos tienen paredes musculares y numerosas válvulas para lograr un flujo linfático activo y unidireccional.
También existe un sistema intramuscular de vasos linfáticos con trayectoria paralela a las arterias profundas que drena el compartimento muscular, las articulaciones y la membrana sinovial. Es probable que los sistemas linfáticos superficiales y profundos funcionen de forma independiente, excepto en estados anormales, aunque hay pruebas de que se comunican cerca de los ganglios linfáticos.[8] La linfa drena desde los miembros inferiores hasta cada tronco linfático lumbar. Ambos troncos linfáticos lumbares se unen al tronco linfático intestinal y la cisterna del quilo (o cisterna de Pecquet) para formar el conducto torácico, que desemboca en la vena subclavia izquierda. Los vasos linfáticos del brazo izquierdo drenan en el tronco linfático subclavio izquierdo y luego en la vena subclavia izquierda. Los vasos linfáticos del brazo derecho drenan en el tronco linfático subclavio derecho y luego en la vena subclavia derecha.
Características fisiopatológicas del linfedema
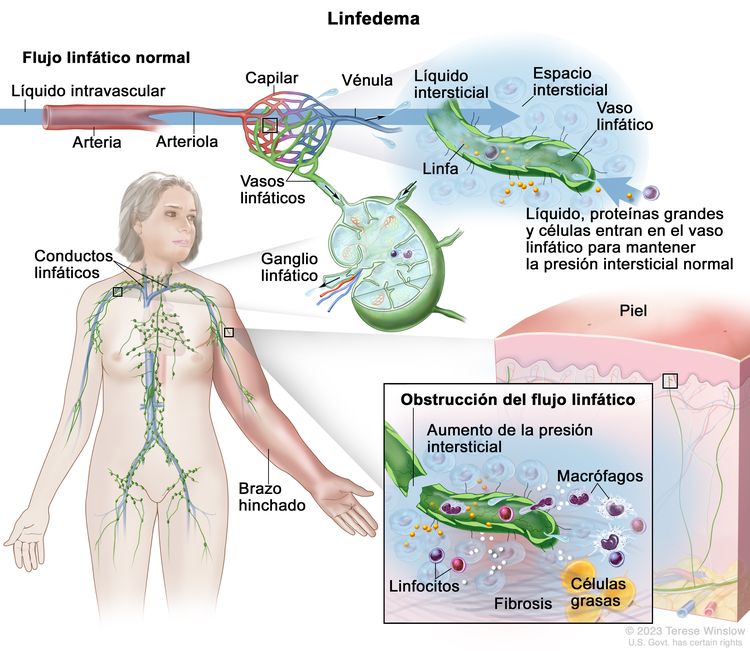
Los líquidos corporales se analizan en términos de su composición y el compartimento específico en el que se encuentran. El líquido intracelular incluye todo el líquido encapsulado por las membranas plasmáticas de las células. El líquido extracelular rodea todas las células del cuerpo y tiene 2 componentes primarios: el plasma intravascular y el líquido intersticial que rodea todas las células que no están en el plasma. El linfedema es la acumulación anormal de líquido rico en proteínas en el espacio intersticial, acompañada de inflamación y, finalmente, fibrosis.
La formación de líquido intersticial se debe al movimiento del líquido intravascular a través de las membranas capilares debido a la presión sanguínea arteriolar. Gran parte del líquido intersticial regresa al líquido intravascular a través de las vénulas poscapilares. Las presiones hidrostáticas arteriales y venosas, la presión tisular, las presiones oncóticas del líquido intravascular e intersticial y la permeabilidad de la membrana influyen en la dinámica de la producción de líquido. Por lo general, esta dinámica favorece una ganancia neta de líquido intersticial y el exceso se elimina a través de los canales linfáticos. Debido a que los vasos linfáticos a menudo carecen de una membrana basal, pueden también reabsorber moléculas demasiado grandes para la captación venosa. En resumen, el sistema linfático controla la presión, el volumen y la composición del líquido intersticial.
La obstrucción linfática produce un aumento del líquido intersticial que, a menudo, contiene proteínas grandes y residuos celulares. A través de mecanismos que no se conocen por completo, el aumento del líquido intersticial causa inflamación, destrucción o esclerosis de los vasos linfáticos, fibrosis y, en última instancia, hipertrofia del tejido adiposo.
Epidemiología y factores de riesgo
Es difícil establecer cálculos precisos de la incidencia y la prevalencia del linfedema debido, en parte, a las diferencias en la definición del linfedema (por ejemplo, informes de los pacientes vs. mediciones objetivas del volumen) y al momento de la evaluación del linfedema en relación con el tratamiento del cáncer. Otros factores son las diferencias en las técnicas quirúrgicas relacionadas con el tipo de disección de ganglios linfáticos o la dosis total, las fracciones y el campo de radiación tratado.
Los factores de riesgo comunes de presentar linfedema son los siguientes:
- Extensión de la cirugía local.
- Localización anatómica de la disección de ganglios linfáticos.
- Radiación dirigida a los ganglios linfáticos.
- Infección localizada o retraso en la cicatrización de la herida.
- Tumor que causa obstrucción linfática de los ganglios cervicales, torácicos, axilares, pélvicos o abdominales anteriores.
- Tumores intrapélvicos o intrabdominales que afectan o comprimen de manera directa los vasos linfáticos o la cisterna del quilo y el conducto torácico.
- Un estadio de la enfermedad más alto.
- Sobrepeso (índice de masa corporal [IMC] ≥25 kg/m2) u obesidad (IMC ≥30 kg/m2).[9]
- Raza negra o etnia hispana.[10]
- Residencia en áreas rurales.[10]
Bibliografía
- Ridner SH: Quality of life and a symptom cluster associated with breast cancer treatment-related lymphedema. Support Care Cancer 13 (11): 904-11, 2005. [PUBMED Abstract]
- Dunberger G, Lindquist H, Waldenström AC, et al.: Lower limb lymphedema in gynecological cancer survivors--effect on daily life functioning. Support Care Cancer 21 (11): 3063-70, 2013. [PUBMED Abstract]
- Zhang X, McLaughlin EM, Krok-Schoen JL, et al.: Association of Lower Extremity Lymphedema With Physical Functioning and Activities of Daily Living Among Older Survivors of Colorectal, Endometrial, and Ovarian Cancer. JAMA Netw Open 5 (3): e221671, 2022. [PUBMED Abstract]
- Pyszel A, Malyszczak K, Pyszel K, et al.: Disability, psychological distress and quality of life in breast cancer survivors with arm lymphedema. Lymphology 39 (4): 185-92, 2006. [PUBMED Abstract]
- Gjorup CA, Groenvold M, Hendel HW, et al.: Health-related quality of life in melanoma patients: Impact of melanoma-related limb lymphoedema. Eur J Cancer 85: 122-132, 2017. [PUBMED Abstract]
- Beckjord EB, Reynolds KA, van Londen GJ, et al.: Population-level trends in posttreatment cancer survivors' concerns and associated receipt of care: results from the 2006 and 2010 LIVESTRONG surveys. J Psychosoc Oncol 32 (2): 125-51, 2014. [PUBMED Abstract]
- Paskett ED, Le-Rademacher J, Oliveri JM, et al.: A randomized study to prevent lymphedema in women treated for breast cancer: CALGB 70305 (Alliance). Cancer 127 (2): 291-299, 2021. [PUBMED Abstract]
- Horsley JS, Styblo T: Lymphedema in the postmastectomy patient. In: Bland KI, Copeland EM, eds.: The Breast: Comprehensive Management of Benign and Malignant Diseases. Saunders, 1991, pp 701-6.
- McLaughlin SA, Brunelle CL, Taghian A: Breast Cancer-Related Lymphedema: Risk Factors, Screening, Management, and the Impact of Locoregional Treatment. J Clin Oncol 38 (20): 2341-2350, 2020. [PUBMED Abstract]
- Montagna G, Zhang J, Sevilimedu V, et al.: Risk Factors and Racial and Ethnic Disparities in Patients With Breast Cancer-Related Lymphedema. JAMA Oncol 8 (8): 1195-1200, 2022. [PUBMED Abstract]
Linfedema específico de determinadas enfermedades
Cáncer de mama
En una revisión sistemática, se observó que la prevalencia del linfedema fue del 21,4 % (14,9–29,8 %) en pacientes con cáncer de mama.[1] La incidencia aumentó hasta 2 años después del diagnóstico del cáncer de mama o la cirugía, y fue más alta en las mujeres que se sometieron a disección de ganglios linfáticos axilares versus biopsia de ganglio linfático centinela (19,9 vs. 5,6 %). Como resultado, la omisión de la disección de ganglios linfáticos axilares en mujeres con ganglio linfático centinela comprometido es una práctica aceptada en la actualidad. Esta práctica es el resultado de un estudio aleatorizado de fase III (ACOSOG-Z0011) en el que no se observó ninguna diferencia en la supervivencia general en las mujeres que no se sometieron a una disección de ganglios linfáticos axilares completa, en comparación con las que sí lo hicieron.[2] Otros factores de riesgo para el desarrollo del linfedema fueron el mayor número de ganglios linfáticos disecados, la mastectomía y el sobrepeso o la obesidad.[1,3] En un estudio prospectivo de quimioterapia neoadyuvante seguida de disección de ganglios linfáticos axilares (ACOSOG-Z1071), la incidencia del linfedema al cabo de una mediana de seguimiento de 3 años fue del 37,8 % (intervalo de confianza [IC] 95 %, 33,1–43,2 %). El aumento del índice de masa corporal (IMC) (cociente de riesgos instantáneos [CRI], 1,04; IC 95 %, 1,01–1,06), la duración de la quimioterapia neoadyuvante (CRI, 1,48; IC 95 %, 1,01–2,17), el número de ganglios linfáticos extirpados y el número de ganglios linfáticos comprometidos se relacionaron con síntomas de linfedema.[4]
En un estudio observacional prospectivo a 2 años en el que se usaron datos de 304 pacientes con cáncer de mama, que se habían sometido a disección de ganglio linfático axilar y radioterapia, se demostraron varios factores de riesgo vinculados al linfedema relacionado con el cáncer de mama (LRCM). La incidencia acumulada del linfedema se midió mediante el aumento de más del 10 % en el volumen del brazo y se realizaron análisis univariante y multivariable. En el análisis multivariable, la raza negra y la etnia hispana (oportunidad relativa [OR], 3,88; IC 95 %, 2,14–7,08 y OR, 3,01; IC 95 %, 1,10–7,62, respectivamente; P < 0,001 por cada uno), la administración de quimioterapia neoadyuvante (OR, 2,10; IC 95 %, 1,16–3,95; P = 0,01), la edad avanzada (OR, 1,04; IC 95 %, 1,02–1,07 de aumento cada año; P = 0,001), y el intervalo más prolongado de seguimiento (OR, 1,57; IC 95 %, 1,30–1,90 de aumento cada 6 meses; P < 0,001) se relacionaron de forma independiente con un aumento del riesgo.[5][Nivel de evidencia: II]
En otro estudio se examinaron los factores de riesgo del LRCM vinculado al tratamiento, las morbilidades y el estilo de vida en 918 mujeres que participaron en el ensayo Prospective Surveillance and Early Intervention (PSEI). Las mujeres se asignaron al azar a espectroscopia por bioimpedancia (BIS) o cinta de medición (CM).[6] En un análisis secundario se usaron factores de riesgo para evaluar el vínculo de los factores con los desenlaces (diferentes a linfedema, linfedema subclínico, progresión a linfedema crónico después de la intervención, progresión a linfedema crónico sin intervención). Los factores relacionados al riesgo de LRCM fueron disección de ganglio linfático axilar (P < 0,001), quimioterapia a base de taxano (P < 0,001), irradiación de los ganglios regionales (P ≤ 0,001), IMC mayor que 30 (P = 0,002) y residencia en áreas rurales (P = 0,037).[6]
Cánceres ginecológicos
En un estudio de cohortes se respalda la evidencia de que una proporción significativa de mujeres presentan linfedema de los miembros inferiores después del tratamiento para cáncer ginecológico o cáncer colorrectal. La prevalencia más alta (36,5 %) se observó en las sobrevivientes de cáncer de ovario, seguida de las sobrevivientes de cáncer de endometrio (32,5 %) y las sobrevivientes de cáncer colorrectal (31,4 %).[7]
En un estudio, 802 de 1774 mujeres diagnosticadas con cáncer ginecológico entre 1999 y 2004 respondieron a una encuesta sobre linfedema.[8] El 25 % de las encuestadas notificaron edema en los miembros inferiores; al 10 % se le había diagnosticado linfedema. La mayoría de las encuestadas (75 %) habían recibido el diagnóstico de estas afecciones durante el primer año tras el diagnóstico de cáncer. Las mujeres con cáncer de vulva tuvieron más probabilidad de presentar síntomas (36 %). La disección de ganglios linfáticos aumentó el riesgo de síntomas en mujeres con cáncer de cuello uterino, pero no en las que tenían cáncer uterino. La variedad de síntomas incluyó sensación de piernas pesadas, dolor y tirantez de la piel. Estar de pie todo el día, los viajes largos y el calor fueron condiciones precipitantes. Los tratamientos más comunes fueron prendas de compresión, masajes y ejercicios linfáticos. Se verificaron los hallazgos relacionados con la prevalencia alta en pacientes con cáncer de vulva y la aparición de síntomas durante el primer año.[9]
Se obtuvieron mediciones seriadas del volumen del miembro en las participantes de una cohorte de mujeres sometidas a disección de ganglios linfáticos por cáncer de vulva (n = 42), endometrio (n = 734) o cuello uterino (n = 138) 4 a 6 semanas después de la cirugía y luego cada 3 meses.[10] La incidencia de un aumento en el volumen de los miembros de más del 10 % fue del 43 % para el cáncer de vulva, del 34 % para el cáncer de endometrio y del 33 % para el cáncer de cuello uterino. La incidencia de linfedema grave (>40 % de aumento del volumen) fue inferior al 2 % en todas las cohortes. La incidencia máxima se produjo en el punto temporal de las 4 a 6 semanas, pero se identificaron casos nuevos en todos los puntos temporales. En el análisis de factores de riesgo se identificó una reducción del riesgo en las mujeres mayores de 65 años y un riesgo más alto en las mujeres a las que se les extirparon más de 8 ganglios linfáticos en la cohorte de cáncer de endometrio.
Cáncer de cabeza y cuello
Los pacientes con cáncer de cabeza y cuello tienen predisposición a presentar linfedema externo e interno. Por lo general, el linfedema externo se presenta con edema submentoniano o hinchazón en la parte inferior del cuello. El linfedema interno se distribuye de forma más amplia en las regiones anatómicas de la orofaringe. En un estudio transversal pequeño con exámenes asistidos por video, 59 de 61 pacientes presentaron algún grado de linfedema.[11][Nivel de evidencia: II] El 61 % de los pacientes tenía linfedema interno solo, el 35 % tenía linfedema interno y externo, y el 4 % tenía linfedema externo solo. La radioterapia posoperatoria fue un factor de riesgo del linfedema combinado. La quimioterapia fue un factor de riesgo solo para los pacientes con linfedema interno.
Melanoma
En un estudio transversal de un solo centro se notificó la presencia de linfedema después de una biopsia de ganglio linfático centinela o una disección de ganglios linfáticos en 435 pacientes que recibieron tratamiento para melanoma entre 1997 y 2015.[12] Los autores notificaron una prevalencia del linfedema del 25 %. De los pacientes, 48 (44 %) presentaron linfedema en estadio I (edema con fóvea) de la International Society of Lymphology (ISL) y 61 pacientes (56 %) tenían linfedema en estadio II o III de la ISL. En análisis multivariantes se identificaron como factores predictivos potenciales el sitio primario de la enfermedad en el miembro afectado, la cirugía inguinal y el dolor persistente en el sitio de la cirugía ganglionar. La celulitis en los miembros fue un factor de riesgo de linfedema en estadio II y III de la ISL. En una publicación anterior los mismos investigadores también informaron sobre la calidad de vida relacionada con la salud. En otro estudio retrospectivo de una sola institución más pequeño, de 66 pacientes sometidos a disección ganglionar terapéutica, la tasa de linfedema permanente para la disección ganglionar inguinal fue del 38 %, en comparación con el 12 % para la disección ganglionar axilar.[13] Otra variable potencialmente relevante es el tipo de disección. En una revisión sistemática de 2017 no se encontró ninguna diferencia apreciable entre la tasa de linfedema después de la linfadenectomía terapéutica y la finalización del muestreo ganglionar después de una biopsia de ganglio linfático centinela con resultado positivo para compromiso ganglionar.[14] En ambos casos, la tasa fue de alrededor del 20 %.
Cáncer de próstata
Hay pocos estudios sobre el linfedema después del tratamiento de cáncer de próstata. En una pequeña encuesta transversal de hombres que se sometieron a prostatectomía radical, se notificó que 19 de 54 encuestados (35,2 %) presentaron linfedema bilateral de las extremidades inferiores.[15][Nivel de evidencia: II] Cabe destacar que 25 de los pacientes encuestados notificaron que habían recibido terapia de drenaje linfático manual. Los hombres que no presentaron regresión experimentaron más sufrimiento relacionado con el funcionamiento físico y mental que aquellos que sí lo hicieron. Un IMC elevado y una mala salud general fueron factores de riesgo de linfedema.
Sarcoma
En un estudio se midieron los datos demográficos de los pacientes, los desenlaces quirúrgicos, los desenlaces funcionales y la gravedad del linfedema con una escala validada para 289 pacientes que se sometieron a cirugía con conservación del miembro para un sarcoma de extremidad entre 2000 y 2007.[16] La media de tiempo desde la cirugía fue de 35 meses (intervalo, 12–60 meses). De los pacientes, 83 presentaron algún grado de linfedema: 58 tenían hinchazón leve pero definida, 22 con hinchazón moderada y 3 hinchazón considerable. Ningún paciente presentó hinchazón de grado 4 o muy grave con piel brillante y agrietamiento cutáneo. En el análisis univariante se demostró que la radioterapia, el tamaño del tumor y la profundidad del mismo se correlacionaron con la gravedad. La ubicación del sarcoma (extremidad superior o inferior), la disección de ganglios linfáticos (sí o no) y el IMC no se correlacionaron con la gravedad. En el análisis multivariante se demostró que el tamaño del tumor fue el único factor de predicción independiente.
Bibliografía
- DiSipio T, Rye S, Newman B, et al.: Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis. Lancet Oncol 14 (6): 500-15, 2013. [PUBMED Abstract]
- Giuliano AE, Ballman KV, McCall L, et al.: Effect of Axillary Dissection vs No Axillary Dissection on 10-Year Overall Survival Among Women With Invasive Breast Cancer and Sentinel Node Metastasis: The ACOSOG Z0011 (Alliance) Randomized Clinical Trial. JAMA 318 (10): 918-926, 2017. [PUBMED Abstract]
- McLaughlin SA, Brunelle CL, Taghian A: Breast Cancer-Related Lymphedema: Risk Factors, Screening, Management, and the Impact of Locoregional Treatment. J Clin Oncol 38 (20): 2341-2350, 2020. [PUBMED Abstract]
- Armer JM, Ballman KV, McCall L, et al.: Factors Associated With Lymphedema in Women With Node-Positive Breast Cancer Treated With Neoadjuvant Chemotherapy and Axillary Dissection. JAMA Surg 154 (9): 800-809, 2019. [PUBMED Abstract]
- Montagna G, Zhang J, Sevilimedu V, et al.: Risk Factors and Racial and Ethnic Disparities in Patients With Breast Cancer-Related Lymphedema. JAMA Oncol 8 (8): 1195-1200, 2022. [PUBMED Abstract]
- Koelmeyer LA, Gaitatzis K, Dietrich MS, et al.: Risk factors for breast cancer-related lymphedema in patients undergoing 3 years of prospective surveillance with intervention. Cancer 128 (18): 3408-3415, 2022. [PUBMED Abstract]
- Zhang X, McLaughlin EM, Krok-Schoen JL, et al.: Association of Lower Extremity Lymphedema With Physical Functioning and Activities of Daily Living Among Older Survivors of Colorectal, Endometrial, and Ovarian Cancer. JAMA Netw Open 5 (3): e221671, 2022. [PUBMED Abstract]
- Beesley V, Janda M, Eakin E, et al.: Lymphedema after gynecological cancer treatment : prevalence, correlates, and supportive care needs. Cancer 109 (12): 2607-14, 2007. [PUBMED Abstract]
- Ryan M, Stainton MC, Slaytor EK, et al.: Aetiology and prevalence of lower limb lymphoedema following treatment for gynaecological cancer. Aust N Z J Obstet Gynaecol 43 (2): 148-51, 2003. [PUBMED Abstract]
- Carter J, Huang HQ, Armer J, et al.: GOG 244 - The LymphEdema and Gynecologic cancer (LEG) study: The association between the gynecologic cancer lymphedema questionnaire (GCLQ) and lymphedema of the lower extremity (LLE). Gynecol Oncol 155 (3): 452-460, 2019. [PUBMED Abstract]
- Jeans C, Brown B, Ward EC, et al.: Comparing the prevalence, location, and severity of head and neck lymphedema after postoperative radiotherapy for oral cavity cancers and definitive chemoradiotherapy for oropharyngeal, laryngeal, and hypopharyngeal cancers. Head Neck 42 (11): 3364-3374, 2020. [PUBMED Abstract]
- Gjorup CA, Groenvold M, Hendel HW, et al.: Health-related quality of life in melanoma patients: Impact of melanoma-related limb lymphoedema. Eur J Cancer 85: 122-132, 2017. [PUBMED Abstract]
- Deban M, Vallance P, Jost E, et al.: Higher Rate of Lymphedema with Inguinal versus Axillary Complete Lymph Node Dissection for Melanoma: A Potential Target for Immediate Lymphatic Reconstruction? Curr Oncol 29 (8): 5655-5663, 2022. [PUBMED Abstract]
- Moody JA, Botham SJ, Dahill KE, et al.: Complications following completion lymphadenectomy versus therapeutic lymphadenectomy for melanoma - A systematic review of the literature. Eur J Surg Oncol 43 (9): 1760-1767, 2017. [PUBMED Abstract]
- Neuberger M, Schmidt L, Wessels F, et al.: Onset and burden of lower limb lymphedema after radical prostatectomy: a cross-sectional study. Support Care Cancer 30 (2): 1303-1313, 2022. [PUBMED Abstract]
- Friedmann D, Wunder JS, Ferguson P, et al.: Incidence and Severity of Lymphoedema following Limb Salvage of Extremity Soft Tissue Sarcoma. Sarcoma 2011: 289673, 2011. [PUBMED Abstract]
Diagnóstico de linfedema
Signos, síntomas y examen físico
El linfedema suele ser evidente por hallazgos clínicos como el edema unilateral sin fóvea, por lo general con compromiso de los dígitos, en un paciente con factores de riesgo conocidos (por ejemplo, una paciente de cáncer de mama con disección de ganglios linfáticos axilares previa). En el diagnóstico diferencial se deben considerar otras causas de hinchazón de los miembros, como trombosis venosa profunda, neoplasia maligna e infección, y se deben excluir con estudios apropiados, si se indica.
El linfedema en pacientes con cáncer de cabeza y cuello puede presentarse de forma ligeramente diferente. En el linfedema externo se observa hinchazón en el área de la cabeza y el cuello, pero no es así en el caso del linfedema interno. En cambio, los pacientes con linfedema relacionado con el cáncer interno de cabeza y cuello pueden quejarse de cambios en la voz, disfagia y posible dificultad para respirar.
Procedimientos diagnósticos
Medición de los miembros
La amplia variedad de métodos para evaluar el volumen del miembro y la falta de estandarización dificultan la evaluación del miembro en riesgo. Las opciones incluyen el desplazamiento de agua, el uso de una cinta de medición o un metro, el escaneo infrarrojo y las medidas de impedancia bioeléctrica.[1]
El método más común para diagnosticar el linfedema de las extremidades superiores es la medición circunferencial en puntos de referencia anatómica específicos en la extremidad.[2] Las mediciones de la circunferencia del miembro superior se utilizan para calcular las diferencias de volumen entre la extremidad afectada y la no afectada. Las medidas en secuencia se toman en 4 puntos de ambas extremidades superiores: las articulaciones metacarpofalángicas, la muñeca, a 10 cm distales del epicondilo lateral y a 15 cm proximales del epicóndilo lateral. Según algunos expertos, la diferencia de 2 cm o más con la extremidad contralateral no afectada, en cualquier punto de medición, se considera significativa desde el punto de vista clínico. Sin embargo, las diferencias de las mediciones específicas entre ambas extremidades superiores quizás tengan poca repercusión clínica; como lo es una diferencia de 3 cm entre un miembro de una mujer obesa y uno de una mujer delgada. Además, a veces hay variaciones anatómicas inherentes en cuanto a la circunferencia entre el miembro dominante y el no dominante con respecto a la diferencia en la masa muscular; también es posible que las variaciones después del tratamiento de un cáncer de mama correspondan a una atrofia del miembro ipsilateral o hipertrofia del miembro contralateral.[3] En un estudio pequeño, en el que se compararon varios métodos para evaluar el linfedema de los miembros superiores, no se demostró la superioridad de ninguno de esos métodos.[1] Una secuencia de mediciones a lo largo del tiempo, que incluya las mediciones pretratamiento, puede ser más significativa desde el punto de vista clínico.
El método de desplazamiento de agua es otra manera de evaluar un edema en el miembro superior. Por lo general, una diferencia de 200 ml o más entre el miembro afectado y el miembro opuesto se considera el punto límite para definir el linfedema.[4]
Linfografía por resonancia magnética
Esta técnica consiste en la inyección intracutánea de un contraste paramagnético, seguida de imágenes anatómicas linfáticas, los patrones de flujo dérmico y el tejido graso adyacente. En un estudio de 50 mujeres con linfedema relacionado con el cáncer de mama, se compararon las características morfológicas de los vasos linfáticos entre los miembros afectados y no afectados.[5][Nivel de evidencia: II] El linfedema se estadificó de acuerdo con el sistema de estadificación ISL de 2016.[6][Nivel de evidencia: IV] En todos los pacientes, el líquido linfático se encontraba en el tejido celular subcutáneo, pero no en el compartimento subfascial del miembro afectado. En los pacientes en estadio I, los vasos linfáticos eran retorcidos y dilatados, pero no se observó reflujo dérmico ni regeneración de los vasos linfáticos. En los pacientes en estadio II, se observó fibrosis de tejido blando e hipertrofia de tejido adiposo. Los vasos linfáticos eran tortuosos y dilatados, con áreas de reflujo dérmico y regeneración. En los pacientes en estadio III, los vasos linfáticos eran irreconocibles y se observó reflujo dérmico confluente. La fibrosis de tejido blando fue más avanzada. La linfografía por resonancia magnética (LRM) es inocua, factible y proporciona gran detalle anatómico. Sin embargo, su función en el diagnóstico del linfedema aún está por determinarse.
Estadificación y clasificación de gravedad por grados
El sistema de estadificación del ISL refleja los cambios probables con el tiempo según la fisiopatología del linfedema. Los estadios son los siguientes:
- Estadio 0: Este estadio, llamado linfedema subclínico, se caracteriza por alteración del flujo linfático.
- Estadio I: Este estadio es reversible de manera espontánea y, por lo general, se caracteriza por la presencia de edema con fóvea, aumento de la circunferencia del miembro superior y sensación de pesadez.
- Estadio II: Este estadio moderado se caracteriza por la consistencia esponjosa del tejido sin signos de edema con fóvea. La fibrosis tisular a veces provoca endurecimiento y aumento de tamaño del miembro.[2] La hinchazón en este estadio es en su mayoría causada por el componente líquido.
- Estadio III: En el estadio más avanzado,[2] la hinchazón es en su mayoría secundaria a la hipertrofia grasa, por lo que no hay edema con fóvea.
Es posible evaluar la gravedad del linfedema mediante los Common Terminology Criteria for Adverse Events (CTCAE), que se elaboraron para clasificar los efectos adversos en el contexto de los ensayos clínicos.[7] Una ventaja clave del abordaje CTCAE es que incluye tanto medidas objetivas (discrepancia entre los miembros) como evaluaciones clínicas subjetivas para el diagnóstico del linfedema. Este abordaje permite al profesional clínico abordar los signos y síntomas problemáticos que se pueden presentar sin discrepancia significativa entre los miembros. La tercera versión de los CTCAE incluye los siguientes criterios de volumen:
- Grado 1. Entre un 5 % y 10 % de discrepancia, de volumen o circunferencia, entre los miembros en el punto de mayor diferencia visible; hinchazón u ocultación de la arquitectura anatómica durante una inspección minuciosa; edema con fóvea.
- Grado 2. Más del 10 % hasta el 30 % de discrepancia, de volumen o circunferencia, entre miembros en el punto de mayor diferencia visible; oscurecimiento evidente de la arquitectura anatómica; obliteración de los pliegues cutáneos; desviación evidente del contorno anatómico normal.
- Grado 3. Más del 30 % de discrepancia de volumen entre miembros; linforragia; desviación macroscópica del contorno anatómico normal; interferencia con las actividades de la vida diaria (AVD).
- Grado 4. Progresión a neoplasia maligna (por ejemplo, linfangiosarcoma); amputación indicada; linfedema incapacitante.
La quinta versión del CTCAE está más simplificada y no incluye criterios de volúmenes:[8]
- Grado 1. Indicios de engrosamiento o cambio de color leve.
- Grado 2. Cambio de color marcado; textura coriácea de la piel (parecida al cuero); formación papilar; limitación de las AVD instrumentales.
- Grado 3. Síntomas graves; limitación de las AVD de autocuidado.
Bibliografía
- Ridner SH, Montgomery LD, Hepworth JT, et al.: Comparison of upper limb volume measurement techniques and arm symptoms between healthy volunteers and individuals with known lymphedema. Lymphology 40 (1): 35-46, 2007. [PUBMED Abstract]
- Bicego D, Brown K, Ruddick M, et al.: Exercise for women with or at risk for breast cancer-related lymphedema. Phys Ther 86 (10): 1398-405, 2006. [PUBMED Abstract]
- Petrek JA: Commentary: prospective trial of complete decongestive therapy for upper extremity lymphedema after breast cancer therapy. Cancer J 10 (1): 17-9, 2004.
- Mondry TE, Riffenburgh RH, Johnstone PA: Prospective trial of complete decongestive therapy for upper extremity lymphedema after breast cancer therapy. Cancer J 10 (1): 42-8; discussion 17-9, 2004 Jan-Feb. [PUBMED Abstract]
- Sheng L, Zhang G, Li S, et al.: Magnetic Resonance Lymphography of Lymphatic Vessels in Upper Extremity With Breast Cancer-Related Lymphedema. Ann Plast Surg 84 (1): 100-105, 2020. [PUBMED Abstract]
- Executive Committee: The Diagnosis and Treatment of Peripheral Lymphedema: 2016 Consensus Document of the International Society of Lymphology. Lymphology 49 (4): 170-84, 2016. [PUBMED Abstract]
- Cheville AL, McGarvey CL, Petrek JA, et al.: The grading of lymphedema in oncology clinical trials. Semin Radiat Oncol 13 (3): 214-25, 2003. [PUBMED Abstract]
- National Cancer Institute: Common Terminology Criteria for Adverse Events (CTCAE), Version 5.0. Bethesda, Md: U.S. Department of Health and Human Services, National Institutes of Health, 2017. Available online. Last accessed Dec. 18, 2024.
Aspectos generales de las opciones de prevención y tratamiento del linfedema
Hay muchas intervenciones posibles para reducir el riesgo de linfedema o aminorar sus consecuencias negativas. En general, las intervenciones de prevención y tratamiento se dividen en abordajes no quirúrgicos y quirúrgicos. Las intervenciones no quirúrgicas se dividen en farmacológicas, compresivas o relacionadas con el ejercicio. Antes de considerar las opciones quirúrgicas, se deben probar y agotar las opciones conservadoras. En esta sección se ofrece una descripción general de diversas intervenciones, seguida de un análisis más detallado de ensayos individuales por tipo de cáncer.
Opciones no quirúrgicas
Prendas de compresión
Las prendas de compresión se usan para prevenir y tratar el linfedema al ayudar a disminuir el exceso de formación de líquido intersticial, prevenir el reflujo de líquido linfático y proporcionar una barrera para ayudar a los músculos a bombear líquido hacia el sistema linfático.[1][Nivel de evidencia: I] El uso de prendas de compresión de tejido plano (inelásticas) es mejor que la compresión elástica durante las fases de reducción y mantenimiento del linfedema en estadios II y III. Las prendas de compresión inelásticas permiten que los músculos esqueléticos impulsen de manera más eficiente el líquido linfático por el sistema linfático deteriorado. Las prendas de tejido plano también tienen la ventaja de aplicar presión sobre el edema firme para ablandarlo. Esta presión se aplica en un gradiente uniforme sobre un área grande. Las prendas de tejido circular ejercen más presión en la parte distal (estrecha) de la prenda y son mejores para la insuficiencia venosa que para el linfedema.
Es recomendable usar prendas elásticas para el linfedema en estadio I y el linfedema que se convirtió en estadio II después de la terapia descongestiva completa (TDC).
Compresión neumática externa intermitente
Este abordaje se debe usar junto con prendas de compresión y solo si la compresión no es suficiente para prevenir o tratar el linfedema. Las preocupaciones sobre el uso de la compresión neumática intermitente incluyen la cantidad óptima de presión, el programa de tratamiento y la necesidad de terapia de mantenimiento después de la reducción inicial del edema.[2][Nivel de evidencia: I] Existe una preocupación teórica de que presiones superiores a 60 mm Hg y el uso prolongado pueden lesionar los vasos linfáticos.
Es posible que la compresión neumática externa intermitente facilite el tratamiento del linfedema cuando se usa de forma adyuvante con la terapia linfática descongestiva. En un ensayo aleatorizado pequeño de 23 mujeres con linfedema nuevo relacionado con el cáncer de mama, se encontró una reducción significativa adicional del volumen, en comparación con el drenaje linfático manual solo (45 vs. 26 %).[3][Nivel de evidencia: I] De manera similar, también se observaron mejoras en la fase de mantenimiento del tratamiento.
Hay varios obstáculos para utilizar la terapia descongestiva multidisciplinaria, como el costo, el número insuficiente de terapeutas entrenados y el tiempo que hay que dedicarle. En respuesta a estas dificultades, un grupo de investigadores llevó a cabo un ensayo con una prenda que se encontraba en fase de desarrollo comercial.[4] El dispositivo se ajustó a los pacientes, a quienes se les indicó que lo usaran 2 veces al día durante 8 semanas. Los investigadores asignaron al azar a los pacientes al grupo de dispositivo o a un grupo de control en lista de espera. El uso del dispositivo fue viable, aunque la mayoría de los pacientes encontraron que la frecuencia de 2 veces al día era demasiado inoportuna. Los pacientes tratados notificaron una mayor capacidad percibida para controlar el linfedema y notificaron de manera subjetiva menos hinchazón. No hubo efectos adversos graves relacionados con el uso del dispositivo. El costo económico de los dispositivos avanzados de compresión en el linfedema relacionado con la insuficiencia venosa se compararon de manera favorable con otras técnicas compresivas en un estudio de datos de reclamaciones de seguros.[5]
Terapia descongestiva completa
La terapia descongestiva completa (TDC) es el tratamiento de referencia para el linfedema en estadio II. Sin embargo, no se ha determinado cuál es el programa óptimo.
La TDC tiene 2 fases:
- Fase 1 —Descongestión y reducción. Abarca el cuidado de la piel o las heridas, ejercicio, drenaje linfático manual y vendajes de compresión a diario durante un promedio de 15 días.
- Fase 2 —Mantenimiento. Abarca cuidado de la piel o las heridas, ejercicio, drenaje linfático manual, según sea necesario, y prendas de compresión.
En un estudio se comparó el drenaje linfático manual con el ejercicio para tratar el linfedema en 39 personas con cáncer de cavidad oral.[6] El ejercicio y el drenaje linfático manual mejoraron por separado la amplitud de movimiento del cuello y el control del linfedema, pero los resultados fueron mejores cuando estas intervenciones se combinaron.
En una revisión sistemática del drenaje linfático manual en pacientes con cáncer de mama se informó sobre 10 estudios.[7] En 4 de los estudios se notificó que el drenaje linfático manual podría reducir la incidencia de linfedema (cociente de riesgos, 0,58; intervalo de confianza [IC] 95 %, 0,37–0,93). Sin embargo, no se observó ninguna diferencia estadística en los cambios volumétricos en 7 de los estudios. Sí se observó una diferencia estadística en el control del dolor, aunque no en la calidad de vida.
Actividad física
La actividad o ejercicio físico tal vez sean valiosos para el tratamiento del linfedema por varias razones, como la mejora del flujo linfático por las contracciones musculares y la mejora del funcionamiento cardiovascular general.[8] Por el contrario, no se ha confirmado la preocupación inicial de que el ejercicio pueda causar algún daño.[9,10] Los resultados de un estudio aleatorizado pequeño indican que es posible indicar ejercicios de resistencia junto con la TDC.[11][Nivel de evidencia: I]
En una revisión sistemática y metanálisis se informó sobre 12 estudios de prevención y 36 estudios de tratamiento con ejercicio para prevenir o tratar el linfedema relacionado con el cáncer.[8] En la mayoría de los estudios (11 de 12 y 32 de 36) se inscribieron pacientes con cáncer de mama. Además, si bien en la mayoría de los estudios se investigó alguna forma de entrenamiento de resistencia, algunos usaron ejercicio aeróbico solo. El riesgo relativo de presentar linfedema después del ejercicio fue de 0,90 (IC 95 %, 0,72–1,13), lo cual no fue significativo. Sin embargo, se indicó un beneficio en los pacientes a quienes se les extirparon más de 5 ganglios linfáticos. En este caso, el riesgo relativo fue de 0,49 (IC 95 %, 0,28–0,85). Para los pacientes en los estudios de tratamiento, la diferencia de medias estandarizada (DME) en los desenlaces medidos fue de −0,11 (IC 95 %, −0,22 a 0,01). La diferencia, en comparación con el estado controlado, fue de −0,10 (IC 95 %, −0,24 a 0,04). Se detectaron diferencias significativas en los desenlaces discretos, como dolor, funcionamiento y fuerza de la parte superior del cuerpo, fuerza de la parte inferior del cuerpo, fatiga y calidad de vida en los participantes del grupo de ejercicio (DME, 0,3–0,8; P < 0,05).
El American College of Sports Medicine aconseja que un programa supervisado de ejercicio físico progresivo de resistencia es inocuo para los pacientes con linfedema después del cáncer de mama, o en riesgo de padecer el linfedema. No hay datos adecuados sobre la inocuidad del ejercicio físico sin supervisión. Se desconoce la inocuidad del ejercicio en otros tipos de cáncer.[12][Nivel de evidencia: IV]
Terapia farmacológica
Medicamentos antiinflamatorios no esteroideos
En un par de ensayos pequeños se demostró el beneficio potencial del antiinflamatorio no esteroideo (AINE) ketoprofeno con respecto al linfedema.[13] La justificación del uso de AINE se basa en las observaciones de cambios inflamatorios histopatológicos en el tejido afectado y una posible relación entre inflamación persistente y alteración de la linfangiogénesis. Los autores informaron sobre un ensayo sin enmascaramiento, seguido de un ensayo pequeño controlado con placebo. En este último, se trató a 18 pacientes con placebo y 16 pacientes recibieron tratamiento con ketoprofeno durante 4 meses. En ambos ensayos, el tratamiento con ketoprofeno produjo una reducción significativa del grosor de la piel y una mejora en el aspecto histopatológico de la piel. Sin embargo, en ninguno de los ensayos hubo cambios en el volumen de los miembros o la impedancia cutánea. Estos prometedores resultados iniciales requieren verificación, dados los posibles riesgos gastrointestinales y cardiovasculares de los AINE.
Opciones quirúrgicas
Las opciones quirúrgicas para el tratamiento del linfedema son la anastomosis linfática-venosa (ALV), el trasplante de ganglios linfáticos vascularizados (VLNT) y la reducción del exceso de volumen tisular mediante la liposucción. En varias revisiones informativas se describe la toma de decisiones quirúrgicas que implica la selección de pacientes y el tipo de operación.[14]
Hay datos limitados que orientan la elección entre las técnicas de liposucción y microcirugía, y algunos investigadores proponen un abordaje combinado.[15] La elección de las técnicas microquirúrgicas tal vez se facilite mediante la obtención de imágenes y la clasificación clínica de la gravedad del linfedema. En una propuesta se indica que los pacientes son aptos para recibir ALV si se observa una obstrucción parcial en la linfocentellografía y un linfedema de grado 1 o 2 con conductos linfáticos evidentes en la linfografía con verde de indocianina. Por otro lado, es posible que el VLNT sea mejor para los pacientes que exhiben una obstrucción total observada en la linfocentellografía y linfedema de grado 3 o 4 sin conductos linfáticos evidentes observado en la linfografía con verde de indocianina.[16]
Anastomosis linfática-venosa
Por lo general, la cirugía de anastomosis linfática-venosa (ALV) se usa en pacientes con linfedema de grado temprano debido a la dificultad para encontrar los vasos linfáticos. En un estudio se notificaron los resultados de 42 pacientes con linfedema de grado más avanzado en los miembros inferiores que se sometieron a linfangiografía por resonancia magnética preoperatoria y ecografía.[17] Gracias a las imágenes los pacientes tuvieran un promedio de 5 anastomosis exitosas por miembro. Los desenlaces clínicos fueron favorables, lo que aumentó la posibilidad de ampliar las indicaciones para esta cirugía.
La reconstrucción linfática inmediata en el momento de la cirugía del cáncer se encuentra en investigación activa.
Transferencia de ganglios linfáticos vascularizados
El trasplante o trasferencia de ganglios linfáticos vascularizados (VLNT) consiste en la recolección de ganglios linfáticos sanos, junto con sus vasos venosos y arteriales relevantes, de un sitio donante y la transferencia a la cuenca ganglionar de la extremidad afectada. Los mecanismos de acción propuestos incluyen facilitar rutas alternativas de drenaje linfático y fomentar la linfangiogénesis para crear nuevos vasos linfáticos en el miembro. En la actualidad hay pocos datos clínicos, pero prometedores, sobre la eficacia del VLNT.[18]
En una revisión y resumen sistemáticos de pacientes con linfedema relacionado con el cáncer de mama que se sometieron a TDC o VLNT [19] se examinó la evidencia de que ambas intervenciones tienen una repercusión favorable en las medidas de calidad de vida relacionadas con la salud. Como se anticipó, los datos del VLNT fueron más limitados (2 estudios, 65 pacientes) que el de la TDC (14 estudios, 569 pacientes). Sin embargo, dentro de estos límites, los datos del VLNT indicaron que las mejoras se observaron con frecuencia. Los datos de la TDC fueron más heterogéneos y la mejora a menudo fue menos significativa. Estos datos proporcionan a los profesionales clínicos motivos para considerar la intervención quirúrgica, aunque en la actualidad la práctica estándar sea la TDC.
En un estudio retrospectivo de 124 pacientes con linfedema relacionado con el cáncer de mama, el grado de mejora de la circunferencia de los miembros y la reducción de los episodios de celulitis fue mayor en los pacientes sometidos a VLNT que en quienes se sometieron a ALV.[16] Además de la precaución habitual en la interpretación de datos retrospectivos, los pacientes que se sometieron a VLNT no eran aptos para recibir ALV, según los resultados de la linfografía. Este hallazgo parece respaldar el uso de imágenes para guiar la selección de pacientes. En 2 estudios pequeños de cohortes de VLNT en pacientes con cáncer de mama se observaron mejoras aparentes en las mediciones objetivas de los miembros, así como en las mediciones subjetivas de la calidad de vida relacionada con la salud de los pacientes.[20][Nivel de evidencia: III]; [21][Nivel de evidencia: II]
Liposucción
Es posible que el linfedema crónico sin fóvea se deba a la hipertrofia del tejido adiposo. En este caso, una opción es la liposucción para eliminar el exceso de tejido adiposo. Las prendas de compresión siguen siendo necesarias después de la liposucción; además, es posible que se requiera la extirpación de la piel sobrante después de la liposucción.[22]
En un estudio retrospectivo se comparó la frecuencia de episodios documentados de erisipela en 130 pacientes antes y después de la liposucción.[23] Como se anticipó, el exceso medio de volumen del brazo disminuyó de 1607 ml a -43 ml, y la tasa del grupo afectado al grupo normal disminuyó de 1,5 a 1,0. La aparición registrada de erisipela disminuyó de 0,47 a 0,06 ataques por año. Se notificaron desenlaces similares en otro estudio,[24] en el que los autores revisaron las historias clínicas de 105 mujeres con linfedema relacionado con el cáncer de mama resistente al tratamiento compresivo que se sometieron a liposucción entre 1993 y 2012. En particular, las pacientes tuvieron que presentar edema sin fóvea. Todas las mujeres se beneficiaron y el beneficio persistió durante al menos 5 años según la medición.
Terapia láser
La terapia láser de bajo nivel (TLBN) es una técnica no invasiva en la que los tejidos afectados reciben fototerapia de varias longitudes de onda con un intervalo de 650 a 1000 nm. No se ha establecido la función del TLBN en la atención de las personas con linfedema, aunque en una revisión sistemática de 2017 se observó evidencia prometedora.[25] Los mecanismos de acción propuestos incluyen proliferación celular de macrófagos con reducción de la fibrosis, reducción de los mediadores inflamatorios, linfangiogénesis y mejora del flujo linfático.[25] Además, el tratamiento con láser de dióxido de carbono también tal vez produzca mejoras clínicas, aunque en la actualidad los datos solo provienen de series de casos pequeñas.[26] El láser de dióxido de carbono estimula la remodelación de colágeno anormal por metaloproteinasas de matriz y neocolagénesis dérmica por fibroblastos y apoya la generación de nuevos vasos linfáticos.
Bibliografía
- Nadal Castells MJ, Ramirez Mirabal E, Cuartero Archs J, et al.: Effectiveness of Lymphedema Prevention Programs With Compression Garment After Lymphatic Node Dissection in Breast Cancer: A Randomized Controlled Clinical Trial. Front Rehabil Sci 2: 727256, 2021. [PUBMED Abstract]
- Dini D, Del Mastro L, Gozza A, et al.: The role of pneumatic compression in the treatment of postmastectomy lymphedema. A randomized phase III study. Ann Oncol 9 (2): 187-90, 1998. [PUBMED Abstract]
- Szuba A, Achalu R, Rockson SG: Decongestive lymphatic therapy for patients with breast carcinoma-associated lymphedema. A randomized, prospective study of a role for adjunctive intermittent pneumatic compression. Cancer 95 (11): 2260-7, 2002. [PUBMED Abstract]
- Ridner SH, Dietrich MS, Deng J, et al.: Advanced pneumatic compression for treatment of lymphedema of the head and neck: a randomized wait-list controlled trial. Support Care Cancer 29 (2): 795-803, 2021. [PUBMED Abstract]
- Lerman M, Gaebler JA, Hoy S, et al.: Health and economic benefits of advanced pneumatic compression devices in patients with phlebolymphedema. J Vasc Surg 69 (2): 571-580, 2019. [PUBMED Abstract]
- Tsai KY, Liao SF, Chen KL, et al.: Effect of early interventions with manual lymphatic drainage and rehabilitation exercise on morbidity and lymphedema in patients with oral cavity cancer. Medicine (Baltimore) 101 (42): e30910, 2022. [PUBMED Abstract]
- Lin Y, Yang Y, Zhang X, et al.: Manual Lymphatic Drainage for Breast Cancer-related Lymphedema: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Clin Breast Cancer 22 (5): e664-e673, 2022. [PUBMED Abstract]
- Hayes SC, Singh B, Reul-Hirche H, et al.: The Effect of Exercise for the Prevention and Treatment of Cancer-Related Lymphedema: A Systematic Review with Meta-analysis. Med Sci Sports Exerc 54 (8): 1389-1399, 2022. [PUBMED Abstract]
- Schmitz KH, Ahmed RL, Troxel A, et al.: Weight lifting in women with breast-cancer-related lymphedema. N Engl J Med 361 (7): 664-73, 2009. [PUBMED Abstract]
- Singh B, Disipio T, Peake J, et al.: Systematic Review and Meta-Analysis of the Effects of Exercise for Those With Cancer-Related Lymphedema. Arch Phys Med Rehabil 97 (2): 302-315.e13, 2016. [PUBMED Abstract]
- Do JH, Kim W, Cho YK, et al.: EFFECTS OF RESISTANCE EXERCISES AND COMPLEX DECONGESTIVE THERAPY ON ARM FUNCTION AND MUSCULAR STRENGTH IN BREAST CANCER RELATED LYMPHEDEMA. Lymphology 48 (4): 184-96, 2015. [PUBMED Abstract]
- Campbell KL, Winters-Stone KM, Wiskemann J, et al.: Exercise Guidelines for Cancer Survivors: Consensus Statement from International Multidisciplinary Roundtable. Med Sci Sports Exerc 51 (11): 2375-2390, 2019. [PUBMED Abstract]
- Rockson SG, Tian W, Jiang X, et al.: Pilot studies demonstrate the potential benefits of antiinflammatory therapy in human lymphedema. JCI Insight 3 (20): , 2018. [PUBMED Abstract]
- Schaverien MV, Coroneos CJ: Surgical Treatment of Lymphedema. Plast Reconstr Surg 144 (3): 738-758, 2019. [PUBMED Abstract]
- Forte AJ, Boczar D, Huayllani MT, et al.: Pharmacotherapy Agents in Lymphedema Treatment: A Systematic Review. Cureus 11 (12): e6300, 2019. [PUBMED Abstract]
- Engel H, Lin CY, Huang JJ, et al.: Outcomes of Lymphedema Microsurgery for Breast Cancer-related Lymphedema With or Without Microvascular Breast Reconstruction. Ann Surg 268 (6): 1076-1083, 2018. [PUBMED Abstract]
- Cha HG, Oh TM, Cho MJ, et al.: Changing the Paradigm: Lymphovenous Anastomosis in Advanced Stage Lower Extremity Lymphedema. Plast Reconstr Surg 147 (1): 199-207, 2021. [PUBMED Abstract]
- Gould DJ, Mehrara BJ, Neligan P, et al.: Lymph node transplantation for the treatment of lymphedema. J Surg Oncol 118 (5): 736-742, 2018. [PUBMED Abstract]
- Fish ML, Grover R, Schwarz GS: Quality-of-Life Outcomes in Surgical vs Nonsurgical Treatment of Breast Cancer-Related Lymphedema: A Systematic Review. JAMA Surg 155 (6): 513-519, 2020. [PUBMED Abstract]
- Aljaaly HA, Fries CA, Cheng MH: Dorsal Wrist Placement for Vascularized Submental Lymph Node Transfer Significantly Improves Breast Cancer-Related Lymphedema. Plast Reconstr Surg Glob Open 7 (2): e2149, 2019. [PUBMED Abstract]
- Gratzon A, Schultz J, Secrest K, et al.: Clinical and Psychosocial Outcomes of Vascularized Lymph Node Transfer for the Treatment of Upper Extremity Lymphedema After Breast Cancer Therapy. Ann Surg Oncol 24 (6): 1475-1481, 2017. [PUBMED Abstract]
- Chen WF, Zeng WF, Hawkes PJ, et al.: Lymphedema Liposuction with Immediate Limb Contouring. Plast Reconstr Surg Glob Open 7 (11): e2513, 2019. [PUBMED Abstract]
- Lee D, Piller N, Hoffner M, et al.: Liposuction of Postmastectomy Arm Lymphedema Decreases the Incidence of Erysipelas. Lymphology 49 (2): 85-92, 2016. [PUBMED Abstract]
- Hoffner M, Ohlin K, Svensson B, et al.: Liposuction Gives Complete Reduction of Arm Lymphedema following Breast Cancer Treatment-A 5-year Prospective Study in 105 Patients without Recurrence. Plast Reconstr Surg Glob Open 6 (8): e1912, 2018. [PUBMED Abstract]
- Baxter GD, Liu L, Petrich S, et al.: Low level laser therapy (Photobiomodulation therapy) for breast cancer-related lymphedema: a systematic review. BMC Cancer 17 (1): 833, 2017. [PUBMED Abstract]
- Menzer C, Aleisa A, Wilson BN, et al.: Efficacy of laser CO2 treatment for refractory lymphedema secondary to cancer treatments. Lasers Surg Med 54 (3): 337-341, 2022. [PUBMED Abstract]
Intervenciones específicas de la enfermedad para la prevención o el tratamiento del linfedema
Cáncer de mama: Prevención del linfedema
Prendas de compresión
En un estudio aleatorizado de mujeres que se sometieron a disección axilar se indicó que las mangas de compresión que se usaron desde el primer día posoperatorio hasta 3 meses después de finalizar la terapia adyuvante, redujeron el riesgo de linfedema.[1][Nivel de evidencia: I] Las mujeres (n = 155) que se asignaron al azar a la intervención de compresión presentaron menos hinchazón en el brazo, según se determinó mediate los umbrales de espectroscopia por bioimpedancia (BIS) y aumento del volumen relativo del brazo (AVRB) que las mujeres que se asignaron a la atención habitual. La incidencia acumulada de la hinchazón del brazo a 1 año fue del 42 % mediante BIS y del 14 % mediante AVRB en las mujeres que usaron prendas de compresión, en comparación con el 52 % y el 25 %, respectivamente, para la atención habitual. El cociente de riesgos para el inicio de hinchazón en el brazo del grupo de compresión en comparación con el grupo de control fue de 0,61 (intervalo de confianza (IC), 95 %, 0,43–0,85; P = 0,004) mediate BIS y 0,56 (IC 95 %, 0,33–0,96; P = 0,034) mediante AVRB. No hubo diferencias en los desenlaces que las pacientes informaron.
Ejercicio
En un ensayo aleatorizado se indicó que es posible que el ejercicio ayude a prevenir el linfedema después de la cirugía para el cáncer de mama.[2][Nivel de evidencia: I] Los investigadores asignaron al azar a 77 mujeres aptas a un grupo de control o a un grupo con membresía a un gimnasio por 12 meses y sesiones de entrenamiento de levantamiento de pesas por 13 semanas. Los criterios de selección incluyeron diagnóstico de cáncer de mama en el transcurso de 1 a 5 años, extirpación de al menos 2 ganglios linfáticos, índice de masa corporal (IMC) menor que 50, ausencia de antecedentes de linfedema y ausencia de asimetría en los brazos mayor que el 10 %. El desenlace primario fue un aumento en el volumen del brazo afectado mayor al 5 % en 1 año. El desenlace secundario fue linfedema definido por el médico. Los porcentajes de las mujeres que cumplieron con los criterios para el desenlace primario en las cohortes de control y levantamiento de pesas fueron del 17 % y el 11 %, respectivamente (P = 0,04). La reducción en la tasa de las mujeres que se sometieron a la extirpación de 5 o más ganglios linfáticos fue aún mayor (22 % en la cohorte de control vs. 7 % en la cohorte de levantamiento de pesas; P = 0,003). Sin embargo, no hubo diferencias en las tasas de linfedema definido por el médico, que fueron mucho más bajas en cada grupo (4,4 % en la cohorte de control vs. 1,5 % en la cohorte de levantamiento de pesas).
En un ensayo aleatorizado de 2021 se estudió a pacientes con cáncer de mama que se sometieron a disección de ganglio linfático axilar o centinela.[3][Nivel de evidencia: I] Los investigadores asignaron al azar a 568 mujeres a uno de dos grupos. Todas las participantes se reunieron con un educador capacitado en prevención de linfedema y recibieron información sobre el linfedema, incluso sobre las prácticas preventivas de autocuidado. Las 315 mujeres que recibieron la intervención activa se reunieron con un fisioterapeuta que les proporcionó un programa de ejercicios individual, pesas y una manga de compresión elástica para que la usaran. El criterio principal de valoración fue la tasa sin linfedema a los 18 meses. El linfedema se definió por un aumento en el volumen de la extremidad afectada de más del 10 % o el diagnóstico del médico. No hubo diferencias entre los grupos en cuanto al criterio principal de valoración. En general, el 69 % de las participantes en el grupo de educación sola y el 70 % en el grupo de intervención no presentaron linfedema al cabo de 18 meses. Aunque el cumplimiento en el grupo de intervención fue escaso (menos del 50 %) debido a las limitaciones de tiempo y la falta de percepción del beneficio. No hubo diferencias en la calidad de vida relacionada con la salud entre las cohortes.[4]
En la actualidad, la terapia de ejercicio junto con prendas de compresión quizás no prevenga el linfedema de forma eficaz. La terapia de ejercicio con otras intervenciones está en investigación. Por ejemplo, en un estudio se informaron los resultados de un ensayo aleatorizado sobre el drenaje linfático manual en adición a la terapia de ejercicio para prevenir el linfedema.[5][Nivel de evidencia: I] Los investigadores asignaron al azar a 160 mujeres a recibir drenaje linfático manual, o a no recibirlo, en adición al ejercicio y sugerencias para reducir el linfedema. Las participantes se sometieron a mediciones seriales del volumen. Al cabo de 6 meses, el 24 % de las mujeres en el grupo de intervención y el 19 % en el grupo de control presentaron un aumento en el volumen de más de 200 ml.
Cáncer de mama: Tratamiento del linfedema
Terapia descongestiva completa
Las mangas de compresión solas quizás prevengan la progresión del linfedema menos grave, pero con frecuencia las mujeres necesitan intervenciones más intensivas.[6][Nivel de evidencia: I] En un estudio, 103 mujeres presentaron linfedema posterior al cáncer de mama que causó, por lo menos, un aumento del 10 % en el volumen del miembro afectado, en comparación con el miembro no afectado. Las participantes se asignaron al azar a recibir terapia descongestiva completa (TDC) con prendas de compresión elásticas y 20 sesiones diarias de drenaje linfático manual con un terapeuta capacitado (n = 57) o prendas de compresión elásticas solas (n = 46).[7][Nivel de evidencia: I] El desenlace primario fue el cambio porcentual en el exceso de volumen del miembro desde el inicio hasta las 6 semanas. Las mujeres asignadas a recibir TDC experimentaron una pérdida de volumen absoluta mayor que las mujeres tratadas con prendas de compresión solas (250 ml vs. 143 ml). Sin embargo, no hubo ninguna diferencia en la media de reducción del exceso de volumen del miembro entre los grupos debido a las diferencias iniciales en el volumen del miembro en las 2 cohortes. Además, no hubo diferencias en los desenlaces secundarios y la función del miembro.
Actividad física
Los resultados de ensayos aleatorizados de actividad o ejercicio físicos, en comparación con la atención habitual, no demuestran de manera sistemática ningún beneficio para los pacientes con cáncer de mama y linfedema. En un estudio se observó que las mujeres sometidas a extirpación amplia y disección de ganglios linfáticos axilares y que se asignaron al azar a un programa de ejercicio supervisado (3 horas por semana durante 12 semanas) notificaron menos síntomas relacionados con el linfedema que las mujeres asignadas a un grupo de control.[8][Nivel de evidencia: I] El grupo de ejercicio demostró una mayor reducción del líquido extracelular, según se evaluó con espectroscopia por bioimpedancia, en comparación con el grupo de control. No hubo ninguna diferencia significativa en el grosor dérmico de la mama, según la evaluación mediante ecografía.
A partir de los resultados prometedores de una intervención de ejercicio institucional, en un ensayo se utilizó un diseño factorial de 2 x 2 para probar un programa de ejercicio en el hogar, con o sin una intervención para pérdida de peso dirigida por un dietista.[9][Nivel de evidencia: I] Los investigadores asignaron al azar a 351 mujeres aptas a 1 de 4 grupos: control (n = 90), ejercicio solo (n = 87), pérdida de peso sola (n = 87) y ejercicio y pérdida de peso combinados (n = 87). Todos los pacientes recibieron prendas de compresión y asistieron a consultas con terapeutas de linfedema certificados. Los criterios de selección incluyeron indicios de linfedema en el examen clínico o antecedentes de linfedema más de 6 meses después de la cirugía, un IMC entre 25 y 50, y la capacidad de hacer ejercicio, pero sin antecedentes de ejercicio constante. El desenlace primario fue la diferencia porcentual entre los miembros afectados y los no afectados. Los desenlaces secundarios incluyeron evaluación clínica, encuestas a pacientes y tasas de exacerbación del linfedema o celulitis. No se observaron diferencias notables entre los distintos grupos respecto a los desenlaces. Este resultado plantea la posibilidad de que las terapias en el hogar sean inferiores al tratamiento institucional. La función de la pérdida de peso, si la hay, aún requiere aclararse.
Trasplante de ganglios linfáticos
Se notificó un ensayo aleatorizado de trasplante microquirúrgico de ganglios linfáticos y fisioterapia de compresión versus fisioterapia de compresión sola.[10][Nivel de evidencia: I] Los 18 pacientes que se sometieron a cirugía tuvieron una mayor reducción en el volumen de los miembros (57 vs. 18 %), menos complicaciones infecciosas por el linfedema y mejoría de los síntomas y estado funcional, en comparación con los pacientes que recibieron fisioterapia de compresión sola. Los autores estimaron que el procedimiento tuvo una buena rentabilidad cuando se tuvo en cuenta la reducción de las complicaciones del linfedema.
Cáncer de cuello uterino: Prevención del linfedema
En un estudio participaron 120 mujeres con cáncer de cuello uterino que se sometieron a una histerectomía radical laparoscópica con linfadenectomía pélvica. Las participantes se asignaron al azar a una intervención de educación sola o a una intervención con TDC.[11][Nivel de evidencia: I] La TDC consistió en capacitación en drenaje linfático manual, seguida de drenaje linfático manual autoadministrado en el hogar, medias de compresión y un programa de ejercicios aeróbicos. Las intervenciones comenzaron de 7 a 10 días después de la cirugía. Otros criterios de selección fueron la extirpación de más de 20 ganglios linfáticos o radioterapia anticipada (ambos factores de riesgo del linfedema de los miembros inferiores después de la cirugía por cáncer de cuello uterino). El desenlace primario fue el volumen de los miembros calculado a partir de mediciones de circunferencia múltiple. Los desenlaces secundarios incluyeron síntomas autonotificados de los pacientes relacionados con el linfedema. Al cabo de un seguimiento de 1 año, 20 de 58 pacientes (24 %) en el grupo de control y 8 de 59 (14 %) en el grupo de TDC presentaron linfedema (P = 0,008). El exceso de volumen también fue menor en el grupo experimental. Sin embargo, no hubo ninguna diferencia en los síntomas notificados por los pacientes ni en la clasificación de la gravedad del linfedema. Estos resultados prometedores fueron respaldados por un estudio piloto más pequeño[12] y una revisión retrospectiva de una experiencia de una sola institución con mujeres que presentaron linfedema después del tratamiento de varios cánceres ginecológicos.[13]
Cáncer de cabeza y cuello: Tratamiento del linfedema
Revisión sistemática
En una revisión sistemática se examinaron publicaciones relacionadas con el tratamiento del linfedema en pacientes tratados por cánceres de cabeza y cuello.[14] Los autores identificaron 23 estudios primarios, incluidos 14 estudios de cohortes, 7 informes de casos y 2 ensayos controlados aleatorizados. Las intervenciones incluyeron drenaje linfático manual, acupuntura, administración de suplementos de selenio y liposucción.
Terapia descongestiva completa
En un ensayo aleatorizado pequeño de pacientes con linfedema después de la cirugía para cáncer de cabeza y cuello, 21 pacientes se asignaron a uno de 3 grupos: control (n = 7), terapia descongestiva completa (TDC) (n = 7) y terapia en el hogar (n = 7).[15] Se enseñaron técnicas manuales de drenaje linfático a los pacientes que recibieron terapia en el hogar. Los pacientes que recibieron TDC usaron una máscara de compresión y un terapeuta capacitado les administró drenaje linfático manual; el tiempo dedicado fue significativo; estos pacientes experimentaron una mayor reducción del volumen y no presentaron complicaciones fibróticas. El pequeño tamaño de la muestra y el tiempo requerido para recibir TDC indicaron que el efecto se debe verificar en un estudio más grande antes de que se pueda adoptar de más amplia.
Dispositivo de compresión neumática avanzada
La escasez de terapeutas con capacitación para el linfedema y la inconveniencia de realizar múltiples visitas clínicas han alentado la creación de un dispositivo que los pacientes pueden usar en el hogar. En un ensayo aleatorizado pequeño de dicho dispositivo, los pacientes se asignaron al dispositivo (n = 24) o a un control de lista de espera (n = 25).[16] A las 8 semanas, los pacientes del grupo de tratamiento activo notificaron menos síntomas de angustia y los exámenes endoscópicos repetidos revelaron menos edema, en comparación con los pacientes del grupo de control. No se modificaron las evaluaciones funcionales. Los autores indicaron que los pacientes solían usar el dispositivo 1 vez al día, en lugar de las 2 veces al día prescritas. Son necesarios más estudios.
Liposucción
Se ha realizado un ensayo aleatorizado pequeño de liposucción submentoniana de pacientes que se quejaron de hinchazón después del tratamiento del cáncer de cabeza y cuello. Los 10 pacientes que se sometieron a una liposucción notificaron mejoras más importantes en la apariencia personal a los 6 meses, en comparación con los pacientes de control. No se notificaron efectos adversos de la liposucción.[17][Nivel de evidencia: I]
Sarcoma de las extremidades: Prevención del linfedema
En un estudio se comparó la incidencia de linfedema en una cohorte de 8 pacientes con sarcoma de muslo, a los que se realizó anastomosis linfático-venosas en combinación con resección de tumores de tejido blando de muslo, con una cohorte histórica de 20 pacientes.[18] Solo 1 de 8 pacientes presentó linfedema, en comparación con 9 pacientes de la cohorte histórica. Los síntomas autonotificados por los pacientes fueron infrecuentes en los 8 pacientes.
Bibliografía
- Paramanandam VS, Dylke E, Clark GM, et al.: Prophylactic Use of Compression Sleeves Reduces the Incidence of Arm Swelling in Women at High Risk of Breast Cancer-Related Lymphedema: A Randomized Controlled Trial. J Clin Oncol 40 (18): 2004-2012, 2022. [PUBMED Abstract]
- Schmitz KH, Ahmed RL, Troxel AB, et al.: Weight lifting for women at risk for breast cancer-related lymphedema: a randomized trial. JAMA 304 (24): 2699-705, 2010. [PUBMED Abstract]
- Paskett ED, Le-Rademacher J, Oliveri JM, et al.: A randomized study to prevent lymphedema in women treated for breast cancer: CALGB 70305 (Alliance). Cancer 127 (2): 291-299, 2021. [PUBMED Abstract]
- Naughton MJ, Liu H, Seisler DK, et al.: Health-related quality of life outcomes for the LEAP study-CALGB 70305 (Alliance): A lymphedema prevention intervention trial for newly diagnosed breast cancer patients. Cancer 127 (2): 300-309, 2021. [PUBMED Abstract]
- Devoogdt N, Geraerts I, Van Kampen M, et al.: Manual lymph drainage may not have a preventive effect on the development of breast cancer-related lymphoedema in the long term: a randomised trial. J Physiother 64 (4): 245-254, 2018. [PUBMED Abstract]
- Blom KY, Johansson KI, Nilsson-Wikmar LB, et al.: Early intervention with compression garments prevents progression in mild breast cancer-related arm lymphedema: a randomized controlled trial. Acta Oncol 61 (7): 897-905, 2022. [PUBMED Abstract]
- Dayes IS, Whelan TJ, Julian JA, et al.: Randomized trial of decongestive lymphatic therapy for the treatment of lymphedema in women with breast cancer. J Clin Oncol 31 (30): 3758-63, 2013. [PUBMED Abstract]
- Kilbreath SL, Ward LC, Davis GM, et al.: Reduction of breast lymphoedema secondary to breast cancer: a randomised controlled exercise trial. Breast Cancer Res Treat 184 (2): 459-467, 2020. [PUBMED Abstract]
- Schmitz KH, Troxel AB, Dean LT, et al.: Effect of Home-Based Exercise and Weight Loss Programs on Breast Cancer-Related Lymphedema Outcomes Among Overweight Breast Cancer Survivors: The WISER Survivor Randomized Clinical Trial. JAMA Oncol 5 (11): 1605-1613, 2019. [PUBMED Abstract]
- Dionyssiou D, Demiri E, Tsimponis A, et al.: A randomized control study of treating secondary stage II breast cancer-related lymphoedema with free lymph node transfer. Breast Cancer Res Treat 156 (1): 73-9, 2016. [PUBMED Abstract]
- Wang X, Ding Y, Cai HY, et al.: Effectiveness of modified complex decongestive physiotherapy for preventing lower extremity lymphedema after radical surgery for cervical cancer: a randomized controlled trial. Int J Gynecol Cancer 30 (6): 757-763, 2020. [PUBMED Abstract]
- Shallwani SM, Towers A, Newman A, et al.: Feasibility of a Pilot Randomized Controlled Trial Examining a Multidimensional Intervention in Women with Gynecological Cancer at Risk of Lymphedema. Curr Oncol 28 (1): 455-470, 2021. [PUBMED Abstract]
- Liao SF, Li SH, Huang HY: The efficacy of complex decongestive physiotherapy (CDP) and predictive factors of response to CDP in lower limb lymphedema (LLL) after pelvic cancer treatment. Gynecol Oncol 125 (3): 712-5, 2012. [PUBMED Abstract]
- Tyker A, Franco J, Massa ST, et al.: Treatment for lymphedema following head and neck cancer therapy: A systematic review. Am J Otolaryngol 40 (5): 761-769, 2019. [PUBMED Abstract]
- Ozdemir K, Keser I, Duzlu M, et al.: The Effects of Clinical and Home-based Physiotherapy Programs in Secondary Head and Neck Lymphedema. Laryngoscope 131 (5): E1550-E1557, 2021. [PUBMED Abstract]
- Ridner SH, Dietrich MS, Deng J, et al.: Advanced pneumatic compression for treatment of lymphedema of the head and neck: a randomized wait-list controlled trial. Support Care Cancer 29 (2): 795-803, 2021. [PUBMED Abstract]
- Alamoudi U, Taylor B, MacKay C, et al.: Submental liposuction for the management of lymphedema following head and neck cancer treatment: a randomized controlled trial. J Otolaryngol Head Neck Surg 47 (1): 22, 2018. [PUBMED Abstract]
- Wagner JM, Dadras M, Ufton D, et al.: Prophylactic lymphaticovenous anastomoses for resection of soft tissue tumors of the thigh to prevent secondary lymphedema-a retrospective comparative cohort analysis. Microsurgery 42 (3): 239-245, 2022. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (04/11/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre los cuidados médicos de apoyo y los cuidados paliativos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre la fisiopatología y el tratamiento del linfedema. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre los cuidados médicos de apoyo y los cuidados paliativos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Linfedema son:
- Larry D. Cripe, MD (Indiana University School of Medicine)
- James T. Pastrnak, MD (Indiana University School of Medicine)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre los cuidados médicos de apoyo y los cuidados paliativos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre los cuidados médicos de apoyo y los cuidados paliativos. PDQ Linfedema. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/cancer/tratamiento/efectos-secundarios/linfedema/linfedema-pro-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.