Tratamiento del cáncer de orofaringe (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de orofaringe
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por cáncer de cavidad oral y faringe en los Estados Unidos para 2025:[1]
- Casos nuevos: 59 660.
- Defunciones: 12 770.
El aumento en la incidencia del cáncer de orofaringe se atribuye al incremento de casos relacionados con el virus del papiloma humano (VPH). La probabilidad de presentar este cáncer es casi el triple en los hombres que en las mujeres.[1,2]
Características anatómicas
Desde el punto de vista anatómico, la orofaringe se sitúa entre el paladar blando (arriba) y el hueso hioides (abajo). Se comunica con la cavidad oral en su porción anterior, con la nasofaringe en su porción superior, y con la laringe supraglótica y la hipofaringe en su porción inferior.
La orofaringe se divide en las siguientes partes:[3]
- Base de la lengua, que incluye los pliegues faringoepiglóticos y glosoepiglóticos.
- Valécula.
- Región amigdalina, que incluye las fosas amigdalinas, y los pilares anterior y posterior.
- Paladar blando, que incluye la úvula.
- Paredes faríngeas posterior y lateral.
Características anatómicas de los ganglios linfáticos regionales de la cabeza y el cuello
Los ganglios linfáticos regionales de la cabeza y el cuello son los ganglios linfáticos que corren de forma paralela a las venas yugulares, el nervio accesorio espinal y la arteria facial, y entran en el triángulo submandibular. La comprensión de las características anatómicas regionales y del estado de los ganglios linfáticos regionales es muy importante para la atención de los pacientes con cáncer de cabeza y cuello.[4-6] Con el fin de facilitar la comunicación de las características anatómicas de los ganglios linfáticos, las regiones del cuello se dividen en niveles I a IV y en un área retrofaríngea.
- El nivel I contiene los ganglios linfáticos submentonianos y submandibulares.
- El nivel II contiene los ganglios linfáticos yugulares superiores, que están encima del músculo digástrico.
- El nivel III contiene los ganglios linfáticos yugulares medios, que están entre el músculo omohioideo y el músculo digástrico.
- El nivel IV contiene los ganglios linfáticos yugulares inferiores.
- El nivel V contiene los ganglios linfáticos del triángulo posterior.
- Ganglios linfáticos retrofaríngeos.
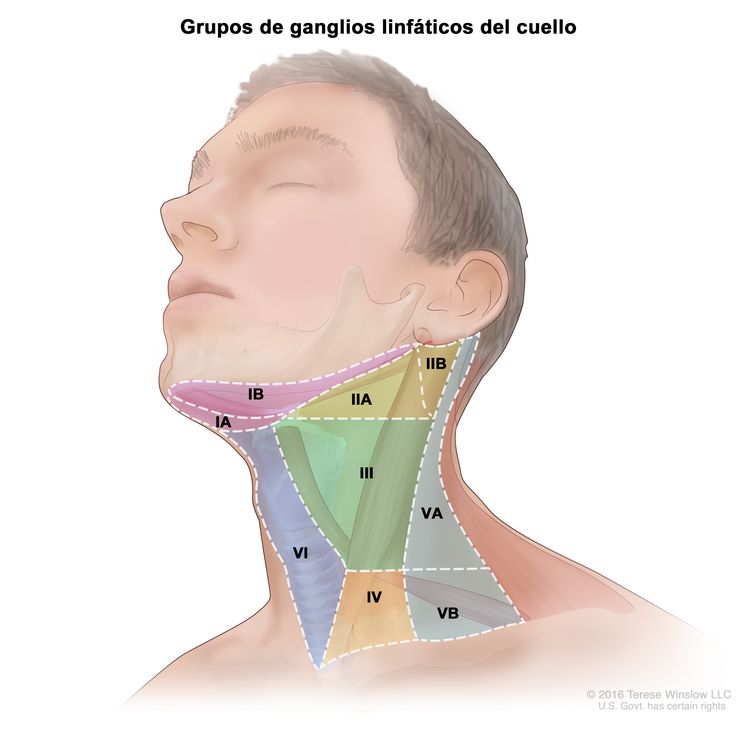
Los ganglios linfáticos retrofaríngeos son un sitio posible de diseminación ganglionar del cáncer de orofaringe. En un estudio retrospectivo grande de cohortes del MD Anderson Cancer Center se describieron las características clínicas de 981 pacientes con cáncer de orofaringe que se sometieron a radioterapia primaria.[7][Nivel de evidencia C1][Nivel de evidencia C2]
- La base de la lengua (47 %) y la amígdala (46 %) fueron los sitios primarios más comunes.
- La mayoría de los pacientes tenían tumores primarios en los estadios T1 a T2 (64 %) y enfermedad en los estadios III a IVB (94 %).
- La incidencia de compromiso ganglionar retrofaríngeo en las radiografías fue del 10 %, más alta en la pared faríngea (23 %) y más baja en la base de la lengua (6 %).
- En un análisis multivariante, el compromiso ganglionar retrofaríngeo se relacionó con menor control local a 5 años, y con resultados más precarios de supervivencia sin recaída y supervivencia general.
Factores de riesgo
Los factores de riesgo del carcinoma de células escamosas (CCE) de orofaringe son los siguientes:[8]
- Antecedentes de consumo de tabaco con un índice de 10 paquetes-año y consumo de otros tipos de tabaco.[9,10]
- Consumo excesivo de bebidas alcohólicas.
- Infección por el virus del papiloma humano (VPH), en especial el VHP de tipo 16, que también se llama VPH-16.[11-13]
- Antecedentes personales de cáncer de cabeza y cuello.
- Betel masticable.
Para obtener más información, consultar Prevención de los cánceres de cavidad oral, orofaringe, hipofaringe y laringe.
Infección por el virus del papiloma humano
Debido a la disminución de la incidencia de consumo de tabaco en los Estados Unidos, el cáncer de orofaringe relacionado con el consumo de tabaco que es negativo para el VPH está en disminución; sin embargo, la incidencia de cáncer de orofaringe positivo para el VPH está en aumento. Según los datos del repositorio de tejidos del Programa Surveillance, Epidemiology and End Results (SEER) de 1988 a 2004, la prevalencia de cáncer de orofaringe negativo para el VPH disminuyó en un 50 % y la prevalencia del cáncer de orofaringe positivo para el VPH aumentó en un 225 %.[14][Nivel de evidencia C1]
Los cánceres de orofaringe positivos para el VPH quizás representen una entidad patológica distinta cuya causa es la infección por el VPH y que se vincula con mejor pronóstico. En varios estudios, se indica que la supervivencia de los pacientes con tumores positivos para el VPH es mucho mayor.[12,15-17] En la estadificación de la 8a edición del American Joint Committee on Cancer se divide la estadificación del cáncer de orofaringe según la presencia o ausencia de la infección por el VPH debido a su importancia pronóstica.[5,6] En un estudio prospectivo de 253 pacientes con CCE de cabeza y cuello recién diagnosticado o recidivante, se detectó el VPH en el 25 % de los pacientes. El grado avanzado del tumor y un sitio en la orofaringe aumentaron de manera independiente la probabilidad de la presencia del HPV.[12] Es más probable que los tumores de orofaringe sean positivos para el VPH (57 %) que los tumores de cavidad oral (12 %) y los tumores de otros sitios fuera de la orofaringe (14 %). La mayoría de los cánceres de orofaringe positivos para el VPH surgen en las amígdalas palatinas o linguales. En los sitios de la amígdala o la base de la lengua, el 62 % de los tumores fueron positivos para el VPH en comparación con el 25 % de los tumores en otros sitios de la orofaringe.
Antecedentes personales de cáncer de cabeza y cuello
El riesgo de un segundo tumor primario en pacientes con tumores de tubo aerodigestivo superior se calculó en un 3 % a 7 % por año.[18,19] A causa de este riesgo, estos pacientes se deben vigilar de por vida. El consumo de tabaco y el consumo de bebidas alcohólicas después del tratamiento se relacionan con segundos tumores primarios en el tubo aerodigestivo.[20-22] Es posible que los pacientes necesiten asesoramiento para abandonar el consumo de tabaco y bebidas alcohólicas.
El proceso de campo de cancerización quizás explique, en parte, los múltiples CCE primarios sincrónicos que se presentan en pacientes con cáncer de orofaringe y que se relacionan con antecedentes de consumo de tabaco. Este concepto, descrito originalmente en 1953, plantea que los tumores se forman de manera multifocal dentro de un campo de tejido expuesto a carcinógenos en forma crónica.[23] Los estudios moleculares que detectan alteraciones genéticas en tejido histológicamente normal en personas de riesgo alto, avalan este concepto.[24-28]
Se llevó a cabo una comparación de pacientes (N = 2230) con un CCE inicial en un sitio de la orofaringe y otros pacientes con un CCE inicial en otros sitios fuera de la orofaringe (es decir, cavidad oral, laringe e hipofaringe) para determinar la probabilidad de segundas neoplasias malignas primarias. La tasa de segundas neoplasias malignas primarias fue más baja en los pacientes con un CCE inicial en la orofaringe que en los pacientes con un cáncer inicial fuera de la orofaringe (P < 0,001). Entre los pacientes con CCE de orofaringe, los exfumadores tuvieron un riesgo 50 % más alto de una segunda neoplasia maligna primaria que quienes nunca habían fumado; los fumadores activos tuvieron un riesgo 100 % más alto que quienes nunca habían fumado (tendencia de P = 0,008). Estos datos indican que los pacientes que se ajustan al fenotipo típico del VPH tienen un riesgo muy bajo de una segunda neoplasia maligna primaria.[29]
Betel masticable
El consumo de betel masticable, una preparación estimulante común en partes de Asia, aumenta el riesgo de cáncer de orofaringe.[30]
Otros factores de riesgo
Otros factores de riesgo son los siguientes:[8]
- Eliminación deficiente del acetaldehído, un carcinógeno del metabolismo del alcohol. En las personas, sobre todo aquellas de raza de Asia Oriental, que son portadoras de un alelo mutado inactivo de la alcohol 2-deshidrogenasa, el consumo de bebidas alcohólicas se relaciona con una susceptibilidad a múltiples cánceres de orofaringe metacrónicos debido a una disminución de la eliminación del acetaldehído.[31]
El CCE de orofaringe no se ha asociado con ninguna anomalía cromosómica o genética específica. Las anomalías genéticas y cromosómicas de estos cánceres son complejas.[32,33] Pese a la ausencia de anomalías genéticas específicas, es posible que los exámenes para detectar alteraciones genéticas o ploidía en las lesiones iniciales en la orofaringe permitan identificar a los pacientes con mayor riesgo de progresión de la enfermedad, lo que conlleva un tratamiento más definitivo.[34]
Cuadro clínico inicial
El cuadro clínico inicial del cáncer de orofaringe depende de la localización del tumor en la orofaringe. El cáncer de orofaringe se presenta en los siguientes sitios:
- Amígdala, fosa amigdalina, pilares amigdalinos o surco glosoamigdalino.
- Base de la lengua (tercio posterior de la lengua hasta las papilas caliciformes).
- Valécula.
- Paladar blando, superficie inferior o úvula.
- Pared faríngea posterior.
Amígdala
El pilar amigdalino anterior y la amígdala son los sitios más comunes de los tumores primarios de orofaringe.[3] Las lesiones que comprometen el pilar amigdalino anterior a veces se ven como áreas de displasia, inflamación o como una lesión de diseminación superficial. En ocasiones, estos cánceres se diseminan por una región amplia que incluye la porción lateral del paladar blando, el trígono retromolar, la mucosa yugal y la fosa amigdalina.[3,4] El drenaje linfático se dirige de manera primaria a los ganglios del nivel II.
Es posibles que los tumores de pilar amigdalino posterior se diseminen hacia abajo hasta comprometer el pliegue faringoepiglótico y la cara posterior del cartílago tiroideo. Estas lesiones afectan con mayor frecuencia los ganglios del nivel V.
Las lesiones en la fosa amigdalina a veces son exofíticas o ulcerosas, y exhiben un modelo de diseminación similar a las lesiones en el pilar amigdalino anterior. Estos tumores se presentan como una enfermedad en estadio avanzado con más frecuencia que los cánceres de pilar amigdalino. Alrededor del 75 % de los pacientes presentan la enfermedad en estadio III o estadio IV.[3,4] El drenaje linfático se dirige de manera primaria a los ganglios del nivel V. Es posibles que los tumores de pilar amigdalino posterior se diseminen hacia abajo hasta comprometer el pliegue faringoepiglótico y la cara posterior del cartílago tiroideo. Estas lesiones afectan con mayor frecuencia los ganglios del nivel V.
Los signos y síntomas de las lesiones amigdalinas son los siguientes:[3,4]
- Dolor.
- Disfagia.
- Pérdida de peso.
- Otalgia ipsilateral referida.
- Masa en el cuello.
Base de la lengua
Desde el punto de vista clínico, los cánceres que surgen en la base de la lengua son insidiosos. Estos cánceres crecen según un patrón infiltrante o exofítico. Debido a que la base de la lengua carece de fibras de dolor, estos tumores suelen ser asintomáticos hasta que hay progresión tumoral significativa.[3]
Los signos y síntomas de los cánceres de base de la lengua en estadio avanzado son los siguientes:[3,4]
- Dolor.
- Disfagia.
- Pérdida de peso.
- Otalgia referida secundaria al compromiso de nervios craneales.
- Trismo secundario al compromiso del músculo pterigoideo.
- Fijación de la lengua por infiltración muscular profunda.
- Masa en el cuello.
Las metástasis en los ganglios linfáticos son comunes debido al abundante drenaje linfático de la base de la lengua. Alrededor del 70 % o más de los pacientes con cáncer de base de la lengua en estadio avanzado tienen metástasis ganglionares cervicales ipsilaterales; el 30 % o menos de los pacientes tienen metástasis ganglionares cervicales bilaterales.[3,35] Los ganglios linfáticos cervicales comprometidos con mayor frecuencia están en los niveles II, III, IV y V, así como los ganglios linfáticos retrofaríngeos.
Paladar blando
Los tumores de paladar blando se encuentran más a menudo en la superficie anterior.[3] Es posible que las lesiones en esta área permanezcan superficiales y en estadios tempranos.[4] El drenaje linfático se dirige de manera primaria a los ganglios del nivel II.
Pared faríngea
Las lesiones en la pared faríngea se pueden diseminar hacia arriba a la nasofaringe, hacia atrás a la fascia prevertebral y hacia abajo a los senos piriformes y las paredes hipofaríngeas. El drenaje linfático se dirige de manera primaria a los ganglios retrofaríngeos, y a los ganglios de los niveles II y III. Debido a que la mayoría de los tumores faríngeos se diseminan más allá de la línea media, las metástasis cervicales bilaterales son comunes.
Los tumores en estadio temprano suelen ser asintomáticos. Por lo general, los tumores que surgen en la pared faríngea se diagnostican en estadio avanzado.[3,4]
Los signos y síntomas de los tumores de pared faríngea en estadio avanzado son los siguientes:
- Dolor.
- Hemorragia.
- Disfagia.
- Pérdida de peso.
- Masa en el cuello.
Leucoplasia
Los términos leucoplasia o leucoplaquia solo se usan como términos clínicos para describir lo que el observador ve como un mancha blanca que no se quita al frotarla; la importancia de esta observación dependerá de los hallazgos histológicos.[8] La leucoplasia incluye desde una hiperqueratosis hasta un carcinoma invasivo temprano, incluso, a veces es solo una infección micótica, liquen plano u otra enfermedad oral benigna.
Evaluación diagnóstica
Cuando es posible, la evaluación del tumor primario se basa en la inspección y palpación así como en un examen indirecto con espejos. Las áreas correspondientes de drenaje ganglionar se examinan mediante palpación cuidadosa. Se debe confirmar el tumor mediante estudio histológico. También se consideran los datos patológicos obtenidos en la biopsia y otros estudios radiográficos.
Para evaluar el tumor primario se usan los siguientes procedimientos:
- Tomografía por emisión de positrones con tomografía computarizada (TEP-TC).
- Imágenes por resonancia magnética.
- Endoscopia.
- Laringoscopia.
- Biopsia y pruebas de p16 para evaluar el estado del VPH.
La TEP-TC produce datos morfológicos y metabólicos que sirven para detectar un tumor primario, enfermedad ganglionar y enfermedad metastásica a distancia. También es posible utilizarla para orientar la planificación de la radioterapia. En datos retrospectivos se demostró que los parámetros morfológicos y glicolíticos de la TEP (medidos mediante TEP-TC con fluorodesoxiglucosa) son mucho más grandes (según el diámetro más grande de Response Evaluation Criteria In Solid Tumors [RECIST]) y más heterogéneos en la enfermedad negativa para el VPH que en la enfermedad positiva para el VPH en un tumor primario del carcinoma de orofaringe. Estos parámetros de la TEP-TC también tienen valores más altos del valor de captación normalizado (VCN) máximo, la media del VCN y el volumen metabólico tumoral. Sin embargo, los mismos parámetros de TEP a menudo son más altos en la enfermedad ganglionar regional en pacientes con enfermedad positiva para el VPH.[36][Nivel de evidencia C3]
Factores pronósticos y supervivencia
Los factores pronósticos del carcinoma de orofaringe son los siguientes:
- Estado del VPH.
- Antecedentes de consumo de tabaco (índice de 10 paquetes-año o más alto).
- Estadio del tumor y estadio ganglionar.
Los criterios descritos en el Cuadro 1 se utilizan para determinar si los pacientes tienen riesgo bajo, riesgo intermedio o riesgo alto de carcinoma de orofaringe. Estos criterios se definieron mediante análisis de partición recursiva en un análisis retrospectivo de un ensayo aleatorizado de pacientes con CCE de orofaringe en estadios III y IV tratados con quimiorradiación.[17]
| Grado de riesgo | Características | Tasa de SG a 3 años |
|---|---|---|
| IC = intervalo de confianza; SG = supervivencia general; VPH = virus del papiloma humano; + = positivo; - = negativo Para obtener más información, consultar la sección Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer. | ||
| aAng KK, Harris J, Wheeler R, et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 363 (1): 24–35, 2010. | ||
| Bajo | VPH+, antecedentes de consumo de tabaco con índice de ≤10 paquetes-año y antecedentes de enfermedad ganglionar N0–N2a | 93 % (IC 95 %, 88,3–97,7 %) |
| Intermedio | VPH+, antecedentes de consumo de tabaco con índice de >10 paquetes-año y antecedentes de enfermedad ganglionar N2b–N3; o | 70,8 % (IC 95 %, 60,7–80,8 %) |
| VPH-, antecedentes de consumo de tabaco con índice de ≤10 paquetes-año y antecedentes de enfermedad ganglionar N2b–N3, o tumores T2–T3 | ||
| Alto | VPH-, antecedentes de consumo de tabaco con índice de >10 paquetes-año o | 46,2 % (IC 95 %, 34,7–57,7 %) |
| VPH-, antecedentes de consumo de tabaco con índice de ≤10 paquetes-año y enfermedad T4 | ||
Seguimiento después del tratamiento
Un examen cuidadoso de la cabeza y el cuello del paciente permite al médico determinar si hay recidiva y se debe hacer cada 6 a 12 semanas durante el primer año postratamiento, cada 3 meses durante el segundo año, cada 3 o 4 meses durante el tercer año y, a partir de entonces cada 6 meses.
Bibliografía
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Bray F, Laversanne M, Sung H, et al.: Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 74 (3): 229-263, 2024. [PUBMED Abstract]
- Choi WH, Hu KS, Culliney B, et al.: Cancer of the oropharynx. In: Harrison LB, Sessions RB, Hong WK, eds.: Head and Neck Cancer: A Multidisciplinary Approach. 3rd ed. Lippincott, William & Wilkins, 2009, pp 285-335.
- Mendenhall WM, Werning JW, Pfister DG: Treatment of head and neck cancer. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 729-80.
- HPV-Mediated (p16+) Oropharyngeal Cancer. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 113-21.
- Oropharynx (p16-) and Hypopharynx. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 123-35.
- Gunn GB, Debnam JM, Fuller CD, et al.: The impact of radiographic retropharyngeal adenopathy in oropharyngeal cancer. Cancer 119 (17): 3162-9, 2013. [PUBMED Abstract]
- Neville BW, Day TA: Oral cancer and precancerous lesions. CA Cancer J Clin 52 (4): 195-215, 2002 Jul-Aug. [PUBMED Abstract]
- Mendenhall WM, Werning JW, Pfister DG: Treatment of head and neck cancer. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 729-80.
- Licitra L, Bernier J, Grandi C, et al.: Cancer of the oropharynx. Crit Rev Oncol Hematol 41 (1): 107-22, 2002. [PUBMED Abstract]
- Mork J, Lie AK, Glattre E, et al.: Human papillomavirus infection as a risk factor for squamous-cell carcinoma of the head and neck. N Engl J Med 344 (15): 1125-31, 2001. [PUBMED Abstract]
- Gillison ML, Koch WM, Capone RB, et al.: Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. J Natl Cancer Inst 92 (9): 709-20, 2000. [PUBMED Abstract]
- D'Souza G, Kreimer AR, Viscidi R, et al.: Case-control study of human papillomavirus and oropharyngeal cancer. N Engl J Med 356 (19): 1944-56, 2007. [PUBMED Abstract]
- Chaturvedi AK, Engels EA, Pfeiffer RM, et al.: Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol 29 (32): 4294-301, 2011. [PUBMED Abstract]
- Ringström E, Peters E, Hasegawa M, et al.: Human papillomavirus type 16 and squamous cell carcinoma of the head and neck. Clin Cancer Res 8 (10): 3187-92, 2002. [PUBMED Abstract]
- Schwartz SR, Yueh B, McDougall JK, et al.: Human papillomavirus infection and survival in oral squamous cell cancer: a population-based study. Otolaryngol Head Neck Surg 125 (1): 1-9, 2001. [PUBMED Abstract]
- Ang KK, Harris J, Wheeler R, et al.: Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 363 (1): 24-35, 2010. [PUBMED Abstract]
- Khuri FR, Lippman SM, Spitz MR, et al.: Molecular epidemiology and retinoid chemoprevention of head and neck cancer. J Natl Cancer Inst 89 (3): 199-211, 1997. [PUBMED Abstract]
- León X, Quer M, Diez S, et al.: Second neoplasm in patients with head and neck cancer. Head Neck 21 (3): 204-10, 1999. [PUBMED Abstract]
- Do KA, Johnson MM, Doherty DA, et al.: Second primary tumors in patients with upper aerodigestive tract cancers: joint effects of smoking and alcohol (United States). Cancer Causes Control 14 (2): 131-8, 2003. [PUBMED Abstract]
- Khuri FR, Kim ES, Lee JJ, et al.: The impact of smoking status, disease stage, and index tumor site on second primary tumor incidence and tumor recurrence in the head and neck retinoid chemoprevention trial. Cancer Epidemiol Biomarkers Prev 10 (8): 823-9, 2001. [PUBMED Abstract]
- Day GL, Blot WJ, Shore RE, et al.: Second cancers following oral and pharyngeal cancers: role of tobacco and alcohol. J Natl Cancer Inst 86 (2): 131-7, 1994. [PUBMED Abstract]
- Slaughter DP, Southwick HW, Smejkal W: Field cancerization in oral stratified squamous epithelium: clinical implications of multicentric origin. Cancer 6 (5): 963-8, 1953. [PUBMED Abstract]
- Braakhuis BJ, Tabor MP, Leemans CR, et al.: Second primary tumors and field cancerization in oral and oropharyngeal cancer: molecular techniques provide new insights and definitions. Head Neck 24 (2): 198-206, 2002. [PUBMED Abstract]
- Braakhuis BJ, Tabor MP, Kummer JA, et al.: A genetic explanation of Slaughter's concept of field cancerization: evidence and clinical implications. Cancer Res 63 (8): 1727-30, 2003. [PUBMED Abstract]
- Tabor MP, Brakenhoff RH, van Houten VM, et al.: Persistence of genetically altered fields in head and neck cancer patients: biological and clinical implications. Clin Cancer Res 7 (6): 1523-32, 2001. [PUBMED Abstract]
- Tabor MP, Brakenhoff RH, Ruijter-Schippers HJ, et al.: Multiple head and neck tumors frequently originate from a single preneoplastic lesion. Am J Pathol 161 (3): 1051-60, 2002. [PUBMED Abstract]
- Ha PK, Califano JA: The molecular biology of mucosal field cancerization of the head and neck. Crit Rev Oral Biol Med 14 (5): 363-9, 2003. [PUBMED Abstract]
- Gan SJ, Dahlstrom KR, Peck BW, et al.: Incidence and pattern of second primary malignancies in patients with index oropharyngeal cancers versus index nonoropharyngeal head and neck cancers. Cancer 119 (14): 2593-601, 2013. [PUBMED Abstract]
- Ho PS, Ko YC, Yang YH, et al.: The incidence of oropharyngeal cancer in Taiwan: an endemic betel quid chewing area. J Oral Pathol Med 31 (4): 213-9, 2002. [PUBMED Abstract]
- Yokoyama A, Watanabe H, Fukuda H, et al.: Multiple cancers associated with esophageal and oropharyngolaryngeal squamous cell carcinoma and the aldehyde dehydrogenase-2 genotype in male Japanese drinkers. Cancer Epidemiol Biomarkers Prev 11 (9): 895-900, 2002. [PUBMED Abstract]
- Tremmel SC, Götte K, Popp S, et al.: Intratumoral genomic heterogeneity in advanced head and neck cancer detected by comparative genomic hybridization. Cancer Genet Cytogenet 144 (2): 165-74, 2003. [PUBMED Abstract]
- Brieger J, Jacob R, Riazimand HS, et al.: Chromosomal aberrations in premalignant and malignant squamous epithelium. Cancer Genet Cytogenet 144 (2): 148-55, 2003. [PUBMED Abstract]
- Forastiere A, Koch W, Trotti A, et al.: Head and neck cancer. N Engl J Med 345 (26): 1890-900, 2001. [PUBMED Abstract]
- Lindberg R: Distribution of cervical lymph node metastases from squamous cell carcinoma of the upper respiratory and digestive tracts. Cancer 29 (6): 1446-9, 1972. [PUBMED Abstract]
- Tahari AK, Alluri KC, Quon H, et al.: FDG PET/CT imaging of oropharyngeal squamous cell carcinoma: characteristics of human papillomavirus-positive and -negative tumors. Clin Nucl Med 39 (3): 225-31, 2014. [PUBMED Abstract]
Clasificación celular del cáncer de orofaringe
La mayoría de los cánceres de orofaringe son carcinomas de células escamosas (CCE).[1-3] Los CCE pueden ser invasivos o no invasivos. Se usa el término carcinoma in situ para los CCE no invasivos. Desde el punto de vista histológico, los carcinomas invasivos se clasifican en bien diferenciados, moderadamente diferenciados, pobremente diferenciados o indiferenciados. Los CCE suelen exhibir diferenciación moderada o pobre.[4] Es posible que la clasificación de los márgenes invasivos profundos (por ejemplo, invasión frontal) de un CCE ofrezca mejor información pronóstica que la clasificación de todo el tumor.[5] Los cánceres de orofaringe positivos para el virus del papiloma humano (VPH) que surgen en las amígdalas linguales y palatinas corresponden a una entidad diferente desde el punto de vista molecular y patológico, que se vincula con la infección por el VPH; en especial, el VPH-16. En comparación con los tumores negativos para el VPH, los tumores positivos para el VPH suelen exhibir una diferenciación pobre y no son queratinizantes. Con mucha frecuencia presentan características morfológicas basaloides y es menos probable que tengan variantes de TP53.[6]
El examen inmunohistoquímico de los tejidos para detectar la expresión del biomarcador Ki-67, un antígeno de proliferación, quizás complemente la clasificación histológica. La expresión de Ki-67, un indicador molecular de displasia epitelial de la orofaringe, se correlaciona bien con la pérdida de heterocigosis (LOH) en las células tumorales. En un estudio retrospectivo de 43 muestras tisulares de 25 pacientes, la evaluación de la proliferación mediante Ki-67 constituyó un mejor sustituto de la LOH que la clasificación histológica.[7]
Otros tipos de cáncer de orofaringe son los siguientes:
- Tumores de glándulas salivales menores.
- Linfomas.
- Linfoepiteliomas (por ejemplo, fosa amigdalina).
Para obtener más información, consultar Tratamiento del cáncer de glándulas salivales, Tratamiento del linfoma de Hodgkin, Tratamiento del linfoma no Hodgkin de células B de crecimiento lento, Tratamiento del linfoma no Hodgkin de células B de crecimiento rápido y Tratamiento del linfoma no Hodgkin periférico de células T.
Bibliografía
- Mendenhall WM, Werning JW, Pfister DG: Treatment of head and neck cancer. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 729-80.
- HPV-Mediated (p16+) Oropharyngeal Cancer. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 113-21.
- Oropharynx (p16-) and Hypopharynx. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 123-35.
- Oral cavity and oropharynx. In: Rosai J, ed.: Rosai and Ackerman's Surgical Pathology. Vol. 1. 10th ed. Mosby Elsevier, 2011, pp. 237-264.
- Bryne M, Boysen M, Alfsen CG, et al.: The invasive front of carcinomas. The most important area for tumour prognosis? Anticancer Res 18 (6B): 4757-64, 1998 Nov-Dec. [PUBMED Abstract]
- Gillison ML, Koch WM, Capone RB, et al.: Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. J Natl Cancer Inst 92 (9): 709-20, 2000. [PUBMED Abstract]
- Tabor MP, Braakhuis BJ, van der Wal JE, et al.: Comparative molecular and histological grading of epithelial dysplasia of the oral cavity and the oropharynx. J Pathol 199 (3): 354-60, 2003. [PUBMED Abstract]
Información sobre los estadios del cáncer de orofaringe
El sistema de estadificación del cáncer de orofaringe se basa más en las características clínicas que en las patológicas. Se formula a partir del mejor cálculo posible de la extensión de la enfermedad antes del tratamiento.
La estadificación anatómica clínica del cáncer de orofaringe incluye la evaluación clínica y obtención de las imágenes descritas a continuación:
- Inspección y palpación de los sitios (cuando sea posible) y los ganglios del cuello.
- Examen neurológico de todos los nervios craneales.
- Tomografía computarizada (TC) de la cabeza y el cuello con contraste para evaluar el maxilar superior e inferior.[1]
- Imágenes por resonancia magnética para evaluar la extensión de la enfermedad a los tejidos blandos.
- Tomografía por emisión de positrones con tomografía computarizada (TEP-TC) para evaluar la diseminación metastásica primaria, regional y a distancia.
- Endoscopia completa después de los otros estudios de estadificación con el fin de evaluar con exactitud la extensión del tumor y facilitar la obtención de una biopsia. Este procedimiento se suele realizar con anestesia general, lo que también permite la palpación de la invasión muscular profunda. Debido a la incidencia de tumores primarios múltiples simultáneos, se indica una búsqueda minuciosa de otros tumores primarios en el tubo aerodigestivo superior.[2]
Se ha investigado el uso de la TEP como una modalidad de imagen para el cáncer de orofaringe recidivante.[3]
Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer
El American Joint Committee on Cancer (AJCC) designó los estadios mediante la clasificación TNM (tumor, ganglio linfático y metástasis) para definir el cáncer de orofaringe.[2,4] Se excluyen los tumores no epiteliales, como los de tejido linfoide, tejido blando, hueso y cartílago.
El AJCC utiliza sistemas de estadificación diferentes para el carcinoma de células escamosas de orofaringe relacionado con el virus del papiloma humano (VPH) [4] y para los cánceres de células escamosas de orofaringe negativos para p16.[2]
Grupos de estadios pronósticos del AJCC para el cáncer de orofaringe mediado por el virus del papiloma humano (positivo para p16)
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: HPV-Mediated (p16+) Oropharyngeal Cancer. En: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp.113–21. | ||
| I | T0, T1, o T2; N0 o N1; M0 | T0, T1, o T2 = consultar la descripción del estadio IV en el Cuadro 5 a continuación. |
| N0 o N1 = consultar la descripción del estadio IV en el Cuadro 5 a continuación. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: HPV-Mediated (p16+) Oropharyngeal Cancer. En: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp.113–21. | ||
| II | T0, T1, o T2; N2; M0 | T0, T1, o T2 = consultar la descripción del estadio IV en el Cuadro 5 a continuación. |
| N2 = ganglios linfáticos contralaterales o bilaterales, ninguno mide >6 cm. | ||
| M0 = sin metástasis a distancia. | ||
| T3; N0, N1, o N2; M0 | T3 = tumor que mide >4 cm en su mayor dimensión o se diseminó a la superficie lingual de la epiglotis. | |
| N0, N1, o N2 = consultar la descripción del estadio IV en el Cuadro 5 a continuación. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: HPV-Mediated (p16+) Oropharyngeal Cancer. En: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp.113–21. | ||
| bLa diseminación por la mucosa a la superficie lingual de la epiglotis a partir de tumores primarios de base de la lengua y valécula no constituye una invasión de la laringe. | ||
| III | T0, T1, T2, T3, o T4; N3; M0 | T0, T1, T2, T3, o T4 = consultar la descripción del estadio IV en el Cuadro 5 a continuación. |
| N3 = uno o más ganglios linfáticos que miden >6 cm. | ||
| M0 = sin metástasis a distancia. | ||
| T4; N0, N1, N2, o N3; M0 | T4 = enfermedad local moderadamente avanzada. Tumor con invasión de la laringe, el músculo extrínseco de la lengua, el músculo pterigoideo medio, el paladar duro, el maxilar inferior o de otras partes.b | |
| N0, N1, N2, o N3 = consultar la descripción del estadio IV en el Cuadro 5 a continuación. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: HPV-Mediated (p16+) Oropharyngeal Cancer. En: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp.113–21. | ||
| bLa diseminación por la mucosa a la superficie lingual de la epiglotis a partir de tumores primarios de base de la lengua y valécula no constituye una invasión de la laringe. | ||
| IV | Cualquier T, cualquier N, M1 | T0 = tumor primario no identificable. |
| T1 = tumor que mide ≤2 cm en su mayor dimensión. | ||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión. | ||
| T3 = tumor que mide >4 cm en su mayor dimensión o se diseminó a la superficie lingual de la epiglotis. | ||
| T4 = enfermedad local moderadamente avanzada. Tumor con invasión de la laringe, el músculo extrínseco de la lengua, el músculo pterigoideo medio, el paladar duro, el maxilar inferior o de otras partes.b | ||
| NX = ganglios linfáticos regionales no evaluables. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| N1 = uno o más ganglios linfáticos ipsilaterales, ninguno mide >6 cm. | ||
| N2 = ganglios linfáticos contralaterales o bilaterales, ninguno mide >6 cm. | ||
| N3 = uno o más ganglios linfáticos que miden >6 cm. | ||
| M1 = metástasis a distancia. | ||
Grupos de estadios pronósticos del AJCC para los cánceres de células escamosas de orofaringe negativos para p16
| Estadio | TNbM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: Oropharynx (p16−) and Hypopharynx. En: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 123–35. | ||
| La explicación del superíndice b se encuentra al final del Cuadro 10. | ||
| 0 | Tis, N0, M0 | Tis = carcinoma in situ. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNbM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: Oropharynx (p16−) and Hypopharynx. En: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 123–35. | ||
| La explicación del superíndice b se encuentra al final del Cuadro 10. | ||
| I | T1, N0, M0 | T1 = tumor que mide ≤2 cm en su mayor dimensión. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNbM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: Oropharynx (p16−) and Hypopharynx. En: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 123–35. | ||
| La explicación del superíndice b se encuentra al final del Cuadro 10. | ||
| II | T2, N0, M0 | T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNbM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; ENE = diseminación extraganglionar. | ||
| aReproducción autorizada de AJCC: Oropharynx (p16−) and Hypopharynx. En: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 123–35. | ||
| La explicación del superíndice b se encuentra al final del Cuadro 10. | ||
| III | T3, N0, M0 | T3 = tumor que mide >4 cm en su mayor dimensión o se diseminó a la superficie lingual de la epiglotis. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| T1, T2, T3; N1; M0 | T1, T2, T3 = consultar la descripción del estadio IVC en el Cuadro 10 a continuación. | |
| N1= metástasis en un solo ganglio linfático ipsilateral, que mide ≤3 cm en su mayor dimensión y ENE-. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; ENE = diseminación extraganglionar. | ||
| aReproducción autorizada de AJCC: Oropharynx (p16−) and Hypopharynx. En: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 123–35. | ||
| bEn ocasiones, se usa la designación "U" o "L" para cualquier categoría N con el fin de indicar metástasis por encima del borde inferior del cricoides (U) o por debajo del borde inferior del cricoides (L). De modo similar, la ENE clínica o patológica se deberá registrar como sin ENE- o con ENE+. | ||
| cLa diseminación por la mucosa a la superficie lingual de la epiglotis a partir de tumores primarios de base de la lengua y valécula no constituye una invasión de la laringe. | ||
| IVA | T4a; N0, N1; M0 | T4a = enfermedad local moderadamente avanzada. Tumor con invasión de la laringe, el músculo extrínseco de la lengua, el músculo pterigoideo medio, el paladar duro o el maxilar inferior.c |
| N0, N1 = consultar la descripción del estadio IVC a continuación en este cuadro. | ||
| M0 = sin metástasis a distancia. | ||
| T1, T2, T3, T4a; N2; M0 | T1, T2, T3, T4a = consultar la descripción del estadio IVC a continuación en este cuadro. | |
| N2 = metástasis en un solo ganglio linfático ipsilateral que mide >3 cm pero ≤6 cm en su mayor dimensión y ENE-; o metástasis en múltiples ganglios linfáticos ipsilaterales, ninguno mide >6 cm en su mayor dimensión y ENE-; o metástasis en ganglios linfáticos bilaterales o contralaterales, ninguno mide >6 cm en su mayor dimensión y ENE-. | ||
| M0 = sin metástasis a distancia. | ||
| IVB | Cualquier T, N3, M0 | Cualquier T = consultar las descripciones del estadio IVC en este cuadro. |
| N3 = metástasis en un ganglio linfático que mide >6 cm en su mayor dimensión y ENE-; o metástasis en uno o más ganglios linfáticos y ENE+ manifiesta desde el punto de vista clínico. | ||
| M0 = sin metástasis a distancia. | ||
| T4b, cualquier N, M0 | T4b = enfermedad local muy avanzada. Tumor con invasión del músculo pterigoideo lateral, las placas pterigoideas, la nasofaringe lateral, la base del cráneo; o atrapamiento de la arteria carótida. | |
| Cualquier N = consultar la descripción del estadio IVC a continuación en este cuadro. | ||
| M0 = sin metástasis a distancia. | ||
| IVC | Cualquier T, cualquier N, M1 | TX = tumor primario no evaluable. |
| Tis = carcinoma in situ. | ||
| T1 = tumor que mide ≤2 cm en su mayor dimensión. | ||
| T2 = tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión. | ||
| T3 = tumor que mide >4 cm en su mayor dimensión o se diseminó a la superficie lingual de la epiglotis. | ||
| T4 = enfermedad local moderadamente avanzada o muy avanzada. | ||
| −T4a = enfermedad local moderadamente avanzada. Tumor con invasión de la laringe, el músculo extrínseco de la lengua, el músculo pterigoideo medio, el paladar duro o el maxilar inferior.c | ||
| −T4b = enfermedad local muy avanzada. Tumor con invasión del músculo pterigoideo lateral, las placas pterigoideas, la nasofaringe lateral, la base del cráneo; o atrapamiento de la arteria carótida. | ||
| NX = ganglios linfáticos regionales no evaluables. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| N1= metástasis en un solo ganglio linfático ipsilateral, que mide ≤3 cm en su mayor dimensión y ENE-. | ||
| N2 = metástasis en un solo ganglio linfático ipsilateral que mide >3 cm pero ≤6 cm en su mayor dimensión y ENE-; o metástasis en múltiples ganglios linfáticos ipsilaterales, ninguno mide >6 cm en su mayor dimensión y ENE-; o metástasis en ganglios linfáticos bilaterales o contralaterales, ninguno mide >6 cm en su mayor dimensión y ENE-. | ||
| −N2a = metástasis en un solo ganglio linfático ipsilateral que mide >3 cm, pero ≤6 cm en su mayor dimensión y ENE-. | ||
| −N2b = metástasis en múltiples ganglios linfáticos ipsilaterales, ninguno mide >6 cm en su mayor dimensión y ENE-. | ||
| −N2c = metástasis en ganglios linfáticos bilaterales o contralaterales, ninguno mide >6 cm en su mayor dimensión y ENE-. | ||
| N3 = metástasis en un ganglio linfático que mide >6 cm en su mayor dimensión y ENE-; o metástasis en uno o más ganglios linfáticos y ENE+ manifiesta desde el punto de vista clínico. | ||
| −N3a = metástasis en un ganglio linfático que mide >6 cm en su mayor dimensión y ENE(−). | ||
| –N3b = metástasis en uno o más ganglios linfáticos con ENE+ manifiesta desde el punto clínico. | ||
| M1 = metástasis a distancia. | ||
Bibliografía
- Weber AL, Romo L, Hashmi S: Malignant tumors of the oral cavity and oropharynx: clinical, pathologic, and radiologic evaluation. Neuroimaging Clin N Am 13 (3): 443-64, 2003. [PUBMED Abstract]
- Oropharynx (p16-) and Hypopharynx. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 123-35.
- Wong RJ, Lin DT, Schöder H, et al.: Diagnostic and prognostic value of [(18)F]fluorodeoxyglucose positron emission tomography for recurrent head and neck squamous cell carcinoma. J Clin Oncol 20 (20): 4199-208, 2002. [PUBMED Abstract]
- HPV-Mediated (p16+) Oropharyngeal Cancer. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 113-21.
Aspectos generales de las opciones de tratamiento del cáncer de orofaringe
No es fácil definir un abordaje óptimo para el tratamiento del cáncer de orofaringe porque ningún régimen en particular ofrece una ventaja de supervivencia claramente superior. En la bibliografía se registran diversas opciones terapéuticas, pero no se presentan estudios comparativos válidos para estas opciones. Las consideraciones de tratamiento deben tener en cuenta el estado funcional y de rendimiento, incluso los desenlaces para el habla y la deglución.
Cirugía o radioterapia
La cirugía y la radioterapia han sido el tratamiento estándar del cáncer de orofaringe; sin embargo, los datos de desenlaces obtenidos en ensayos aleatorizados son limitados. En los estudios se ha evaluado si se debe usar cirugía o radiación, pero no han tenido suficiente potencia estadística.[1]
Evidencia (cirugía o radioterapia):
- En un ensayo prospectivo aleatorizado, 564 pacientes de cáncer de cabeza y cuello con enfermedad N2 o N3 se asignaron para someterse a disección de cuello planificada o vigilancia mediante tomografía por emisión de positrones y tomografía computarizada (TEP-TC).[2]
- Después de una mediana de seguimiento de 36 meses, la vigilancia con TEP-TC condujo a menos disecciones de cuello en comparación con el grupo asignado a cirugía (54 vs. 221); la tasa de supervivencia a 2 años fue del 84,9 % en el grupo de disección del cuello y del 81,5 % en el grupo de cirugía. El cociente de riesgos instantáneos (CRI) de muerte (CRIde muerte) favoreció un poco la vigilancia guiada por TEP-TC y se indicó un resultado de ausencia de inferioridad (límite superior del intervalo de confianza [IC] del 95 % para el CRI, <1,50; P = 0,004).
- En un análisis conjunto de 6400 pacientes con carcinoma de orofaringe de base de la lengua de 51 series notificadas entre 1970 y 2000, se demostró lo siguiente:[3]
- Tasas de control local del 79 % (cirugía con radioterapia o sin esta) y del 76 % (radioterapia sola), (P = 0,087); el control locorregional fue del 60 % para la cirugía con radioterapia o sin esta versus 69 % para la radioterapia sola (P = 0,009).
- La tasa de supervivencia a 5 años fue del 49 % para la cirugía con radioterapia o sin esta versus el 52 % (P = 0,2) para la radioterapia con disección del cuello o sin esta.
- La tasa de complicaciones graves fue del 32 % en el grupo de cirugía versus el 3,8 % en el grupo de radioterapia (P = < 0,001).
- La tasa de complicaciones mortales fue del 3,5 % en el grupo de cirugía versus el 0,4 % en el grupo de radioterapia (P = < 0,001).
Tradicionalmente, el estado funcional y de rendimiento posterior al tratamiento de los pacientes con tumores primarios de base de la lengua fue superior después de la radioterapia que después de la cirugía. El control local y la supervivencia son similares con ambas opciones de tratamiento.[4,5]
- En el mismo estudio, los resultados para los pacientes con carcinoma de células escamosas (CCE) en la región amigdalina sometidos a cirugía con radioterapia o sin esta versus radioterapia con disección del cuello o sin esta fueron los siguientes:[3]
- Tasas de control local del 70 % (cirugía con radioterapia o sin esta) y del 68 % (radioterapia), (P = 0,2); el control locorregional fue de 65 % para la cirugía con radioterapia o sin esta versus 69 % para la radioterapia sola (P = 0,1).
- La tasa de supervivencia a 5 años fue del 47 % para la cirugía con radioterapia o sin esta versus el 43 % (P = 0,2) para la radioterapia con disección del cuello o sin esta.
- La tasa de complicaciones graves fue del 23 % para el grupo de cirugía versus el 6 % para el grupo de radioterapia (P = < 0,001).
- La tasa de complicaciones mortales fue del 3,2% en el grupo de cirugía versus el 0,8% en el grupo de radioterapia (P = < 0,001).
Para los pacientes con enfermedad en estadio temprano, se prefiere una modalidad de tratamiento simple. Si bien tradicionalmente la radiación sola ha sido el tratamiento preferido, está en aumento el uso de nuevas técnicas quirúrgicas que incluyen la cirugía transoral y la cirugía robótica transoral. Las comparaciones no aleatorizadas de la cirugía transoral versus la radioterapia primaria indican que se logra una calidad de vida (CV) superior con las técnicas quirúrgicas mínimamente invasivas.[6] Las técnicas quirúrgicas más invasoras se relacionan con una CV inferior y una morbilidad superior.
En un ensayo prospectivo multicéntrico, ECOG-3311 (NCT01898494), se evalúan abordajes quirúrgicos transorales para el carcinoma de orofaringe positivo para el virus del papiloma humano acompañado de una disminución gradual de la dosis de radiación posoperatoria.
Cirugía seguida de radioterapia posoperatoria con quimioterapia simultánea o sin esta, para pacientes con enfermedad localmente avanzada
Las nuevas técnicas quirúrgicas de resección y reconstrucción que proporcionan acceso y conservación del funcionamiento han ampliado las opciones quirúrgicas para los pacientes con cáncer de orofaringe en estadio III o estadio IV. Los procedimientos quirúrgicos específicos y sus modificaciones no se describen aquí debido a la amplia variedad de abordajes quirúrgicos, la variedad de opiniones sobre la función de las disecciones modificadas del cuello y las múltiples técnicas reconstructivas que producen el mismo resultado. El tratamiento de este grupo de pacientes deberá estar a cargo de cirujanos de cabeza y cuello capacitados en los múltiples procedimientos disponibles y que participen de manera activa en la atención de estos pacientes.
De acuerdo con los hallazgos patológicos después de la cirugía primaria, se usa la radioterapia posoperatoria (RTPO), con quimioterapia o sin esta, en el entorno adyuvante para tratar pacientes con los siguientes tipos histológicos:
- Enfermedad T4.
- Invasión perineural.
- Invasión linfovascular.
- Márgenes positivos o menores de 5 mm.
- Diseminación extracapsular a un ganglio linfático.
- Compromiso de 2 o más ganglios linfáticos.
La adición de quimioterapia a la RTPO para los CCE de orofaringe demostró control locorregional y beneficio para la supervivencia general (SG) en comparación con la radioterapia sola en pacientes con factores de riesgo patológico alto, extensión extracapsular (ECE) en un ganglio linfático o márgenes positivos, de acuerdo con un análisis conjunto de los estudios EORTC-22931 (NCT00002555) y RTOG-9501 (NCT00002670).[7-10][Nivel de evidencia A1]
No está claro si la adición de quimioterapia con cisplatino administrada de modo simultáneo con RTPO favorece a los pacientes con factores patológicos de riesgo intermedio. Los factores patológicos de riesgo intermedio son los siguientes:
- Enfermedad T3 y T4 (o enfermedad en estadio III y estadio IV).
- Infiltración perineural.
- Embolias vasculares.
- Adenopatías clínicas en los niveles IV–V que dependen de los tumores que surgen en la cavidad oral o la orofaringe.
- Compromiso histopatológico de 2 o más ganglios linfáticos sin ECE.
- Márgenes estrechos de menos de 5 mm.
La adición de cetuximab y radioterapia en el entorno posoperatorio para pacientes con estos factores de riesgo intermedio está en estudio en un ensayo aleatorizado (RTOG-0920 [NCT00956007]).
Radioterapia
En una revisión de resultados clínicos publicados de radioterapia para el cáncer de cabeza y cuello, se indicó una pérdida significativa de control local cuando se prolongó la administración de radioterapia. En consecuencia, es perjudicial prolongar los programas de tratamiento estándar.[11,12]
Durante la radioterapia, los pacientes fumadores exhiben tasas más bajas de respuesta y supervivencia más cortas que los pacientes no fumadores.[13]Es posible que sea beneficioso asesorar a los pacientes para que dejen de fumar antes de empezar la radioterapia.
La radioterapia de intensidad modulada (RTIM) se ha convertido en una técnica estándar de radioterapia dirigida a la cabeza y el cuello. La RTIM hace posible el uso de una técnica para modelar la dosis, también conocida como una técnica de refuerzo simultáneo integrado (SIB) con una dosis por fracción un poco más alta de 2 Gy, lo que permite un ligero acortamiento del tiempo total de tratamiento y aumenta la dosis biológicamente equivalente dirigida al tumor.
Evidencia (radioterapia definitiva):
- La RTIM se estudió en un ensayo de fase II (RTOG-0022 [NCT00006360]) en 69 pacientes con carcinoma de orofaringe en estadios T1 a T2, N0 a N1, M0 tratados con radioterapia primaria sin quimioterapia.[14] La mediana de seguimiento fue de 2,8 años. Las dosis del volumen blanco planificado (PTV) dirigido al tumor primario y los ganglios comprometidos fue de 66 a 2,2 Gy por fracción durante 6 semanas. Los pacientes de PTV subclínicos recibieron simultáneamente 54 a 60 Gy, con fracciones de 1,8 a 2,0 Gy mediante una técnica SIB. Se observaron los siguientes resultados:
- La tasa calculada de fracaso locorregional a 2 años fue del 9 %. Se presentó fracaso locorregional en 2 de 4 pacientes (50 %) con grandes desviaciones por dosis insuficientes, en comparación con 3 de 49 pacientes (6 %) sin estas desviaciones (P = 0,04).
- Los efectos tóxicos tardíos más frecuentes de grado 2 o mayores se presentaron en la piel (12 %), las mucosas (24 %), las glándulas salivales (67 %) y el esófago (19 %), además se presentaron casos de osteorradionecrosis (6 %).
- Un seguimiento más prolongado reveló una reducción de los efectos tóxicos tardíos en todas las categorías. Se observó xerostomía de grado 2 o más alta en el 55 % de los pacientes a los 6 meses, pero esta se redujo al 25 % a los 12 meses y al 16 % a los 24 meses.
En el estudio RTOG-0022, se observaron tasas de control altas y viabilidad de la RTIM en un entorno multinstitucional; en el estudio también se observaron tasas altas de control tumoral y reducción de los efectos tóxicos salivales en comparación con los estudios anteriores del RTOG. Sin embargo, las principales desviaciones por dosis insuficientes dirigidas al tumor primario se relacionaron con una tasa superior de fracaso locorregional.
- En estudios multicéntricos no aleatorizados se utilizaron aumentos graduales de las dosis que oscilaron entre 2,3 y 2,5 Gy con RTIM. Estas dosis fueron inocuas cuando se administraron con quimioterapia simultánea para el CCE de faringe T2N0, T2N1 o de laringe T3N0.[15-19]
- No se observó diferencia en la toxicidad entre los diferentes grupos de aumento gradual de la dosis.
- En un ensayo aleatorizado (PARSPORT [NCT00081029]) realizado en el Reino Unido, se comparó la radioterapia conformada tridimensional con la RTIM. Se observaron los siguientes resultados:[20][Nivel de evidencia A1]
- La tasa de xerostomía fue significativamente más baja en el grupo de RTIM que en el grupo de tratamiento convencional.
- La fatiga fue más prevalente en el grupo de RTIM.
- No se observaron diferencias significativas en los efectos tóxicos tardíos diferentes a la xerostomía, en el control locorregional o en la SG a 24 meses.
Radioterapia de fraccionamiento modificado versus radioterapia de fraccionamiento estándar
Es posible utilizar la radioterapia sola con fraccionamiento modificado para los pacientes con cáncer de orofaringe localmente avanzado que no son aptos para recibir quimioterapia. La radioterapia de fraccionamiento modificado produce una tasa más alta de control locorregional que la radioterapia de fraccionamiento estándar para pacientes con cáncer de orofaringe en estadio III y estadio IV.
Evidencia (fraccionamiento modificado vs. fraccionamiento estándar):
- En el ensayo aleatorizado RTOG-9003 (NCT00771641) se incluyeron los siguientes 4 grupos de tratamiento con radioterapia:[21,22][Nivel de evidencia A1]
- Fraccionamiento estándar (SFX): 70 Gy en 35 fracciones diarias durante 7 semanas.
- Hiperfraccionamiento (HFX): 81,6 Gy en 68 fracciones 2 veces por día durante 7 semanas.
- Fraccionamiento acelerado de ciclo dividido (AFX-S): 67,2 Gy en 42 fracciones durante 6 semanas, y 2 semanas de descanso después de 38,4 Gy.
- Fraccionamiento acelerado con refuerzo simultáneo (AFX-C): 72 Gy en 42 fracciones durante 6 semanas.
En un análisis a largo plazo, se compararon los tres grupos en investigación con el grupo de SFX.
- Solo el grupo de HFX exhibió un control locorregional y una supervivencia a 5 años superiores en comparación con el grupo de SFX (CRI, 0,79; IC 95 %, 0,62–1,00; P = 0,05).
- El método AFX-C se relacionó con el aumento de efectos tóxicos tardíos comparado con el SFX.
- En un metanálisis de 15 ensayos aleatorizados con 6515 pacientes y una mediana de seguimiento de 6 años en los que se evaluó HFX o AFX-S para pacientes con cáncer de orofaringe en estadios III y IV, se observaron los siguientes resultados:[23][Nivel de evidencia A1]
- Hubo un beneficio significativo de supervivencia con la radioterapia fraccionada modificada; el beneficio absoluto fue del 3,4 % a los 5 años (CRI, 0,92; IC 95 %, 0,86–0,97; P = 0,003).
- La radioterapia fraccionada modificada mejora el control locorregional, con un beneficio más alto en los pacientes más jóvenes.
- El método HFX demostró un mayor beneficio en la supervivencia (8 % a los 5 años) que AFX-S (2 % con fraccionamiento acelerado sin reducción de la dosis total y 1,7 % con reducción de la dosis total a los 5 años, P = 0,02).
Otro efecto tardío de la radioterapia es el hipotiroidismo en el 30 % al 40 % de los pacientes que recibieron radioterapia de haz externo dirigida a toda la glándula tiroidea. Se considera la evaluación del funcionamiento tiroideo de los pacientes antes del tratamiento y como parte del seguimiento postratamiento.[24,25]
En los datos prospectivos de 2 ensayos aleatorizados controlados, se notificó la incidencia de hipotiroidismo.[26]
- Al cabo de una mediana de seguimiento de 41 meses, el 55,1 % de los pacientes presentó hipotiroidismo (39,3 % subclínico, 15,7 % bioquímico).
- Los pacientes sometidos a RTIM presentaron más hipotiroidismo subclínico (51,1 vs. 27,3 %; P = 0,021), que alcanzó su punto máximo 1 año después de la radioterapia.
- La edad más temprana, la ubicación del tumor primario en la hipofaringe o la laringe, el compromiso ganglionar, una dosis o fracción más alta (grupo de RTIM) y D100 fueron factores estadísticamente significativos de la presencia de hipotiroidismo.[26][Nivel de evidencia A3]
Para los pacientes de cáncer de orofaringe bien lateralizado, como los tumores primarios de amígdala T1 o T2 con diseminación limitada al paladar o la base de la lengua, y compromiso limitado de ganglio linfático ipsilateral sin diseminación extracapsular, el tratamiento electivo de los ganglios linfáticos ipsilaterales produce solo un riesgo mínimo de diseminación contralateral en el cuello.[27] Para los tumores T3 y T4 ubicados en la línea media o cerca de esta, se debe considerar el tratamiento ganglionar bilateral. Además de la cadena de ganglios linfáticos cervicales, también es posible incluir los ganglios linfáticos retrofaríngeos en el tratamiento ganglionar electivo.
Quimiorradioterapia simultánea
La quimiorradioterapia simultánea es una opción de tratamiento estándar para pacientes con carcinoma de orofaringe localmente avanzado (estadio III y estadio IV) y es superior a la radioterapia sola.[28] Con este abordaje de tratamiento, se enfatiza la conservación de los órganos y de su funcionamiento.[29,30]
Evidencia (quimiorradioterapia simultánea):
- Un metanálisis, en el que al comienzo se incluyeron 93 ensayos prospectivos aleatorizados de cánceres de cabeza y cuello publicados entre 1965 y 2000, se actualizó con la incorporación de 16 ensayos nuevos (que incluyeron 2767 pacientes) y 11 ensayos revisados. Los resultados confirmaron el beneficio y la superioridad de la adición de quimioterapia simultánea para el cáncer de cabeza y cuello no metastásico.[31,32][Nivel de evidencia A2]
- El subconjunto de pacientes que recibieron quimiorradioterapia tuvo una ventaja absoluta de supervivencia del 6,5 %; la SG aumentó del 27,7 % al 33,6 % a los 5 años y del 17,3 % al 20,9 % a los 10 años.
- Los pacientes que recibieron quimioterapia simultánea tuvieron un mayor beneficio de supervivencia que quienes recibieron quimioterapia neoadyuvante.
-
La quimiorradioterapia posoperatoria con 100 mg/m2 de cisplatino administrado 1 vez cada 3 semanas es el tratamiento estándar para los pacientes que presentan enfermedad en riesgo alto de recidiva, sobre todo para aquellos con extensión ganglionar extracapsular y márgenes quirúrgicos positivos. Sin embargo, esta dosificación ha generado preocupación sobre la administración insuficiente de cisplatino debido a la toxicidad vinculada a las dosis altas. La quimiorradioterapia con cisplatino semanal se usa de manera generalizada como una alternativa con mejor perfil de inocuidad.
En un ensayo de fase II/III multicéntrico, sin enmascaramiento, de ausencia de inferioridad se compararon diferentes cronogramas de cisplatino como parte del tratamiento posoperatorio de pacientes con CCE de cabeza y cuello de riesgo alto localmente avanzado. Los pacientes recibieron cisplatino (40 mg/m2) 1 vez por semana o la dosis estándar de cisplatino (100 mg/m2) 1 vez cada 3 semanas, siempre en combinación con radioterapia. La SG fue el criterio principal de valoración de la fase III del estudio. Se estableció un CRI de 1,32 como margen de ausencia de inferioridad. Participaron un total de 261 pacientes (cisplatino cada 3 semanas, 132 pacientes; cisplatino semanal, 129 pacientes).[33]
- En el momento del tercer análisis interino planificado en la fase III del ensayo, al cabo de una mediana de seguimiento de 2,2 años, la quimiorradioterapia con cisplatino semanal no fue inferior al cisplatino cada 3 semanas respecto a la SG (CRI, 0,69; IC 99,1 %, 0,374–1,273 [<1,32]; P unilateral para la ausencia de inferioridad = 0,0027).[33][Nivel de evidencia A1]
- La neutropenia y las infecciones de grados 3 o 4 fueron menos frecuentes en los pacientes que recibieron el cisplatino semanal. Se presentó neutropenia de grado 3 o 4 en el 49 % de los pacientes que recibieron cisplatino cada 3 semanas y en el 35 % de los que recibieron cisplatino semanal. Las infecciones de grado 3 o 4 ocurrieron en el 12 % de los pacientes que recibieron el cisplatino cada 3 semanas y en el 7 % de los que recibieron el cisplatino semanal. La disfunción renal y auditiva de grados 3 o 4 también fueron menos frecuentes en los pacientes que recibieron cisplatino semanal. No se notificaron muertes relacionadas con el tratamiento entre los pacientes que recibieron cisplatino cada 3 semanas, y se notificaron 2 muertes entre los pacientes que recibieron cisplatino semanal (1,6 %).
Los regímenes con cisplatino semanal y aquellos en los que se administra cada 3 semanas se consideran el tratamiento estándar. Se está evaluando la eficacia equivalente de estos regímenes en un ensayo prospectivo, aleatorizado, de gran tamaño.
- En un ensayo de fase III aleatorizado que se hizo en India se incluyeron pacientes con CCE de cabeza y cuello localmente avanzado no aptos para recibir quimiorradiación a base de cisplatino. En este estudio se evaluó el uso de docetaxel como radiosensibilizador. Los pacientes con un estado funcional (EF) del Eastern Cooperative Oncology Group (ECOG) de 0 a 2 se asignaron de manera aleatoria (1:1) para recibir radioterapia sola o con docetaxel simultáneo (15 mg/m2) 1 vez por semana durante un máximo de 7 ciclos. El criterio principal de valoración fue la supervivencia sin enfermedad (SSE) a 2 años. En la mayoría de los pacientes (alrededor del 60 %) se usó como tratamiento definitivo. Se utilizaron varios parámetros con el fin de definir si el paciente no era apto para recibir cisplatino, incluso un EF ECOG de 2, un aclaramiento de creatinina estimado <50 ml/min y una disfunción orgánica de grado 2 o superior. Se incluyeron un total de 356 pacientes (176 en el grupo de radioterapia y 180 en el grupo de radiación y docetaxel).[34]
- La tasa de SSE a 2 años fue del 30,3 % en el grupo de radioterapia sola (IC 95 %, 23,6–37,4 %) y del 42 % en el grupo de radiación y docetaxel (IC 95 %, 34,6–49,2 %) (CRI, 0,673; IC 95 %, 0,521–0,868; P = 0,002).
- La mediana de SG correspondiente fue de 15,3 meses en el grupo de radioterapia sola (IC 95 %, 13,1–22,0) y 25,5 meses en el grupo de radioterapia y docetaxel (IC 95 %, 17,6–32,5) (orden logarítmico P = 0,035). La tasa de SG a 2 años fue del 41,7 % en el grupo de radioterapia sola (IC 95 %, 34,1–49,1 %) y del 50,8 % en el grupo de radioterapia y docetaxel (IC 95 %, 43,1–58,1 %) (CRI, 0,747; IC 95 %, 0,569–0,980; P = 0,035).[34][Nivel de evidencia A1]
- Fue más elevada la incidencia de mucositis (22,2 vs. 49,7 %; P < 0,001), odinofagia (33,5 vs. 52,5 %; P < 0,001) y disfagia (33 vs. 49,7 %; P = 0,002) de grado 3 o superior en los pacientes que recibieron radioterapia y docetaxel que en los que recibieron radioterapia sola.
- El aumento de la toxicidad observada en el grupo de radioterapia y docetaxel no perjudicó de manera significativa la dosis de radiación total que recibieron los pacientes . El 88,9 % de los pacientes en el grupo de radiación y docetaxel y un 93,8 % de los pacientes en el grupo de radiación sola recibieron el total de la dosis de radiación. En el grupo de radiación y docetaxel, el 85,6 % de los pacientes recibieron 5 o más ciclos de quimioterapia.
- En un ensayo aleatorizado con pacientes de cáncer de cabeza y cuello localmente avanzado, se comparó la radioterapia sola con intención curativa (213 pacientes) y la radioterapia con cetuximab semanal (211 pacientes).[35] La dosis inicial de cetuximab fue de 400 mg/m2 de área de superficie corporal 1 semana antes de comenzar la radioterapia, seguida de una dosis semanal de 250 mg/m2 de área de superficie corporal administrada durante todo el período de radioterapia. En este estudio se permitieron los regímenes de fraccionamiento modificado en ambos grupos.[35,36][Nivel de evidencia A1]
- En el momento de una mediana de seguimiento de 54 meses, los pacientes tratados con cetuximab y radioterapia exhibieron una supervivencia sin progresión (SSP) significativamente más alta (CRIde muerte o progresión de la enfermedad, 0,70; P = 0,006).
- Los pacientes del grupo de cetuximab exhibieron tasas más altas de erupción acneiforme y reacciones a la infusión, aunque la incidencia de otros efectos tóxicos de grado 3 o más altos, incluso mucositis, no difirió significativamente entre los 2 grupos.
Cetuximab versus cisplatino en pacientes con cáncer de orofaringe positivo para el virus del papiloma humano
Hay estudios en curso en los que se evalúa la desintensificación con disminución de la dosis de radioterapia (NRG-HN002 [NCT02254278] y ECOG-3311 [NCT01898494]) en pacientes con cáncer de orofaringe positivo para el virus del papiloma humano (VPH) de riesgo bajo. El cetuximab, un inhibidor del factor de crecimiento epidérmico, se evaluó en 2 ensayos aleatorizados como una estrategia de desintensificación con el fin de reducir la toxicidad del tratamiento a base de cisplatino.
Evidencia (cetuximab versus cisplatino en pacientes con cáncer de orofaringe positivo para el VPH):
- En el ensayo aleatorizado RTOG-1016 (NCT01302834), los pacientes con cáncer de orofaringe positivo para el VPH (confirmado en laboratorio central mediante estudio de inmunohistoquímica de p16), se asignaron al azar (1:1) a recibir radioterapia y cetuximab o radioterapia y cisplatino. El objetivo del ensayo fue determinar si el tratamiento con radioterapia y cetuximab resultaba en ausencia de inferioridad para la supervivencia en comparación con el tratamiento de radioterapia y cisplatino. De los 987 pacientes inscritos, 849 se asignaron al azar a recibir radioterapia y cetuximab (n = 425) o radioterapia y cisplatino (n = 424). Después, 399 pacientes asignados a recibir cetuximab y 406 pacientes asignados a recibir cisplatino se consideraron aptos. Los pacientes recibieron 70 Gy de radioterapia acelerada en 6 semanas (6 fracciones por semana) acompañada de 2 ciclos de cisplatino (100 mg/m2) cada 3 semanas o cetuximab semanal.[37][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 4,5 años, la radioterapia con cetuximab no cumplió con los criterios de ausencia de inferioridad para la SG (CRI, 1,45; IC 95 % superior unilateral, 1,94; P = 0,5056 para la ausencia de inferioridad; orden logarítmico unilateral P = 0,0163).[38][Nivel de evidencia A1]
- La tasa de SG a 5 años estimada fue del 77,9 % (IC 95 %, 73,4–82,5 %) en el grupo de cetuximab versus el 84,6 % (80,6–88,6 %) en el grupo de cisplatino.
- La SSP fue significativamente inferior en el grupo de cetuximab en comparación con el grupo de cisplatino (CRI, 1,72; IC 95 %, 1,29–2,29; P = 0,0002; tasa de SSP a 5 años del 67,3 %; IC 95 %, 62,4–72,2 % vs. 78,4 %, 73,8–83,0 %), y el fracaso locorregional fue significativamente superior en el grupo de cetuximab que el grupo de cisplatino.
- La toxicidad aguda moderada a grave (77,4 %, IC 95 %, 73,0–81,5 % vs. 81,7 %, 77,5–85,3 %; P = 0,1586) y la toxicidad tardía moderada a grave (16,5 %, IC 95 %, 12,9–20,7 % vs. 20,4 %, 16,4–24,8 %; P = 0,1904) fueron similares entre los grupos de cetuximab y cisplatino.
- El De-ESCALaTE HPV [NCT01874171] fue un ensayo aleatorizado controlado sin enmascaramiento de fase III en 32 centros de tratamiento de cánceres de cabeza y cuello de Irlanda, los Países Bajos y el Reino Unido. En el ensayo se incluyeron pacientes de 18 años o más con cáncer de orofaringe positivo para el VPH de riesgo bajo (no fumadores o exfumadores con índice de consumo de tabaco <10 paquetes-año).[39] Los pacientes se asignaron al azar (1:1) a recibir, además de la radioterapia (70 Gy en 35 fracciones), cisplatino intravenoso (100 mg/m2 en los días 1, 22 y 43 de la radioterapia) o cetuximab intravenoso (400 mg/m2 de dosis de carga seguida de 7 infusiones semanales de 250 mg/m2 cada una).
El resultado primario fue la toxicidad grave general (grados 3–5) a los 24 meses de finalizar el tratamiento. El resultado principal se evaluó mediante el análisis por intención de tratar y el análisis por protocolo. Desde el 12 de noviembre de 2012 hasta el 1 de octubre de 2016, se inscribieron 334 pacientes (166 en el grupo de cisplatino y 168 en el grupo de cetuximab).
- La toxicidad general (aguda y tardía) grave (grados 3–5) no fue significativamente diferente entre los grupos de tratamiento a los 24 meses (media del número de episodios tóxicos por paciente, 4,8 [IC 95 %, 4,2–5,4] con cisplatino vs. 4,8 [4,2–5,4] con cetuximab; P = 0,98).[39][Nivel de evidencia A1]
- A los 24 meses, la toxicidad general de todos los grados no fue significativamente diferente (media del número de episodios por paciente, 29,2 [IC 95 %, 27,3–31,0] con cisplatino vs. 30,1 [28,3–31,9] con cetuximab; P = 0,49).
- La SG fue inferior y la tasa de recidiva local fue superior en el grupo de cetuximab. La tasa de SG a 2 años fue del 97,5 % en el grupo de cisplatino versus el 89,4 % en el grupo de cetuximab (CRI, 5,0; IC 95 %, 1,7–14,7; P = 0,001), y la tasa de recidiva a 2 años fue del 6,0 % en el grupo de cisplatino versus el 16,1 % en el grupo de cetuximab (CRI, 3,4; 1,6–7,2; P = 0,0007).
Estos hallazgos reflejan la inferioridad del cetuximab en comparación con el cisplatino para la SG y la tasa de recidiva local en pacientes con cáncer de orofaringe locorregional avanzado relacionado con el VPH, además no logran demostrar que la toxicidad disminuya cuando se usa cetuximab y radioterapia en comparación con cisplatino. El tratamiento con la combinación de radioterapia y cetuximab produjo SG y SSP inferiores en comparación con el tratamiento de radioterapia y cisplatino; por lo tanto, el tratamiento con radioterapia y cisplatino todavía se considera el estándar de atención.
Para obtener más información sobre los efectos tóxicos orales, consultar Complicaciones orales del tratamiento del cáncer.
Quimioterapia neoadyuvante seguida de quimiorradioterapia simultánea
En un metanálisis de 5 ensayos aleatorizados, 1022 pacientes con CCE de cabeza y cuello se asignaron para recibir quimioterapia neoadyuvante con docetaxel, cisplatino y fluorouracilo (TPF) seguida de quimioterapia simultánea o quimiorradioterapia simultánea sola. El análisis no reveló una ventaja de la SG (CRI, 1,01; límites de confianza [LC] del 95 %, 0,84, 1,21; P = 0,92) o SSP (CRI, 0,91; LC 95 %, 0,75, 1,1; P = 0,32) para la quimioterapia neoadyuvante con el uso del régimen TPF en lugar de la quimiorradiación simultánea sola.[40][Nivel de evidencia A1]
Evidencia (quimioterapia neoadyuvante seguida de quimiorradioterapia simultánea):
- En un estudio de fase II de quimioterapia neoadyuvante con cisplatino, paclitaxel y cetuximab en pacientes con CCE de orofaringe relacionado con el VPH (ECOG 1308 [NCT01084083]), los pacientes que obtuvieron una respuesta clínica completa a 3 ciclos de quimioterapia neoadyuvante recibieron RTIM con dosis reducidas de 54 Gy y cetuximab semanal. Los pacientes que obtuvieron menos de una respuesta completa recibieron 69,3 Gy de radiación dirigida al sitio primario o los ganglios y cetuximab.[41]
- Al cabo de una mediana de seguimiento de 35,4 meses, la tasa de SSP a 2 años fue del 80 % y la tasa de SG fue del 94 % para los pacientes que lograron una respuesta clínica completa y se trataron con 54 Gy de radiación.
- Para los pacientes con un tumor primario (T) en estadio menor de T4 y ganglios linfáticos regionales (N) en estadio menor de N2c que además tienen antecedentes de un índice de consumo de tabaco de 10 paquetes-año, la tasa de SSP a 2 años fue del 96 % y la tasa de SG fue del 96 %.
- La radiación de dosis bajas de 54 Gy se relacionó con tasas más bajas de disfagia a los alimentos sólidos y menos alteración del estado nutricional.
- Al parecer no hay beneficio del tratamiento con quimioterapia neoadyuvante seguido de quimiorradioterapia simultánea en dosis completas (≥70 Gy). Quizá el tratamiento con reducción de la dosis cumpla una función en los pacientes positivos para el VPH con enfermedad de riesgo bajo que alcanzaron respuesta clínica completa luego de la quimioterapia neoadyuvante.
En general, la función de la quimioterapia neoadyuvante para los pacientes con cáncer de orofaringe sigue sin aclararse. Sin embargo, en los subgrupos definidos por el VPH, se necesita más información porque, como se sugiere en este estudio de fase II, en ese contexto, se puede usar la quimioterapia neoadyuvante con menos quimiorradiación.[40,42-45][Nivel de evidencia A1]
Administración de fluorouracilo
El gen DPYD codifica la enzima que cataboliza las pirimidinas y las fluoropirimidinas, como la capecitabina y el fluorouracilo. Se estima que entre el 1 % y el 2 % de la población tiene variantes defectuosas de DPYD que reducen la función de la proteína DPD y la acumulación de pirimidinas y fluoropirimidinas en el cuerpo.[46,47] Los pacientes con la variante DPYD*2A que reciben fluoropirimidinas quizás presenten efectos tóxicos graves que ponen en riesgo la salud, y a veces son mortales. Se han identificado muchas otras variantes de DPYD, con diferentes efectos clínicos.[46-48] Es posible que se recomiende evitar la fluoropirimidina o reducir la dosis al 50 % según el genotipo DPYD del paciente y el número de alelos funcionales de DPYD.[49-51] Las pruebas genéticas para DPYD cuestan menos de $200, pero la cobertura del seguro varía debido a la falta de directrices nacionales.[52] Además, es posible que las pruebas retrasen el tratamiento por 2 semanas, lo que no sería aconsejable en casos de urgencia. Este tema es objeto de controversia y requiere evaluación adicional.[53]
Bibliografía
- Iyer NG, Tan DS, Tan VK, et al.: Randomized trial comparing surgery and adjuvant radiotherapy versus concurrent chemoradiotherapy in patients with advanced, nonmetastatic squamous cell carcinoma of the head and neck: 10-year update and subset analysis. Cancer 121 (10): 1599-607, 2015. [PUBMED Abstract]
- Mehanna H, Wong WL, McConkey CC, et al.: PET-CT Surveillance versus Neck Dissection in Advanced Head and Neck Cancer. N Engl J Med 374 (15): 1444-54, 2016. [PUBMED Abstract]
- Parsons JT, Mendenhall WM, Stringer SP, et al.: Squamous cell carcinoma of the oropharynx: surgery, radiation therapy, or both. Cancer 94 (11): 2967-80, 2002. [PUBMED Abstract]
- Harrison LB, Zelefsky MJ, Armstrong JG, et al.: Performance status after treatment for squamous cell cancer of the base of tongue--a comparison of primary radiation therapy versus primary surgery. Int J Radiat Oncol Biol Phys 30 (4): 953-7, 1994. [PUBMED Abstract]
- Mendenhall WM, Morris CG, Amdur RJ, et al.: Definitive radiotherapy for squamous cell carcinoma of the base of tongue. Am J Clin Oncol 29 (1): 32-9, 2006. [PUBMED Abstract]
- Chen AM, Daly ME, Luu Q, et al.: Comparison of functional outcomes and quality of life between transoral surgery and definitive chemoradiotherapy for oropharyngeal cancer. Head Neck 37 (3): 381-5, 2015. [PUBMED Abstract]
- Cooper JS, Pajak TF, Forastiere AA, et al.: Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N Engl J Med 350 (19): 1937-44, 2004. [PUBMED Abstract]
- Bernier J, Domenge C, Ozsahin M, et al.: Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med 350 (19): 1945-52, 2004. [PUBMED Abstract]
- Bernier J, Cooper JS, Pajak TF, et al.: Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (#22931) and RTOG (# 9501). Head Neck 27 (10): 843-50, 2005. [PUBMED Abstract]
- Cooper JS, Zhang Q, Pajak TF, et al.: Long-term follow-up of the RTOG 9501/intergroup phase III trial: postoperative concurrent radiation therapy and chemotherapy in high-risk squamous cell carcinoma of the head and neck. Int J Radiat Oncol Biol Phys 84 (5): 1198-205, 2012. [PUBMED Abstract]
- Fowler JF, Lindstrom MJ: Loss of local control with prolongation in radiotherapy. Int J Radiat Oncol Biol Phys 23 (2): 457-67, 1992. [PUBMED Abstract]
- Allal AS, de Pree C, Dulguerov P, et al.: Avoidance of treatment interruption: an unrecognized benefit of accelerated radiotherapy in oropharyngeal carcinomas? Int J Radiat Oncol Biol Phys 45 (1): 41-5, 1999. [PUBMED Abstract]
- Browman GP, Wong G, Hodson I, et al.: Influence of cigarette smoking on the efficacy of radiation therapy in head and neck cancer. N Engl J Med 328 (3): 159-63, 1993. [PUBMED Abstract]
- Eisbruch A, Harris J, Garden AS, et al.: Multi-institutional trial of accelerated hypofractionated intensity-modulated radiation therapy for early-stage oropharyngeal cancer (RTOG 00-22). Int J Radiat Oncol Biol Phys 76 (5): 1333-8, 2010. [PUBMED Abstract]
- Leclerc M, Maingon P, Hamoir M, et al.: A dose escalation study with intensity modulated radiation therapy (IMRT) in T2N0, T2N1, T3N0 squamous cell carcinomas (SCC) of the oropharynx, larynx and hypopharynx using a simultaneous integrated boost (SIB) approach. Radiother Oncol 106 (3): 333-40, 2013. [PUBMED Abstract]
- Buettner F, Miah AB, Gulliford SL, et al.: Novel approaches to improve the therapeutic index of head and neck radiotherapy: an analysis of data from the PARSPORT randomised phase III trial. Radiother Oncol 103 (1): 82-7, 2012. [PUBMED Abstract]
- Gulliford SL, Miah AB, Brennan S, et al.: Dosimetric explanations of fatigue in head and neck radiotherapy: an analysis from the PARSPORT Phase III trial. Radiother Oncol 104 (2): 205-12, 2012. [PUBMED Abstract]
- Kohler RE, Sheets NC, Wheeler SB, et al.: Two-year and lifetime cost-effectiveness of intensity modulated radiation therapy versus 3-dimensional conformal radiation therapy for head-and-neck cancer. Int J Radiat Oncol Biol Phys 87 (4): 683-9, 2013. [PUBMED Abstract]
- Gupta T, Agarwal J, Jain S, et al.: Three-dimensional conformal radiotherapy (3D-CRT) versus intensity modulated radiation therapy (IMRT) in squamous cell carcinoma of the head and neck: a randomized controlled trial. Radiother Oncol 104 (3): 343-8, 2012. [PUBMED Abstract]
- Nutting CM, Morden JP, Harrington KJ, et al.: Parotid-sparing intensity modulated versus conventional radiotherapy in head and neck cancer (PARSPORT): a phase 3 multicentre randomised controlled trial. Lancet Oncol 12 (2): 127-36, 2011. [PUBMED Abstract]
- Fu KK, Pajak TF, Trotti A, et al.: A Radiation Therapy Oncology Group (RTOG) phase III randomized study to compare hyperfractionation and two variants of accelerated fractionation to standard fractionation radiotherapy for head and neck squamous cell carcinomas: first report of RTOG 9003. Int J Radiat Oncol Biol Phys 48 (1): 7-16, 2000. [PUBMED Abstract]
- Beitler JJ, Zhang Q, Fu KK, et al.: Final results of local-regional control and late toxicity of RTOG 9003: a randomized trial of altered fractionation radiation for locally advanced head and neck cancer. Int J Radiat Oncol Biol Phys 89 (1): 13-20, 2014. [PUBMED Abstract]
- Baujat B, Bourhis J, Blanchard P, et al.: Hyperfractionated or accelerated radiotherapy for head and neck cancer. Cochrane Database Syst Rev (12): CD002026, 2010. [PUBMED Abstract]
- Turner SL, Tiver KW, Boyages SC: Thyroid dysfunction following radiotherapy for head and neck cancer. Int J Radiat Oncol Biol Phys 31 (2): 279-83, 1995. [PUBMED Abstract]
- Constine LS: What else don't we know about the late effects of radiation in patients treated for head and neck cancer? Int J Radiat Oncol Biol Phys 31 (2): 427-9, 1995. [PUBMED Abstract]
- Murthy V, Narang K, Ghosh-Laskar S, et al.: Hypothyroidism after 3-dimensional conformal radiotherapy and intensity-modulated radiotherapy for head and neck cancers: prospective data from 2 randomized controlled trials. Head Neck 36 (11): 1573-80, 2014. [PUBMED Abstract]
- O'Sullivan B, Warde P, Grice B, et al.: The benefits and pitfalls of ipsilateral radiotherapy in carcinoma of the tonsillar region. Int J Radiat Oncol Biol Phys 51 (2): 332-43, 2001. [PUBMED Abstract]
- Denis F, Garaud P, Bardet E, et al.: Final results of the 94-01 French Head and Neck Oncology and Radiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced-stage oropharynx carcinoma. J Clin Oncol 22 (1): 69-76, 2004. [PUBMED Abstract]
- Mendenhall WM, Werning JW, Pfister DG: Treatment of head and neck cancer. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 729-80.
- Adelstein DJ: Oropharyngeal cancer: the role of chemotherapy. Curr Treat Options Oncol 4 (1): 3-13, 2003. [PUBMED Abstract]
- Pignon JP, le Maître A, Maillard E, et al.: Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an update on 93 randomised trials and 17,346 patients. Radiother Oncol 92 (1): 4-14, 2009. [PUBMED Abstract]
- Lacas B, Carmel A, Landais C, et al.: Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): An update on 107 randomized trials and 19,805 patients, on behalf of MACH-NC Group. Radiother Oncol 156: 281-293, 2021. [PUBMED Abstract]
- Kiyota N, Tahara M, Mizusawa J, et al.: Weekly Cisplatin Plus Radiation for Postoperative Head and Neck Cancer (JCOG1008): A Multicenter, Noninferiority, Phase II/III Randomized Controlled Trial. J Clin Oncol 40 (18): 1980-1990, 2022. [PUBMED Abstract]
- Patil VM, Noronha V, Menon N, et al.: Results of Phase III Randomized Trial for Use of Docetaxel as a Radiosensitizer in Patients With Head and Neck Cancer, Unsuitable for Cisplatin-Based Chemoradiation. J Clin Oncol 41 (13): 2350-2361, 2023. [PUBMED Abstract]
- Bonner JA, Harari PM, Giralt J, et al.: Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 354 (6): 567-78, 2006. [PUBMED Abstract]
- Curran D, Giralt J, Harari PM, et al.: Quality of life in head and neck cancer patients after treatment with high-dose radiotherapy alone or in combination with cetuximab. J Clin Oncol 25 (16): 2191-7, 2007. [PUBMED Abstract]
- Trotti A, Harris J, Gillison M, et al.: NRG-RTOG 1016: phase III trial comparing radiation/cetuximab to radiation/cisplatin in HPV-related cancer of the oropharynx. [Abstract] Int J Radiat Oncol Biol Phys 102 (5): A-LBA4, 1604-5, 2018. Also available online. Last accessed November 18, 2024.
- Gillison ML, Trotti AM, Harris J, et al.: Radiotherapy plus cetuximab or cisplatin in human papillomavirus-positive oropharyngeal cancer (NRG Oncology RTOG 1016): a randomised, multicentre, non-inferiority trial. Lancet 393 (10166): 40-50, 2019. [PUBMED Abstract]
- Mehanna H, Robinson M, Hartley A, et al.: Radiotherapy plus cisplatin or cetuximab in low-risk human papillomavirus-positive oropharyngeal cancer (De-ESCALaTE HPV): an open-label randomised controlled phase 3 trial. Lancet 393 (10166): 51-60, 2019. [PUBMED Abstract]
- Budach W, Bölke E, Kammers K, et al.: Induction chemotherapy followed by concurrent radio-chemotherapy versus concurrent radio-chemotherapy alone as treatment of locally advanced squamous cell carcinoma of the head and neck (HNSCC): A meta-analysis of randomized trials. Radiother Oncol 118 (2): 238-43, 2016. [PUBMED Abstract]
- Marur S, Li S, Cmelak AJ, et al.: E1308: Phase II Trial of Induction Chemotherapy Followed by Reduced-Dose Radiation and Weekly Cetuximab in Patients With HPV-Associated Resectable Squamous Cell Carcinoma of the Oropharynx- ECOG-ACRIN Cancer Research Group. J Clin Oncol 35 (5): 490-497, 2017. [PUBMED Abstract]
- Haddad R, O'Neill A, Rabinowits G, et al.: Induction chemotherapy followed by concurrent chemoradiotherapy (sequential chemoradiotherapy) versus concurrent chemoradiotherapy alone in locally advanced head and neck cancer (PARADIGM): a randomised phase 3 trial. Lancet Oncol 14 (3): 257-64, 2013. [PUBMED Abstract]
- Cohen EE, Karrison TG, Kocherginsky M, et al.: Phase III randomized trial of induction chemotherapy in patients with N2 or N3 locally advanced head and neck cancer. J Clin Oncol 32 (25): 2735-43, 2014. [PUBMED Abstract]
- Hitt R, Grau JJ, López-Pousa A, et al.: A randomized phase III trial comparing induction chemotherapy followed by chemoradiotherapy versus chemoradiotherapy alone as treatment of unresectable head and neck cancer. Ann Oncol 25 (1): 216-25, 2014. [PUBMED Abstract]
- Driessen CM, de Boer JP, Gelderblom H, et al.: Induction chemotherapy with docetaxel/cisplatin/5-fluorouracil followed by randomization to two cisplatin-based concomitant chemoradiotherapy schedules in patients with locally advanced head and neck cancer (CONDOR study) (Dutch Head and Neck Society 08-01): A randomized phase II study. Eur J Cancer 52: 77-84, 2016. [PUBMED Abstract]
- Sharma BB, Rai K, Blunt H, et al.: Pathogenic DPYD Variants and Treatment-Related Mortality in Patients Receiving Fluoropyrimidine Chemotherapy: A Systematic Review and Meta-Analysis. Oncologist 26 (12): 1008-1016, 2021. [PUBMED Abstract]
- Lam SW, Guchelaar HJ, Boven E: The role of pharmacogenetics in capecitabine efficacy and toxicity. Cancer Treat Rev 50: 9-22, 2016. [PUBMED Abstract]
- Shakeel F, Fang F, Kwon JW, et al.: Patients carrying DPYD variant alleles have increased risk of severe toxicity and related treatment modifications during fluoropyrimidine chemotherapy. Pharmacogenomics 22 (3): 145-155, 2021. [PUBMED Abstract]
- Amstutz U, Henricks LM, Offer SM, et al.: Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clin Pharmacol Ther 103 (2): 210-216, 2018. [PUBMED Abstract]
- Henricks LM, Lunenburg CATC, de Man FM, et al.: DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. Lancet Oncol 19 (11): 1459-1467, 2018. [PUBMED Abstract]
- Lau-Min KS, Varughese LA, Nelson MN, et al.: Preemptive pharmacogenetic testing to guide chemotherapy dosing in patients with gastrointestinal malignancies: a qualitative study of barriers to implementation. BMC Cancer 22 (1): 47, 2022. [PUBMED Abstract]
- Brooks GA, Tapp S, Daly AT, et al.: Cost-effectiveness of DPYD Genotyping Prior to Fluoropyrimidine-based Adjuvant Chemotherapy for Colon Cancer. Clin Colorectal Cancer 21 (3): e189-e195, 2022. [PUBMED Abstract]
- Baker SD, Bates SE, Brooks GA, et al.: DPYD Testing: Time to Put Patient Safety First. J Clin Oncol 41 (15): 2701-2705, 2023. [PUBMED Abstract]
Tratamiento del cáncer de orofaringe en estadio I y estadio II
Opciones de tratamiento para el cáncer de orofaringe en estadio I y estadio II
El tratamiento de los carcinomas de orofaringe en estadio I y estadio II exige un aporte multidisciplinario para establecer el abordaje óptimo. La radioterapia o la cirugía son igualmente exitosas para controlar el cáncer de orofaringe en estadio I y estadio II. Para obtener más información, consultar la sección Aspectos generales de las opciones de tratamiento del cáncer de orofaringe.
La elección del tratamiento se determina por el desenlace funcional anticipado para el habla y la deglución, así como del resultado cosmético que ofrecen las opciones de tratamiento, y de la pericia del cirujano o el radioncólogo. El tratamiento se individualiza para cada paciente.
Las opciones de tratamiento para el cáncer de orofaringe en estadio I y estadio II son las siguientes:
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Tratamiento del cáncer de orofaringe en estadio III y estadio IV
El tratamiento de los carcinomas de orofaringe en estadio III y estadio IV es complejo y exige un aporte multidisciplinario para establecer el abordaje óptimo. Para obtener más información, consultar la sección Aspectos generales de las opciones de tratamiento del cáncer de orofaringe.
Opciones de tratamiento para el cáncer de orofaringe en estadio III y estadio IV
Las opciones de tratamiento para el cáncer de orofaringe en estadio III y estadio IV son las siguientes:
- Cirugía y radioterapia posoperatoria (RTPO), con quimioterapia o sin esta para pacientes de enfermedad avanzada.[1-4][Nivel de evidencia A1]
- Radioterapia con fraccionamiento modificado.[5-9][Nivel de evidencia A1]
- Quimiorradioterapia simultánea.[10-15][Nivel de evidencia A1]
- Quimioterapia neoadyuvante seguida de quimiorradioterapia simultánea.
- Quimiorradioterapia con inmunoterapia (en evaluación clínica). En el ensayo RTOG 3504 (NCT02764593) se evaluó la quimiorradiación simultánea con nivolumab en pacientes con riesgo intermedio a alto de cáncer de cabeza y cuello.
- En el ensayo NRG-HN002 (NCT02254278) se está estudiando la desintensificación del tratamiento mediante la reducción gradual de la dosis de radiación.
- En el ensayo ECOG-3311 (NCT01898494) se está estudiando la desintensificación del tratamiento mediante la cirugía transoral seguida de una reducción gradual de la dosis de radiación.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Bernier J, Cooper JS, Pajak TF, et al.: Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (#22931) and RTOG (# 9501). Head Neck 27 (10): 843-50, 2005. [PUBMED Abstract]
- Cooper JS, Zhang Q, Pajak TF, et al.: Long-term follow-up of the RTOG 9501/intergroup phase III trial: postoperative concurrent radiation therapy and chemotherapy in high-risk squamous cell carcinoma of the head and neck. Int J Radiat Oncol Biol Phys 84 (5): 1198-205, 2012. [PUBMED Abstract]
- Cooper JS, Pajak TF, Forastiere AA, et al.: Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N Engl J Med 350 (19): 1937-44, 2004. [PUBMED Abstract]
- Bernier J, Domenge C, Ozsahin M, et al.: Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med 350 (19): 1945-52, 2004. [PUBMED Abstract]
- Horiot JC, Le Fur R, N'Guyen T, et al.: Hyperfractionation versus conventional fractionation in oropharyngeal carcinoma: final analysis of a randomized trial of the EORTC cooperative group of radiotherapy. Radiother Oncol 25 (4): 231-41, 1992. [PUBMED Abstract]
- Bourhis J, Lapeyre M, Tortochaux J, et al.: Phase III randomized trial of very accelerated radiation therapy compared with conventional radiation therapy in squamous cell head and neck cancer: a GORTEC trial. J Clin Oncol 24 (18): 2873-8, 2006. [PUBMED Abstract]
- Overgaard J, Hansen HS, Specht L, et al.: Five compared with six fractions per week of conventional radiotherapy of squamous-cell carcinoma of head and neck: DAHANCA 6 and 7 randomised controlled trial. Lancet 362 (9388): 933-40, 2003. [PUBMED Abstract]
- Overgaard J, Mohanti BK, Begum N, et al.: Five versus six fractions of radiotherapy per week for squamous-cell carcinoma of the head and neck (IAEA-ACC study): a randomised, multicentre trial. Lancet Oncol 11 (6): 553-60, 2010. [PUBMED Abstract]
- Fu KK, Pajak TF, Trotti A, et al.: A Radiation Therapy Oncology Group (RTOG) phase III randomized study to compare hyperfractionation and two variants of accelerated fractionation to standard fractionation radiotherapy for head and neck squamous cell carcinomas: first report of RTOG 9003. Int J Radiat Oncol Biol Phys 48 (1): 7-16, 2000. [PUBMED Abstract]
- Bonner JA, Harari PM, Giralt J, et al.: Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 354 (6): 567-78, 2006. [PUBMED Abstract]
- Curran D, Giralt J, Harari PM, et al.: Quality of life in head and neck cancer patients after treatment with high-dose radiotherapy alone or in combination with cetuximab. J Clin Oncol 25 (16): 2191-7, 2007. [PUBMED Abstract]
- Denis F, Garaud P, Bardet E, et al.: Final results of the 94-01 French Head and Neck Oncology and Radiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced-stage oropharynx carcinoma. J Clin Oncol 22 (1): 69-76, 2004. [PUBMED Abstract]
- Olmi P, Crispino S, Fallai C, et al.: Locoregionally advanced carcinoma of the oropharynx: conventional radiotherapy vs. accelerated hyperfractionated radiotherapy vs. concomitant radiotherapy and chemotherapy--a multicenter randomized trial. Int J Radiat Oncol Biol Phys 55 (1): 78-92, 2003. [PUBMED Abstract]
- Semrau R, Mueller RP, Stuetzer H, et al.: Efficacy of intensified hyperfractionated and accelerated radiotherapy and concurrent chemotherapy with carboplatin and 5-fluorouracil: updated results of a randomized multicentric trial in advanced head-and-neck cancer. Int J Radiat Oncol Biol Phys 64 (5): 1308-16, 2006. [PUBMED Abstract]
- Pignon JP, le Maître A, Maillard E, et al.: Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an update on 93 randomised trials and 17,346 patients. Radiother Oncol 92 (1): 4-14, 2009. [PUBMED Abstract]
Tratamiento del cáncer de orofaringe metastásico y recidivante
Opciones de tratamiento para el cáncer de orofaringe metastásico y recidivante
El tratamiento de los carcinomas de orofaringe metastásicos y recidivantes es complejo y exige un aporte multidisciplinario para establecer el abordaje óptimo. Para obtener más información, consultar la sección Aspectos generales de las opciones de tratamiento del cáncer de orofaringe.
Las opciones de tratamiento del cáncer de orofaringe metastásico y recidivante son las siguientes:
- Resección quirúrgica, si es técnicamente posible y el tumor no responde a la radioterapia.[1]
- Radioterapia, si el tumor no se puede extirpar por completo mediante cirugía y no se administraron antes dosis curativas de radiación.[2]
- Cirugía de revisión, si es técnicamente posible y el tumor no se extirpó al inicio.[1]
- Quimioterapia para la enfermedad locorregional recidivante irresecable.
- Radioterapia adicional con radioterapia fraccionada convencional o radioterapia hiperfraccionada (HFX) con quimioterapia simultánea.[3]
- Radioterapia estereotáctica corporal con cetuximab simultáneo.[4]
- Se puede emplear inmunoterapia (inhibidor de la vía del ligando de muerte celular programada 1 [PD-L1]) después del fracaso de la quimioterapia a base de derivados del platino[5,6], o desde el comienzo del tratamiento en los pacientes con enfermedad metastásica o recidiva local.[7,8]
- La participación en ensayos clínicos en los que se evalúe la radioterapia adicional con HFX y quimioterapia simultánea, la terapia dirigida, la radioterapia corporal estereotáctica o la inmunoterapia.[9]
Quimioterapia
La quimioterapia a base de derivados del platino se suele usar como tratamiento de primera línea para pacientes con carcinoma de células escamosas (CCE) de cabeza y cuello metastásico o recidivante.
Evidencia (quimioterapia):
- En un ensayo aleatorizado de fase III, participaron 442 pacientes con CCE de cabeza y cuello metastásico o recidivante no tratado, en quienes se encontró que la adición de cetuximab al tratamiento con un derivado del platino y fluorouracilo (5-FU) en comparación con un derivado del platino y 5-FU solos, mejoró la supervivencia general (SG). La mediana de supervivencia fue de 10,1 meses versus 7,4 meses (cociente de riesgos instantáneos [CRI]de muerte, 0,80; intervalo de confianza [IC] 95 %, 0,64–0,99; P = 0,04).[10]
- No se afectó de forma adversa la calidad de vida (CV) al añadir cetuximab al régimen a base de derivados del platino.[11]
El número de copias del gen EGFR en el tumor no fue un biomarcador predictivo de la eficacia del cetuximab, un derivado del platino y el 5-FU como terapia de primera línea para pacientes con CCE de cabeza y cuello metastásico o recidivante.[12][Nivel de evidencia A1]
- En un ensayo aleatorizado sin anonimato de fase III, se demostró que la supervivencia sin progresión (SSP) mejoró en los pacientes que recibieron afatinib en comparación con los pacientes que recibieron metotrexato.[13]
- Al cabo de una mediana de seguimiento de 6,7 meses, la mediana de SSP fue de 2,6 meses (IC 95 %, 2,0–2,7) en el grupo de afatinib y de 1,7 meses (IC 95 %, 1,5–2,4) en el grupo de metotrexato (CRI, 0,80; IC 95 %, 0,65–0,98; P = 0,030).
- Los efectos adversos de grado 3 o grado 4 más frecuentes relacionados con los fármacos en los pacientes tratados con afatinib o metotrexato fueron los siguientes:
- Exantema o acné (10 % para afatinib vs. 0 % para metotrexato).
- Diarrea (9 % para afatinib vs. 2 % para metotrexato).
- Estomatitis (6 % para afatinib vs. 8 % para metotrexato).
- Fatiga (6 % para afatinib vs. 3 % para metotrexato).
- Neutropenia (<1 % para afatinib vs. 7 % para metotrexato).
- Se presentaron efectos adversos generales graves en el 14 % de los pacientes tratados con afanitib y en el 11 % de los pacientes tratados con metotrexato.
Inmunoterapia
Pembrolizumab
El pembrolizumab es un anticuerpo monoclonal y un inhibidor de la vía de la muerte celular programada 1 (PD-1), que se ha evaluado, en varios estudios, para el tratamiento de pacientes con carcinoma de células escamosas (CCE) de cabeza y cuello metastásico o recidivante incurable.
Evidencia (pembrolizumab como terapia de primera línea):
- El ensayo KEYNOTE-048 (NCT02358031) fue un estudio aleatorizado sin enmascaramiento de fase III, realizado en 200 sitios de 37 países, en el que se inscribieron pacientes con CCE de cabeza y cuello metastásico o recidivante localmente incurable que no habían recibido tratamiento.[7] Se asignaron al azar 882 pacientes en una proporción de 1:1:1 para recibir pembrolizumab solo (n = 301), pembrolizumab con un derivado del platino y fluorouracilo (5-FU) (pembrolizumab con quimioterapia) (n = 281), o cetuximab con un derivado del platino y 5-FU (cetuximab con quimioterapia) (n = 300). Los investigadores, los pacientes y los representantes del patrocinador desconocían los resultados de la puntuación positiva combinada (CPS) de PD-L1; no se exigió positividad de PD-L1 para ingresar al estudio. En este estudio, 754 pacientes (85 %) tenían CPS de 1 o superior, y 381 pacientes (43 %) tenían CPS de 20 o superior.
Los criterios principales de valoración fueron la supervivencia general (SG) y la supervivencia sin progresión (SSP). La progresión se definió como enfermedad progresiva confirmada radiográficamente o la muerte por cualquier causa, lo que sucediera primero, en la población por intención de tratar.
- En el segundo análisis interino, el pembrolizumab solo mostró mejora de la SG o una SG que no fue inferior en la comparación con el tratamiento de cetuximab con quimioterapia. Los resultados de la mediana de SG se notificaron de la siguiente manera:[7][Nivel de evidencia A1]
- Entre la población con CPS de 20 o superior, la mediana de SG fue de 14,9 meses en los pacientes que recibieron pembrolizumab solo y de 10,7 meses en los pacientes que recibieron cetuximab con quimioterapia (cociente de riesgos instantáneos [CRI], 0,61; intervalo de confianza [IC] 95 %, 0,45–0,83; P = 0,0007).
- Entre la población con CPS de 1 o superior, la mediana de SG fue de 12,3 meses en los pacientes que recibieron pembrolizumab solo y de 10,3 meses en los pacientes que recibieron cetuximab con quimioterapia (CRI, 0,78; IC 95 %, 0,64–0,96; P = 0,0086).
- Entre la población total, los pacientes que recibieron pembrolizumab solo tuvieron una SG que no fue inferior (11,6 meses) en la comparación con los pacientes que recibieron cetuximab con quimioterapia (10,7 meses) (CRI, 0,85; IC 95 %, 0,71–1,03; P = 0,0456).
- El tratamiento de pembrolizumab con quimioterapia mostró una mejora de la SG versus el tratamiento de cetuximab con quimioterapia. Los resultados de la SG se notificaron de la siguiente manera:
- En el segundo análisis interino, en la población total, la mediana de SG fue de 13,0 meses en los pacientes del grupo de pembrolizumab con quimioterapia y de 10,7 meses en los pacientes del grupo de cetuximab con quimioterapia (CRI, 0,77; IC 95 %, 0,63–0,93; P = 0,0034).
- En el análisis final, en la población con CPS de 20 o superior, la mediana de SG fue de 14,7 meses en los pacientes del grupo de pembrolizumab con quimioterapia y de 11,0 meses en los pacientes del grupo de cetuximab con quimioterapia (CRI, 0,60; IC 95 %, 0,45–0,82; P = 0,0004).
- En el análisis final, en la población con CPS de 1 o superior, la mediana de SG fue de 13,6 meses en los pacientes que recibieron pembrolizumab con quimioterapia y de 10,4 meses en los pacientes que recibieron cetuximab con quimioterapia (CRI, 0,65; IC 95 %, 0,53–0,80; P < 0,0001).
- En el segundo análisis interino, ni el pembrolizumab solo ni el pembrolizumab con quimioterapia mejoraron la SSP.
- En el análisis final, se presentaron efectos adversos por cualquier causa de grado 3 o superior en 164 de 300 pacientes (55 %) del grupo de pembrolizumab solo, en 235 de 276 pacientes (85 %) del grupo de pembrolizumab con quimioterapia y en 239 de 287 pacientes (83 %) del grupo de cetuximab con quimioterapia.
- Los efectos adversos produjeron la muerte de 25 pacientes (8 %) en el grupo de pembrolizumab solo, 32 pacientes (12 %) en el grupo de pembrolizumab con quimioterapia y 28 pacientes (10 %) en el grupo de cetuximab con quimioterapia.
- En el segundo análisis interino, el pembrolizumab solo mostró mejora de la SG o una SG que no fue inferior en la comparación con el tratamiento de cetuximab con quimioterapia. Los resultados de la mediana de SG se notificaron de la siguiente manera:[7][Nivel de evidencia A1]
El pembrolizumab combinado con un derivado del platino y 5-FU es un tratamiento de primera línea indicado para los pacientes con CCE de cabeza y cuello metastásico o recidivante. La monoterapia de pembrolizumab es un tratamiento de primera línea indicado para los pacientes con CCE de cabeza y cuello metastásico o recidivante positivo para PD-L1. Estos resultados se confirmaron en un análisis hecho con una mediana de seguimiento más larga de 45 meses (intervalo intercuartílico, 41,0–49,2).[8]
Evidencia (pembrolizumab después de la progresión con el tratamiento a base de derivados del platino):
- En el ensayo de fase III KEYNOTE-040 (NCT02252042), se incluyeron pacientes con CCE de cabeza y cuello metastásico o recidivante incurable que habían recibido tratamiento a base de derivados del platino en el transcurso de 3 a 6 meses.[5] Los pacientes se asignaron al azar al grupo de pembrolizumab (200 mg cada 3 semanas [247 pacientes]) o al grupo de tratamiento estándar elegido por el investigador (metotrexato, docetaxel o cetuximab [248 pacientes]). Los pacientes recibieron tratamiento hasta la progresión o presencia de toxicidad. La duración máxima del pembrolizumab fue de 24 meses. El criterio principal de valoración fue la SG en la población por intención de tratar.
- La mediana de SG fue de 8,4 meses en el grupo de pembrolizumab y de 6,9 meses en el grupo de tratamiento estándar (CRI, 0,80; IC 95 %, 0,65–0,98; P = 0,0161).[5][Nivel de evidencia A1]
- El pembrolizumab se asoció con menos efectos adversos de grado 3 o superior (pembrolizumab, 13 % vs. tratamiento estándar, 36 %). Los efectos adversos más comunes relacionados con el tratamiento fueron hipotiroidismo (13 %) en el grupo de pembrolizumab y fatiga (18 %) en el grupo de tratamiento estándar.
- En el grupo de pembrolizumab, 4 pacientes murieron por causas relacionadas con el tratamiento por perforación intestinal grande, síndrome de Stevens-Johnson y progresión maligna no especificada. En el grupo de tratamiento estándar, 2 pacientes murieron por causas relacionadas con el tratamiento por progresión maligna y neumonía.
- La CPS de PD-L1 fue de 1 o superior en el 79 % de los pacientes en el grupo de pembrolizumab y en el 77 % de los pacientes en el grupo de tratamiento estándar.
- En comparación con los pacientes que recibieron terapia estándar, se observó una reducción del CRImuerte entre los pacientes que recibieron pembrolizumab y presentaron expresión de PD-1 tumoral o en el microentorno tumoral, expresada por CPS de PD-L1 de 1 o superior (CRI, 0,74; IC 95 %, 0,58–0,93; P nominal = 0,0049) o una puntuación de proporción tumoral de PD-L1 del 50 % o superior (CRI, 0,53; IC 95 %, 0,35–0,81; P nominal = 0,0014).
Nivolumab
El nivolumab es un anticuerpo monoclonal humano de inmunoglobulina G4 anti-PD-1.
Evidencia (nivolumab combinado con ipilimumab en pacientes que no han recibido terapia sistémica):
- El ensayo CheckMate 651 (NCT02741570) fue un estudio en el que se evaluó la administración de nivolumab con ipilimumab de primera línea versus la administración del régimen EXTREME (cetuximab, cisplatino, carboplatino y 5-FU durante un máximo de 6 ciclos seguidos de mantenimiento con cetuximab) en pacientes con CCE de cabeza y cuello metastásico o recidivante.[14] Los criterios principales de valoración fueron la SG en todos los pacientes aleatorizados y en los pacientes con CPS de PD-L1 de 20 o superior. Los criterios secundarios de valoración incluyeron la SG en pacientes con CPS de PD-L1 de 1 o superior, además de la SSP, la tasa de respuesta objetiva y la duración de la respuesta en todos los pacientes aleatorizados y en los pacientes con CPS de PD-L1 de 20 o superior.
- En el grupo de todos los pacientes aleatorizados no se observó ninguna diferencia estadísticamente significativa en la SG entre quienes recibieron nivolumab con ipilimumab versus el régimen EXTREME (mediana de SG, 13,9 vs. 13,5 meses; CRI, 0,95; IC 97,9 %, 0,80–1,13; P = 0,4951). Entre los pacientes con CPS de PD-L1 de 20 o superior, tampoco se observó una diferencia estadísticamente significativa de la SG entre los dos tratamientos (mediana de SG, 17,6 vs. 14,6 meses; CRI, 0,78; IC 97,51 %, 0,59–1,03; P = 0,0469).[14][Nivel de evidencia A1]
- Entre los pacientes con CPS de 1 o superior, la mediana de SG fue de 15,7 meses en los pacientes que recibieron nivolumab con ipilimumab versus 13,2 meses en los pacientes que recibieron el régimen EXTREME (CRI, 0,82; IC 95 %, 0,69–0,97).
- Entre los pacientes con CPS de 20 o superior, la mediana de SSP fue de 5,4 meses en los pacientes que recibieron nivolumab con ipilimumab y de 7,0 meses en los pacientes que recibieron el régimen EXTREME. La tasa de respuesta objetiva fue del 34,1 % en los pacientes que recibieron nivolumab con ipilimumab y del 36 % en los pacientes que recibieron el régimen EXTREME.
- Se presentaron efectos adversos relacionados con el tratamiento de grado 3 o 4 en el 28,2 % de los pacientes del grupo de nivolumab con ipilimumab y en el 70,7 % de los pacientes del grupo del régimen EXTREME.
- El ensayo CheckMate 651 no satisfizo sus criterios principales de valoración de SG en la población aleatorizada ni en la población de participantes con CPS de 20 o superior.
La ausencia de un beneficio de supervivencia para los inhibidores de puntos de control inmunitario en este ensayo fue un desenlace inesperado, dada la similitud del nivolumab con el pembrolizumab en los estudios de pacientes con enfermedad resistente al cisplatino.[5,6] En un artículo editorial relativo al ensayo CheckMate 651 se analizaron algunos de los factores que quizás contribuyeron a un resultado diferente. En el artículo se indicó que la supervivencia en el grupo de control, que fue más larga que la notificada en estudios previos, quizás se haya visto afectada por la mayor disponibilidad de inmunoterapia de segunda línea en el grupo de control (un 46 % en el ensayo CheckMate 651, en comparación con un 25 % en el ensayo KEYNOTE-048). Los autores también indicaron que la administración conjunta de ipilimumab limitó la actividad del nivolumab, como se demostró en el ensayo CheckMate 714.[15]
- El estudio CheckMate 714 (NCT02823574) fue un ensayo de fase II con enmascaramiento doble en el que se evaluó el beneficio clínico del nivolumab con ipilimumab de primera línea versus nivolumab solo en 425 pacientes con CCE de cabeza y cuello metastásico o recidivante.[16] Los pacientes se asignaron al azar en una proporción de 2:1 para recibir nivolumab (3 mg/kg intravenoso [IV] cada 2 semanas) con ipilimumab (1 mg/kg IV cada 6 semanas) o nivolumab (3 mg/kg IV cada 2 semanas) con placebo. El tratamiento continuó durante un máximo de 2 años o hasta que se presentara progresión de la enfermedad, efectos tóxicos inaceptables o retiro del consentimiento. Los criterios principales de valoración fueron la tasa de respuesta objetiva y la duración de la respuesta en los grupos de tratamiento, evaluados mediante revisión central independiente enmascarada en la población con enfermedad metastásica o recidivante resistente al tratamiento con derivados del platino. Esta población abarcó los pacientes que presentaron enfermedad recidivante menos de 6 meses después de completar la quimioterapia a base de derivados del platino (adyuvante o neoadyuvante, o como parte de un tratamiento multimodal [quimioterapia, cirugía o radioterapia]). Entre los 241 pacientes (56,7 %) con enfermedad resistente al tratamiento con derivados del platino, 159 se asignaron a recibir nivolumab con ipilimumab y 82 a recibir nivolumab solo. Entre los 184 pacientes (43,3 %) con enfermedad apta para recibir derivados del platino, 123 se asignaron a recibir nivolumab con ipilimumab y 61 a recibir nivolumab solo.[16][Nivel de evidencia B3]
- En el momento del cierre primario de la base de datos, la tasa de respuesta objetiva en la población con enfermedad resistente a los derivados del platino fue del 13,2 % (IC 95 %, 8,4–19,5 %) en el grupo de nivolumab con ipilimumab y del 18,3 % (IC 95 %, 10,6–28,4 %) en el grupo de nivolumab solo (oportunidad relativa, 0,68; IC 95 %, 0,33–1,43; P = 0,29).
- No se alcanzó (NA) la mediana de duración de la respuesta en el grupo de nivolumab con ipilimumab (IC 95 %, 11,0 meses–NA) y fue de 11,1 meses (IC 95 %, 4,1–NA) en el grupo de nivolumab solo. En la población con enfermedad apta para recibir derivados del platino, la tasa de respuesta objetiva fue del 20,3 % (IC 95 %, 13,6–28,5 %) en el grupo de nivolumab con ipilimumab y del 29,5 % (IC 95 %, 18,5–42,6 %) en el grupo de nivolumab solo.
- En la población con enfermedad resistente a los derivados del platino, se presentaron efectos adversos relacionados con el tratamiento de grado 3 o 4 en 25 de 158 pacientes (15,8 %) del grupo que recibió nivolumab con ipilimumab y en 12 de 82 pacientes (14,6 %) del grupo que recibió nivolumab solo. En la población con enfermedad apta para recibir derivados del platino, se presentaron efectos adversos relacionados con el tratamiento de grado 3 o 4 en 30 de 122 pacientes (24,6 %) del grupo que recibió nivolumab con ipilimumab y en 8 de 61 pacientes (13,1 %) del grupo que recibió nivolumab solo.
- En este ensayo no se alcanzó el criterio principal de valoración de beneficio en la tasa de respuesta objetiva del tratamiento de primera línea con nivolumab e ipilimumab versus el tratamiento con nivolumab solo en pacientes con CCE de cabeza y cuello metastásico o recidivante resistente al tratamiento con derivados del platino.
Evidencia (nivolumab después de la progresión con el tratamiento a base de derivados del platino):
- En un ensayo sin enmascaramiento de fase III se incluyeron 361 pacientes con CCE de cabeza y cuello recidivante y progresión de la enfermedad dentro de los 6 meses posteriores a la quimioterapia a base de derivados del platino. Los pacientes se asignaron al azar en una proporción de 2:1 para recibir nivolumab (dosis de 3 mg/kg de peso corporal) cada 2 semanas o terapia sistémica estándar en monoterapia (metotrexato, docetaxel o cetuximab). El criterio principal de valoración fue la SG.[6]
- La mediana de SG fue de 7,5 meses (IC 95 %, 5,5–9,1) en el grupo de nivolumab versus 5,1 meses (IC 95 % 4,0–6,0) en el grupo de terapia estándar. La SG fue significativamente más larga en el grupo de nivolumab que el grupo de terapia estándar (CRImuerte, 0,70; IC 97,73 %, 0,51–0,96; P = 0,01). La tasa estimada de supervivencia a 1 año fue aproximadamente un 19 % más alta en los pacientes que recibieron nivolumab (36 %) que en aquellos que recibieron terapia estándar (16,6 %).[6][Nivel de evidencia A1]
- No hubo diferencia estadísticamente significativa en la mediana de SSP entre los grupos de tratamiento. La tasa de SSP a los 6 meses fue del 19,7 % con nivolumab versus el 9,9 % con la terapia estándar.
- La tasa de respuesta fue del 13,3 % en el grupo de nivolumab versus el 5,8 % en el grupo de terapia estándar.
- Se presentaron efectos adversos relacionados con el tratamiento de grado 3 o 4 en el 13,1 % de los pacientes del grupo de nivolumab, en comparación con el 35,1 % de los pacientes en el grupo de terapia estándar.
- Los desenlaces de calidad de vida (que abarcaron la función física, la función de rol, la función social, el dolor, los problemas sensoriales y de contacto social), se mantuvieron estables en el grupo de nivolumab, pero empeoraron en el grupo de terapia estándar. Estos desenlaces se evaluaron mediante el instrumento European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire (QLQ), específicamente el módulo base QLQ-C30 y el módulo de cabeza y cuello QLQ-H&N35.
- En el subgrupo de pacientes con un nivel de expresión de PD-L1 de 1 % o superior, el CRImuerte fue de 0,55 (IC 95 %, 0,36–0,83) entre los pacientes tratados con nivolumab versus aquellos tratados con terapia estándar. En el subgrupo de pacientes con un nivel de expresión de PD-L1 inferior al 1 %, el CRI fue de 0,89 (IC 95 %, 0,54–1,45; P = 0,17 para la interacción).
- En la India se llevó a cabo un estudio aleatorizado de fase III para evaluar la superioridad de un tratamiento en el que se analizó la dosis de los inhibidores de puntos de control inmunitario en el entorno de los cuidados paliativos para pacientes con cáncer avanzado de cabeza y cuello. Se añadió nivolumab en dosis bajas (20 mg IV cada 3 semanas) a un régimen de quimioterapia metronómica triple de metotrexato oral (9 mg/m2 1 vez por semana), celecoxib (200 mg 2 veces al día) y erlotinib (150 mg 1 vez al día). Cabe destacar que esta dosis de nivolumab es menor al 10 % de la dosis recomendada por la Administración de Alimentos y Medicamentos de los Estados Unidos y la Agencia Europea de Medicamentos. Participaron 151 pacientes asignados al azar para recibir quimioterapia metronómica triple sola (n = 75) o quimioterapia metronómica triple con nivolumab (n = 76). El criterio principal de valoración fue la SG a 1 año.[17]
- La adición del nivolumab en dosis bajas a la quimioterapia metronómica triple mejoró la tasa de SG a 1 año que pasó del 16,3 % (IC 95 %, 8,0–27,4 %) al 43,4 % (IC 95 %, 30,8–55,3 %) (CRI, 0,545; IC 95 %, 0,362–0,820; P = 0,0036).[17][Nivel de evidencia A1]
- La mediana de SG fue de 6,7 meses (IC 95 %, 5,8–8,1) en los pacientes que recibieron quimioterapia metronómica triple sola y de 10,1 meses (IC 95 %, 7,4–12,6) en los pacientes que recibieron quimioterapia metronómica triple con nivolumab (P = 0,0052).
- La tasa de efectos adversos de grado 3 o superior fue del 50 % en los pacientes que recibieron quimioterapia metronómica triple sola y del 46,1 % en los pacientes que recibieron quimioterapia metronómica triple con nivolumab (P = 0,744).
Aunque el grupo de control de este estudio no se puede considerar un grupo de terapia estándar, se encontraron indicios de beneficio de la administración de dosis más bajas de inmunoterapia en este entorno.[18]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Wong LY, Wei WI, Lam LK, et al.: Salvage of recurrent head and neck squamous cell carcinoma after primary curative surgery. Head Neck 25 (11): 953-9, 2003. [PUBMED Abstract]
- Vikram B, Strong EW, Shah JP, et al.: Intraoperative radiotherapy in patients with recurrent head and neck cancer. Am J Surg 150 (4): 485-7, 1985. [PUBMED Abstract]
- Spencer SA, Harris J, Wheeler RH, et al.: RTOG 96-10: reirradiation with concurrent hydroxyurea and 5-fluorouracil in patients with squamous cell cancer of the head and neck. Int J Radiat Oncol Biol Phys 51 (5): 1299-304, 2001. [PUBMED Abstract]
- Vargo JA, Ferris RL, Ohr J, et al.: A prospective phase 2 trial of reirradiation with stereotactic body radiation therapy plus cetuximab in patients with previously irradiated recurrent squamous cell carcinoma of the head and neck. Int J Radiat Oncol Biol Phys 91 (3): 480-8, 2015. [PUBMED Abstract]
- Cohen EEW, Soulières D, Le Tourneau C, et al.: Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head-and-neck squamous cell carcinoma (KEYNOTE-040): a randomised, open-label, phase 3 study. Lancet 393 (10167): 156-167, 2019. [PUBMED Abstract]
- Ferris RL, Blumenschein G, Fayette J, et al.: Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med 375 (19): 1856-1867, 2016. [PUBMED Abstract]
- Burtness B, Harrington KJ, Greil R, et al.: Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet 394 (10212): 1915-1928, 2019. [PUBMED Abstract]
- Harrington KJ, Burtness B, Greil R, et al.: Pembrolizumab With or Without Chemotherapy in Recurrent or Metastatic Head and Neck Squamous Cell Carcinoma: Updated Results of the Phase III KEYNOTE-048 Study. J Clin Oncol 41 (4): 790-802, 2023. [PUBMED Abstract]
- Tortochaux J, Tao Y, Tournay E, et al.: Randomized phase III trial (GORTEC 98-03) comparing re-irradiation plus chemotherapy versus methotrexate in patients with recurrent or a second primary head and neck squamous cell carcinoma, treated with a palliative intent. Radiother Oncol 100 (1): 70-5, 2011. [PUBMED Abstract]
- Vermorken JB, Mesia R, Rivera F, et al.: Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med 359 (11): 1116-27, 2008. [PUBMED Abstract]
- Mesía R, Rivera F, Kawecki A, et al.: Quality of life of patients receiving platinum-based chemotherapy plus cetuximab first line for recurrent and/or metastatic squamous cell carcinoma of the head and neck. Ann Oncol 21 (10): 1967-73, 2010. [PUBMED Abstract]
- Licitra L, Mesia R, Rivera F, et al.: Evaluation of EGFR gene copy number as a predictive biomarker for the efficacy of cetuximab in combination with chemotherapy in the first-line treatment of recurrent and/or metastatic squamous cell carcinoma of the head and neck: EXTREME study. Ann Oncol 22 (5): 1078-87, 2011. [PUBMED Abstract]
- Machiels JP, Haddad RI, Fayette J, et al.: Afatinib versus methotrexate as second-line treatment in patients with recurrent or metastatic squamous-cell carcinoma of the head and neck progressing on or after platinum-based therapy (LUX-Head & Neck 1): an open-label, randomised phase 3 trial. Lancet Oncol 16 (5): 583-94, 2015. [PUBMED Abstract]
- Haddad RI, Harrington K, Tahara M, et al.: Nivolumab Plus Ipilimumab Versus EXTREME Regimen as First-Line Treatment for Recurrent/Metastatic Squamous Cell Carcinoma of the Head and Neck: The Final Results of CheckMate 651. J Clin Oncol 41 (12): 2166-2180, 2023. [PUBMED Abstract]
- Burtness B: First-Line Nivolumab Plus Ipilimumab in Recurrent/Metastatic Head and Neck Cancer-What Happened? J Clin Oncol 41 (12): 2134-2137, 2023. [PUBMED Abstract]
- Harrington KJ, Ferris RL, Gillison M, et al.: Efficacy and Safety of Nivolumab Plus Ipilimumab vs Nivolumab Alone for Treatment of Recurrent or Metastatic Squamous Cell Carcinoma of the Head and Neck: The Phase 2 CheckMate 714 Randomized Clinical Trial. JAMA Oncol 9 (6): 779-789, 2023. [PUBMED Abstract]
- Patil VM, Noronha V, Menon N, et al.: Low-Dose Immunotherapy in Head and Neck Cancer: A Randomized Study. J Clin Oncol 41 (2): 222-232, 2023. [PUBMED Abstract]
- Mitchell AP, Goldstein DA: Cost Savings and Increased Access With Ultra-Low-Dose Immunotherapy. J Clin Oncol 41 (2): 170-172, 2023. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (04/30/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes hechos a este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de orofaringe en adultos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de orofaringe son:
- Andrea Bonetti, MD (Pederzoli Hospital)
- Minh Tam Truong, MD (Boston University Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de orofaringe. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/cabeza-cuello/pro/adulto/tratamiento-orofaringe-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.