Tratamiento del cáncer de próstata (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de próstata
La mediana de edad en el momento del diagnóstico del cáncer de próstata es de 67 años.[1] El cáncer de próstata se puede curar cuando está localizado y, con frecuencia, responde al tratamiento cuando está diseminado. La tasa de crecimiento tumoral oscila de muy lento a moderadamente rápido y, algunos pacientes tienen una supervivencia prolongada incluso después de que se presentan metástasis en sitios distantes, como los huesos. En los Estados Unidos, la tasa de supervivencia relativa a 5 años para los hombres con un diagnóstico entre 2014 y 2020 de enfermedad local o regional superó el 99 % y en el caso de enfermedad a distancia, la tasa fue del 37 %; cuando se combinaron todos los estadios, la tasa fue del 97 %.[2] El abordaje de tratamiento depende de la edad y de los problemas médicos concomitantes. Se deben considerar los efectos secundarios de las distintas formas de tratamiento para seleccionar el tratamiento apropiado.
Muchos pacientes (en especial, aquellos con tumores localizados) mueren debido a otras enfermedades sin sufrir ninguna discapacidad por el cáncer de próstata, incluso cuando se utiliza un tratamiento conservador sin intención curativa.[3,4] En parte, es posible que estos desenlaces favorables sean consecuencia del uso generalizado de los exámenes de detección con la prueba del antígeno prostático específico (PSA), que permiten identificar a pacientes que tienen tumores asintomáticos con una probabilidad baja o nula de causar la muerte.[5] Según las series de autopsias de hombres que mueren por causas no relacionadas con el cáncer de próstata, se estima que la prevalencia de tumores de escasa malignidad clínica oscila entre el 30 % y el 70 % en hombres mayores de 60 años.[6,7]
Dado que los métodos de diagnóstico han cambiado con el tiempo, cualquier análisis de la supervivencia después del tratamiento del cáncer de próstata y los análisis comparativos de las diversas estrategias de tratamiento se complican ya que se comprueba un aumento creciente en el diagnóstico de tumores no mortales. En las comparaciones no aleatorizadas de tratamientos hay confusión que no solo se debe a los factores relacionados con la selección de los pacientes, sino también a las tendencias temporales.
Por ejemplo, en un estudio poblacional en Suecia, se observó que desde 1960 hasta finales de la década de 1980 (antes del uso de la prueba de PSA como examen de detección), las tasas de supervivencia relativa a largo plazo después del diagnóstico de cáncer de próstata mejoraron bastante a medida que se incorporaron métodos diagnósticos más sensibles. Esto tuvo lugar pese al uso de conducta expectante, vigilancia activa o un tratamiento paliativo con hormonas como las estrategias de tratamiento más comunes para el cáncer de próstata localizado durante toda esta época (en Suecia se realizaron <150 prostatectomías radicales por año durante finales de la década de 1980). Los investigadores calcularon que, si todos los cánceres de próstata diagnosticados entre 1960 y 1964 fueron mortales, entonces por lo menos el 33 % de los cánceres diagnosticados entre 1980 y 1984 no lo fueron.[8][Nivel de evidencia C1] Con el advenimiento de las pruebas del PSA como el método de detección más común en los Estados Unidos, aumentó aún más la capacidad de diagnosticar cánceres de próstata no mortales.
Otro aspecto que dificulta la comparación de resultados entre series no simultáneas de pacientes es la posibilidad de cambios en los criterios para el diagnóstico histológico del cáncer de próstata.[9] Este fenómeno genera un artefacto estadístico que conlleva un sentido falso de logro terapéutico y a veces conduce a un tratamiento más intensivo.
Hay controversias sobre la utilidad de los exámenes de detección, la forma más apropiada para evaluar el estadio y el tratamiento óptimo para cada estadio de la enfermedad.[10-13,13,14]
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por cáncer de próstata en los Estados Unidos para 2025:[1,2]
- Casos nuevos: 313 780.
- Defunciones: 35 770.
Características anatómicas
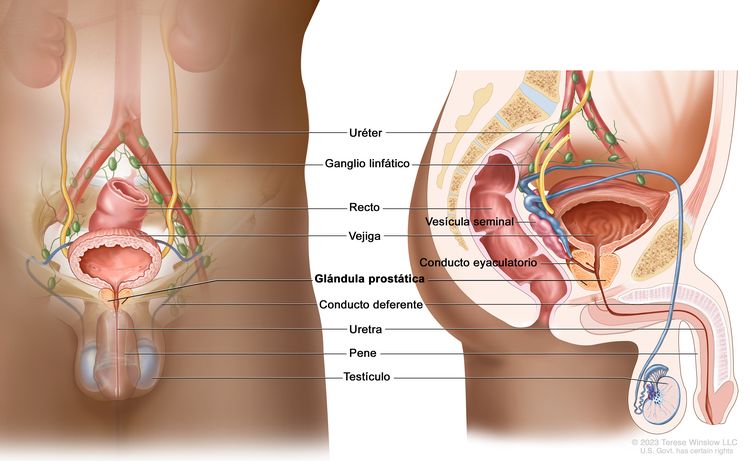
Exámenes de detección
El tema relacionado con la realización de exámenes de detección del cáncer de próstata es objeto de polémica. En los Estados Unidos, la mayoría de los cánceres de próstata se diagnostican a partir de los exámenes de detección, ya sea una prueba de PSA en la sangre o, con menos frecuencia, un examen digital del recto. Los resultados de los ensayos aleatorizados de este tipo son contradictorios.[15-17] En las revisiones sistemáticas de la bibliografía y en los metanálisis no se notificó evidencia clara de que los exámenes de detección del cáncer de próstata disminuyan el riesgo de muerte por cáncer de próstata o que sus beneficios sobrepasen los perjuicios.[18,19]
Para obtener un resumen detallado de la evidencia sobre los beneficios y perjuicios de los exámenes de detección del cáncer de próstata, consultar Exámenes de detección del cáncer de próstata.
Características patológicas
Más del 95 % de los cánceres de próstata primarios son adenocarcinomas. Con frecuencia, los adenocarcinomas de próstata son multifocales y heterogéneos en sus modelos de diferenciación. La neoplasia prostática intraepitelial (NPI) es la presencia de células epiteliales atípicas no invasivas dentro de acinos de apariencia benigna y a menudo se presenta de manera simultánea con un adenocarcinoma de próstata. La NPI se subdivide en grado bajo y grado alto. La NPI de grado alto a veces es precursora de un adenocarcinoma.[20]
El resto de los casos corresponden a varios tumores raros, como los siguientes:
- Tumores de células pequeñas.
- Carcinomas acinares intralobulares.
- Carcinomas ductales.
- Carcinomas de células claras.
- Carcinomas mucinosos.[21]
Puntaje de Gleason
El grado histológico de los adenocarcinomas de próstata por lo general se notifica de acuerdo con una de las variaciones del sistema de puntaje de Gleason, que proporciona un complemento útil, aunque impreciso, a la estadificación tumoral para establecer el pronóstico.[21] El puntaje de Gleason se calcula según los grados histológicos dominantes: desde el grado 1 (bien diferenciado) hasta el grado 5 (muy pobremente diferenciado). El puntaje clásico es la suma de los dos grados de los patrones más prevalentes, que resulta en un puntaje que oscila entre 2 y 10. Debido a que hay evidencia de que el componente menos diferenciado de la muestra a veces proporciona información pronóstica independiente, el puntaje a menudo se registra con sus componentes separados (por ejemplo, puntaje de Gleason 3 + 4 = 7; o 4 + 3 = 7).[22]
Hay indicios de que, con el tiempo, hubo una tendencia entre los patólogos de asignar puntajes de Gleason más altos a los mismos patrones histológicos, un fenómeno que a veces se conoce como inflación del grado.[23,24] Este fenómeno complica las comparaciones de desenlaces entre las series de pacientes actuales e históricas. Por ejemplo, las biopsias de próstata de una cohorte poblacional de 1858 hombres que recibieron un diagnóstico de cáncer de próstata entre 1990 y 1992, se volvieron a interpretar entre 2002 y 2004.[23,24] Los valores contemporáneos del puntaje de Gleason fueron, en promedio, 0,85 puntos más altos (intervalo de confianza 95 %, 0,79–0,91; P < 0,001) que los valores otorgados a las mismas preparaciones microscópicas 10 años antes. Como resultado, en estos hombres las tasas de mortalidad por cáncer de próstata estandarizadas de acuerdo con el puntaje de Gleason mejoraron de manera artificial de 2,08 a 1,50 muertes por 100 años-persona (una disminución del 28 %), aunque los desenlaces generales no cambiaron.
Marcadores moleculares
Varios marcadores tumorales se relacionan con el desenlace de pacientes con cáncer de próstata, entre estos, los siguientes:[20,21]
- Marcadores de apoptosis, como Bcl-2 y Bax.
- Marcadores de tasa de proliferación, como Ki67.
- Variante o expresión de TP53.
- p27.
- E-caderina.
- Densidad microvascular.
- Ploidía de ADN.
- p16.
- Hipermetilación y pérdidas alélicas del gen PTEN.
Sin embargo, ninguno de estos marcadores se validó de modo prospectivo y no forman parte del tratamiento habitual de los pacientes.
Cuadro clínico inicial
En los Estados Unidos, la mayoría de los cánceres de próstata se diagnostican mediante exámenes de detección; en consecuencia, los síntomas de cáncer son infrecuentes en el momento del diagnóstico.[21] No obstante, el crecimiento local del tumor a veces produce síntomas de obstrucción urinaria como los siguientes:
- Disminución del chorro miccional.
- Urgencia miccional.
- Retardo miccional.
- Nicturia.
- Vaciado vesical incompleto.
Estos síntomas son inespecíficos y más indicativos de hiperplasia prostática benigna que de cáncer.
El cáncer de próstata también se manifiesta con síntomas de metástasis, como dolor óseo, fracturas patológicas o síntomas de compromiso de la médula ósea; sin embargo, esto es muy infrecuente en vista de la amplia disponibilidad de exámenes de detección en la actualidad.
Evaluación diagnóstica
La biopsia con aguja es el método más común para diagnosticar el cáncer de próstata. En la actualidad, la mayoría de los urólogos hacen la biopsia transrectal con una pistola para biopsias y guía ecográfica. Con menor frecuencia, se usa un abordaje transperineal guiado por ecografía en los pacientes que tienen un riesgo alto de complicaciones con el abordaje transrectal.[25] Con los años, surgió la tendencia a tomar 8, 10 o más muestras de biopsia en varias áreas de la próstata de manera simultánea; esto aumentó la capacidad para detectar un cáncer después de obtener concentraciones elevadas en una prueba de PSA en sangre.[21]
El uso de la biopsia guiada con IRM en la evaluación diagnóstica inicial para el cáncer de próstata también está en evaluación, ya sea como sustituto o complemento de las biopsias con aguja sistemáticas estándar. En esencia, radiólogos de IRM y urólogos expertos que trabajan en centros de referencia notificaron estos datos y la posibilidad de generalización de los desenlaces es incierta. En un ensayo multicéntrico aleatorizado de 500 pacientes, se demostró que, en manos de expertos, la biopsia guiada con IRM multiparamétrica es más exacta que la biopsia transrectal para detectar cánceres de importancia clínica. Las IRM condujeron a la detección de más lesiones con puntaje de Gleason alto (≥7) y menos lesiones con puntaje de Gleason bajo (<7) y, en general, se usaron menos biopsias.[26] Los datos sugieren que es posible que la biopsia guiada con IRM sustituya a las biopsias transrectales. Sin embargo, los hallazgos de un estudio grande de un centro único y de un solo grupo de 2103 hombres con lesiones que se observaron en las IRM; y quienes se sometieron a biopsias guiadas con IRM y biopsias con aguja de próstata sistemáticas estándar con visualización ecográfica, sugieren lo contrario.[27] En ese mismo estudio, solo las biopsias guiadas con IRM condujeron a la clasificación incorrecta del 8,8 % de los cánceres de importancia clínica (puntaje de Gleason 4 + 3 o mayor) en comparación con la combinación de ambas técnicas de biopsia. Ambos estudios solo notificaron sobre los criterios de valoración histológicos en el momento del diagnóstico, en lugar de los desenlaces de salud durante el seguimiento.
A menudo se utilizan antibióticos profilácticos, en especial las fluoroquinolonas, antes de la biopsia transrectal con aguja. Hay informes de aumento en las tasas de septicemia, en particular por Escherichia coli resistente a fluoroquinolonas, y de hospitalizaciones después del procedimiento.[28,29] En consecuencia, se debe indicar a los hombres sometidos a biopsia transrectal que busquen atención médica de inmediato si presentan fiebre después de la biopsia.
Factores pronósticos
Los siguientes factores afectan la supervivencia de los pacientes con cáncer de próstata:[30-34]
Extensión del tumor
Cuando el cáncer se limita a la glándula prostática, el pronóstico a largo plazo es excelente. El cáncer localmente avanzado por lo general no se cura, pero a pesar de esto, la tasa de supervivencia a 5 años es muy buena. Si el cáncer de próstata se diseminó a órganos distantes, el tratamiento actual no lo curará. La mediana de supervivencia por lo general es de 1 a 3 años, y la mayoría de los pacientes morirá por cáncer de próstata. Incluso en este grupo de pacientes, a veces se observan evoluciones clínicas de escasa malignidad que duran muchos años.
Grado histológico del tumor
Es más probable que los tumores poco diferenciados hayan producido metástasis antes del diagnóstico y acarreen un pronóstico más precario. El método que más se utiliza para notificar la diferenciación tumoral es el puntaje de Gleason. Para obtener más información, consultar la sección Características patológicas.
Edad y estado de salud del paciente
Los beneficios del tratamiento local definitivo con intención curativa quizás demoren años en aparecer. Por lo tanto, el tratamiento con intención curativa a menudo se reserva para hombres con una esperanza de vida lo bastante larga. Por ejemplo, la prostatectomía radical a menudo se reserva para hombres con una esperanza de vida de por lo menos 10 años.
Concentración del antígeno prostático específico
El antígeno prostático específico (PSA), un marcador específico de la próstata, a menudo se utiliza como marcador tumoral.[32,33,35-40] Cuanto más alto es el valor inicial de la concentración del PSA, mayor es el riesgo de enfermedad metastásica o progresión de la enfermedad posterior. Sin embargo, es un marcador impreciso del riesgo.
Por ejemplo, el valor inicial y la tasa de cambio del PSA se relacionaron con metástasis o muerte por cáncer de próstata en una cohorte de 267 hombres con cáncer de próstata clínicamente localizado sometidos a conducta expectante o vigilancia activa en el grupo de control de un ensayo aleatorizado en el que se comparó la prostatectomía radical con la conducta expectante o la vigilancia activa.[41,42] A pesar de ello, la exactitud para clasificar a los hombres en un grupo de cáncer inactivo y otro grupo de cáncer progresivo fue deficiente para todos los valores de corte y las tasas de cambio del PSA analizados.
Concentraciones séricas de la fosfatasa ácida
La elevación de la fosfatasa ácida en el suero se relaciona con un pronóstico precario en pacientes con enfermedad localizada y diseminada. No obstante, las concentraciones séricas de fosfatasa ácida no se incorporaron en el sistema de estadificación del American Joint Committee on Cancer para el cáncer de próstata.[35]
Uso de nomogramas como instrumento pronóstico
Se formularon varios nomogramas para predecir los resultados antes de una prostatectomía radical [43-46] o después de una prostatectomía radical [47,48] con intención curativa. En los nomogramas preoperatorios se usan el estadio clínico, la concentración del PSA, el puntaje de Gleason y el número de resultados positivos o negativos para cáncer de las biopsias con aguja gruesa de la próstata. Un nomograma validado de manera independiente indicó un aumento de la exactitud para predecir la supervivencia sin recidiva bioquímica cuando se usaron las concentraciones plasmáticas preoperatorias del factor de crecimiento transformante B1 y del receptor soluble de la interleucina 6.[49,50]
En los nomogramas posoperatorios se añaden hallazgos patológicos, como invasión capsular, estado de los márgenes quirúrgicos, invasión de vesícula seminal y compromiso de los ganglios linfáticos. Sin embargo, los nomogramas se formularon en centros académicos y es posible que no sean tan exactos cuando se extiende su uso a hospitales no académicos, donde se trata a la mayoría de los pacientes.[51,52] Además, en los nomogramas se usan resultados intermedios (no clínicos), como el aumento del PSA o hallazgos patológicos quirúrgicos, y criterios de valoración subjetivos, como la necesidad de tratamiento adicional que percibe el médico. Asimismo, es posible que los cambios en los métodos diagnósticos o en la terapia neoadyuvante afecten los nomogramas.[53]
Seguimiento posterior al tratamiento
La estrategia óptima de seguimiento para hombres tratados por cáncer de próstata es incierta. Se debe entrevistar y examinar a los hombres para detectar síntomas o signos de enfermedad recidivante o progresiva, así como efectos secundarios que se puedan resolver con cambios de tratamiento. Sin embargo, el uso de criterios indirectos de valoración para la toma de decisiones clínicas es objeto de polémica y la evidencia que indica que el cambio de tratamiento a partir de estos criterios se traduce en un beneficio clínico es débil. Con frecuencia, se considera que las tasas de cambio del PSA son marcadores de progresión tumoral. No obstante, aunque un marcador tumoral o una característica se relacione de manera constante con riesgo alto de progresión del cáncer de próstata o muerte, estos quizás no sean útiles para definir el pronóstico o su utilidad sea limitada para la toma de decisiones terapéuticas.
Aunque la prueba de PSA se usa en casi todo el mundo para el seguimiento de los pacientes, la diversidad de recomendaciones sobre la atención de seguimiento refleja la falta de datos de investigación que sustenten conclusiones firmes. En una revisión sistemática de pautas internacionales se señala la necesidad de una investigación primaria muy sólida con el fin de plantear futuros modelos basados en evidencia para el seguimiento de hombres con cáncer de próstata.[54]
En los datos preliminares de una cohorte retrospectiva de 8669 pacientes de cáncer de próstata clínicamente localizado tratados con prostatectomía radical o radioterapia, se indicó que un tiempo de duplicación del PSA corto después del tratamiento (<3 meses en este estudio) satisface algunos de los requisitos para usarlo como criterio indirecto de valoración de la mortalidad por cualquier causa y la mortalidad específica por cáncer de próstata después de la cirugía o la radioterapia.[55]
De la misma manera, en un análisis retrospectivo (SWOG-S9916 [NCT00004001]) se observó que un grado de reducción del PSA del 20 % al 40 % (pero no del 50 %) a los 3 meses, y del 30 % o más a los 2 meses después del inicio de la quimioterapia para el cáncer de próstata independiente de hormonas cumple con varios requisitos para considerarlo un criterio indirecto de valoración de supervivencia general (SG).[56]
Estas observaciones se deberán confirmar de modo independiente en diseños de estudios prospectivos y es posible que no se apliquen a pacientes tratados con terapia hormonal. Además, no hay requisitos estandarizados para definir los criterios indirectos ni un límite estandarizado para definir la idoneidad de estos, ni siquiera en los ensayos prospectivos.[57]
Seguimiento posterior a la prostatectomía radical
Después de una prostatectomía radical, la detección de concentraciones del PSA permite identificar a los pacientes con riesgo elevado de fracaso terapéutico con recidiva local o enfermedad metastásica;[37] sin embargo, una proporción importante de pacientes con una concentración del PSA elevada o en aumento después de la cirugía, permanece sin síntomas clínicos durante períodos prolongados.[58] En consecuencia, es posible que la prueba bioquímica de fracaso terapéutico a partir de una concentración del PSA elevada o en aumento gradual sea insuficiente para iniciar tratamiento adicional.
Por ejemplo, en un análisis retrospectivo de casi 2000 hombres sometidos a prostatectomía radical con intención curativa y en seguimiento durante una media de 5,3 años, se encontró que 315 hombres (15 %) tenían una concentración del PSA anormal de 0,2 ng/ml o más, que se considera prueba de recidiva bioquímica. De estos 315 hombres, 103 (34 %) presentaron manifestaciones clínicas de recidiva. La mediana de tiempo hasta que aparecieron metástasis sintomáticas después de la recidiva bioquímica fue de 8 años. Después de que los hombres presentaron enfermedad metastásica, la mediana de tiempo hasta la muerte fue de 5 años adicionales.[53]
Seguimiento posterior a la radioterapia
Para los pacientes tratados con radioterapia, el riesgo de recaída a menudo se calcula mediante una combinación del estadio clínico del tumor, el puntaje de Gleason y la concentración del PSA antes del tratamiento.[59][Nivel de evidencia C2] Al igual que luego de la prostatectomía, se hace un seguimiento del PSA para identificar signos de recidiva tumoral después de la radioterapia. Después de la radioterapia con intención curativa, la concentración de PSA continuamente elevada o en aumento puede ser un factor pronóstico de recidiva clínica de la enfermedad; sin embargo, en series de casos notificadas se usó una variedad de definiciones de recaída del PSA. El American Society for Therapeutic Radiology and Oncology Consensus Panel formuló criterios sobre este tema.[60,61] Es difícil decidir si es necesario iniciar un tratamiento adicional cuando solo hay fracaso terapéutico con recidiva bioquímica sola. No se conocen las consecuencias en la SG de usar distintas definiciones de recaída del PSA, y como ocurre en series quirúrgicas, es posible que muchas recaídas bioquímicas (aumento del PSA solo) no se manifiesten de forma clínica en los pacientes tratados con radioterapia.[62,63]
Seguimiento posterior a la terapia hormonal
Después de la administración de terapia hormonal, la reducción del PSA a concentraciones indetectables proporciona información con respecto a la duración del estado sin progresión de la enfermedad; no obstante, es posible que una disminución del PSA menor del 80 % no sea predictiva.[32] Debido a que la expresión del PSA por sí misma está bajo control hormonal, la terapia de privación androgénica puede disminuir la concentración sérica del PSA independientemente de la respuesta tumoral. En consecuencia, los médicos no pueden depender solo de la concentración sérica de PSA para controlar la respuesta de un paciente a la terapia hormonal; también deben tener en cuenta criterios clínicos.[64]
Bibliografía
- National Cancer Institute: SEER Stat Fact Sheets: Prostate. Bethesda, Md: National Cancer Institute. Available online. Last accessed April 8, 2025.
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Lu-Yao GL, Albertsen PC, Moore DF, et al.: Outcomes of localized prostate cancer following conservative management. JAMA 302 (11): 1202-9, 2009. [PUBMED Abstract]
- Albertsen PC, Moore DF, Shih W, et al.: Impact of comorbidity on survival among men with localized prostate cancer. J Clin Oncol 29 (10): 1335-41, 2011. [PUBMED Abstract]
- Welch HG, Albertsen PC: Prostate cancer diagnosis and treatment after the introduction of prostate-specific antigen screening: 1986-2005. J Natl Cancer Inst 101 (19): 1325-9, 2009. [PUBMED Abstract]
- Welch HG, Black WC: Overdiagnosis in cancer. J Natl Cancer Inst 102 (9): 605-13, 2010. [PUBMED Abstract]
- Zlotta AR, Egawa S, Pushkar D, et al.: Prevalence of prostate cancer on autopsy: cross-sectional study on unscreened Caucasian and Asian men. J Natl Cancer Inst 105 (14): 1050-8, 2013. [PUBMED Abstract]
- Helgesen F, Holmberg L, Johansson JE, et al.: Trends in prostate cancer survival in Sweden, 1960 through 1988: evidence of increasing diagnosis of nonlethal tumors. J Natl Cancer Inst 88 (17): 1216-21, 1996. [PUBMED Abstract]
- Berner A, Harvei S, Skjorten FJ: Follow-up of localized prostate cancer, with emphasis on previous undiagnosed incidental cancer. BJU Int 83 (1): 47-52, 1999. [PUBMED Abstract]
- Garnick MB: Prostate cancer: screening, diagnosis, and management. Ann Intern Med 118 (10): 804-18, 1993. [PUBMED Abstract]
- Croswell JM, Kramer BS, Crawford ED: Screening for prostate cancer with PSA testing: current status and future directions. Oncology (Williston Park) 25 (6): 452-60, 463, 2011. [PUBMED Abstract]
- Bill-Axelson A, Holmberg L, Ruutu M, et al.: Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 352 (19): 1977-84, 2005. [PUBMED Abstract]
- Wilt TJ, Brawer MK, Jones KM, et al.: Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 367 (3): 203-13, 2012. [PUBMED Abstract]
- Hegarty J, Beirne PV, Walsh E, et al.: Radical prostatectomy versus watchful waiting for prostate cancer. Cochrane Database Syst Rev (11): CD006590, 2010. [PUBMED Abstract]
- Andriole GL, Grubb RL, Buys SS, et al.: Mortality results from a randomized prostate-cancer screening trial. N Engl J Med 360 (13): 1310-9, 2009. [PUBMED Abstract]
- Schröder FH, Hugosson J, Roobol MJ, et al.: Screening and prostate-cancer mortality in a randomized European study. N Engl J Med 360 (13): 1320-8, 2009. [PUBMED Abstract]
- Sandblom G, Varenhorst E, Rosell J, et al.: Randomised prostate cancer screening trial: 20 year follow-up. BMJ 342: d1539, 2011. [PUBMED Abstract]
- Djulbegovic M, Beyth RJ, Neuberger MM, et al.: Screening for prostate cancer: systematic review and meta-analysis of randomised controlled trials. BMJ 341: c4543, 2010. [PUBMED Abstract]
- Ilic D, O'Connor D, Green S, et al.: Screening for prostate cancer: an updated Cochrane systematic review. BJU Int 107 (6): 882-91, 2011. [PUBMED Abstract]
- Nelson WG, De Marzo AM, Isaacs WB: Prostate cancer. N Engl J Med 349 (4): 366-81, 2003. [PUBMED Abstract]
- Zelefsky MJ, Eastham JA, Sartor AO: Cancer of the prostate. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1220-71.
- Chan TY, Partin AW, Walsh PC, et al.: Prognostic significance of Gleason score 3+4 versus Gleason score 4+3 tumor at radical prostatectomy. Urology 56 (5): 823-7, 2000. [PUBMED Abstract]
- Albertsen PC, Hanley JA, Barrows GH, et al.: Prostate cancer and the Will Rogers phenomenon. J Natl Cancer Inst 97 (17): 1248-53, 2005. [PUBMED Abstract]
- Thompson IM, Canby-Hagino E, Lucia MS: Stage migration and grade inflation in prostate cancer: Will Rogers meets Garrison Keillor. J Natl Cancer Inst 97 (17): 1236-7, 2005. [PUBMED Abstract]
- Webb JA, Shanmuganathan K, McLean A: Complications of ultrasound-guided transperineal prostate biopsy. A prospective study. Br J Urol 72 (5 Pt 2): 775-7, 1993. [PUBMED Abstract]
- Kasivisvanathan V, Rannikko AS, Borghi M, et al.: MRI-Targeted or Standard Biopsy for Prostate-Cancer Diagnosis. N Engl J Med 378 (19): 1767-1777, 2018. [PUBMED Abstract]
- Ahdoot M, Wilbur AR, Reese SE, et al.: MRI-Targeted, Systematic, and Combined Biopsy for Prostate Cancer Diagnosis. N Engl J Med 382 (10): 917-928, 2020. [PUBMED Abstract]
- Nam RK, Saskin R, Lee Y, et al.: Increasing hospital admission rates for urological complications after transrectal ultrasound guided prostate biopsy. J Urol 183 (3): 963-8, 2010. [PUBMED Abstract]
- Liss MA, Chang A, Santos R, et al.: Prevalence and significance of fluoroquinolone resistant Escherichia coli in patients undergoing transrectal ultrasound guided prostate needle biopsy. J Urol 185 (4): 1283-8, 2011. [PUBMED Abstract]
- Gittes RF: Carcinoma of the prostate. N Engl J Med 324 (4): 236-45, 1991. [PUBMED Abstract]
- Paulson DF, Moul JW, Walther PJ: Radical prostatectomy for clinical stage T1-2N0M0 prostatic adenocarcinoma: long-term results. J Urol 144 (5): 1180-4, 1990. [PUBMED Abstract]
- Matzkin H, Eber P, Todd B, et al.: Prognostic significance of changes in prostate-specific markers after endocrine treatment of stage D2 prostatic cancer. Cancer 70 (9): 2302-9, 1992. [PUBMED Abstract]
- Pisansky TM, Cha SS, Earle JD, et al.: Prostate-specific antigen as a pretherapy prognostic factor in patients treated with radiation therapy for clinically localized prostate cancer. J Clin Oncol 11 (11): 2158-66, 1993. [PUBMED Abstract]
- Chodak GW, Thisted RA, Gerber GS, et al.: Results of conservative management of clinically localized prostate cancer. N Engl J Med 330 (4): 242-8, 1994. [PUBMED Abstract]
- Carlton JC, Zagars GK, Oswald MJ: The role of serum prostatic acid phosphatase in the management of adenocarcinoma of the prostate with radiotherapy. Int J Radiat Oncol Biol Phys 19 (6): 1383-8, 1990. [PUBMED Abstract]
- Stamey TA, Yang N, Hay AR, et al.: Prostate-specific antigen as a serum marker for adenocarcinoma of the prostate. N Engl J Med 317 (15): 909-16, 1987. [PUBMED Abstract]
- Stamey TA, Kabalin JN: Prostate specific antigen in the diagnosis and treatment of adenocarcinoma of the prostate. I. Untreated patients. J Urol 141 (5): 1070-5, 1989. [PUBMED Abstract]
- Stamey TA, Kabalin JN, McNeal JE, et al.: Prostate specific antigen in the diagnosis and treatment of adenocarcinoma of the prostate. II. Radical prostatectomy treated patients. J Urol 141 (5): 1076-83, 1989. [PUBMED Abstract]
- Stamey TA, Kabalin JN, Ferrari M: Prostate specific antigen in the diagnosis and treatment of adenocarcinoma of the prostate. III. Radiation treated patients. J Urol 141 (5): 1084-7, 1989. [PUBMED Abstract]
- Andriole GL: Serum prostate-specific antigen: the most useful tumor marker. J Clin Oncol 10 (8): 1205-7, 1992. [PUBMED Abstract]
- Fall K, Garmo H, Andrén O, et al.: Prostate-specific antigen levels as a predictor of lethal prostate cancer. J Natl Cancer Inst 99 (7): 526-32, 2007. [PUBMED Abstract]
- Parekh DJ, Ankerst DP, Thompson IM: Prostate-specific antigen levels, prostate-specific antigen kinetics, and prostate cancer prognosis: a tocsin calling for prospective studies. J Natl Cancer Inst 99 (7): 496-7, 2007. [PUBMED Abstract]
- Partin AW, Kattan MW, Subong EN, et al.: Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer. A multi-institutional update. JAMA 277 (18): 1445-51, 1997. [PUBMED Abstract]
- Partin AW, Mangold LA, Lamm DM, et al.: Contemporary update of prostate cancer staging nomograms (Partin Tables) for the new millennium. Urology 58 (6): 843-8, 2001. [PUBMED Abstract]
- Kattan MW, Eastham JA, Stapleton AM, et al.: A preoperative nomogram for disease recurrence following radical prostatectomy for prostate cancer. J Natl Cancer Inst 90 (10): 766-71, 1998. [PUBMED Abstract]
- Stephenson AJ, Scardino PT, Eastham JA, et al.: Preoperative nomogram predicting the 10-year probability of prostate cancer recurrence after radical prostatectomy. J Natl Cancer Inst 98 (10): 715-7, 2006. [PUBMED Abstract]
- Kattan MW, Wheeler TM, Scardino PT: Postoperative nomogram for disease recurrence after radical prostatectomy for prostate cancer. J Clin Oncol 17 (5): 1499-507, 1999. [PUBMED Abstract]
- Stephenson AJ, Scardino PT, Eastham JA, et al.: Postoperative nomogram predicting the 10-year probability of prostate cancer recurrence after radical prostatectomy. J Clin Oncol 23 (28): 7005-12, 2005. [PUBMED Abstract]
- Shariat SF, Walz J, Roehrborn CG, et al.: External validation of a biomarker-based preoperative nomogram predicts biochemical recurrence after radical prostatectomy. J Clin Oncol 26 (9): 1526-31, 2008. [PUBMED Abstract]
- Kattan MW, Shariat SF, Andrews B, et al.: The addition of interleukin-6 soluble receptor and transforming growth factor beta1 improves a preoperative nomogram for predicting biochemical progression in patients with clinically localized prostate cancer. J Clin Oncol 21 (19): 3573-9, 2003. [PUBMED Abstract]
- Penson DF, Grossfeld GD, Li YP, et al.: How well does the Partin nomogram predict pathological stage after radical prostatectomy in a community based population? Results of the cancer of the prostate strategic urological research endeavor. J Urol 167 (4): 1653-7; discussion 1657-8, 2002. [PUBMED Abstract]
- Greene KL, Meng MV, Elkin EP, et al.: Validation of the Kattan preoperative nomogram for prostate cancer recurrence using a community based cohort: results from cancer of the prostate strategic urological research endeavor (capsure). J Urol 171 (6 Pt 1): 2255-9, 2004. [PUBMED Abstract]
- Pound CR, Partin AW, Eisenberger MA, et al.: Natural history of progression after PSA elevation following radical prostatectomy. JAMA 281 (17): 1591-7, 1999. [PUBMED Abstract]
- McIntosh HM, Neal RD, Rose P, et al.: Follow-up care for men with prostate cancer and the role of primary care: a systematic review of international guidelines. Br J Cancer 100 (12): 1852-60, 2009. [PUBMED Abstract]
- D'Amico AV, Moul JW, Carroll PR, et al.: Surrogate end point for prostate cancer-specific mortality after radical prostatectomy or radiation therapy. J Natl Cancer Inst 95 (18): 1376-83, 2003. [PUBMED Abstract]
- Petrylak DP, Ankerst DP, Jiang CS, et al.: Evaluation of prostate-specific antigen declines for surrogacy in patients treated on SWOG 99-16. J Natl Cancer Inst 98 (8): 516-21, 2006. [PUBMED Abstract]
- Baker SG: Surrogate endpoints: wishful thinking or reality? J Natl Cancer Inst 98 (8): 502-3, 2006. [PUBMED Abstract]
- Frazier HA, Robertson JE, Humphrey PA, et al.: Is prostate specific antigen of clinical importance in evaluating outcome after radical prostatectomy. J Urol 149 (3): 516-8, 1993. [PUBMED Abstract]
- Pisansky TM, Kahn MJ, Rasp GM, et al.: A multiple prognostic index predictive of disease outcome after irradiation for clinically localized prostate carcinoma. Cancer 79 (2): 337-44, 1997. [PUBMED Abstract]
- Consensus statement: guidelines for PSA following radiation therapy. American Society for Therapeutic Radiology and Oncology Consensus Panel. Int J Radiat Oncol Biol Phys 37 (5): 1035-41, 1997. [PUBMED Abstract]
- Roach M, Hanks G, Thames H, et al.: Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: recommendations of the RTOG-ASTRO Phoenix Consensus Conference. Int J Radiat Oncol Biol Phys 65 (4): 965-74, 2006. [PUBMED Abstract]
- Kuban DA, el-Mahdi AM, Schellhammer PF: Prostate-specific antigen for pretreatment prediction and posttreatment evaluation of outcome after definitive irradiation for prostate cancer. Int J Radiat Oncol Biol Phys 32 (2): 307-16, 1995. [PUBMED Abstract]
- Sandler HM, Dunn RL, McLaughlin PW, et al.: Overall survival after prostate-specific-antigen-detected recurrence following conformal radiation therapy. Int J Radiat Oncol Biol Phys 48 (3): 629-33, 2000. [PUBMED Abstract]
- Ruckle HC, Klee GG, Oesterling JE: Prostate-specific antigen: concepts for staging prostate cancer and monitoring response to therapy. Mayo Clin Proc 69 (1): 69-79, 1994. [PUBMED Abstract]
Información sobre los estadios del cáncer de próstata
Pruebas de estadificación
La mayoría de los hombres con diagnóstico de cáncer de próstata manifiestan la enfermedad en estadio clínico temprano y no tienen metástasis detectables. En general, no se tienen que someter a pruebas de estadificación, como la gammagrafía ósea, la tomografía computarizada (TC) o la obtención de imágenes por resonancia magnética (IRM). No obstante, se hacen estudios de estadificación si hay sospecha clínica de metástasis, como dolor óseo, diseminación local del tumor más allá de la cápsula prostática o un riesgo importante de metástasis (antígeno prostático específico [PSA] >20 ng/ml y puntaje de Gleason >7).[1]
Las pruebas que se usan para estadificar el cáncer de próstata son las siguientes:
- Concentración sérica del antígeno prostático específico.
- Imágenes por resonancia magnética.
- Tomografía por emisión de positrones.
- Disección de ganglio linfático pélvico.
- Biopsia transrectal o transperineal.
- Ecografía transrectal.
- Tomografías computarizadas.
- Gammagrafía ósea con tecnecio Tc 99m-difosfonato de metileno.
Concentración sérica del antígeno prostático específico
La concentración sérica del antígeno prostático específico (PSA) sirve para predecir los resultados de las gammagrafías óseas con radionúclido en pacientes con diagnóstico reciente.
- En una serie, solo 2 de 852 pacientes (0,23 %) con una concentración del PSA menor de 20 ng/ml tuvieron un resultado positivo para metástasis en la gammagrafía ósea aunque no tenían dolor óseo.[2]
- En otra serie de 265 pacientes con cáncer de próstata, 0 de 23 pacientes con una concentración del PSA menor de 4 ng/ml tuvieron un resultado positivo para metástasis en la gammagrafía ósea y 2 de 114 pacientes con concentración del PSA menor de 10 ng/ml tuvieron un resultado positivo para metástasis en la gammagrafía ósea.[3]
Imágenes por resonancia magnética
Aunque las imágenes por resonancia magnética (IRM) se utilizan para detectar la diseminación extracapsular del cáncer de próstata, un valor pronóstico positivo de alrededor del 70 % y una variación considerable entre observadores son problemas que evitan su uso rutinario para la estadificación.[4] Sin embargo, el uso de ecografía y de las IRM reduce la subestadificación clínica y, en consecuencia, mejora la selección de pacientes para tratamiento local. Las IRM con espiral endorrectal parecen ser más exactas para identificar la enfermedad extracapsular o limitada al órgano, en especial, cuando se combinan con espectroscopia.[1] Las IRM son una herramienta inadecuada para evaluar la enfermedad ganglionar.
Son más sensibles que las gammagrafías óseas con radionúclido para detectar metástasis óseas, pero no son prácticas para evaluar todo el esqueleto.
Tomografía por emisión de positrones
Cada vez es más común el uso de la tomografía por emisión de positrones-tomografía computarizada (TEP-TC) con marcadores radionúclidos para estadificar el cáncer de próstata. Se han probado varios marcadores que demostraron detectar metástasis ganglionares o metástasis a distancia en ciertos pacientes con cáncer de próstata.
Tomografía por emisión de positrones-tomografía computarizada con Galio 68 gozetótida y flúor F 18-piflufolastat
El antígeno prostático específico de membrana (PSMA) es un receptor transmembranario que se expresa en concentraciones elevadas en el cáncer de próstata. Las TEP-TC con Galio 68 (68Ga)-gozetótida y flúor F 18 (18F)-piflufolastat detectan el PSMA. Estos marcadores radionúclidos se probaron en el diagnóstico por imágenes de ganglios linfáticos y metástasis durante la estadificación inicial del cáncer de próstata de riesgo intermedio y alto, al igual que en el diagnóstico por imágenes de los pacientes con concentraciones elevadas de PSA con sospecha de recidiva de la enfermedad después del tratamiento.
En un ensayo de fase III participaron 764 pacientes con cáncer de próstata de riesgo intermedio o alto que se habían sometido a la estadificación mediante TEP-TC con 68Ga-gozetótida. En el ensayo, se notificó una sensibilidad del 40 % y una especificidad del 95 % en la detección de la enfermedad ganglionar en comparación con la DGLP.[5]
Se estudió la TEP-TC con 68Ga-gozetótida junto con la TC y la gammagrafía ósea para la detección de enfermedad metastásica en hombres con cáncer de próstata de riesgo alto. Cuando se comparó con las técnicas de imágenes tradicionales, la TEP-TC con 68Ga-gozetótida demostró tener más sensibilidad (85 vs. 38 %) y especificidad (98 vs. 91 %).[6] También se estudió la TEP-TC con 68Ga-gozetótida a fin de analizar la enfermedad recidivante. Se demostró la superioridad de esta prueba en el valor predictivo positivo (VPP) y en la tasa de detección.[7] En este contexto también se observaron mejores resultados con 68Ga-gozetótida que con 18F-piflufolastat.[8]
La TEP-TC con 18F-piflufolastat demostró una sensibilidad del 40 % y una especificidad del 98 % en la estadificación del cáncer de próstata de riesgo intermedio o alto en comparación con la DGLP.[9] Para la detección del cáncer de próstata recidivante o metastásico en el contexto del aumento de PSA, la TEP-TC con 18F-piflufolastat demostró una sensibilidad del 95,8 % y un VPP del 81,9 %.[9]
Teniendo en cuenta estos datos, la Administración de Alimentos y Medicamentos (FDA) de los Estados Unidos aprobó la TEP-TC con 68Ga-gozetótida y con 18F-piflufolastat para la estadificación inicial de los pacientes con cáncer de próstata y sospecha de enfermedad metastásica, y para evaluar posibles recidivas a partir de las concentraciones elevadas de PSA después del tratamiento.[10,11]
Tomografía por emisión de positrones-tomografía computarizada con flúor F 18-fluciclovina
La tomografía por emisión de positrones-tomografía computarizada (TEP-TC) con flúor F 18 (18F)-fluciclovina demostró una sensibilidad inferior pero una especificidad superior en el contexto de estadificación ganglionar inicial del cáncer de próstata de riesgo intermedio y alto, en comparación con la DGLP.[12-14] Cuando se comparó esta prueba con las técnicas tradicionales de imágenes, la especificidad fue similar, pero la sensibilidad fue superior para la detección de enfermedad extraprostática.[14]
Las imágenes con 18F-fluciclovina también detectaron más metástasis óseas y demostraron tener mejor sensibilidad y especificidad que la gammagrafía ósea con 99mTc-MDP.[15]
La FDA aprobó la TEP-TC con 18F-fluciclovina para evaluar la sospecha de enfermedad recidivante en hombres con PSA que aumenta después del tratamiento.
Disección de ganglio linfático pélvico
La disección de ganglio linfático pélvico (DGLP) sigue siendo el método más exacto para evaluar metástasis en los ganglios pélvicos, y la DGLP laparoscópica permite evaluar con exactitud los ganglios pélvicos con la misma eficacia que un procedimiento abierto.[16]
El factor determinante para decidir si está indicado hacer algún tipo de DGLP es que el resultado pueda alterar el tratamiento definitivo. Por ejemplo, en general se reserva la prostatectomía radical para hombres sin metástasis ganglionares. De la igual manera, una biopsia de vesícula seminal antes de la cirugía quizás sirva para pacientes con ganglios palpables que se someterán a una prostatectomía radical (a menos que tengan un puntaje de Gleason bajo), porque el compromiso de vesícula seminal podría afectar la elección del tratamiento primario y predice las metástasis ganglionares pélvicas.[17]
Para los pacientes de cáncer de próstata clínicamente localizado (estadio I o estadio II), el grado patológico de Gleason y los valores séricos de la enzima fosfatasa ácida prostática (incluso dentro de un intervalo normal) predicen la probabilidad de penetración capsular, la invasión de la vesícula seminal o el compromiso de ganglios linfáticos regionales.[18] El análisis de una serie de 166 pacientes de cáncer de próstata en estadio clínico I o II sometidos a prostatectomía radical reveló una relación entre el puntaje de Gleason de la biopsia y el riesgo de encontrar metástasis ganglionares durante la cirugía. El riesgo de metástasis ganglionar en los pacientes agrupados según el puntaje de Gleason de la biopsia fue del 2 % para un puntaje de Gleason de 5, del 13 % para un puntaje de Gleason de 6 y del 23 % para un puntaje de Gleason de 8.[19]
Es cuestionable someter a todos los pacientes a una DGLP, aunque a menudo se evalúa de manera sistemática el estado ganglionar de los pacientes sometidos a una prostatectomía radical retropúbica. Cada vez hay más evidencia que indica que la DGLP es quizás innecesaria en los pacientes con un PSA menor que 20 ng/ml, un puntaje de Gleason bajo y que se someterán a prostatectomía perineal radical. Esto es particularmente cierto en pacientes cuyas neoplasias malignas se detectaron mediante ecografía y no mediante palpación.[18,20]
Biopsia transrectal o transperineal
El método más común para establecer el diagnóstico y determinar el puntaje de Gleason en casos de presunto cáncer de próstata es una biopsia con aguja. En la actualidad, la mayoría de los urólogos hacen la biopsia transrectal con una pistola para biopsias y guía ecográfica. Con menor frecuencia, se usa un abordaje transperineal guiado por ecografía en los pacientes que tienen un riesgo alto de complicaciones con el abordaje transrectal.[21] Con los años, surgió la tendencia a tomar 8, 10 o más muestras de biopsia en varias áreas de la próstata de manera simultánea; esto aumentó la capacidad para detectar un cáncer después de obtener concentraciones elevadas en una prueba de PSA en sangre.[1]
Ecografía transrectal
La ecografía transrectal (ETR) a veces facilita el diagnóstico porque permite dirigir la biopsia con aguja; no obstante, la ecografía depende del operador del ecógrafo y no permite evaluar el tamaño del ganglio linfático.
En un estudio prospectivo multinstitucional de ETR preoperatoria de hombres con cáncer de próstata clínicamente localizado aptos para una prostatectomía radical, se observó que la ETR no fue mejor que un examen digital del recto para predecir la extensión extracapsular del tumor ni el compromiso de vesícula seminal.[22]
Tomografías computarizadas
Las tomografías computarizadas permiten detectar linfadenopatías de gran tamaño, pero no definen bien las características intraprostáticas;[23] en consecuencia, no son confiables para la estadificación de la enfermedad ganglionar pélvica cuando se comparan con la estadificación quirúrgica.[24]
Gammagrafía ósea con tecnecio Tc 99m-difosfonato de metileno
La gammagrafía ósea con tecnecio Tc 99m (99mTc)-difosfonato de metileno (MDP) es la prueba que más se usa para la metástasis ósea. Los huesos son el sitio más común de diseminación tumoral a distancia.
Sistemas de estadificación
Tradicionalmente, se han usado 2 sistemas para la estadificación del cáncer de próstata.
- En 1975, se describió el sistema Jewet (estadio A a estadio D), que se modificó desde entonces.[25] El sistema de estadificación ya casi no se usa, pero se encuentran menciones del sistema en estudios y publicaciones antiguos.
- En 1997, el American Joint Committee on Cancer (AJCC) y la International Union Against Cancer adoptaron un sistema TNM (tumor, ganglio linfático y metástasis) revisado en el que se emplean las mismas categorías de estadificación T amplias que se usan en el sistema Jewett, pero, además, se incluyen subcategorías para el estadio T, como un estadio para describir a los pacientes cuyo diagnóstico se basó en un examen de detección del PSA. En este sistema TNM revisado se estratifica de manera más precisa a los pacientes con diagnóstico reciente.
Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer
El American Joint Committee on Cancer (AJCC) designó los estadios mediante la clasificación TNM (tumor, ganglio linfático y metástasis).[26]
| Grupo de grado | Puntaje de Gleason | Patrón de Gleason |
|---|---|---|
| aAdaptación de AJCC: Prostate. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 715–26. | ||
| 1 | ≤6 | ≤3 + 3 |
| 2 | 7 | 3 + 4 |
| 3 | 7 | 4 + 3 |
| 4 | 8 | 4 + 4, 3 + 5 o 5 + 3 |
| 5 | 9 o 10 | 4 + 5, 5 + 4 o 5 + 5 |
| Estadio | TNM | Descripciónb,c,d,e | PSAf | Puntaje de Gleason; patrón de Gleason (grupo de grado)g | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; cT = T clínico; PSA = antígeno prostático específico; pT = T patológico. | |||||
| aAdaptación de AJCC: Prostate. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 715–26. | |||||
| Las explicaciones de los superíndices b a g están al final del Cuadro 5. | |||||
| I | cT1a–c, cT2a, N0, M0 | cT1 = tumor asintomático en la evaluación clínica y no es palpable. | <10 | Puntaje de Gleason, ≤6; patrón de Gleason, ≤3 + 3 (1). |
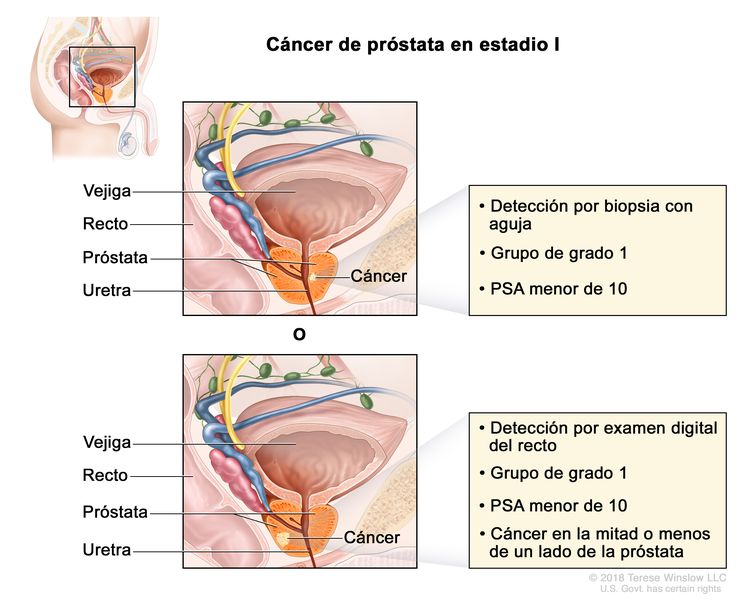 |
| –cT1a = tumor identificado de manera imprevista en un examen histológico y compromete ≤5 % del tejido resecado. | |||||
| –cT1b = tumor identificado de manera imprevista en un examen histológico y compromete >5 % del tejido resecado. | |||||
| –cT1c = tumor identificado por biopsia con aguja, se encuentra en uno o ambos lados de la próstata, pero no es palpable. | |||||
| cT2 = tumor palpable y limitado a la próstata. | |||||
| –cT2a = tumor con compromiso de la mitad o menos de un solo lado de la próstata. | |||||
| N0 = sin compromiso de ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| pT2, N0, M0 | pT2 = tumor limitado al órgano. | <10 | Puntaje de Gleason, ≤6; patrón de Gleason, ≤3 + 3 (1). | ||
| N0 = sin compromiso de ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Estadio | TNM | Descripciónb,c,d,e | PSAf | Puntaje de Gleason; patrón de Gleason (grupo de grado)g | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; cT = T clínico; PSA = antígeno prostático específico; pT = T patológico. | |||||
| aAdaptación de AJCC: Prostate. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 715–26. | |||||
| Las explicaciones de los superíndices b a g están al final del Cuadro 5. | |||||
| IIA | cT1a–c, cT2a, pT2, N0, M0 | Consultar las descripciones de cT1a–c, cT2a para el estadio I en el Cuadro 2. | ≥10 <20 | Puntaje de Gleason, ≤6; patrón de Gleason, ≤3 + 3 (1). |
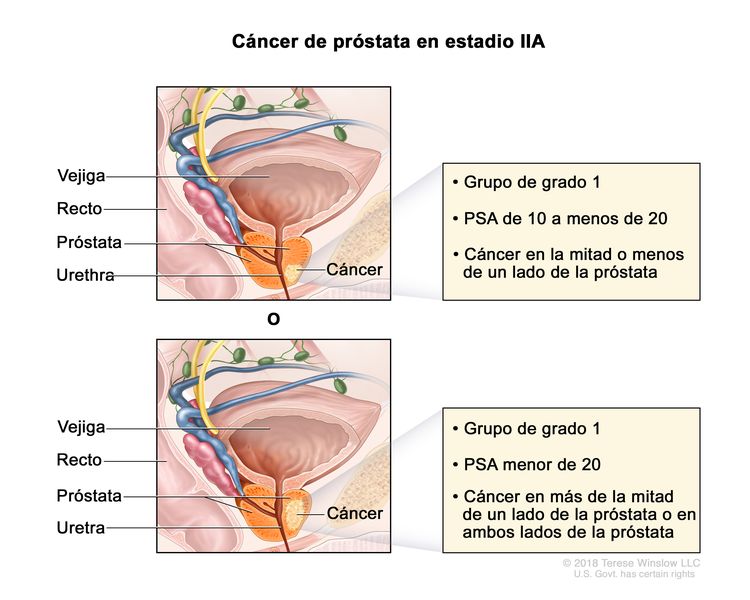 |
| pT2 = tumor limitado al órgano. | |||||
| cT2b–c, N0, M0 | cT2 = tumor palpable y limitado a la próstata. | <20 | Puntaje de Gleason, ≤6; patrón de Gleason, ≤3 + 3 (1). | ||
| cT2b = tumor con compromiso de más de la mitad de un lado de la próstata, pero no de ambos lados. | |||||
| cT2c = tumor con compromiso de ambos lados de la próstata. | |||||
| N0 = sin compromiso de ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| IIB | T1–2, N0, M0 | T1 = tumor asintomático en la evaluación clínica y no es palpable. | <20 | Puntaje de Gleason, 7; patrón de Gleason, 3 + 4 (2). |
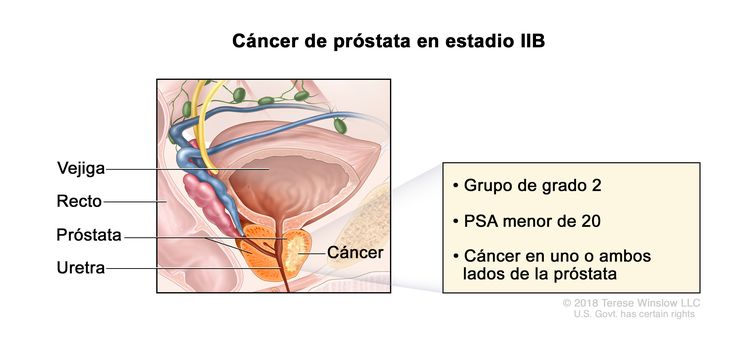 |
| –T1a = tumor identificado de manera imprevista en un examen histológico y compromete ≤5 % del tejido resecado. | |||||
| –T1b = tumor identificado de manera imprevista en un examen histológico y compromete >5 % del tejido resecado. | |||||
| –T1c = tumor identificado por biopsia con aguja, se encuentra en uno o ambos lados de la próstata, pero no es palpable. | |||||
| cT2 = tumor palpable y limitado a la próstata. | |||||
| –cT2a = tumor con compromiso de la mitad o menos de un solo lado de la próstata. | |||||
| –cT2b = tumor con compromiso de más de la mitad de un lado de la próstata, pero no de ambos lados. | |||||
| –cT2c = tumor con compromiso de ambos lados de la próstata. | |||||
| pT2 = tumor limitado al órgano. | |||||
| N0 = sin compromiso de ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| IIC | T1–2, N0, M0 | Consultar las descripciones previas para T1–2, N0, M0 en el estadio IIB. | <20 | Puntaje de Gleason, 7; patrón de Gleason, 4 + 3 (3). |
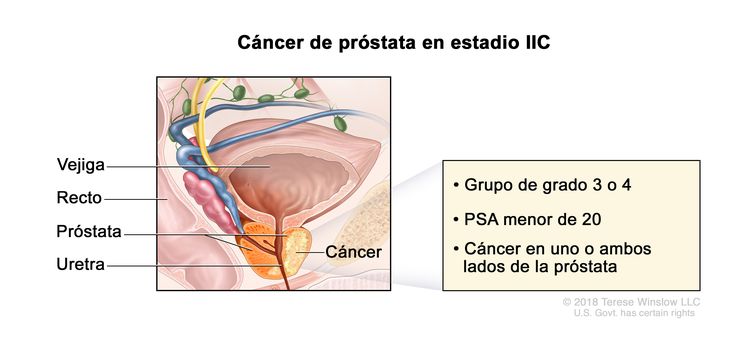 |
| T1–2, N0, M0 | Consultar las descripciones previas para T1–2, N0, M0 en el estadio IIB. | <20 | Puntaje de Gleason, 8; patrón de Gleason, 4 + 4, 3 + 5 o 5 + 3 (4). | ||
| Estadio | TNM | Descripciónb,c,d,e | PSAf | Puntaje de Gleason; patrón de Gleason (grupo de grado)g | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; cT = T clínico; PSA = antígeno prostático específico; pT = T patológico. | |||||
| aAdaptación de AJCC: Prostate. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 715–26. | |||||
| Las explicaciones de los superíndices b a g están al final del Cuadro 5. | |||||
| IIIA | T1–2, N0, M0 | Consultar las descripciones de T1–2, N0, M0 para el estadio IIB en el Cuadro 3. | ≥20 | Puntaje de Gleason, ≤6; patrón de Gleason, ≤3 + 3 (1). |
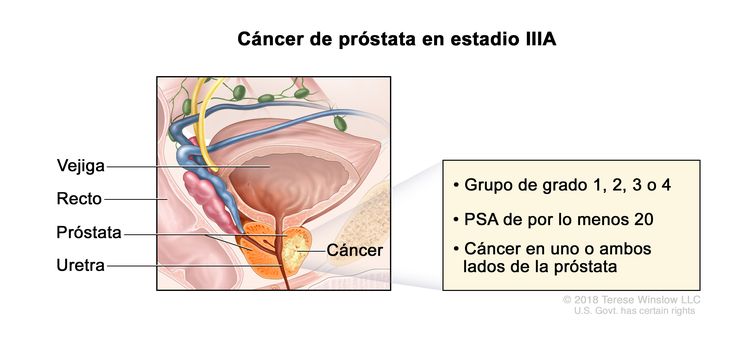 |
| Puntaje de Gleason, 7; patrón de Gleason, 3 + 4 (2). | |||||
| Puntaje de Gleason, 7; patrón de Gleason, 4 + 3 (3). | |||||
| Puntaje de Gleason, 8; patrón de Gleason, 4 + 4, 3 + 5 o 5 + 3 (4). | |||||
| IIIB | T3–4, N0, M0 | cT3 = tumor extraprostático sin fijación ni invasión de estructuras adyacentes. | Cualquier valor | Puntaje de Gleason, ≤6; patrón de Gleason, ≤3 + 3 (1). |
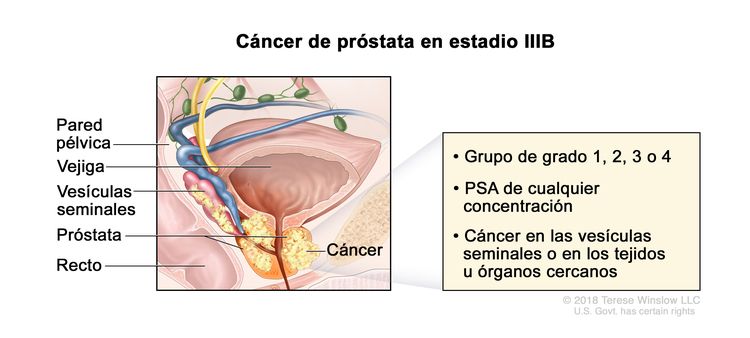 |
| –cT3a = diseminación extraprostática (unilateral o bilateral). | Puntaje de Gleason, 7; patrón de Gleason, 3 + 4 (2). | ||||
| –cT3b = tumor con invasión de una vesícula seminal o ambas. | Puntaje de Gleason, 7; patrón de Gleason, 4 + 3 (3). | ||||
| pT3 = diseminación extraprostática. | Puntaje de Gleason, 8; patrón de Gleason, 4 + 4, 3 + 5 o 5 + 3 (4). | ||||
| –pT3a = diseminación extraprostática (unilateral o bilateral) o invasión microscópica del cuello vesical. | |||||
| –pT3b = tumor con invasión de una vesícula seminal o ambas. | |||||
| cT4 o pT4= tumor con fijación o invasión de estructuras adyacentes diferentes a las vesículas seminales, como el esfínter externo, el recto, la vejiga, los músculos elevadores o la pared pélvica. | |||||
| N0 = sin compromiso de ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| IIIC | Cualquier T, N0, M0 | TX = tumor primario no evaluable. | Cualquier valor | Puntaje de Gleason, 9 o 10; patrón de Gleason, 4 + 5, 5 + 4 o 5 + 5 (5). |
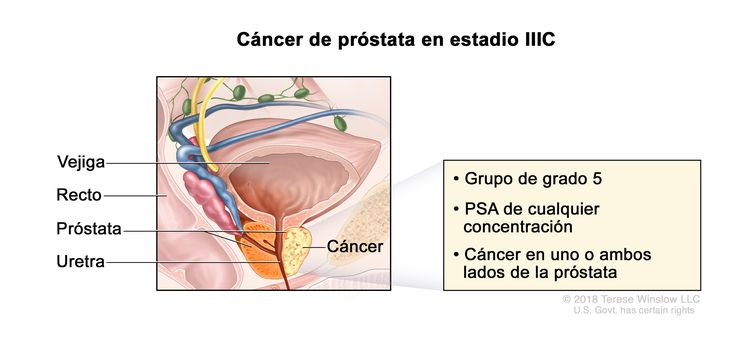 |
| T0 = sin indicios de tumor primario. | |||||
| T1 = tumor asintomático en la evaluación clínica y no es palpable. | |||||
| –T1a = tumor identificado de manera imprevista en un examen histológico y compromete ≤5 % del tejido resecado. | |||||
| –T1b = tumor identificado de manera imprevista en un examen histológico y compromete >5 % del tejido resecado. | |||||
| –T1c = tumor identificado por biopsia con aguja, se encuentra en uno o ambos lados de la próstata, pero no es palpable. | |||||
| cT2 = tumor palpable y limitado a la próstata. | |||||
| –cT2a = tumor con compromiso de la mitad o menos de un solo lado de la próstata. | |||||
| –cT2b = tumor con compromiso de más de la mitad de un lado de la próstata, pero no de ambos lados. | |||||
| –cT2c = tumor con compromiso de ambos lados de la próstata. | |||||
| –pT2 = tumor limitado al órgano. | |||||
| cT3 = tumor extraprostático sin fijación ni invasión de estructuras adyacentes. | |||||
| –cT3a = diseminación extraprostática (unilateral o bilateral). | |||||
| –cT3b = tumor con invasión de una vesícula seminal o ambas. | |||||
| pT3 = diseminación extraprostática. | |||||
| –pT3a = diseminación extraprostática (unilateral o bilateral) o invasión microscópica del cuello vesical. | |||||
| –pT3b = tumor con invasión de una vesícula seminal o ambas. | |||||
| cT4 o pT4= tumor con fijación o invasión de estructuras adyacentes diferentes a las vesículas seminales, como el esfínter externo, el recto, la vejiga, los músculos elevadores o la pared pélvica. | |||||
| N0 = sin compromiso de ganglios linfáticos regionales. | |||||
| M0 = sin metástasis a distancia. | |||||
| Estadio | TNM | Descripciónb,c,d,e | PSAf | Puntaje de Gleason; patrón de Gleason (grupo de grado)g | Imagen |
|---|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; cT = T clínico; PSA = antígeno prostático específico; pT = T patológico. | |||||
| aAdaptación de AJCC: Prostate. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 715–26. | |||||
| bCuando no se disponga del PSA o del grupo de grado, el agrupamiento se determinará de acuerdo con la categoría T y el valor del PSA o el grupo de grado, según el que esté disponible. | |||||
| cNo hay una clasificación patológica para T1. | |||||
| dEl compromiso del margen quirúrgico se deberá registrar mediante un descriptor R1, que indica enfermedad residual microscópica. | |||||
| eCuando hay más de un sitio de metástasis, se usa la categoría más avanzada. M1c es la categoría más avanzada. | |||||
| fSe usan los valores del PSA para asignar esta categoría. | |||||
| gRecientemente el sistema de Gleason se sintetizó en los llamados grupos de grado.[27] | |||||
| IVA | Cualquier T, N1, M0 | Cualquier T = consultar las descripciones para el estadio IIIC en el Cuadro 4. | Consultar la categoría de cualquier valor de PSA para el estadio IIIC en el Cuadro 4. | Puntaje de Gleason, ≤6; patrón de Gleason, ≤3 + 3 (1). |
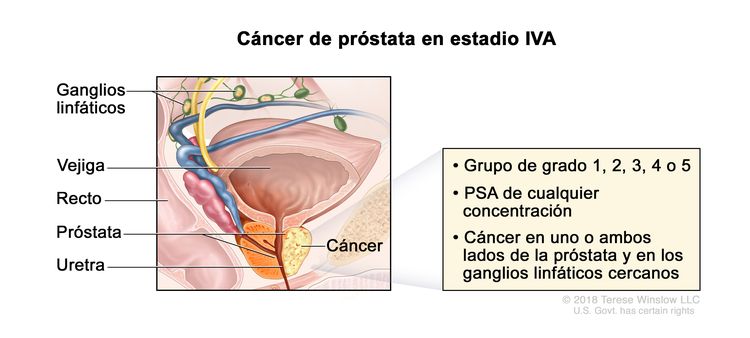 |
| Puntaje de Gleason, 7; patrón de Gleason, 3 + 4 (2). | |||||
| Puntaje de Gleason, 7; patrón de Gleason, 4 + 3 (3). | |||||
| N1 = metástasis en ganglios linfáticos regionales. | Puntaje de Gleason, 8; patrón de Gleason, 4 + 4, 3 + 5 o 5 + 3 (4). | ||||
| M0 = sin metástasis a distancia. | Puntaje de Gleason, 9 o 10; patrón de Gleason, 4 + 5, 5 + 4 o 5 + 5 (5). | ||||
| IVB | Cualquier T, cualquier N, M1 | Cualquier T = consultar las descripciones para el estadio IIIC en el Cuadro 4. | Consultar la categoría de cualquier valor de PSA para el estadio IIIC en el Cuadro 4. | Cualquier puntaje de Gleason; patrón de Gleason (grupo de grado) consultar las descripciones del estadio IVA. |
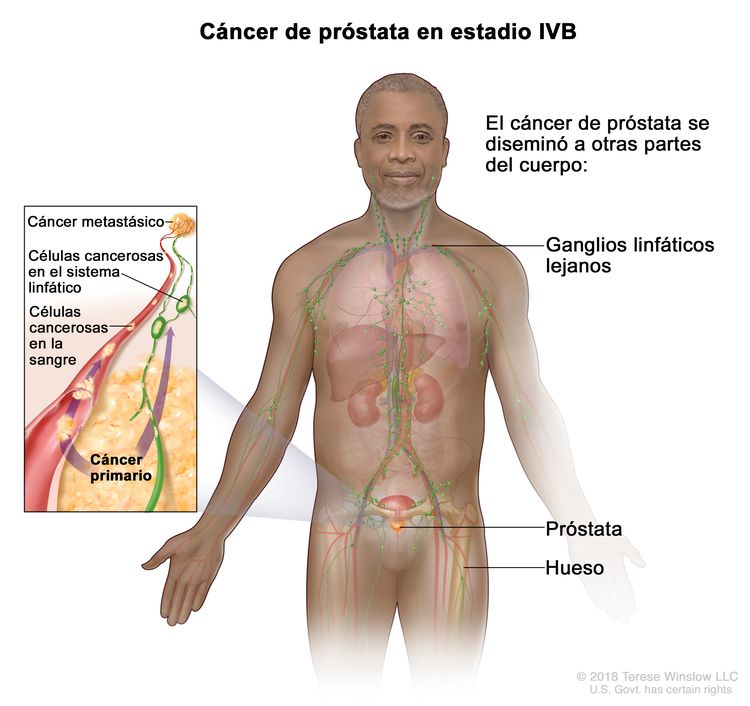 |
| NX = ganglios linfáticos regionales no evaluables. | |||||
| N0 = sin compromiso de ganglios linfáticos regionales. | |||||
| N1 = metástasis en ganglios linfáticos regionales. | |||||
| M1 = metástasis a distancia. | |||||
| –M1a = metástasis ganglionares no regionales. | |||||
| –M1b = metástasis óseas. | |||||
| –M1c = metástasis en otros sitios, con enfermedad ósea o sin esta. | |||||
Bibliografía
- Zelefsky MJ, Eastham JA, Sartor AO: Cancer of the prostate. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1220-71.
- Oesterling JE, Martin SK, Bergstralh EJ, et al.: The use of prostate-specific antigen in staging patients with newly diagnosed prostate cancer. JAMA 269 (1): 57-60, 1993. [PUBMED Abstract]
- Huncharek M, Muscat J: Serum prostate-specific antigen as a predictor of radiographic staging studies in newly diagnosed prostate cancer. Cancer Invest 13 (1): 31-5, 1995. [PUBMED Abstract]
- Schiebler ML, Yankaskas BC, Tempany C, et al.: MR imaging in adenocarcinoma of the prostate: interobserver variation and efficacy for determining stage C disease. AJR Am J Roentgenol 158 (3): 559-62; discussion 563-4, 1992. [PUBMED Abstract]
- Hope TA, Eiber M, Armstrong WR, et al.: Diagnostic Accuracy of 68Ga-PSMA-11 PET for Pelvic Nodal Metastasis Detection Prior to Radical Prostatectomy and Pelvic Lymph Node Dissection: A Multicenter Prospective Phase 3 Imaging Trial. JAMA Oncol 7 (11): 1635-1642, 2021. [PUBMED Abstract]
- Hofman MS, Lawrentschuk N, Francis RJ, et al.: Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet 395 (10231): 1208-1216, 2020. [PUBMED Abstract]
- Fendler WP, Calais J, Eiber M, et al.: Assessment of 68Ga-PSMA-11 PET Accuracy in Localizing Recurrent Prostate Cancer: A Prospective Single-Arm Clinical Trial. JAMA Oncol 5 (6): 856-863, 2019. [PUBMED Abstract]
- Calais J, Ceci F, Eiber M, et al.: 18F-fluciclovine PET-CT and 68Ga-PSMA-11 PET-CT in patients with early biochemical recurrence after prostatectomy: a prospective, single-centre, single-arm, comparative imaging trial. Lancet Oncol 20 (9): 1286-1294, 2019. [PUBMED Abstract]
- Pienta KJ, Gorin MA, Rowe SP, et al.: A Phase 2/3 Prospective Multicenter Study of the Diagnostic Accuracy of Prostate Specific Membrane Antigen PET/CT with 18F-DCFPyL in Prostate Cancer Patients (OSPREY). J Urol 206 (1): 52-61, 2021. [PUBMED Abstract]
- U.S. Food and Drug Administration: FDA approves first PSMA-targeted PET imaging drug for men with prostate cancer. Food and Drug Administration, 2020. Available online. Last accessed February 13, 2025.
- U.S. Food and Drug Administration: FDA approves second PSMA-targeted PET imaging drug for men with prostate cancer. Food and Drug Administration, 2021. Available online. Last accessed February 13, 2025.
- Selnæs KM, Krüger-Stokke B, Elschot M, et al.: 18F-Fluciclovine PET/MRI for preoperative lymph node staging in high-risk prostate cancer patients. Eur Radiol 28 (8): 3151-3159, 2018. [PUBMED Abstract]
- Suzuki H, Jinnouchi S, Kaji Y, et al.: Diagnostic performance of 18F-fluciclovine PET/CT for regional lymph node metastases in patients with primary prostate cancer: a multicenter phase II clinical trial. Jpn J Clin Oncol 49 (9): 803-811, 2019. [PUBMED Abstract]
- Alemozaffar M, Akintayo AA, Abiodun-Ojo OA, et al.: [18F]Fluciclovine Positron Emission Tomography/Computerized Tomography for Preoperative Staging in Patients with Intermediate to High Risk Primary Prostate Cancer. J Urol 204 (4): 734-740, 2020. [PUBMED Abstract]
- Chen B, Wei P, Macapinlac HA, et al.: Comparison of 18F-Fluciclovine PET/CT and 99mTc-MDP bone scan in detection of bone metastasis in prostate cancer. Nucl Med Commun 40 (9): 940-946, 2019. [PUBMED Abstract]
- Schuessler WW, Pharand D, Vancaillie TG: Laparoscopic standard pelvic node dissection for carcinoma of the prostate: is it accurate? J Urol 150 (3): 898-901, 1993. [PUBMED Abstract]
- Stone NN, Stock RG, Unger P: Indications for seminal vesicle biopsy and laparoscopic pelvic lymph node dissection in men with localized carcinoma of the prostate. J Urol 154 (4): 1392-6, 1995. [PUBMED Abstract]
- Oesterling JE, Brendler CB, Epstein JI, et al.: Correlation of clinical stage, serum prostatic acid phosphatase and preoperative Gleason grade with final pathological stage in 275 patients with clinically localized adenocarcinoma of the prostate. J Urol 138 (1): 92-8, 1987. [PUBMED Abstract]
- Fournier GR, Narayan P: Re-evaluation of the need for pelvic lymphadenectomy in low grade prostate cancer. Br J Urol 72 (4): 484-8, 1993. [PUBMED Abstract]
- Daniels GF, McNeal JE, Stamey TA: Predictive value of contralateral biopsies in unilaterally palpable prostate cancer. J Urol 147 (3 Pt 2): 870-4, 1992. [PUBMED Abstract]
- Webb JA, Shanmuganathan K, McLean A: Complications of ultrasound-guided transperineal prostate biopsy. A prospective study. Br J Urol 72 (5 Pt 2): 775-7, 1993. [PUBMED Abstract]
- Smith JA, Scardino PT, Resnick MI, et al.: Transrectal ultrasound versus digital rectal examination for the staging of carcinoma of the prostate: results of a prospective, multi-institutional trial. J Urol 157 (3): 902-6, 1997. [PUBMED Abstract]
- Gerber GS, Goldberg R, Chodak GW: Local staging of prostate cancer by tumor volume, prostate-specific antigen, and transrectal ultrasound. Urology 40 (4): 311-6, 1992. [PUBMED Abstract]
- Hanks GE, Krall JM, Pilepich MV, et al.: Comparison of pathologic and clinical evaluation of lymph nodes in prostate cancer: implications of RTOG data for patient management and trial design and stratification. Int J Radiat Oncol Biol Phys 23 (2): 293-8, 1992. [PUBMED Abstract]
- Jewett HJ: The present status of radical prostatectomy for stages A and B prostatic cancer. Urol Clin North Am 2 (1): 105-24, 1975. [PUBMED Abstract]
- Prostate. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 715–26.
- Epstein JI, Egevad L, Amin MB, et al.: The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading Patterns and Proposal for a New Grading System. Am J Surg Pathol 40 (2): 244-52, 2016. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento del cáncer de próstata
Las modalidades de tratamiento local se relacionan con una supervivencia sin enfermedad (SSE) prolongada para muchos pacientes de cáncer de próstata localizado, pero a menudo no son curativas para pacientes con tumores localmente extensos. Debido a que el uso de las técnicas diagnósticas vigentes lleva a la subestadificación (incluso cuando en el examen clínico el cáncer parece estar localizado en la glándula prostática), algunos pacientes presentan tumores diseminados después del tratamiento local con cirugía o radiación.
Las opciones de tratamiento para cada estadio del cáncer de próstata se presentan en el Cuadro 6.
Los efectos secundarios de cada abordaje de tratamiento se describen a continuación en las secciones correspondientes. Hay grandes variaciones en los efectos adversos autonotificados para cada una de las opciones de atención de los pacientes con enfermedad clínica localizada, y hay pocas comparaciones directas de opciones como la conducta expectante, la vigilancia activa (seguimiento activo), la prostatectomía radical y la radioterapia. Las diferencias en los efectos adversos cumplen una función importante cuando el paciente elige entre varias opciones de tratamiento. Se han descrito comparaciones detalladas de estos efectos adversos en estudios de cohortes poblacionales, aunque los períodos de seguimiento fueron relativamente breves (2 a 3 años).[1,2]
Conducta expectante o vigilancia activa (seguimiento activo)
Para los pacientes de edad avanzada asintomáticos o que tienen una enfermedad simultánea, quizás se justifique un abordaje de observación rigurosa sin administrar un tratamiento activo inmediato.[3,4] La espera cautelosa, la observación, la conducta expectante, la actitud expectante, la vigilancia activa y el seguimiento activo son términos que indican una estrategia en la que no se utiliza un tratamiento inmediato con intención curativa.
La conducta expectante, la vigilancia activa y el seguimiento activo son los términos que se usan con mayor frecuencia, pero en la bibliografía médica no siempre se diferencian con claridad, lo que dificulta la interpretación de los resultados. El concepto general de la conducta expectante es el seguimiento del estado del paciente y la administración de atención paliativa cuando se necesita para aliviar los síntomas de progresión tumoral. No hay un intento planificado de administrar un tratamiento curativo en ningún momento del seguimiento. Por ejemplo, es posible que se use la resección transuretral de la próstata (RTUP) o la terapia hormonal para aliviar una obstrucción uretral relacionada con el tumor cuando haya crecimiento tumoral local y la terapia hormonal o la radiación ósea quizás se usen para aliviar el dolor producido por las metástasis. La prostatectomía radical se comparó con la conducta expectante o la vigilancia activa (seguimiento activo) en hombres con enfermedad en estadio temprano (es decir, estadio clínicos T1b, T1c o T2).[5] Para obtener más información, consultar la sección Prostatectomía radical.
Por el contrario, la estrategia base de la vigilancia activa (seguimiento activo) es diferir el tratamiento de la enfermedad clínicamente localizada, pero hacer controles periódicos con el fin de iniciar tratamiento local con intención curativa si el paciente presenta cualquier signo de progresión tumoral.[6-9] La intención es evitar las complicaciones del tratamiento en los hombres que tienen una enfermedad de crecimiento lento o sin progresión, y al mismo tiempo mantener la posibilidad de curarlos si el tumor progresa. Con frecuencia, la vigilancia activa (seguimiento activo) incluyen los siguientes aspectos:
- Consultas médicas periódicas.
- Exámenes digitales del recto.
- Pruebas del antígeno prostático específico (PSA).
- Ecografías transrectales (en algunas series).
- Biopsias transrectales con aguja (en algunas series).
Los criterios de selección de los pacientes, los intervalos entre las evaluaciones, el tipo de pruebas específicas y los criterios de intervención son arbitrarios y no se han establecido en ensayos controlados.
En los Estados Unidos, como en otros entornos donde se usan mucho los exámenes de detección con la prueba de PSA, los resultados del tratamiento conservador del cáncer de próstata localizado son muy favorables. En conjunto, los hombres atendidos mediante conducta expectante o vigilancia activa (seguimiento activo), de acuerdo con diversos criterios en cada estudio, presentaron tasas de mortalidad específicas por cáncer de próstata muy favorables que oscilan entre el 1 % y el 10 % (las tasas son más favorables en las series más recientes).[10-18] Por lo tanto, la mayoría de los hombres con cáncer de próstata identificado mediante exámenes de detección son aptos para someterse a vigilancia activa (seguimiento activo) de modo que se reserva el tratamiento definitivo para el momento en que presentan signos de progresión tumoral. Esto se observó con suma claridad en el gran ensayo aleatorizado Prostate Testing for Cancer Treatment (ProtecT [NCT02044172 y ISRCTN20141297]) en el que se comparó el seguimiento activo, la prostatectomía radical y la radioterapia.[19] Para obtener más información, consultar la sección Prostatectomía radical.
Para obtener más información, consultar la sección Tratamiento del cáncer de próstata en estadio II.
Prostatectomía radical
La prostatectomía radical a menudo se reserva para los pacientes que cumplen con las siguientes condiciones:[20-22]
- Tienen buena salud y eligen una intervención quirúrgica.
- Tienen un tumor limitado a la próstata (estadio I y estadio II).
La prostatectomía abierta se puede realizar con un abordaje quirúrgico perineal o retropúbico. El abordaje perineal exige una incisión separada para la disección de ganglios linfáticos. La linfadenectomía laparoscópica es técnicamente posible.[23] La prostatectomía robótica es una alternativa a la prostatectomía abierta y se ha vuelto la técnica más común en países desarrollados. En manos expertas, los resultados funcionales de la prostatectomía abierta y robótica son muy similares, por lo menos a corto y mediano plazo. En un ensayo aleatorizado con 308 hombres aptos para prostatectomía, se encontró que los resultados urinarios, sexuales y de funcionamiento intestinal fueron similares cuando se comparó la cirugía abierta retropúbica y la cirugía robótica al cabo de una mediana de seguimiento de 24 meses.[24] El tamaño de la muestra y la duración del seguimiento fueron muy bajos como para detectar diferencias importantes en los resultados del cáncer.
Cuando se encuentran ganglios pequeños bien diferenciados, la incidencia de compromiso ganglionar es menor del 20 %, y es posible omitir la disección ganglionar pélvica.[25] La disección ganglionar pélvica es más importante para los tumores más grandes menos diferenciados. En estos casos, la disección ganglionar pélvica por vía abierta o laparoscópica no tiene una utilidad terapéutica, pero evita la morbilidad relacionada con la prostatectomía en pacientes con compromiso ganglionar. Por lo general, no se lleva a cabo una prostatectomía radical si se encuentran metástasis en la evaluación de la muestra congelada de los ganglios linfáticos; en estos pacientes se debe considerar la participación en ensayos clínicos en curso o la administración de radioterapia para control sintomático.
No se ha establecido la función de la terapia hormonal preoperatoria (neoadyuvante).[26,27]
Después de una prostatectomía radical, la evaluación patológica permite estratificar la extensión del tumor en los siguientes tipos:
- Enfermedad con márgenes comprometidos: la incidencia de recidiva de la enfermedad aumenta cuando hay compromiso tumoral en los márgenes de la pieza quirúrgica.[10,28,29] No se han notificado de manera sistemática los resultados clínicos de pacientes con márgenes quirúrgicos comprometidos.
- Enfermedad limitada a la pieza quirúrgica: la incidencia de enfermedad recidivante aumenta cuando hay tumor fuera de la pieza quirúrgica (extracapsular).[10,28]
- Enfermedad confinada al órgano: los pacientes con enfermedad extraprostática (no confinada al órgano) son aptos para participar en ensayos clínicos como, por ejemplo, el ensayo del Radiation Therapy Oncology Group (RTOG) RTOG-9601 (NCT00002874), que ya se completó. En estos ensayos se incluyó la evaluación de la administración de radiación posoperatoria, medicamentos citotóxicos y terapia hormonal con agonistas de la hormona liberadora de hormona luteinizante (LH-RH) o antiandrógenos.
Prostatectomía radical comparada con otras opciones de tratamiento
En 1993, se realizó una revisión estructurada de la bibliografía de 144 artículos en un intento por comparar las siguientes tres estrategias de tratamiento principales para el cáncer de próstata clínicamente localizado:[30]
- Prostatectomía radical.
- Radioterapia definitiva.
- Observación (conducta expectante o vigilancia activa [seguimiento activo]).
Los autores concluyeron que las deficiencias de notificación y de los factores de selección de todas las series obstaculizaron una comparación válida de la eficacia de las tres estrategias de tratamiento.
En una revisión de la bibliografía de series de casos de pacientes con enfermedad localizada clínicamente palpable, los autores encontraron que las tasas de supervivencia específicas por cáncer de próstata a 10 años fueron mejores en las series de prostatectomía radical (cerca del 93 %), peores en las series de radioterapia (cerca del 75 %) e intermedias con tratamiento diferido (cerca del 85 %).[31] Debido a que es muy improbable que la radioterapia empeore la supervivencia específica de la enfermedad, la explicación más factible es que los factores de selección influyen en el tratamiento elegido. Estos factores de selección hacen que las comparaciones de las estrategias terapéuticas sean imprecisas.[32]
En ensayos clínicos aleatorizados, se comparó la prostatectomía radical con la conducta expectante, la vigilancia activa (seguimiento activo) en hombres con enfermedad en estadio temprano (es decir, estadios clínicos T1b, T1c o T2) y se obtuvieron resultados contradictorios. Es posible que la diferencia en los resultados se deba al modo en que se estableció el diagnóstico de los hombres con cáncer de próstata.
Evidencia (prostatectomía radical vs. conducta expectante o vigilancia activa [seguimiento activo]):
- En un ensayo clínico aleatorizado realizado en Suecia en la época anterior a los exámenes de detección con la prueba de PSA, se asignó al azar a 695 hombres con cáncer de próstata a someterse a prostatectomía radical vs. conducta expectante. El diagnóstico se determinó a partir de la detección con la prueba de PSA en solo el 5 % de los hombres del ensayo. Por lo tanto, estos hombres tenían una enfermedad local más extensa que lo característico para los casos de diagnóstico de cáncer de próstata en los Estados Unidos.[33-35]
- La mortalidad general acumulada a los 18 años fue del 56,1 % en el grupo de prostatectomía radical y del 68,9 % en el grupo de conducta expectante (diferencia absoluta, 12,7 %; intervalo de confianza [IC] 95 %, 5,1–20,3 puntos porcentuales; riesgo relativo [RR]de muerte 0,71; IC 95 %, 0,59–0,86).[35][Nivel de evidencia A1]
- La incidencia acumulada de mortalidad por cáncer de próstata a los 18 años fue del 17,7 % versus el 28,7 % (diferencia absoluta, 11,0 %; IC 95 %, 4,5–17,5 puntos porcentuales; RRde muerte por cáncer de próstata, 0,56; IC 95 %, 0,41–0,77).[35]
- En un análisis de subconjunto posterior, la mejoría en la mortalidad general y específica por cáncer de próstata relacionada con una prostatectomía radical se restringió a hombres menores de 65 años.
- El Prostate Intervention Versus Observation Trial (PIVOT-1 o VA-CSP-407) es un ensayo aleatorizado que se condujo en la era de exámenes de detección con la prueba de PSA en el que se comparaba de manera directa la prostatectomía radical y la conducta expectante. De noviembre de 1994 a enero de 2002, se asignó al azar a 731 hombres de 75 años o menos con cáncer de próstata localizado (estadio T1–2, NX, M0, con PSA sanguíneo <50 ng/ml) y una esperanza de vida de por lo menos 10 años a someterse a una prostatectomía radical o a conducta expectante.[5,36,37][Nivel de evidencia A1]
- Cerca del 50 % de los hombres presentaba enfermedad no palpable, identificada mediante exámenes de detección.
- Después de una mediana de seguimiento de 12,7 años (intervalo hasta cerca de 19,5 años), la mortalidad por cualquier causa fue del 61,3 % en el grupo de prostatectomía vs. el 66,8 % en el grupo de conducta expectante; la diferencia absoluta fue de 5,5 puntos porcentuales (IC 95 %, -1,5–12,4), que no fue estadísticamente significativa (cociente de riesgos instantáneos [CRI], 0,84; IC 95 %, 0,70–1,01). La mortalidad específica por cáncer de próstata fue del 7,4 % vs. 11,4 %, y tampoco fue estadísticamente significativa (CRI, 0,63; IC 95 %, 0,3–1,02).
- Si bien el grupo de observación recibió con más frecuencia el tratamiento para la progresión de la enfermedad, en la mayoría de los casos fue para la progresión asintomática, local o bioquímica (PSA).
- Según lo previsto, la incontinencia urinaria y la disfunción eréctil o sexual fueron más frecuentes en el grupo de prostatectomía durante al menos 10 años de seguimiento. Las diferencias absolutas en el uso de toallas urinarias absorbentes notificado por los pacientes fueron más altas en el grupo de cirugía, con más de 30 puntos porcentuales en todos los momentos de evaluación durante por lo menos 10 años. Las limitaciones en las actividades de la vida diaria relacionadas con la enfermedad o el tratamiento fueron mayores para el grupo de cirugía que para el grupo de observación hasta 2 años después, pero luego fueron similares en ambos grupos de tratamiento.
- En el ensayo ProtecT (NCT02044172 y ISRCTN20141297), se sometió a 82 429 hombres a la prueba de PSA y se diagnosticó cáncer de próstata clínicamente localizado a 2664 hombres. De ellos, 1643 (mediana de edad de 62 años, intervalo de 50 a 69 años) otorgaron consentimiento para su asignación al azar a grupos de comparación de seguimiento activo, prostatectomía radical (con conservación nerviosa, en lo posible) y radioterapia de haz externo conformada tridimensional (74 Gy en 37 fracciones). El criterio principal de valoración fue la mortalidad específica por cáncer de próstata.[19]
- Tras una mediana de seguimiento de 10 años, hubo 17 muertes por cáncer de próstata, sin diferencias estadísticamente significativas entre los 3 grupos del estudio (P = 0,48). Las tasas de supervivencia específica por cáncer de próstata a 10 años fueron del 98,8 % en el grupo de vigilancia activa, el 99,0 % en el grupo de prostatectomía radical y el 99,6 % en el grupo de radioterapia.[19][Nivel de evidencia A1]
- Del mismo modo, la tasa de mortalidad por cualquier causa fue casi idéntica en los 3 grupos del estudio: 10,9 muertes en el grupo de vigilancia activa, 10,1 en el grupo de prostatectomía radical y 10,3 en el grupo de radioterapia por 1000 años-persona (P = 0,87).[19][Nivel de evidencia A1]
- Hubo diferencias estadísticamente significativas en la progresión a enfermedad metastásica en los grupos de tratamiento (33 de los 545 hombres en el grupo de vigilancia activa; 13 de los 553 en el grupo de prostatectomía radical; 16 de 545 en el grupo de radioterapia) que empezaron a surgir después de 4 años, pero estas diferencias no se tradujeron en diferencias de mortalidad después de los 10 años de seguimiento. A lo largo de los 10 años, el 52 % de los pacientes necesitaron algún tipo de intervención activa.
- Como se esperaba, hubo diferencias considerables en los desenlaces notificados por los pacientes entre los 3 abordajes terapéuticos.[38][Nivel de evidencia A3] En un estudio secundario sobre los desenlaces notificados por los pacientes hasta 6 años después de la aleatorización se revelaron los siguientes resultados:
- Los hombres en el grupo de prostatectomía radical presentaron tasas considerables de incontinencia urinaria (por ejemplo, el 46 % notificaron el uso de una o más toallas absorbentes al día a los 6 meses y el 17 % a los 6 años); en los otros 2 grupos del estudio se notificaron muy pocos casos de incontinencia urinaria.
- El funcionamiento sexual también fue peor en el grupo de prostatectomía radical (por ejemplo, a los 6 meses, el 12 % de los hombres notificaron tener erecciones firmes para el coito, en comparación con el 22 % en el grupo de radioterapia y el 52 % en el grupo de vigilancia activa).
- El funcionamiento intestinal, sin embargo, fue peor en el grupo de radioterapia (por ejemplo, alrededor del 5 % notificó heces sanguinolentas al menos la mitad del tiempo a partir de los 2 años; esto no se notificó en el grupo de prostatectomía radical ni en el grupo de vigilancia activa).
Complicaciones de la prostatectomía radical
Las complicaciones de la prostatectomía radical son las siguientes:
- Morbilidad y mortalidad relacionadas con la anestesia general y un procedimiento quirúrgico mayor.[39-41]
- Incontinencia urinaria e impotencia.[42-49]
- Acortamiento del pene.[50-52]
- Hernia inguinal.[53-57]
- Incontinencia fecal.[58]
Los resultados funcionales de la prostatectomía radical con respecto al funcionamiento sexual, urinario, intestinal y la calidad de vida (CV) relacionada con la salud son similares si el procedimiento es retropúbico abierto, laparoscópico o si se hace una prostatectomía radical robótica.[59]
Morbilidad y mortalidad relacionadas con la prostatectomía radical
En un análisis de los archivos de Medicare sobre 101 604 prostatectomías radicales llevadas a cabo entre 1991 y 1994, se observaron los siguientes resultados:[39]
- Tasa de mortalidad operatoria a 30 días del 0,5 %.
- Tasa de reingreso hospitalario del 4,5 %.
- Tasa de complicaciones graves del 28,6 %.
Durante el período del estudio, estas tasas disminuyeron en el 30 %, 8 % y 12 %, respectivamente.[39]
Los siguientes desenlaces se relacionaron con prostatectomías que se llevaron a cabo en hospitales donde se hacen menos procedimientos en comparación con hospitales donde se hacen más procedimientos:[40,41]
- Tasas más altas de mortalidad posoperatoria a los 30 días.
- Complicaciones quirúrgicas agudas más graves.
- Estadías hospitalarias más prolongadas.
- Tasas más altas de reingreso hospitalario.
Las tasas de morbilidad y mortalidad operatorias aumentan con la edad. La comorbilidad, en especial la enfermedad cardiovascular subyacente y los antecedentes de accidente cerebrovascular explican una parte del aumento de mortalidad relacionada con la edad a los 30 días de la cirugía.
En una cohorte de todos los hombres con cáncer de próstata sometidos a prostatectomía radical entre 1990 y 1999 en Ontario, se predijo que los hombres de 75 años sin comorbilidades tendrían una mortalidad a 30 días del 0,74 %. Además, las tasas de complicaciones quirúrgicas a los 30 días dependieron más de la comorbilidad que de la edad (es decir, alrededor del 5 % para hombres sin afecciones comórbidas vs. el 40 % para hombres con ≥4 afecciones comórbidas subyacentes).[41]
Incontinencia urinaria e impotencia
La incontinencia urinaria y la impotencia son posibles complicaciones de una prostatectomía radical y se han estudiado en múltiples estudios.
Evidencia (incontinencia urinaria e impotencia posteriores a una prostatectomía radical):
- En una gran serie de casos de hombres sometidos a una prostatectomía radical con técnica anatómica (conservación nerviosa), se notificaron los siguientes resultados:[43]
- Alrededor del 6 % de los hombres necesitaron usar toallas absorbentes para la incontinencia urinaria; además, otra proporción desconocida de hombres presentaron goteo posmiccional ocasional.
- Cerca del 40 % al 65 % de los hombres con potencia sexual antes de la cirugía conservaron una potencia adecuada para la penetración vaginal y el coito. La conservación de la potencia con esta técnica depende del estadio del tumor y la edad del paciente; sin embargo, es posible que la operación produzca un déficit por lo menos parcial en casi todos los pacientes.
- En una encuesta nacional de pacientes de Medicare sometidos a prostatectomía radical entre 1998 y 1990, se notificó más morbilidad que en la serie de casos notificada antes.[44]
- Más del 30 % de los hombres notificaron que necesitaban toallas absorbentes o pinzas para la incontinencia urinaria y el 63 % de todos los pacientes notificaron incontinencia urinaria en el momento de la encuesta.
- Cerca del 60 % de los hombres notificaron ausencia de erecciones desde la cirugía; casi el 90 % de los hombres notificaron ausencia de erecciones adecuadas para el coito durante el mes anterior a la encuesta.
- Alrededor del 28 % de los pacientes notificaron que se sometieron a seguimiento y tratamiento del cáncer con radioterapia o terapia hormonal durante los 4 años posteriores a la prostatectomía.
- En un estudio longitudinal de cohorte poblacional (Prostate Cancer Outcomes Study) se incluyeron 901 hombres de 55 a 74 años sometidos a prostatectomía radical reciente por cáncer de próstata.[45]
- De todos los hombres, el 15,4 % presentaban incontinencia urinaria frecuente o totalmente 5 años después de la cirugía.
- De los participantes del estudio, el 20,4 % usaban toallas absorbentes para mantenerse secos.
- De todos los hombres, el 79,3 % notificaron incapacidad de mantener una erección adecuada para el coito.
- En una encuesta transversal de pacientes con cáncer de próstata tratados con prostatectomía radical, radioterapia, o conducta expectante y vigilancia activa en un sistema de seguro médico, se notificaron muchos casos de disfunción sexual y urinaria en el grupo de prostatectomía.[46]
- Los resultados notificados por los pacientes fueron congruentes con los de la encuesta nacional de Medicare.
- Además, aunque la potencia estadística fue limitada, las diferencias en la disfunción sexual y urinaria de los hombres sometidos a una prostatectomía radical para conservar el funcionamiento nervioso y los hombres sometidos a una prostatectomía radical estándar no fueron estadísticamente significativas. Este tema necesita más estudio.
- En series de casos de 93, 459 y 89 hombres sometidos a prostatectomía radical por cirujanos con experiencia, se observaron tasas de impotencia altas como las de la encuesta nacional de Medicare cuando se hicieron preguntas detalladas sobre la potencia sexual de los encuestados; sin embargo, en promedio, los hombres de estas series de casos eran más jóvenes que los encuestados de Medicare.[47-49] En una de las series de casos se usó el mismo cuestionario que en la encuesta de Medicare.[47] La tasa de incontinencia urinaria en esa serie también fue similar a la de la encuesta de Medicare.
A menudo, se notifican diferencias entre las encuestas poblacionales y las series de casos de centros individuales. Las razones de estas diferencias podrían obedecer a los siguientes aspectos:
- Diferencias de edad entre las poblaciones.
- Experiencia quirúrgica en los centros notificadores más grandes.
- Factores relacionados con la selección de pacientes.
- Sesgo de publicación de las series con resultados favorables.
- Diferentes métodos de recolección de información de los pacientes.
Acortamiento del pene
En las series de casos de hombres sometidos a prostatectomía radical, se observó una reducción de la longitud del pene (1–2 cm en promedio).[50-52] La consecuencia funcional del acortamiento no está bien estudiada, pero es evidente en algunos hombres.
En un registro de hombres con una concentración del PSA en aumento después del tratamiento inicial de un cáncer de próstata clínicamente localizado, 19 de 510 hombres (3,7 %) sometidos a prostatectomía radical se quejaron por la reducción del tamaño del pene.[60] Sin embargo, los datos se basan en informes médicos de quejas de pacientes en lugar de una entrevista directa con el paciente o la medición de la longitud del pene antes y después del tratamiento. Además, la muestra del estudio se limitó a los pacientes con recidiva tumoral confirmada o presunta, lo que dificulta la generalización.
Se notificó recuperación de la longitud del pene al tamaño preoperatorio al cabo de 1 a 2 años en algunas de las series de casos con seguimiento longitudinal, pero no en todas las series.[61]
Hernia inguinal
Se notificó que la hernia inguinal es una complicación de la prostatectomía radical.
Evidencia (hernia inguinal después de una prostatectomía radical):
- En estudios de cohorte retrospectivos y en series de casos, se observó un aumento de la incidencia de hernia inguinal que oscila entre el 7 % y el 21 % en hombres sometidos a prostatectomía radical; las tasas alcanzan su punto máximo en los 2 años posteriores a la cirugía.[53-57]
- Los estudios observacionales indican que las tasas son más altas cuando se comparan con las tasas de hombres sometidos a biopsia de próstata sola, resecciones transuretrales y prostatectomía simple abierta por una enfermedad benigna;[53,54] o cuando se comparan con hombres de cáncer de próstata sometidos a disección de ganglios linfáticos pélvicos sola o radioterapia.[53,55,56]
Aunque las observaciones de aumento en las tasas de hernia inguinal después de una prostatectomía radical son uniformes, es posible que las tasas de detección de hernias sean más altas en los hombres con cáncer de próstata controlados de cerca por urólogos debido a la frecuencia de los exámenes o los procedimientos diagnósticos por imágenes (es decir, sesgo de detección). Se debe comunicar a los hombres la posibilidad de que se presente esta complicación después de la prostatectomía.
Incontinencia fecal
La prostatectomía radical a veces causa incontinencia fecal; la incidencia varía de acuerdo con el método quirúrgico.[58]
Evidencia (incontinencia fecal después de una prostatectomía radical):
- En una muestra de una encuesta nacional de 907 hombres sometidos a prostatectomía radical por lo menos 1 año antes de la encuesta, el 32 % de los hombres sometidos a una prostatectomía radical perineal (con conservación nerviosa) y el 17 % de los hombres sometidos a prostatectomía radical retropúbica notificaron que tuvieron episodios de incontinencia fecal. De los encuestados, el 10 % notificó incontinencia fecal moderada y el 4 % notificó incontinencia fecal cuantiosa. Menos del 15 % de los hombres con incontinencia fecal habían notificado este síntoma al médico o a otro proveedor de atención médica.[58]
Radioterapia y terapia radiofarmacéutica
Radioterapia de haz externo
En los pacientes aptos para radioterapia definitiva se debe confirmar el diagnóstico mediante análisis patológico cuando el cáncer se encuentra limitado a la próstata o a los tejidos circundantes (fase I, fase II y fase III) en el examen clínico. No se necesita estadificación con laparotomía ni disección ganglionar.
La radioterapia quizás sea una buena opción para pacientes con contraindicaciones médicas para la prostatectomía radical. En estos pacientes la tasa de complicaciones es aceptablemente baja si se controla con cuidado la técnica de administración.[62]
Los resultados a largo plazo de la radioterapia dependen del estadio y se relacionan con la dosimetría de la radiación.
Evidencia (radioterapia de haz externo):
- En una revisión retrospectiva de 999 pacientes tratados con radioterapia en megavoltaje, se observó que las tasas de supervivencia por causa específica a los 10 años variaron considerablemente según el estadio T: T1 (79 %), T2 (66 %), T3 (55 %) y T4 (22 %).[63] Un concentración sérica inicial de PSA mayor de 15 ng/ml es un factor pronóstico de fracaso de la radioterapia convencional.[64]
- En varios estudios aleatorizados se demostró una mejoría en la ausencia de recidiva bioquímica (según el PSA) con dosis más altas de radioterapia (74–79 Gy) en comparación con dosis más bajas (64–70 Gy).[65-69][Nivel de evidencia B1] En ninguno de los estudios se observó un beneficio para la supervivencia por causa específica cuando se usaron dosis altas.
- En el estudio MRC-RT01 [NCT00003290], se asignó al azar a 843 hombres con cáncer de próstata en estadios T1b a T3a, N0, M0 a recibir 64 Gy en 32 fracciones vs. 74 Gy en 37 fracciones mediante administración conformada.[68] Los hombres en ambos grupos del estudio recibieron inyecciones neoadyuvantes de un agonista de la LH-RH cada 4 semanas durante 3 a 6 meses antes de recibir radioterapia y durante el curso de radioterapia. El estudio se diseñó para detectar diferencias en las supervivencia sin progresión (SSP) bioquímica y una diferencia del 15 % en la supervivencia general (SG).
- Después de una mediana de seguimiento de 10 años y a pesar de la mejora estadísticamente significativa de la SSP bioquímica cuando se usaron las dosis más altas de radiación, la tasa de SG a 10 años fue la misma en ambos grupos: 71 % (CRI, 0,99; IC 95 %, 0,77–1,28; P = 0,96). Tampoco hubo diferencias en la supervivencia específica por cáncer de próstata.
- Asimismo, en el ensayo RTOG-0126 (NCT00033631), se asignó al azar a 1532 hombres con cáncer de próstata en estadio cT1b a T2b (puntaje de Gleason de 2 a 6 y PSA de 10 a <20 ng/ml, o puntaje de Gleason de 7 y PSA de <15 ng/ml) para recibir 79,2 Gy en 44 fracciones en comparación con 70,2 Gy en 39 fracciones (usando radioterapia conformada 3D o radioterapia de intensidad modulada [RTIM]).[69] Tras una mediana de seguimiento de 8,4 años (máxima, 13,0 años) las tasas de SG a 8 años fueron del 76 % y 75 % (CRI, 1,00; IC 95 %, 0,83–1,20; P = 0,98). Sin embargo, la administración de dosis altas de radiación se relacionó con un aumento de toxicidad tardía gastrointestinal y genitourinaria de grado 2 o más alto (21 % y 12 % con 79,2 Gy, y 15 % y 7 % con 70,2 Gy).
Para obtener más información, consultar la sección Prostatectomía radical comparada con otras opciones de tratamiento.
La radioterapia profiláctica dirigida a los ganglios linfáticos sin compromiso clínico ni patológico al parecer no mejora la SG ni la supervivencia específica por cáncer de próstata, como se observó en el ensayo RTOG-7706, por ejemplo.[70][Nivel de evidencia A1]
Radioterapia de haz externo hipofraccionada versus convencional
Los programas de administración de radioterapia hipofraccionada que son más prácticos (menos fracciones con una dosis más alta por fracción) al parecer producen resultados similares a los programas de radiación convencionales, por lo menos en cuanto a los resultados intermedios de SSE y la supervivencia sin fracaso terapéutico (grados de comprobación bajos que no se sabe si se traducen en desenlaces clínicos), y los datos iniciales de SG. Sin embargo, es posible que la radiación hipofraccionada ocasione más toxicidad que las dosis estándar según el tipo de régimen de administración que se utilice.[71]
Evidencia (radioterapia de haz externo convencional vs. hipofraccionada):
- En un ensayo aleatorizado pequeño (esencialmente de un solo centro de tratamiento) se encontró que el hipofraccionamiento convencional no fue superior al fraccionamiento convencional.[72] En el ensayo, se asignó al azar a 303 hombres evaluables para recibir una dosis total de 76 Gy de RTIM dividida en 38 fracciones de 2,0 Gy por fracción (RTIM convencional [RTIMC]) en comparación con 70,2 Gy de RTIM dividida en 26 fracciones de 2,7 Gy por fracción (RTIM hipofraccionada [RTIMH]).
- El criterio principal de valoración fue el fracaso terapéutico con recidiva bioquímica o clínica. A los 5 años, las tasas de fracaso terapéutico con recidiva bioquímica o química en ambos grupos fueron del 21,4 % para el grupo de RTIMC (IC 95 %, 14,8–28,7 %) y del 23,3 % para el grupo de RTIMH (IC 95 %, 16,4–31,0 %; P = 0,75).
- De igual forma, no hubo diferencias estadísticamente significativas en los criterios secundarios de valoración de la mortalidad general, la mortalidad específica por cáncer de próstata, el fracaso terapéutico con recidiva local en la próstata ni el fracaso terapéutico con recidiva a distancia, a pesar de que las tasas de mortalidad fueron bajas y el ensayo tuvo una potencia estadística insuficiente para los criterios de valoración de mortalidad.[72][Nivel de evidencia B1]
- En el ensayo CHHiP (NCT00392535), multicéntrico y mucho más grande, se examinó la radioterapia de intensidad modulada convencional o hipofraccionada de dosis alta en 3216 hombres con cáncer de próstata. Los hombres tuvieron cáncer en estadios T1b–T3a, N0, M0 y riesgo estimado de compromiso de vesícula seminal de menos del 30 % y fueron asignados al azar en una proporción 1:1:1 para recibir 74 Gy en 37 fracciones (grupo de fracción convencional), 60 Gy en 20 fracciones o 57 Gy en 19 fracciones.[73,74] El estudio se diseñó como un estudio de ausencia de inferioridad.
- El criterio principal de valoración de fracaso terapéutico con recidiva bioquímica o clínica se notificó después de una mediana de seguimiento de 62,4 meses. Las tasas de supervivencia sin fracaso terapéutico a 5 años fueron del 88,3 % (convencional, grupo de 74 Gy), el 90,6 % (grupo de 60 Gy) y el 85,9 % (grupo de 57 Gy). El grupo de 60 Gy hipofraccionados cumplió con los criterios de ausencia de inferioridad en comparación con el grupo de 74 Gy fraccionados, pero no fue así para el grupo de 57 Gy.[74][Nivel de evidencia B1]
- Las tasas de mortalidad general fueron similares en los tres grupos: 9 %, 7 % y 8 %.[74][Nivel de evidencia A1]
- Se realizó un subestudio de CV con 2100 participantes en el que se observaron resultados casi idénticos para los 3 grupos de tratamiento 2 años después de la inclusión en el estudio (mediana de seguimiento, 50 meses).[73][Nivel de evidencia A3]
- El criterio principal de valoración notificado por el paciente fueron las molestias intestinales. La frecuencia de las molestias moderadas fue del 5 %, el 6 % y el 5 % en los 3 grupos de estudio. Menos del 1 % de los hombres de cada grupo de estudio notificaron molestias graves.
- De igual forma, no hubo diferencias en ningún otro criterio secundario de valoración, entre estos, CV general, molestias urinarias generales y molestias sexuales generales.
- En el ensayo aleatorizado multicéntrico de fase III HYPRO (ISRCTN85138529) se inscribió a 820 hombres con cáncer de próstata de riesgo intermedio o alto (estadios T1b–T4, NX–0, MX–0). Se asignaron al azar para recibir radiación convencional (78 Gy en 39 fracciones durante 8 semanas) o dosis de radiación hipofraccionada (64,6 Gy en 19 fracciones durante 6,5 semanas) en un diseño de ausencia de inferioridad para el hipofraccionamiento.[75,76] La mediana de seguimiento fue de 60 meses.
- El criterio principal de valoración, supervivencia sin recaída a 5 años, fue similar en los 2 grupos del estudio: el 80,5 % (IC 95 %, 75,7–84,4 %) con hipofraccionamiento vs. el 77,1 % (IC 95 %, 71,9–81,5 %) con fraccionamiento convencional (CRI, 0,86; IC 95 %, 0,63–1,16; P = 0,36).[76][Nivel de evidencia B1] La tasa de supervivencia general a 5 años en los 2 grupos también fue similar: el 86,2 % (IC 95 %, 82,3–89,4 %) con hipofraccionamiento versus el 77,1 % (IC 95 %, 81,8–89,2 %) con fraccionamiento convencional (CRI, 1,02; IC 95 %, 0,71–1,46; P = 0,92).[76][Nivel de evidencia A1]
- En cuanto a la toxicidad (criterios de valoración clave de efectos tóxicos de grado 2 o mayor, de tipo genitourinario [GU] o gastrointestinal [GI] a los 3 años), no se logró determinar la ausencia de inferioridad de la radioterapia hipofraccionada después de una mediana de seguimiento de 5 años: toxicidad GU acumulada del 41,3 % con radioterapia hipofraccionada versus el 39 % con la dosis de radioterapia convencional (CRI, 1,16; IC 90 %, 0,98–1,38); toxicidad GI de 21,9 versus el 17,7 % (CRI, 1,19; IC 90 %, 0,93–1,52).
- La toxicidad GU acumulada de grado 3 o mayor fue más común en el grupo de hipofraccionamiento: el 19,0 % versus el 12,9 % (P = 0,02).
- La frecuencia de las deposiciones (≥6 al día) fue más alta en el grupo de hipofraccionamiento: el 7 % versus el 3 % (P = 0,034).
- En un subestudio de 322 hombres tratados con terapia androgénica de corto plazo o sin esta y que se sometieron a una evaluación inicial y al menos una evaluación de seguimiento, se encontró que la disfunción eréctil fue similar entre los dos grupos durante los 3 años de seguimiento.[77]
- El RTOG informó sobre un ensayo de ausencia de inferioridad de 1115 hombres con cáncer de próstata de riesgo bajo (T1b–T2c) que fueron asignados al azar a recibir radioterapia hipofraccionada (70 Gy en 28 fracciones durante 5,6 semanas) en comparación con dosis de radioterapia convencional (73,8 Gy en 41 fracciones durante 8,2 semanas).[78]
- Después de una mediana de seguimiento de 5,8 años, el grupo de radioterapia hipofraccionada cumplió con el criterio prospectivo de ausencia de inferioridad relacionado con la SSE: el 86,3 % con radioterapia hipofraccionada versus el 85,3 % con las dosis de radioterapia convencional (congruente con el CRI, <1,52; P < 0,001 para la hipótesis de ausencia de inferioridad).[78][Nivel de evidencia B1]
- Hubo 49 muertes en el grupo de radioterapia hipofraccionada y 51 muertes en el grupo de dosis de radioterapia convencional (CRI para la SG, 0,95; dosis de radioterapia convencional vs. radioterapia hipofraccionada; IC 95 %, 0,64–1,41).
- No obstante, la toxicidad GI tardía de grado 2 o mayor fue más grave en el grupo de radioterapia hipofraccionada: el 22,4 % versus el 14,0 % (P = 0,002); también se presentó una tendencia hacia una toxicidad GU tardía más grave de grado 2 o mayor: el 29,7 % versus el 22,8 % (P = 0,06).
- En un ensayo multicéntrico (NCT00304759), 1206 hombres con cáncer de próstata de riesgo intermedio (T1–2a, puntaje de Gleason ≤ 6, PSA 10,1–20 ng/ml; T2b–2c, puntaje de Gleason ≤6, PSA ≤ 20 ng/ml; o T1–2, puntaje de Gleason = 7, PSA ≤ 20 ng/ml) se asignaron al azar en un ensayo con diseño de ausencia de inferioridad para que recibieran radioterapia convencional (78 Gy en 39 fracciones) versus radioterapia hipofraccionada (60 Gy en 20 fracciones).[79]
- Después de una mediana de seguimiento de 6 años (máximo de 10 años), el criterio principal de valoración de fracaso terapéutico con recidiva bioquímica o clínica (87 %, recaída del PSA) fue casi idéntico para todos los programas de radioterapia (85 % en ambos grupos; [SSE, IC 95 %, 82–88 %]; CRI, 0,96; IC 90 %, 0,77–1,20).[79][Nivel de evidencia B1]
- El ensayo tuvo una potencia muy inadecuada para detectar diferencias en la mortalidad general y la mortalidad específica por cáncer de próstata. Solo hubo 12 muertes por cáncer de próstata en el grupo de radioterapia convencional y 10 muertes en el grupo de radioterapia hipofraccionada. Solo el 14 % de todas las defunciones se atribuyeron al cáncer de próstata.
- Los efectos tóxicos genitourinarios y gastrointestinales a corto y largo plazo fueron similares en ambos grupos del estudio.
Braquiterapia
A los pacientes con las siguientes características favorables a menudo se les ofrece la braquiterapia:
- Puntaje de Gleason bajo.
- Concentración del PSA baja.
- Tumores en estadios T1 o T2.
Se necesita más información y nuevos estudios para definir mejor los efectos de la braquiterapia intersticial moderna en el control de la enfermedad y la CV, así como para determinar el efecto en los resultados de la selección de pacientes con características favorables.[80][Nivel de evidencia C3]
Para obtener más información sobre los ensayos clínicos en curso, consultar el portal de Internet del NCI.
Terapia radiofarmacéutica
Radiación de rayos α
El radio Ra 223 (223Ra) emite partículas α (es decir, 2 protones y 2 neutrones unidos, de forma idéntica a un núcleo de helio) con una semivida de 11,4 días. Se administra por vía intravenosa y se absorbe de manera selectiva por el estroma óseo recién formado. Las partículas α de energía alta tienen un alcance corto de menos de 100 mcM. El uso de 223Ra mejoró la SG de pacientes con cáncer de próstata metastásico en el hueso. En un ensayo controlado aleatorizado con enmascaramiento doble, se asignó al azar a 921 hombres con cáncer de próstata sintomático resistente a la castración, 2 o más metástasis no viscerales, a recibir 223Ra versus placebo en una proporción 2:1. El uso de 223Ra mejoró la SG de manera estadísticamente significativa (mediana de 14,9 vs. 11,3 meses), la tasa de episodios óseos sintomáticos (33 % vs. 38 %), y la tasa de compresión de la médula espinal (4 % vs. 7 %).[81,82][Nivel de evidencia A1] La administración de una dosis de 50 kBq por kilogramo de peso corporal cada 4 semanas en 6 inyecciones produjo efectos secundarios similares a los del placebo.
Complicaciones de la radioterapia
La radioterapia de haz externo (RHE) definitiva a veces produce cistitis, proctitis y enteritis agudas.[20,42,49,83-85] En general, estas afecciones son reversibles, aunque en ocasiones son crónicas y es infrecuente que exijan una intervención quirúrgica.[85]
En una encuesta transversal de pacientes con cáncer de próstata tratados con prostatectomía radical, radioterapia, o conducta expectante y vigilancia activa en un entorno de seguro médico con atención controlada, se notificaron muchos casos de disfunción sexual y urinaria en el grupo de prostatectomía.[46]
La radiación también es cancerígena.[86-88] La RHE para el cáncer de próstata se relaciona con un aumento del riesgo de cáncer de vejiga y cáncer gastrointestinal. La braquiterapia se relaciona con un aumento del riesgo de cáncer de vejiga.
Reducción de las complicaciones
En la mayoría de los casos, la radioterapia permite conservar la potencia sexual a corto plazo, pero con el tiempo se deteriora.[85] En algunos hombres el citrato de sildenafilo es eficaz para el tratamiento de la disfunción sexual posterior a la radioterapia.
Evidencia (reducción de las complicaciones):
- En un estudio aleatorizado, cruzado y controlado con placebo (RTOG-0215 [NCT00057759]), que ya se completó, participaron 60 hombres sometidos a radioterapia por cáncer de próstata clínicamente localizado quienes notificaron disfunción eréctil de inicio posterior a la radioterapia, entre ellos, el 55 % notificó coito satisfactorio después de consumir sildenafilo versus el 18 % después de tomar un placebo (P < 0,001).[89][Nivel de evidencia A3]
- En un ensayo aleatorizado (RTOG-0831 [NCT00931528]) de 121 hombres con funcionamiento eréctil normal, se comparó el tratamiento preventivo de tadalafilo (5 mg, vía oral [VO] al día) y un placebo durante 24 semanas desde el comienzo de la RHE o la braquiterapia.[90][Nivel de evidencia A3]
- No hubo diferencias estadísticamente significativas en el funcionamiento eréctil espontáneo (criterio principal de valoración) ni en otras medidas de funcionamiento sexual.
Es posible disminuir la morbilidad mediante técnicas sofisticadas de radioterapia (como el uso de aceleradores lineales), simulación y planificación minuciosas del tratamiento.[91,92]
Evidencia (radioterapia conformada tridimensional vs. radioterapia convencional):
- Se compararon los efectos secundarios de dosis similares de radioterapia conformada tridimensional y radioterapia convencional (dosis total, 60–64 Gy) en un estudio aleatorizado sin enmascaramiento.[92][Nivel de evidencia A3]
- No se observaron diferencias en la morbilidad aguda, y los efectos secundarios tardíos suficientemente graves como para exigir tratamiento hospitalario fueron infrecuentes con ambas técnicas; sin embargo, la incidencia acumulada de proctitis leve o más grave fue menor en el grupo de radiación conformada que en el grupo de tratamiento estándar (37 % vs.56 %; P = 0,004). Los síntomas urinarios fueron similares en los 2 grupos de tratamiento, así como las tasas de control local del tumor y las tasas de SG a los 5 años de seguimiento.
La radioterapia se puede administrar después de la disección ganglionar extraperitoneal sin un aumento de las complicaciones, si se usa una técnica de radiación muy controlada. El campo de tratamiento no debe incluir el área de la disección ganglionar pélvica. Si se hace la RTUP antes de la radioterapia, el riesgo de estenosis aumenta a un nivel superior al observado con la radioterapia sola; sin embargo, si la administración de la radioterapia se difiere 4 a 6 semanas después de la RTUP, el riesgo de estenosis es más bajo.[93-95] Se estableció una relación entre la diseminación tumoral y la RTUP que se hace antes del tratamiento definitivo para aliviar los síntomas obstructivos; sin embargo, en un análisis multivariante de casos con estadificación patológica se indica que esta relación quizás se debe al pronóstico subyacente desfavorable de los casos que necesitan una RTUP y no es consecuencia del procedimiento.[96]
Comparación de las complicaciones de la radioterapia y la prostatectomía radical
En general, la prostatectomía radical se relaciona con una tasa más alta de incontinencia urinaria e impotencia sexual temprana, pero con una tasa más baja de incontinencia fecal y lesión rectal. Sin embargo, con el tiempo, las diferencias en la tasa de impotencia sexual disminuyen debido a que el riesgo aumenta con el tiempo trascurrido desde la radiación. Muchos de los efectos secundarios de la terapia local definitiva para el cáncer de próstata persisten incluso después de más de 10 años; además, los problemas urinarios y la impotencia sexual quizá empeoren con la edad.[97]
Evidencia (complicaciones de la prostatectomía radical vs radioterapia):
- Se informó de una encuesta poblacional de beneficiarios de Medicare sometidos a radioterapia como tratamiento primario del cáncer de próstata (similar al diseño de la encuesta de pacientes de Medicare sometidos a prostatectomía radical[44] descrito antes). En este estudio se observaron diferencias importantes en los perfiles de morbilidad posterior al tratamiento entre la cirugía y la radioterapia.[98]
- Aunque los hombres sometidos a radioterapia tenían más años en el momento de la terapia inicial, fue menos probable que notificaran el uso de toallas absorbentes o pinzas para controlar la incontinencia urinaria (7 % vs. >30 %).
- Una proporción mayor de pacientes tratados con radioterapia antes de la cirugía notificó erecciones adecuadas para el coito en el mes previo a la encuesta (hombres <70 años, el 33 % del grupo de radioterapia vs. el 11 % del grupo de cirugía sola; hombres ≥70 años, el 27 % del grupo de radioterapia vs. el 12 % del grupo de cirugía sola).
- Sin embargo, los hombres que recibieron radioterapia fueron más propensos a notificar problemas del funcionamiento intestinal, en especial, deposiciones frecuentes (10 % vs. 3 %).
- Al igual que los resultados de la encuesta de pacientes quirúrgicos, cerca del 24 % de los pacientes del grupo de radiación notificaron que después recibieron tratamiento adicional porque se confirmó o se sospechó un cáncer persistente, o porque recidivó durante los 3 años siguientes al tratamiento primario.
- En un estudio prospectivo de una cohorte comunitaria con hombres de 55 a 74 años sometidos a prostatectomía radical (n = 1156) o RHE (n = 435), se intentó comparar las complicaciones agudas y crónicas de las 2 estrategias de tratamiento después de ajustar por las diferencias iniciales en las características de los pacientes y su estado de salud.[99]
- Con respecto a la morbilidad aguda relacionada con el tratamiento, se encontró que la prostatectomía radical se relacionó con tasas más altas de complicaciones cardiopulmonares (5,5 % vs. 1,9 %) y tratamiento de estenosis urinarias (17,4 % vs. 7,2 %). La radioterapia se relacionó con más prostatitis rectal aguda (18,7 % vs. 1,6 %).
- Con respecto a la morbilidad crónica relacionada con el tratamiento, se encontró que la prostatectomía radical se relacionó con tasas más altas de incontinencia urinaria (9,6 % vs. 3,5 %) e impotencia (80 % vs. 62 %). La radioterapia se relacionó con un poco más de deterioro en el funcionamiento intestinal.
Terapia hormonal y sus complicaciones
Se usan varios abordajes hormonales para el tratamiento de los diferentes estadios del cáncer de próstata.
Estos abordajes son los siguientes:
- Acetato de abiraterona (añadido a la terapia de privación androgénica).
- Orquiectomía bilateral.
- Terapia estrogénica.
- Terapia con agonistas de la hormona liberadora de hormona luteinizante.
- Terapia antiandrogénica.
- Terapia de privación androgénica.
- Terapia antisuprarrenal.
- Ketoconazol.
- Aminoglutetimida.
Acetato de abiraterona
Se demostró que el acetato de abiraterona mejora la SG cuando se añade a la terapia de privación androgénica (TPA) en los hombres con cáncer de próstata en estadio avanzado con enfermedad sensible a la castración. El acetato de abiraterona por lo general se tolera bien; sin embargo, se relaciona con aumento de los efectos mineralocorticoides de grado 3 o 4 (hipertensión e hipopotasemia) en comparación con la TPA sola.[100] También se relacionó con aumento leve en los trastornos respiratorios.[101]
Orquiectomía bilateral
Los beneficios de la orquiectomía bilateral son los siguientes:[42]
- Facilidad del procedimiento.
- Cumplimiento terapéutico.
- Reducción inmediata de las concentraciones de testosterona.
- Bajo costo con respecto a las otras formas de TPA.
Las desventajas de la orquiectomía bilateral son las siguientes:[42,102]
- Efectos psicológicos.
- Pérdida de libido.
- Impotencia menos reversible.
- Sofocos.
- Osteoporosis.[102]
La orquiectomía bilateral también se relacionó con un riesgo elevado de enfermedad coronaria e infarto de miocardio.[103-106]
Para obtener más información, consultar Sofocos y sudores nocturnos.
Terapia estrogénica
Los estrógenos en dosis de 3 mg de dietilestilbestrol (DES) al día producen concentraciones de testosterona en el punto de castración. Al igual que la orquiectomía, el uso de estrógenos a veces causa pérdida de libido e impotencia. Los estrógenos también pueden causar ginecomastia, para prevenir esta complicación se administran dosis bajas de radioterapia profiláctica dirigida a las mamas.
DES ya no se fabrica ni comercializa en los Estados Unidos, y ya casi no se usa debido al riesgo de efectos secundarios graves como infarto de miocardio, accidentes cerebrovasculares y embolia pulmonar.
Terapia con agonistas de la hormona liberadora de hormona luteinizante
Los agonistas de la hormona liberadora de hormona luteinizante (LH-RH), como leuprolida, goserelina y buserelina, disminuyen la testosterona a concentraciones en el punto de castración. Al igual que la orquiectomía y la terapia estrogénica, el uso de agonistas de la LH-RH causa impotencia, sofocos y pérdida de libido. En ocasiones hay crecimiento tumoral transitorio que se puede prevenir con antiandrógenos o una terapia a corto plazo con dosis bajas de estrógenos durante varias semanas.
La evidencia indica que los agonistas de la LH-RH aumentan el riesgo de morbilidad o mortalidad cardiovascular; sin embargo, los resultados son contradictorios.[103-107]
Evidencia (agonistas de la LH-RH y enfermedad cardiovascular):
- En un estudio poblacional del sistema del Departamento de Asuntos de los Veteranos, los agonistas de la LH-RH se relacionaron con un aumento del riesgo de diabetes y enfermedades cardiovasculares, como enfermedad coronaria, infarto de miocardio, muerte súbita y accidente cerebrovascular.[103-105]
- En una revisión sistemática y metanálisis de la evidencia de 8 ensayos (4141 pacientes) de hombres con cáncer de próstata no metastásico asignados al azar para recibir o no agonistas de la LH-RH, no se encontraron diferencias en las tasas de muerte por enfermedad cardiovascular (11,0 vs. 11,2 %; RRde muerte 0,93; IC del 95 %, 0,79–1,10; P = 0,41).[108] El seguimiento en esos estudios osciló entre 7,6 y 13,2 años. No se encontró exceso de riesgo para los agonistas de la LH-RH, con independencia de la duración del tratamiento o la edad del paciente (mediana de edad de <70 o ≥70 años).
Terapia antiandrogénica
Los antiandrogénicos utilizados para el tratamiento del cáncer de próstata son la flutamida y la bicalutamida. En una revisión sistemática de 11 ensayos aleatorizados, se comparó la monoterapia antiandrogénica no esteroidea y la castración quirúrgica o farmacológica en 3060 hombres con enfermedad localmente avanzada, metastásica o recidivante después de tratamiento local.[109] El uso de monoterapia con un antiandrógeno no esteroideo disminuyó la SG y aumentó la tasa de progresión tumoral clínica y fracaso del tratamiento.[109][Nivel de evidencia A1]
El antiandrógeno puro flutamida a veces produce diarrea, sensibilidad mamaria y náuseas. En informes de casos se notificaron toxicidad hepática mortal y no mortal.[110] Para obtener más información, consultar Complicaciones gastrointestinales.
La bicalutamida a veces produce náuseas, sensibilidad mamaria, sofocos, pérdida de libido e impotencia.[111] Para obtener más información, consultar Náuseas y vómitos relacionados con el tratamiento del cáncer y Sofocos y sudores nocturnos.
El antiandrógeno esteroideo acetato de megestrol inhibe de manera incompleta la producción de andrógenos y, por lo general, no se usa como tratamiento inicial.
Se necesitan más estudios para evaluar los efectos de las distintas terapias hormonales en la CV.[112]
Terapia de privación androgénica
En una encuesta nacional de Medicare de hombres sometidos a prostatectomía radical por cáncer de próstata y que se sometieron o no a privación androgénica (médica o quirúrgica), se observó que en el grupo de privación androgénica disminuyeron las siguientes 7 mediciones de calidad de vida relacionadas con la salud:[113][Nivel de evidencia C1]
- Efecto del cáncer y su tratamiento.
- Preocupaciones relacionadas con la imagen corporal.
- Salud mental.
- Salud general.
- Actividad.
- Preocupaciones con respecto al cáncer y la muerte.
- Energía.
La terapia de privación androgénica (TPA) a veces causa osteoporosis y fracturas óseas. En una muestra poblacional de 50613 pacientes de Medicare de 66 años o más que fueron seguidos durante una mediana de 5,1 años, se observó que los hombres tratados con una hormona liberadora de gonadotropina (GnRH) u orquiectomía presentaron una tasa de fracturas óseas del 19,4 % en comparación con el 12,6 % en los hombres que no recibieron terapia de privación hormonal. El efecto fue similar en los hombres con enfermedad ósea metastásica o sin esta.[114]
El uso de TPA se relaciona con quejas de acortamiento del pene, pero hay muy pocos datos sobre esta complicación.[60] En un estudio de un registro de hombres con una concentración del PSA en aumento después del tratamiento inicial del cáncer de próstata localizado según la evaluación clínica y que recibieron radioterapia con TPA, se encontró que 19 de 510 hombres (3,7 %) se quejaron de reducción del tamaño del pene. Ninguno de los 213 hombres tratados con radioterapia, pero sin TPA, se quejó de cambios en el tamaño del pene. Sin embargo, los datos se basan en informes médicos de quejas de pacientes en lugar de una entrevista directa con el paciente o la medición de la longitud del pene antes y después del tratamiento. Además, la muestra del estudio se limitó a los pacientes con recidiva tumoral confirmada o presunta, lo que dificulta la generalización.
En los ensayos aleatorizados controlados con placebo, se observó que el tratamiento de la osteoporosis con bisfosfonatos reduce el riesgo de fracturas óseas en los hombres sometidos a TPA por cáncer de próstata (RR, 0,80 en un metanálisis de 15 ensayos; IC 95 %:0,69–0,94). En el metanálisis, el zoledronato tuvo el mayor efecto.[115]
El uso de TPA también se relacionó con aumento del riesgo de cáncer colorrectal.
Evidencia (aumento del riesgo de cáncer colorrectal):
- En un estudio de la base de datos SEER de Medicare, los investigadores evaluaron el riesgo de cáncer colorrectal subsiguiente en 107859 hombres de 67 años o más después de un diagnóstico inicial de cáncer de próstata.[116]
- Las tasas de cáncer colorrectal por 1000 años-persona fueron de 6,3 (IC 95 %, 5,3–7,5) en los hombres sometidos a orquiectomía, de 4,4 (IC 95 %, 4,0–4,9) en los hombres tratados con agonistas de la GnRH, y de 3,7 (IC 95 %, 3,05–3,09) en los hombres que no recibieron privación androgénica.
- En los hombres tratados con agonistas de la GnRH, el riesgo aumentó con la duración del tratamiento (P para la tendencia = 0,01).
Terapia antisuprarrenal
Los medicamentos con efecto antisuprarrenal utilizados en el tratamiento del cáncer de próstata son ketoconazol y aminoglutetimida. El uso a largo plazo de ketoconazol a veces produce impotencia, prurito, cambios en las uñas e insuficiencia suprarrenal. Por lo común, la aminoglutetimida causa sedación y erupciones cutáneas. Para obtener más información, consultar Prurito.
Criocirugía
La criocirugía o crioterapia, se encuentra en evaluación para el tratamiento del cáncer de próstata localizado. La criocirugía es una técnica quirúrgica que permite destruir las células cancerosas en el tejido prostático mediante el uso de criosondas que producen congelación y descongelación intermitentes.[117][Nivel de evidencia C1]; [118,119][Nivel de evidencia C3] La evidencia sobre su eficacia e inocuidad es limitada en comparación con la prostatectomía estándar y la radioterapia; la técnica está en evolución a fin de reducir la toxicidad local y la lesión al tejido normal. La evidencia sobre la eficacia es de baja calidad, y en la actualidad se restringe a datos de series de casos relativamente pequeñas, de seguimiento corto y que utilizan criterios indirectos de valoración de la eficacia.[120]
Los efectos tóxicos graves relacionados con la criocirugía incluyen lesión infravesical, incontinencia urinaria, impotencia sexual y lesión rectal. La impotencia es común, oscila entre el 47 % y el 100 %.
La frecuencia de otros efectos secundarios y la probabilidad de control del cáncer a los 5 años de seguimiento varían en los centros notificadores; las series son pequeñas en comparación con las series de cirugía y radioterapia.[118,119] Otras complicaciones graves incluyen desprendimiento uretral, fístula o estenosis urinaria, y obstrucción del cuello vesical.[120]
Terapia con haz de protones
Hay interés en el uso de la terapia con haz de protones para el tratamiento del cáncer de próstata. La distribución de la dosis de este tipo de radiación de partículas cargadas mejora en teoría el cociente terapéutico de radiación dirigida a la próstata, lo que permitiría aumentar la dosis de radiación dirigida al tumor sin aumentar los efectos secundarios. No hay ensayos controlados aleatorizados en los que se compare la eficacia y toxicidad con otras formas de radioterapia.
Terapia fotodinámica
La terapia fotodinámica vascular con un fotosensibilizador se probó en hombres con cáncer de próstata de riesgo bajo.[121]
Terapia hormonal neoadyuvante
No se ha establecido la función de la terapia hormonal neoadyuvante.[26,27]
Bicalutamida
No se demostró que la bicalutamida mejorase la SG en pacientes con cáncer de próstata localizado o localmente avanzado.
Evidencia (bicalutamida):
- El programa Early Prostate Cancer es un gran ensayo internacional aleatorizado y controlado con placebo en el que se comparó la bicalutamida (150 mg VO al día) acompañada de atención estándar (prostatectomía radical, radioterapia o conducta expectante, según el uso habitual local) y el tratamiento estándar solo para hombres con cáncer de próstata no metastásico localizado o localmente avanzado (T1–2, N0, y NX; T3–4; cualquier N o cualquier T, N+). Menos del 2 % de los 8113 hombres tenían enfermedad ganglionar confirmada.[122][Nivel de evidencia A1]
- Al cabo de una mediana de seguimiento de 7,4 años, no hubo diferencia en la SG del grupo de bicalutamida y de placebo (cerca del 76 % en ambos grupos [CRI, 0,99; IC 95 %, 0,91–1,09; P = 0,89]).
Para obtener más información sobre los ensayos clínicos en curso, consultar el portal de Internet del NCI.
Bibliografía
- Barocas DA, Alvarez J, Resnick MJ, et al.: Association Between Radiation Therapy, Surgery, or Observation for Localized Prostate Cancer and Patient-Reported Outcomes After 3 Years. JAMA 317 (11): 1126-1140, 2017. [PUBMED Abstract]
- Chen RC, Basak R, Meyer AM, et al.: Association Between Choice of Radical Prostatectomy, External Beam Radiotherapy, Brachytherapy, or Active Surveillance and Patient-Reported Quality of Life Among Men With Localized Prostate Cancer. JAMA 317 (11): 1141-1150, 2017. [PUBMED Abstract]
- Chodak GW, Thisted RA, Gerber GS, et al.: Results of conservative management of clinically localized prostate cancer. N Engl J Med 330 (4): 242-8, 1994. [PUBMED Abstract]
- Whitmore WF: Expectant management of clinically localized prostatic cancer. Semin Oncol 21 (5): 560-8, 1994. [PUBMED Abstract]
- Wilt TJ, Brawer MK, Jones KM, et al.: Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 367 (3): 203-13, 2012. [PUBMED Abstract]
- Shappley WV, Kenfield SA, Kasperzyk JL, et al.: Prospective study of determinants and outcomes of deferred treatment or watchful waiting among men with prostate cancer in a nationwide cohort. J Clin Oncol 27 (30): 4980-5, 2009. [PUBMED Abstract]
- Klotz L: Active surveillance with selective delayed intervention: using natural history to guide treatment in good risk prostate cancer. J Urol 172 (5 Pt 2): S48-50; discussion S50-1, 2004. [PUBMED Abstract]
- Carter HB, Walsh PC, Landis P, et al.: Expectant management of nonpalpable prostate cancer with curative intent: preliminary results. J Urol 167 (3): 1231-4, 2002. [PUBMED Abstract]
- Klotz L, Vesprini D, Sethukavalan P, et al.: Long-term follow-up of a large active surveillance cohort of patients with prostate cancer. J Clin Oncol 33 (3): 272-7, 2015. [PUBMED Abstract]
- Johansson JE, Holmberg L, Johansson S, et al.: Fifteen-year survival in prostate cancer. A prospective, population-based study in Sweden. JAMA 277 (6): 467-71, 1997. [PUBMED Abstract]
- Johansson JE, Andrén O, Andersson SO, et al.: Natural history of early, localized prostate cancer. JAMA 291 (22): 2713-9, 2004. [PUBMED Abstract]
- Waaler G, Stenwig AE: Prognosis of localised prostatic cancer managed by "watch and wait" policy. Br J Urol 72 (2): 214-9, 1993. [PUBMED Abstract]
- Lu-Yao GL, Albertsen PC, Moore DF, et al.: Outcomes of localized prostate cancer following conservative management. JAMA 302 (11): 1202-9, 2009. [PUBMED Abstract]
- Stattin P, Holmberg E, Johansson JE, et al.: Outcomes in localized prostate cancer: National Prostate Cancer Register of Sweden follow-up study. J Natl Cancer Inst 102 (13): 950-8, 2010. [PUBMED Abstract]
- Holmström B, Holmberg E, Egevad L, et al.: Outcome of primary versus deferred radical prostatectomy in the National Prostate Cancer Register of Sweden Follow-Up Study. J Urol 184 (4): 1322-7, 2010. [PUBMED Abstract]
- Barry MJ, Albertsen PC, Bagshaw MA, et al.: Outcomes for men with clinically nonmetastatic prostate carcinoma managed with radical prostactectomy, external beam radiotherapy, or expectant management: a retrospective analysis. Cancer 91 (12): 2302-14, 2001. [PUBMED Abstract]
- Lu-Yao GL, Yao SL: Population-based study of long-term survival in patients with clinically localised prostate cancer. Lancet 349 (9056): 906-10, 1997. [PUBMED Abstract]
- van den Bergh RC, Roemeling S, Roobol MJ, et al.: Outcomes of men with screen-detected prostate cancer eligible for active surveillance who were managed expectantly. Eur Urol 55 (1): 1-8, 2009. [PUBMED Abstract]
- Hamdy FC, Donovan JL, Lane JA, et al.: 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 375 (15): 1415-1424, 2016. [PUBMED Abstract]
- Catalona WJ, Bigg SW: Nerve-sparing radical prostatectomy: evaluation of results after 250 patients. J Urol 143 (3): 538-43; discussion 544, 1990. [PUBMED Abstract]
- Corral DA, Bahnson RR: Survival of men with clinically localized prostate cancer detected in the eighth decade of life. J Urol 151 (5): 1326-9, 1994. [PUBMED Abstract]
- Zincke H, Bergstralh EJ, Blute ML, et al.: Radical prostatectomy for clinically localized prostate cancer: long-term results of 1,143 patients from a single institution. J Clin Oncol 12 (11): 2254-63, 1994. [PUBMED Abstract]
- Schuessler WW, Vancaillie TG, Reich H, et al.: Transperitoneal endosurgical lymphadenectomy in patients with localized prostate cancer. J Urol 145 (5): 988-91, 1991. [PUBMED Abstract]
- Coughlin GD, Yaxley JW, Chambers SK, et al.: Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: 24-month outcomes from a randomised controlled study. Lancet Oncol 19 (8): 1051-1060, 2018. [PUBMED Abstract]
- Fournier GR, Narayan P: Re-evaluation of the need for pelvic lymphadenectomy in low grade prostate cancer. Br J Urol 72 (4): 484-8, 1993. [PUBMED Abstract]
- Witjes WP, Schulman CC, Debruyne FM: Preliminary results of a prospective randomized study comparing radical prostatectomy versus radical prostatectomy associated with neoadjuvant hormonal combination therapy in T2-3 N0 M0 prostatic carcinoma. The European Study Group on Neoadjuvant Treatment of Prostate Cancer. Urology 49 (3A Suppl): 65-9, 1997. [PUBMED Abstract]
- Fair WR, Cookson MS, Stroumbakis N, et al.: The indications, rationale, and results of neoadjuvant androgen deprivation in the treatment of prostatic cancer: Memorial Sloan-Kettering Cancer Center results. Urology 49 (3A Suppl): 46-55, 1997. [PUBMED Abstract]
- Adolfsson J, Rönström L, Löwhagen T, et al.: Deferred treatment of clinically localized low grade prostate cancer: the experience from a prospective series at the Karolinska Hospital. J Urol 152 (5 Pt 2): 1757-60, 1994. [PUBMED Abstract]
- Grossfeld GD, Chang JJ, Broering JM, et al.: Impact of positive surgical margins on prostate cancer recurrence and the use of secondary cancer treatment: data from the CaPSURE database. J Urol 163 (4): 1171-7; quiz 1295, 2000. [PUBMED Abstract]
- Wasson JH, Cushman CC, Bruskewitz RC, et al.: A structured literature review of treatment for localized prostate cancer. Prostate Disease Patient Outcome Research Team. Arch Fam Med 2 (5): 487-93, 1993. [PUBMED Abstract]
- Adolfsson J, Steineck G, Whitmore WF: Recent results of management of palpable clinically localized prostate cancer. Cancer 72 (2): 310-22, 1993. [PUBMED Abstract]
- Austenfeld MS, Thompson IM, Middleton RG: Meta-analysis of the literature: guideline development for prostate cancer treatment. American Urological Association Prostate Cancer Guideline Panel. J Urol 152 (5 Pt 2): 1866-9, 1994. [PUBMED Abstract]
- Holmberg L, Bill-Axelson A, Helgesen F, et al.: A randomized trial comparing radical prostatectomy with watchful waiting in early prostate cancer. N Engl J Med 347 (11): 781-9, 2002. [PUBMED Abstract]
- Bill-Axelson A, Holmberg L, Ruutu M, et al.: Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 352 (19): 1977-84, 2005. [PUBMED Abstract]
- Bill-Axelson A, Holmberg L, Garmo H, et al.: Radical prostatectomy or watchful waiting in early prostate cancer. N Engl J Med 370 (10): 932-42, 2014. [PUBMED Abstract]
- Wilt TJ: The Prostate Cancer Intervention Versus Observation Trial: VA/NCI/AHRQ Cooperative Studies Program #407 (PIVOT): design and baseline results of a randomized controlled trial comparing radical prostatectomy with watchful waiting for men with clinically localized prostate cancer. J Natl Cancer Inst Monogr 2012 (45): 184-90, 2012. [PUBMED Abstract]
- Wilt TJ, Jones KM, Barry MJ, et al.: Follow-up of Prostatectomy versus Observation for Early Prostate Cancer. N Engl J Med 377 (2): 132-142, 2017. [PUBMED Abstract]
- Donovan JL, Hamdy FC, Lane JA, et al.: Patient-Reported Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. N Engl J Med 375 (15): 1425-1437, 2016. [PUBMED Abstract]
- Yao SL, Lu-Yao G: Population-based study of relationships between hospital volume of prostatectomies, patient outcomes, and length of hospital stay. J Natl Cancer Inst 91 (22): 1950-6, 1999. [PUBMED Abstract]
- Lu-Yao GL, McLerran D, Wasson J, et al.: An assessment of radical prostatectomy. Time trends, geographic variation, and outcomes. The Prostate Patient Outcomes Research Team. JAMA 269 (20): 2633-6, 1993. [PUBMED Abstract]
- Alibhai SM, Leach M, Tomlinson G, et al.: 30-day mortality and major complications after radical prostatectomy: influence of age and comorbidity. J Natl Cancer Inst 97 (20): 1525-32, 2005. [PUBMED Abstract]
- Sanda MG, Dunn RL, Michalski J, et al.: Quality of life and satisfaction with outcome among prostate-cancer survivors. N Engl J Med 358 (12): 1250-61, 2008. [PUBMED Abstract]
- Catalona WJ, Basler JW: Return of erections and urinary continence following nerve sparing radical retropubic prostatectomy. J Urol 150 (3): 905-7, 1993. [PUBMED Abstract]
- Fowler FJ, Barry MJ, Lu-Yao G, et al.: Patient-reported complications and follow-up treatment after radical prostatectomy. The National Medicare Experience: 1988-1990 (updated June 1993). Urology 42 (6): 622-9, 1993. [PUBMED Abstract]
- Potosky AL, Davis WW, Hoffman RM, et al.: Five-year outcomes after prostatectomy or radiotherapy for prostate cancer: the prostate cancer outcomes study. J Natl Cancer Inst 96 (18): 1358-67, 2004. [PUBMED Abstract]
- Litwin MS, Hays RD, Fink A, et al.: Quality-of-life outcomes in men treated for localized prostate cancer. JAMA 273 (2): 129-35, 1995. [PUBMED Abstract]
- Jønler M, Messing EM, Rhodes PR, et al.: Sequelae of radical prostatectomy. Br J Urol 74 (3): 352-8, 1994. [PUBMED Abstract]
- Geary ES, Dendinger TE, Freiha FS, et al.: Nerve sparing radical prostatectomy: a different view. J Urol 154 (1): 145-9, 1995. [PUBMED Abstract]
- Lim AJ, Brandon AH, Fiedler J, et al.: Quality of life: radical prostatectomy versus radiation therapy for prostate cancer. J Urol 154 (4): 1420-5, 1995. [PUBMED Abstract]
- Savoie M, Kim SS, Soloway MS: A prospective study measuring penile length in men treated with radical prostatectomy for prostate cancer. J Urol 169 (4): 1462-4, 2003. [PUBMED Abstract]
- Gontero P, Galzerano M, Bartoletti R, et al.: New insights into the pathogenesis of penile shortening after radical prostatectomy and the role of postoperative sexual function. J Urol 178 (2): 602-7, 2007. [PUBMED Abstract]
- McCullough A: Penile change following radical prostatectomy: size, smooth muscle atrophy, and curve. Curr Urol Rep 9 (6): 492-9, 2008. [PUBMED Abstract]
- Sun M, Lughezzani G, Alasker A, et al.: Comparative study of inguinal hernia repair after radical prostatectomy, prostate biopsy, transurethral resection of the prostate or pelvic lymph node dissection. J Urol 183 (3): 970-5, 2010. [PUBMED Abstract]
- Sekita N, Suzuki H, Kamijima S, et al.: Incidence of inguinal hernia after prostate surgery: open radical retropubic prostatectomy versus open simple prostatectomy versus transurethral resection of the prostate. Int J Urol 16 (1): 110-3, 2009. [PUBMED Abstract]
- Lughezzani G, Sun M, Perrotte P, et al.: Comparative study of inguinal hernia repair rates after radical prostatectomy or external beam radiotherapy. Int J Radiat Oncol Biol Phys 78 (5): 1307-13, 2010. [PUBMED Abstract]
- Lodding P, Bergdahl C, Nyberg M, et al.: Inguinal hernia after radical retropubic prostatectomy for prostate cancer: a study of incidence and risk factors in comparison to no operation and lymphadenectomy. J Urol 166 (3): 964-7, 2001. [PUBMED Abstract]
- Lepor H, Robbins D: Inguinal hernias in men undergoing open radical retropubic prostatectomy. Urology 70 (5): 961-4, 2007. [PUBMED Abstract]
- Bishoff JT, Motley G, Optenberg SA, et al.: Incidence of fecal and urinary incontinence following radical perineal and retropubic prostatectomy in a national population. J Urol 160 (2): 454-8, 1998. [PUBMED Abstract]
- Nossiter J, Sujenthiran A, Charman SC, et al.: Robot-assisted radical prostatectomy vs laparoscopic and open retropubic radical prostatectomy: functional outcomes 18 months after diagnosis from a national cohort study in England. Br J Cancer 118 (4): 489-494, 2018. [PUBMED Abstract]
- Parekh A, Chen MH, Hoffman KE, et al.: Reduced penile size and treatment regret in men with recurrent prostate cancer after surgery, radiotherapy plus androgen deprivation, or radiotherapy alone. Urology 81 (1): 130-4, 2013. [PUBMED Abstract]
- Kadono Y, Machioka K, Nakashima K, et al.: Changes in penile length after radical prostatectomy: investigation of the underlying anatomical mechanism. BJU Int 120 (2): 293-299, 2017. [PUBMED Abstract]
- Forman JD, Order SE, Zinreich ES, et al.: Carcinoma of the prostate in the elderly: the therapeutic ratio of definitive radiotherapy. J Urol 136 (6): 1238-41, 1986. [PUBMED Abstract]
- Duncan W, Warde P, Catton CN, et al.: Carcinoma of the prostate: results of radical radiotherapy (1970-1985) Int J Radiat Oncol Biol Phys 26 (2): 203-10, 1993. [PUBMED Abstract]
- Zietman AL, Coen JJ, Shipley WU, et al.: Radical radiation therapy in the management of prostatic adenocarcinoma: the initial prostate specific antigen value as a predictor of treatment outcome. J Urol 151 (3): 640-5, 1994. [PUBMED Abstract]
- Peeters ST, Heemsbergen WD, Koper PC, et al.: Dose-response in radiotherapy for localized prostate cancer: results of the Dutch multicenter randomized phase III trial comparing 68 Gy of radiotherapy with 78 Gy. J Clin Oncol 24 (13): 1990-6, 2006. [PUBMED Abstract]
- Zietman AL, DeSilvio ML, Slater JD, et al.: Comparison of conventional-dose vs high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: a randomized controlled trial. JAMA 294 (10): 1233-9, 2005. [PUBMED Abstract]
- Pollack A, Zagars GK, Starkschall G, et al.: Prostate cancer radiation dose response: results of the M. D. Anderson phase III randomized trial. Int J Radiat Oncol Biol Phys 53 (5): 1097-105, 2002. [PUBMED Abstract]
- Dearnaley DP, Jovic G, Syndikus I, et al.: Escalated-dose versus control-dose conformal radiotherapy for prostate cancer: long-term results from the MRC RT01 randomised controlled trial. Lancet Oncol 15 (4): 464-73, 2014. [PUBMED Abstract]
- Michalski JM, Moughan J, Purdy J, et al.: Effect of Standard vs Dose-Escalated Radiation Therapy for Patients With Intermediate-Risk Prostate Cancer: The NRG Oncology RTOG 0126 Randomized Clinical Trial. JAMA Oncol 4 (6): e180039, 2018. [PUBMED Abstract]
- Asbell SO, Martz KL, Shin KH, et al.: Impact of surgical staging in evaluating the radiotherapeutic outcome in RTOG #77-06, a phase III study for T1BN0M0 (A2) and T2N0M0 (B) prostate carcinoma. Int J Radiat Oncol Biol Phys 40 (4): 769-82, 1998. [PUBMED Abstract]
- Yu JB: Hypofractionated Radiotherapy for Prostate Cancer: Further Evidence to Tip the Scales. J Clin Oncol 35 (17): 1867-1869, 2017. [PUBMED Abstract]
- Pollack A, Walker G, Horwitz EM, et al.: Randomized trial of hypofractionated external-beam radiotherapy for prostate cancer. J Clin Oncol 31 (31): 3860-8, 2013. [PUBMED Abstract]
- Wilkins A, Mossop H, Syndikus I, et al.: Hypofractionated radiotherapy versus conventionally fractionated radiotherapy for patients with intermediate-risk localised prostate cancer: 2-year patient-reported outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol 16 (16): 1605-16, 2015. [PUBMED Abstract]
- Dearnaley D, Syndikus I, Mossop H, et al.: Conventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol 17 (8): 1047-60, 2016. [PUBMED Abstract]
- Aluwini S, Pos F, Schimmel E, et al.: Hypofractionated versus conventionally fractionated radiotherapy for patients with prostate cancer (HYPRO): late toxicity results from a randomised, non-inferiority, phase 3 trial. Lancet Oncol 17 (4): 464-74, 2016. [PUBMED Abstract]
- Incrocci L, Wortel RC, Alemayehu WG, et al.: Hypofractionated versus conventionally fractionated radiotherapy for patients with localised prostate cancer (HYPRO): final efficacy results from a randomised, multicentre, open-label, phase 3 trial. Lancet Oncol 17 (8): 1061-9, 2016. [PUBMED Abstract]
- Wortel RC, Pos FJ, Heemsbergen WD, et al.: Sexual Function After Hypofractionated Versus Conventionally Fractionated Radiotherapy for Prostate Cancer: Results From the Randomized Phase III HYPRO Trial. J Sex Med 13 (11): 1695-1703, 2016. [PUBMED Abstract]
- Lee WR, Dignam JJ, Amin MB, et al.: Randomized Phase III Noninferiority Study Comparing Two Radiotherapy Fractionation Schedules in Patients With Low-Risk Prostate Cancer. J Clin Oncol 34 (20): 2325-32, 2016. [PUBMED Abstract]
- Catton CN, Lukka H, Gu CS, et al.: Randomized Trial of a Hypofractionated Radiation Regimen for the Treatment of Localized Prostate Cancer. J Clin Oncol 35 (17): 1884-1890, 2017. [PUBMED Abstract]
- Ragde H, Blasko JC, Grimm PD, et al.: Interstitial iodine-125 radiation without adjuvant therapy in the treatment of clinically localized prostate carcinoma. Cancer 80 (3): 442-53, 1997. [PUBMED Abstract]
- Parker C, Nilsson S, Heinrich D, et al.: Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 369 (3): 213-23, 2013. [PUBMED Abstract]
- Sartor O, Coleman R, Nilsson S, et al.: Effect of radium-223 dichloride on symptomatic skeletal events in patients with castration-resistant prostate cancer and bone metastases: results from a phase 3, double-blind, randomised trial. Lancet Oncol 15 (7): 738-46, 2014. [PUBMED Abstract]
- Schellhammer PF, Jordan GH, el-Mahdi AM: Pelvic complications after interstitial and external beam irradiation of urologic and gynecologic malignancy. World J Surg 10 (2): 259-68, 1986. [PUBMED Abstract]
- Lee JY, Daignault-Newton S, Heath G, et al.: Multinational Prospective Study of Patient-Reported Outcomes After Prostate Radiation Therapy: Detailed Assessment of Rectal Bleeding. Int J Radiat Oncol Biol Phys 96 (4): 770-777, 2016. [PUBMED Abstract]
- Hamilton AS, Stanford JL, Gilliland FD, et al.: Health outcomes after external-beam radiation therapy for clinically localized prostate cancer: results from the Prostate Cancer Outcomes Study. J Clin Oncol 19 (9): 2517-26, 2001. [PUBMED Abstract]
- Nieder AM, Porter MP, Soloway MS: Radiation therapy for prostate cancer increases subsequent risk of bladder and rectal cancer: a population based cohort study. J Urol 180 (5): 2005-9; discussion 2009-10, 2008. [PUBMED Abstract]
- Abdel-Wahab M, Reis IM, Wu J, et al.: Second primary cancer risk of radiation therapy after radical prostatectomy for prostate cancer: an analysis of SEER data. Urology 74 (4): 866-71, 2009. [PUBMED Abstract]
- Nam RK, Cheung P, Herschorn S, et al.: Incidence of complications other than urinary incontinence or erectile dysfunction after radical prostatectomy or radiotherapy for prostate cancer: a population-based cohort study. Lancet Oncol 15 (2): 223-31, 2014. [PUBMED Abstract]
- Incrocci L, Koper PC, Hop WC, et al.: Sildenafil citrate (Viagra) and erectile dysfunction following external beam radiotherapy for prostate cancer: a randomized, double-blind, placebo-controlled, cross-over study. Int J Radiat Oncol Biol Phys 51 (5): 1190-5, 2001. [PUBMED Abstract]
- Pisansky TM, Pugh SL, Greenberg RE, et al.: Tadalafil for prevention of erectile dysfunction after radiotherapy for prostate cancer: the Radiation Therapy Oncology Group [0831] randomized clinical trial. JAMA 311 (13): 1300-7, 2014. [PUBMED Abstract]
- Hanks GE, Hanlon AL, Schultheiss TE, et al.: Dose escalation with 3D conformal treatment: five year outcomes, treatment optimization, and future directions. Int J Radiat Oncol Biol Phys 41 (3): 501-10, 1998. [PUBMED Abstract]
- Dearnaley DP, Khoo VS, Norman AR, et al.: Comparison of radiation side-effects of conformal and conventional radiotherapy in prostate cancer: a randomised trial. Lancet 353 (9149): 267-72, 1999. [PUBMED Abstract]
- Greskovich FJ, Zagars GK, Sherman NE, et al.: Complications following external beam radiation therapy for prostate cancer: an analysis of patients treated with and without staging pelvic lymphadenectomy. J Urol 146 (3): 798-802, 1991. [PUBMED Abstract]
- Seymore CH, el-Mahdi AM, Schellhammer PF: The effect of prior transurethral resection of the prostate on post radiation urethral strictures and bladder neck contractures. Int J Radiat Oncol Biol Phys 12 (9): 1597-600, 1986. [PUBMED Abstract]
- Green N, Treible D, Wallack H, et al.: Prostate cancer--the impact of irradiation on urinary outlet obstruction. Br J Urol 70 (3): 310-3, 1992. [PUBMED Abstract]
- Zelefsky MJ, Whitmore WF, Leibel SA, et al.: Impact of transurethral resection on the long-term outcome of patients with prostatic carcinoma. J Urol 150 (6): 1860-4, 1993. [PUBMED Abstract]
- Jang JW, Drumm MR, Efstathiou JA, et al.: Long-term quality of life after definitive treatment for prostate cancer: patient-reported outcomes in the second posttreatment decade. Cancer Med 6 (7): 1827-1836, 2017. [PUBMED Abstract]
- Fowler FJ, Barry MJ, Lu-Yao G, et al.: Outcomes of external-beam radiation therapy for prostate cancer: a study of Medicare beneficiaries in three surveillance, epidemiology, and end results areas. J Clin Oncol 14 (8): 2258-65, 1996. [PUBMED Abstract]
- Potosky AL, Legler J, Albertsen PC, et al.: Health outcomes after prostatectomy or radiotherapy for prostate cancer: results from the Prostate Cancer Outcomes Study. J Natl Cancer Inst 92 (19): 1582-92, 2000. [PUBMED Abstract]
- Fizazi K, Tran N, Fein L, et al.: Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 377 (4): 352-360, 2017. [PUBMED Abstract]
- James ND, de Bono JS, Spears MR, et al.: Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy. N Engl J Med 377 (4): 338-351, 2017. [PUBMED Abstract]
- Daniell HW: Osteoporosis after orchiectomy for prostate cancer. J Urol 157 (2): 439-44, 1997. [PUBMED Abstract]
- Keating NL, O'Malley AJ, Freedland SJ, et al.: Diabetes and cardiovascular disease during androgen deprivation therapy: observational study of veterans with prostate cancer. J Natl Cancer Inst 102 (1): 39-46, 2010. [PUBMED Abstract]
- Keating NL, O'Malley AJ, Smith MR: Diabetes and cardiovascular disease during androgen deprivation therapy for prostate cancer. J Clin Oncol 24 (27): 4448-56, 2006. [PUBMED Abstract]
- D'Amico AV, Denham JW, Crook J, et al.: Influence of androgen suppression therapy for prostate cancer on the frequency and timing of fatal myocardial infarctions. J Clin Oncol 25 (17): 2420-5, 2007. [PUBMED Abstract]
- O'Farrell S, Garmo H, Holmberg L, et al.: Risk and timing of cardiovascular disease after androgen-deprivation therapy in men with prostate cancer. J Clin Oncol 33 (11): 1243-51, 2015. [PUBMED Abstract]
- Levine GN, D'Amico AV, Berger P, et al.: Androgen-deprivation therapy in prostate cancer and cardiovascular risk: a science advisory from the American Heart Association, American Cancer Society, and American Urological Association: endorsed by the American Society for Radiation Oncology. CA Cancer J Clin 60 (3): 194-201, 2010 May-Jun. [PUBMED Abstract]
- Nguyen PL, Je Y, Schutz FA, et al.: Association of androgen deprivation therapy with cardiovascular death in patients with prostate cancer: a meta-analysis of randomized trials. JAMA 306 (21): 2359-66, 2011. [PUBMED Abstract]
- Kunath F, Grobe HR, Rücker G, et al.: Non-steroidal antiandrogen monotherapy compared with luteinising hormone-releasing hormone agonists or surgical castration monotherapy for advanced prostate cancer. Cochrane Database Syst Rev (6): CD009266, 2014. [PUBMED Abstract]
- Wysowski DK, Freiman JP, Tourtelot JB, et al.: Fatal and nonfatal hepatotoxicity associated with flutamide. Ann Intern Med 118 (11): 860-4, 1993. [PUBMED Abstract]
- Soloway MS, Schellhammer PF, Smith JA, et al.: Bicalutamide in the treatment of advanced prostatic carcinoma: a phase II multicenter trial. Urology 47 (1A Suppl): 33-7; discussion 48-53, 1996. [PUBMED Abstract]
- Kirschenbaum A: Management of hormonal treatment effects. Cancer 75 (7 Suppl): 1983-86, 1995.
- Fowler FJ, McNaughton Collins M, Walker Corkery E, et al.: The impact of androgen deprivation on quality of life after radical prostatectomy for prostate carcinoma. Cancer 95 (2): 287-95, 2002. [PUBMED Abstract]
- Shahinian VB, Kuo YF, Freeman JL, et al.: Risk of fracture after androgen deprivation for prostate cancer. N Engl J Med 352 (2): 154-64, 2005. [PUBMED Abstract]
- Serpa Neto A, Tobias-Machado M, Esteves MA, et al.: Bisphosphonate therapy in patients under androgen deprivation therapy for prostate cancer: a systematic review and meta-analysis. Prostate Cancer Prostatic Dis 15 (1): 36-44, 2012. [PUBMED Abstract]
- Gillessen S, Templeton A, Marra G, et al.: Risk of colorectal cancer in men on long-term androgen deprivation therapy for prostate cancer. J Natl Cancer Inst 102 (23): 1760-70, 2010. [PUBMED Abstract]
- Robinson JW, Saliken JC, Donnelly BJ, et al.: Quality-of-life outcomes for men treated with cryosurgery for localized prostate carcinoma. Cancer 86 (9): 1793-801, 1999. [PUBMED Abstract]
- Donnelly BJ, Saliken JC, Ernst DS, et al.: Prospective trial of cryosurgical ablation of the prostate: five-year results. Urology 60 (4): 645-9, 2002. [PUBMED Abstract]
- Aus G, Pileblad E, Hugosson J: Cryosurgical ablation of the prostate: 5-year follow-up of a prospective study. Eur Urol 42 (2): 133-8, 2002. [PUBMED Abstract]
- Shelley M, Wilt TJ, Coles B, et al.: Cryotherapy for localised prostate cancer. Cochrane Database Syst Rev (3): CD005010, 2007. [PUBMED Abstract]
- Azzouzi AR, Vincendeau S, Barret E, et al.: Padeliporfin vascular-targeted photodynamic therapy versus active surveillance in men with low-risk prostate cancer (CLIN1001 PCM301): an open-label, phase 3, randomised controlled trial. Lancet Oncol 18 (2): 181-191, 2017. [PUBMED Abstract]
- McLeod DG, Iversen P, See WA, et al.: Bicalutamide 150 mg plus standard care vs standard care alone for early prostate cancer. BJU Int 97 (2): 247-54, 2006. [PUBMED Abstract]
Tratamiento del cáncer de próstata en estadio I
Aspectos generales
El sistema de clasificación TNM (tumor, ganglio linfático y metástasis) del American Joint Committee on Cancer define el cáncer de próstata en estadio I de la siguiente forma:[1]
- cT1a–c, N0, M0, antígeno prostático específico (PSA) <10 ng/ml, Gleason ≤6.
- cT2a, N0, M0, PSA <10 ng/ml, Gleason ≤6.
- pT2, N0, M0, PSA <10 ng/ml, Gleason ≤6.
La frecuencia del cáncer de próstata no metastásico asintomático que se encuentra en la autopsia aumenta bastante con la edad; alcanza a entre el 50 % y el 60 % de los hombres de 90 años y más. Sin lugar a duda, el descubrimiento imprevisto de estos cánceres ocultos durante una cirugía prostática por otro motivo explica que la supervivencia sea similar para los hombres con cáncer de próstata en estadio I y la población masculina sana, ajustada por edad.
Muchos cánceres en estadio I están bien diferenciados el compromiso de la glándula es focal (T1a, N0, M0); la mayoría no exige un tratamiento diferente al seguimiento riguroso.[2]
En los pacientes más jóvenes (50–60 años) que tienen una esperanza de vida prolongada, se debe considerar el tratamiento.[3] La prostatectomía radical, la radioterapia de haz externo (RHE), la colocación de un implante intersticial de radioisótopos, la conducta expectante y la vigilancia activa (seguimiento activo) produjeron tasas de supervivencia similares en series seleccionadas no controladas. La edad, las comorbilidades y los deseos personales son factores para tener en cuenta para decidir si se inicia tratamiento.[3]
Opciones de tratamiento del cáncer de próstata en estadio I
Las opciones de tratamiento de los pacientes con cáncer de próstata en estadio I son las siguientes:
- Conducta expectante o vigilancia activa (seguimiento activo).
- Prostatectomía radical.
- Radioterapia de haz externo.
- Implante intersticial de radioisótopos.
- Ecografía enfocada de alta intensidad (en evaluación clínica).[4-7]
- Terapia fotodinámica (en evaluación clínica).
Conducta expectante o vigilancia activa (seguimiento activo)
Para los pacientes de edad avanzada asintomáticos o que tienen una enfermedad simultánea, se puede considerar un abordaje de observación rigurosa sin administrar un tratamiento activo inmediato.[8-10] La espera cautelosa, la observación, la conducta expectante, la actitud expectante, la vigilancia activa y el seguimiento activo son términos que indican una estrategia sin tratamiento inmediato con intención curativa. Para obtener más información, consultar la sección Conducta expectante o vigilancia activa (seguimiento activo).
Evidencia (observación con terapia hormonal diferida):
- En un análisis retrospectivo conjunto, 828 hombres con cáncer de próstata clínicamente localizado recibieron tratamiento conservador inicial y luego, terapia hormonal en el momento de la progresión sintomática de la enfermedad.
- En este estudio, se observó que los pacientes con tumores de grado 1 o 2 tuvieron una supervivencia específica de la enfermedad del 87 % a los 10 años y que su supervivencia general (SG) se acercó mucho a la supervivencia prevista en hombres de edades similares en la población general.[8]
Prostatectomía radical
La prostatectomía radical, a menudo con linfadenectomía pélvica (con técnica de conservación nerviosa para mantener la potencia, o sin esta), es el tratamiento con intención curativa que se usa con mayor frecuencia.[11-13] La prostatectomía radical quizás sea muy difícil de hacer después de una resección transuretral de la próstata (RTUP).
Debido a que entre el 40 % y el 50 % de los hombres con enfermedad limitada al órgano en el examen clínico tienen diseminación más allá de la cápsula prostática o los márgenes quirúrgicos en el análisis patológico, se estudia la función de la radioterapia adyuvante después la prostatectomía.
También se debe considerar la radioterapia posoperatoria (RTPO) para los pacientes con invasión tumoral de las vesículas seminales que se encuentra en el momento de la prostatectomía o que tienen una concentración detectable del PSA más de 3 semanas después de la cirugía.[14-16] Debido a que la duración del seguimiento en los estudios disponibles todavía es relativamente corta, no se ha determinado el valor de la RTPO, sin embargo, esta sí reduce la recidiva local.[14] Es necesaria la planificación cuidadosa del tratamiento para evitar la morbilidad.
Evidencia (prostatectomía radical seguida de radioterapia):
- En un ensayo aleatorizado de 425 hombres con enfermedad patológica T3, N0, M0, se comparó la RHE posquirúrgica (60–64 Gy dirigidos a la fosa prostática en 30–32 fracciones) y la observación.[15][Nivel de evidencia A1]
- Es posible que se afectara el criterio principal de valoración, la supervivencia sin metástasis, debido al control seriado del PSA y los subsecuentes análisis para determinar si hay metástasis que se hacen cuando se encuentra aumento del PSA. Esto quizás produjo un sesgo a favor de la radioterapia en el análisis del criterio principal de valoración, que se relacionó con una tasa más baja de aumento del PSA. Aun así, la supervivencia sin metástasis no fue estadísticamente diferente entre los 2 grupos del estudio (P = 0,06). Luego de una mediana de seguimiento de alrededor de 10,6 años, la mediana de supervivencia general fue de 14,7 años en el grupo de radioterapia vs. 13,8 años en el grupo de observación (P = 0,16).
- Aunque las tasas de SG no fueron estadísticamente diferentes, las tasas de complicaciones fueron mucho más altas en el grupo de radioterapia: complicaciones generales (23,8 % vs. 11,9 %), complicaciones rectales (3,3 % vs. 0 %) y tasas de estenosis uretral (17,8 % vs. 9,5 %).
- Sin embargo, tras una mediana de seguimiento de alrededor de 12,5 años, la SG fue mejor en el grupo de radioterapia; cociente de riesgos instantáneos (CRI)de muerte 0,72; IC del 95 %, 0,55–0,96; P = 0,23). Las tasas de supervivencia estimadas a 10 años fueron del 74 % en el grupo de radioterapia y del 66 % en el grupo de control. Las tasas de supervivencia sin metástasis estimadas a 10 años fueron del 73 % y el 65 % (P = 0,16).[16][Nivel de evidencia A1]
- En otro ensayo aleatorizado se llegó a una conclusión distinta con respecto al efecto de la radioterapia posoperatoria en la SG.[17][Nivel de evidencia A1] En un ensayo de la European Organisation for Research and Treatment of Cancer (EORTC) (EORTC-22911 [NCT00002511]), participaron 1005 hombres de 75 años o menos con cáncer de próstata en estadios clínicos T0 a T3 sometidos a prostatectomía, ellos se asignaron al azar a RTPO (60 Gy) u observación, y tratamiento posterior diferido hasta la recaída bioquímica o clínica. El tratamiento recomendado para la recidiva local fue la radiación.
- Al cabo de una mediana de seguimiento de 10,6 años (hasta 16,6 años), la tasa de supervivencia sin progresión bioquímica fue más alta en el grupo de observación (60,6 vs 41,1 %; CRI, 0,49, IC 95 %, 0,41–0,59; P < 0,0001). Las tasas de recaída locorregional fueron del 8,4 % vs. 17,3 % a favor de la radiación inmediata (CRI, 0,45; IC 95 %, 0,32–0,68; P < 0,0001).
- Sin embargo, las grandes diferencias en la supervivencia sin recaída bioquímica o recidiva local no se tradujeron en una ventaja en términos de metástasis a distancia (11,0 vs 11,3 %; CRI, 0,99; IC 95 %, 0,67–1,44; P = 0,94) ni para la SG (76,9 % con radiación inmediata vs. 80,7 % con observación; CRI, 1,18; IC 95 %, 0,91–1,53; P = 0,2). Tampoco hubo diferencia en la mortalidad específica por cáncer de próstata (3,9 vs. 5,2 %; CRI, 0,78; IC 95 %, 0,46–1,33; P = 0,34).
- El riesgo acumulado a 10 años de toxicidad tardía grave (grado 3) en el grupo de radiación inmediata fue del 5,3 % vs. el 2,5 % en el grupo de observación (P = 0,52). Los efectos tardíos adversos de cualquier grado también fueron más altos en el grupo de radiación inmediata (70,8 vs. 59,7 %; P = 0,001).
Se comparó la prostatectomía radical con la conducta expectante o la vigilancia activa (seguimiento activo). Para obtener más información, consultar la sección Prostatectomía radical comparada con otras opciones de tratamiento.
Evidencia (prostatectomía radical comparada con conducta expectante):
- El Prostate Intervention Versus Observation Trial (PIVOT-1 o VA-CSP-407 [NCT00007644]) es un ensayo aleatorizado de la época de exámenes de detección con la prueba de PSA en el que se comparó de forma directa la prostatectomía radical y la conducta expectante. De noviembre de 1994 a enero de 2002, se asignó al azar a 731 hombres de 75 años o menos con cáncer de próstata localizado (estadio T1–2, NX, M0, y PSA sanguíneo <50 ng/ml) y una esperanza de vida de por lo menos 10 años a someterse a una prostatectomía radical o a conducta expectante.[18-20][Nivel de evidencia A1]
- Cerca del 50 % de los hombres presentaba enfermedad no palpable, identificada mediante exámenes de detección.
- Después de una mediana de seguimiento de 12,7 años (intervalo hasta cerca de 19,5 años), la mortalidad por cualquier causa fue del 61,3 % en el grupo de prostatectomía vs. el 66,8 % en el grupo de conducta expectante; la diferencia absoluta fue de 5,5 puntos porcentuales (IC 95 %, -1,5–12,4), y no fue estadísticamente significativa (cociente de riesgos instantáneos [CRI], 0,84; IC 95 %, 0,70–1,01). La mortalidad específica por cáncer de próstata fue del 7,4 % vs. el 11,4 %, y tampoco fue estadísticamente significativa (CRI, 0,63; IC 95 %, 0,3–1,02).
- Si bien el grupo de observación recibió con más frecuencia el tratamiento para la progresión de la enfermedad, en la mayoría de los casos fue para la progresión asintomática, local o bioquímica (PSA).
- Según lo previsto, la incontinencia urinaria y la disfunción eréctil o sexual fueron más frecuentes en el grupo de prostatectomía durante por lo menos 10 años de seguimiento. Las diferencias absolutas en el uso de toallas urinarias absorbentes notificado por los pacientes fueron más altas en el grupo de cirugía, con más de 30 puntos porcentuales en todos los momentos de evaluación durante por lo menos 10 años. Las limitaciones en las actividades de la vida diaria relacionadas con la enfermedad o el tratamiento fueron mayores para el grupo de cirugía que para el grupo de observación hasta 2 años después, pero luego fueron similares en ambos grupos de tratamiento.
Radioterapia de haz externo
La radioterapia de haz externo (RHE) es otra opción de tratamiento utilizada con intención curativa.[21-25] La radioterapia definitiva se debe postergar hasta 4 a 6 semanas después de la RTUP para reducir la incidencia de estenosis.[26] Se debe considerar la terapia hormonal adyuvante para los pacientes con tumores voluminosos T2b o T2c.[27,28]
Evidencia (RHE con terapia hormonal adyuvante o sin esta):
- En el ensayo RTOG-7706 del Radiation Therapy Oncology Group (RTOG-7706), la radioterapia profiláctica dirigida a los ganglios linfáticos sin compromiso clínico ni patológico al parecer no mejora la SG ni la supervivencia específica por cáncer de próstata.[29][Nivel de evidencia A1]
- En el ensayo aleatorizado de fase III RTOG-9413 (NCT00769548) se incluyó a 1323 hombres con cáncer de próstata localizado, PSA elevado y riesgo estimado de afectación de los ganglios linfáticos del 15 %. Los pacientes se asignaron al azar a 1 de los 4 grupos de tratamiento: radioterapia pélvica total con terapia hormonal neoadyuvante y concurrente; radioterapia sola dirigida a la próstata con terapia hormonal neoadyuvante y concurrente; radioterapia pélvica total con terapia hormonal adyuvante; o radioterapia sola dirigida a la pelvis con terapia hormonal adyuvante.[30]; [31][Nivel de evidencia B1]
- Las tasas de SG y de recaída del PSA no fueron significativamente diferentes, aunque en el ensayo RTOG-9413 se observó aumento de la SSP a los 4 años para los pacientes con un riesgo estimado del 15 % de compromiso ganglionar que recibieron radioterapia pélvica total en comparación con radioterapia sola dirigida a la próstata.
- En un ensayo aleatorizado, se asignó a 875 hombres con cáncer de próstata no metastásico localmente avanzado (tumores T1b–T2 con diferenciación moderada o pobre, o tumores T3 de cualquier grado) a recibir durante 3 meses un agonista de la hormona liberadora de hormona luteinizante y flutamida a largo plazo (250 mg VO 3 veces al día), con RHE o sin esta.[28][Nivel de evidencia A1]
- Del grupo del estudio, el 19 % tenía un tumor en estadio T2 y el 78 % tenía un tumor en estadio T3. A los 10 años, la mortalidad general (29,6 vs. 39,4 %; IC 95 % para la diferencia, 0,8–18,8 %) y la mortalidad específica por cáncer de próstata (11,9 vs. 23,9 %; IC 95 % para la diferencia, 4,9–19,1 %) favoreció el uso de la combinación de terapia hormonal y radioterapia.
- Aunque la flutamida quizás no se considere una monoterapia hormonal estándar en el entorno de tumores T2 o T3, la radioterapia produjo una supervivencia sin enfermedad o una ventaja de supervivencia específica del tumor incluso cuando se usó esta monoterapia. Este análisis se basa en la suposición de que la flutamida no acorta la esperanza de vida ni la supervivencia específica por cáncer. La radioterapia no se administró de acuerdo con los estándares actuales de dosis y técnica.
Implante intersticial de radioisótopos
La colocación de un implante intersticial de radioisótopos (es decir yodo I 125 [125I], paladio e iridio Ir 192) mediante una técnica transperineal guiada por ecografía o tomografía computarizada se usa para pacientes con tumores T1 o T2a. Los resultados a corto plazo en estos pacientes son similares a los de la prostatectomía radical o la RHE.[32,33]; [34][Nivel de evidencia C3]
Los factores para considerar la utilización de los implantes intersticiales son los siguientes:
- La colocación del implante es una cirugía ambulatoria.
- Se notificaron tasas de conservación de la potencia sexual del 86 % al 92 %.[32,34] Por el contrario, las tasas de mantenimiento de la potencia sexual fueron del 10 % al 40 % con prostatectomía radical y del 40 % al 60 % con RHE.
- Los efectos secundarios característicos de los implantes intersticiales son transitorios, entre ellos, polaquiuria, urgencia miccional y, con menos frecuencia, retención urinaria.
- A veces se produce ulceración rectal. En una serie, se observó una tasa actuarial a 2 años de complicaciones genitourinarias de grado 2 del 10 % y un riesgo de ulceración rectal del 12 %. Este riesgo disminuyó de manera inversa con la experiencia del cirujano y la modificación de la técnica de implantación.[32]
Es necesario un seguimiento a largo plazo de estos pacientes para evaluar la eficacia y los efectos secundarios del tratamiento.
La colocación manual de un implante retropúbico de 125I se relacionó con un aumento de fracaso terapéutico local y tasa de complicaciones; [35,36] en la actualidad este procedimiento es infrecuente.
Terapia fotodinámica
La terapia fotodinámica vascular con un fotosensibilizador se probó en hombres con cáncer de próstata de riesgo bajo. En el ensayo aleatorizado sin anonimato CLIN1001 PCM301 (NCT01310894), se asignó al azar a 413 hombres con cáncer de próstata de riesgo bajo (tumor en estadio T1–T2c, PSA ≤10 ng/ml y, en general, puntaje de Gleason 3 + 3) para someterse a vigilancia activa o recibir un fotosensibilizador, padeliporfina (4 mg/kg intravenosos [IV] durante 10 minutos y fibras ópticas colocadas en el área objetivo de la próstata y activadas con rayo láser de 753 nm a 150 mW/cm durante 22 minutos y 15 segundos).[37] La mediana de tiempo hasta la progresión local de la enfermedad fue de 28,3 meses para los pacientes que recibieron padeliporfina y de 14,1 meses para los pacientes del grupo de vigilancia activa (CRI, 0,34; IC 95 %, 0,24–0,46; P = 0,0001).[37][Nivel de evidencia B1] No obstante, es posible que la población de pacientes aptos para recibir terapia fotodinámica sea muy pequeña de modo que quizás se produce sobretratamiento de hombres con enfermedad de riesgo muy bajo e infratratamiento de hombres con enfermedad de riesgo más alto.[38]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Prostate. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 715–26.
- Consensus conference. The management of clinically localized prostate cancer. JAMA 258 (19): 2727-30, 1987. [PUBMED Abstract]
- Epstein JI, Paull G, Eggleston JC, et al.: Prognosis of untreated stage A1 prostatic carcinoma: a study of 94 cases with extended followup. J Urol 136 (4): 837-9, 1986. [PUBMED Abstract]
- Thüroff S, Chaussy C, Vallancien G, et al.: High-intensity focused ultrasound and localized prostate cancer: efficacy results from the European multicentric study. J Endourol 17 (8): 673-7, 2003. [PUBMED Abstract]
- Blana A, Murat FJ, Walter B, et al.: First analysis of the long-term results with transrectal HIFU in patients with localised prostate cancer. Eur Urol 53 (6): 1194-201, 2008. [PUBMED Abstract]
- Ficarra V, Novara G: Editorial comment on: first analysis of the long-term results with transrectal HIFU in patients with localized prostate cancer. Eur Urol 53 (6): 1201-2, 2008. [PUBMED Abstract]
- Eastham JA: Editorial comment on: first analysis of the long-term results with transrectal HIFU in patients with localized prostate cancer. Eur Urol 53 (6): 1202-3, 2008. [PUBMED Abstract]
- Chodak GW, Thisted RA, Gerber GS, et al.: Results of conservative management of clinically localized prostate cancer. N Engl J Med 330 (4): 242-8, 1994. [PUBMED Abstract]
- Whitmore WF: Expectant management of clinically localized prostatic cancer. Semin Oncol 21 (5): 560-8, 1994. [PUBMED Abstract]
- Shappley WV, Kenfield SA, Kasperzyk JL, et al.: Prospective study of determinants and outcomes of deferred treatment or watchful waiting among men with prostate cancer in a nationwide cohort. J Clin Oncol 27 (30): 4980-5, 2009. [PUBMED Abstract]
- Zincke H, Bergstralh EJ, Blute ML, et al.: Radical prostatectomy for clinically localized prostate cancer: long-term results of 1,143 patients from a single institution. J Clin Oncol 12 (11): 2254-63, 1994. [PUBMED Abstract]
- Catalona WJ, Bigg SW: Nerve-sparing radical prostatectomy: evaluation of results after 250 patients. J Urol 143 (3): 538-43; discussion 544, 1990. [PUBMED Abstract]
- Catalona WJ, Basler JW: Return of erections and urinary continence following nerve sparing radical retropubic prostatectomy. J Urol 150 (3): 905-7, 1993. [PUBMED Abstract]
- Paulson DF, Moul JW, Walther PJ: Radical prostatectomy for clinical stage T1-2N0M0 prostatic adenocarcinoma: long-term results. J Urol 144 (5): 1180-4, 1990. [PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathologically advanced prostate cancer: a randomized clinical trial. JAMA 296 (19): 2329-35, 2006. [PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol 181 (3): 956-62, 2009. [PUBMED Abstract]
- Bolla M, van Poppel H, Collette L, et al.: Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet 366 (9485): 572-8, 2005 Aug 13-19. [PUBMED Abstract]
- Wilt TJ, Brawer MK, Jones KM, et al.: Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 367 (3): 203-13, 2012. [PUBMED Abstract]
- Wilt TJ: The Prostate Cancer Intervention Versus Observation Trial: VA/NCI/AHRQ Cooperative Studies Program #407 (PIVOT): design and baseline results of a randomized controlled trial comparing radical prostatectomy with watchful waiting for men with clinically localized prostate cancer. J Natl Cancer Inst Monogr 2012 (45): 184-90, 2012. [PUBMED Abstract]
- Wilt TJ, Jones KM, Barry MJ, et al.: Follow-up of Prostatectomy versus Observation for Early Prostate Cancer. N Engl J Med 377 (2): 132-142, 2017. [PUBMED Abstract]
- Bagshaw MA: External radiation therapy of carcinoma of the prostate. Cancer 45 (7 Suppl): 1912-21, 1980. [PUBMED Abstract]
- Forman JD, Zinreich E, Lee DJ, et al.: Improving the therapeutic ratio of external beam irradiation for carcinoma of the prostate. Int J Radiat Oncol Biol Phys 11 (12): 2073-80, 1985. [PUBMED Abstract]
- Ploysongsang S, Aron BS, Shehata WM, et al.: Comparison of whole pelvis versus small-field radiation therapy for carcinoma of prostate. Urology 27 (1): 10-6, 1986. [PUBMED Abstract]
- Pilepich MV, Bagshaw MA, Asbell SO, et al.: Definitive radiotherapy in resectable (stage A2 and B) carcinoma of the prostate--results of a nationwide overview. Int J Radiat Oncol Biol Phys 13 (5): 659-63, 1987. [PUBMED Abstract]
- Amdur RJ, Parsons JT, Fitzgerald LT, et al.: The effect of overall treatment time on local control in patients with adenocarcinoma of the prostate treated with radiation therapy. Int J Radiat Oncol Biol Phys 19 (6): 1377-82, 1990. [PUBMED Abstract]
- Seymore CH, el-Mahdi AM, Schellhammer PF: The effect of prior transurethral resection of the prostate on post radiation urethral strictures and bladder neck contractures. Int J Radiat Oncol Biol Phys 12 (9): 1597-600, 1986. [PUBMED Abstract]
- Seidenfeld J, Samson DJ, Aronson N, et al.: Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer. Evid Rep Technol Assess (Summ) (4): i-x, 1-246, I1-36, passim, 1999. [PUBMED Abstract]
- Widmark A, Klepp O, Solberg A, et al.: Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial. Lancet 373 (9660): 301-8, 2009. [PUBMED Abstract]
- Asbell SO, Martz KL, Shin KH, et al.: Impact of surgical staging in evaluating the radiotherapeutic outcome in RTOG #77-06, a phase III study for T1BN0M0 (A2) and T2N0M0 (B) prostate carcinoma. Int J Radiat Oncol Biol Phys 40 (4): 769-82, 1998. [PUBMED Abstract]
- Roach M, DeSilvio M, Lawton C, et al.: Phase III trial comparing whole-pelvic versus prostate-only radiotherapy and neoadjuvant versus adjuvant combined androgen suppression: Radiation Therapy Oncology Group 9413. J Clin Oncol 21 (10): 1904-11, 2003. [PUBMED Abstract]
- Pollack A: A call for more with a desire for less: pelvic radiotherapy with androgen deprivation in the treatment of prostate cancer. J Clin Oncol 21 (10): 1899-901, 2003. [PUBMED Abstract]
- Wallner K, Roy J, Harrison L: Tumor control and morbidity following transperineal iodine 125 implantation for stage T1/T2 prostatic carcinoma. J Clin Oncol 14 (2): 449-53, 1996. [PUBMED Abstract]
- D'Amico AV, Coleman CN: Role of interstitial radiotherapy in the management of clinically organ-confined prostate cancer: the jury is still out. J Clin Oncol 14 (1): 304-15, 1996. [PUBMED Abstract]
- Ragde H, Blasko JC, Grimm PD, et al.: Interstitial iodine-125 radiation without adjuvant therapy in the treatment of clinically localized prostate carcinoma. Cancer 80 (3): 442-53, 1997. [PUBMED Abstract]
- Kuban DA, el-Mahdi AM, Schellhammer PF: I-125 interstitial implantation for prostate cancer. What have we learned 10 years later? Cancer 63 (12): 2415-20, 1989. [PUBMED Abstract]
- Fuks Z, Leibel SA, Wallner KE, et al.: The effect of local control on metastatic dissemination in carcinoma of the prostate: long-term results in patients treated with 125I implantation. Int J Radiat Oncol Biol Phys 21 (3): 537-47, 1991. [PUBMED Abstract]
- Azzouzi AR, Vincendeau S, Barret E, et al.: Padeliporfin vascular-targeted photodynamic therapy versus active surveillance in men with low-risk prostate cancer (CLIN1001 PCM301): an open-label, phase 3, randomised controlled trial. Lancet Oncol 18 (2): 181-191, 2017. [PUBMED Abstract]
- Freedland SJ: Low-risk prostate cancer: to treat or not to treat. Lancet Oncol 18 (2): 156-157, 2017. [PUBMED Abstract]
Tratamiento del cáncer de próstata en estadio II
Aspectos generales
El sistema de clasificación TNM (tumor, ganglio linfático y metástasis) del American Joint Committee on Cancer define el cáncer de próstata en estadio II de la siguiente forma:[1]
Estadio IIA
- cT1a–c, N0, M0, antígeno prostático específico (PSA) ≥10 <20 ng/ml, Gleason ≤6.
- cT2a, N0, M0, PSA ≥10 <20 ng/ml, Gleason ≤6.
- pT2, N0, M0, PSA ≥10 <20 ng/ml, Gleason ≤6.
- cT2b–c, N0, M0, PSA <20 ng/ml, Gleason ≤6.
Estadio IIB
- T1–2, N0, M0, PSA <20 ng/ml, Gleason 7.
Estadio IIC
- T1–2, N0, M0, PSA <20 ng/ml, Gleason 7 y 8.
La prostatectomía, la radioterapia de haz externo (RHE) y el implante intersticial de radioisótopos se emplean para el tratamiento del cáncer de próstata en estadio II, en apariencia con efectos terapéuticos similares. La prostatectomía radical y la radioterapia producen tasas de supervivencia similares después de un período máximo de 10 años de seguimiento. Para pacientes bien seleccionados, la prostatectomía radical se relaciona con una supervivencia a 15 años comparable con la una población de la misma edad sin cáncer de próstata.[2] Por desgracia, no hay de ensayos aleatorizados comparativos de seguimiento prolongado para estos métodos de tratamiento.
Los pacientes con un cáncer pequeño palpable (T2a, N0 y M0) tienen mejor pronóstico que los pacientes con compromiso de ambos lados de la glándula prostática (T2c, N0 y M0). Los pacientes sin metástasis ganglionares en la linfadenectomía pélvica tienen un pronóstico más favorable que los pacientes que no se someten a procedimiento de estadificación; sin embargo, esto es consecuencia de la selección de pacientes con un pronóstico más favorable.
Se deben considerar los efectos secundarios de las diversas formas de tratamiento, como impotencia, incontinencia y lesión intestinal, para determinar el tipo de tratamiento.
El antígeno prostático específico cambia como lo hacen los marcadores de progresión tumoral
A menudo, se piensa que los cambios en el antígeno prostático específico (PSA) indican una progresión tumoral. A pesar de que un marcador o característica tumoral siempre se relacionen con un riesgo alto de progresión del cáncer de próstata o de muerte, estos quizás no sirvan como factores pronósticos y tengan una utilidad muy limitada para la toma de decisiones terapéuticas.
El valor inicial y la tasa de cambio del PSA se relacionaron con metástasis posterior o muerte por cáncer de próstata en una cohorte de 267 hombres con cáncer de próstata clínicamente localizado sometidos a conducta expectante o vigilancia activa en el grupo de control de un ensayo aleatorizado en el que se comparó la prostatectomía radical con la conducta expectante.[3,4] A pesar de ello, la exactitud para clasificar a los hombres en un grupo de cáncer inactivo y otro grupo de cáncer progresivo fue deficiente para todos los valores de corte y las tasas de cambio del PSA analizados.
Bisfosfonatos y riesgo de metástasis óseas
Los pacientes con enfermedad no metastásica localmente avanzada (T2–T4, N0–N1 y M0) están en riesgo de metástasis óseas. Los bisfosfonatos están en estudio como estrategia para disminuir este riesgo.
Evidencia (bisfosfonatos y riesgo de metástasis óseas):
- En un ensayo aleatorizado controlado con placebo (MRC-PR04) se evaluó un régimen de 5 años de tratamiento con el bisfosfonato de primera generación clodronato en dosis altas por vía oral (2080 mg diarios). No se encontró un efecto favorable de la terapia con clodronato en la supervivencia ni en el tiempo transcurrido hasta que se presentara una metástasis ósea sintomática.[5][Nivel de evidencia A1]
Opciones de tratamiento del cáncer de próstata en estadio II
Las opciones de tratamiento de los pacientes con cáncer de próstata en estadio II son las siguientes:
- Conducta expectante o vigilancia activa (seguimiento activo).
- Prostatectomía radical.
- Radioterapia de haz externo, con terapia hormonal o sin esta.
- Implante intersticial de radioisótopos.
- Criocirugía percutánea guiada por ecografía (en evaluación clínica).
- Ecografía enfocada de alta intensidad (en evaluación clínica).
- Radioterapia con haz de protones (en evaluación clínica).
- Terapia fotodinámica (en evaluación clínica).
Los pacientes con cáncer de próstata en estadio II son candidatos aptos para participar en ensayos clínicos, incluso en los que se investiga la terapia hormonal neoadyuvante seguida por una prostatectomía radical.
Conducta expectante o vigilancia activa (seguimiento activo)
Para los pacientes de edad avanzada asintomáticos o que tienen una enfermedad simultánea, se puede considerar un abordaje de observación rigurosa sin administrar un tratamiento activo inmediato.[6-8] La espera cautelosa, la observación, la conducta expectante, la actitud expectante, la vigilancia activa y el seguimiento activo son términos que indican una estrategia en la que no se utiliza un tratamiento inmediato con intención curativa. Para obtener más información, consultar la sección Aspectos generales de las opciones de tratamiento del cáncer de próstata.
Evidencia (observación con terapia hormonal diferida):
- En un análisis retrospectivo conjunto, 828 hombres con cáncer de próstata clínicamente localizado recibieron tratamiento conservador inicial y luego, terapia hormonal en el momento de la progresión sintomática de la enfermedad.[6]
- Los pacientes con tumores con diferenciación buena o moderada tuvieron una supervivencia específica de la enfermedad del 87 % a los 10 años. La supervivencia general (SG) se acercó mucho a la supervivencia prevista en hombres de edades similares en la población general.
- La edad, las comorbilidades y los deseos personales son factores para tener en cuenta para decidir si se inicia tratamiento.
Prostatectomía radical
La prostatectomía radical, a menudo con linfadenectomía pélvica (con técnica de conservación nerviosa para mantener la potencia, o sin esta), es el tratamiento con intención curativa que se usa con mayor frecuencia.[2,9,10] La prostatectomía radical quizás sea muy difícil de hacer después de una resección transuretral de la próstata (RTUP).
Debido a que entre el 40 % y el 50 % de los hombres con enfermedad limitada al órgano en el examen clínico tienen diseminación más allá de la cápsula prostática o los márgenes quirúrgicos en el análisis patológico, se estudia la función de la radioterapia adyuvante después la prostatectomía.
También se debe considerar la radioterapia posoperatoria (RTPO) para los pacientes con invasión tumoral de las vesículas seminales que se encuentra en el momento de la prostatectomía o que tienen una concentración detectable del PSA más de 3 semanas después de la cirugía.[11-13] Debido a que la duración del seguimiento en los estudios disponibles todavía es relativamente corta, no se ha determinado el valor de la RTPO, sin embargo, esta sí reduce la recidiva local.[11] Es necesaria la planificación cuidadosa del tratamiento para evitar la morbilidad.
Evidencia (prostatectomía radical seguida de radioterapia):
- En un ensayo aleatorizado de 425 hombres con enfermedad patológica T3, N0, M0, se comparó la RHE posquirúrgica (60–64 Gy dirigidos a la fosa prostática en 30–32 fracciones) y la observación.[12][Nivel de evidencia A1]
- Es posible que el criterio principal de valoración, la supervivencia sin metástasis, se afectara debido al control seriado del PSA y los subsecuentes análisis para determinar si hay metástasis que se hacen cuando se encuentra aumento del PSA. Esto quizás produjo un sesgo a favor de la radioterapia en el análisis del criterio principal de valoración, que se relacionó con una tasa más baja de aumento del PSA. Aun así, la supervivencia sin metástasis no fue estadísticamente diferente entre los dos grupos del estudio (P = 0,06). Luego de una mediana de seguimiento de alrededor de 10,6 años, la mediana de supervivencia general fue de 14,7 años en el grupo de radioterapia vs. 13,8 años en el grupo de observación (P = 0,16).
- Aunque las tasas de SG no fueron estadísticamente diferentes, las tasas de complicaciones fueron mucho más altas en el grupo de radioterapia en comparación con el grupo de observación: complicaciones generales (23,8 vs. 11,9 %), complicaciones rectales (3,3 vs. 0 %) y tasas de estenosis uretral (17,8 vs. 9,5 %).
- Sin embargo, tras una mediana de seguimiento de alrededor de 12,5 años, la SG fue mejor en el grupo de radioterapia; cociente de riesgos instantáneos (CRI)de muerte 0,72; IC del 95 %, 0,55–0,96; P = 0,23). Las tasas de supervivencia estimadas a 10 años fueron del 74 % en el grupo de radioterapia y del 66 % en el grupo de control. Las tasas de supervivencia sin metástasis estimadas a 10 años fueron del 73 % y el 65 % (P = 0,16).[13][Nivel de evidencia A1]
Evidencia (comparación directa entre la prostatectomía radical, la conducta expectante, la vigilancia activa (seguimiento activo) y la radioterapia de haz externo):
- En un ensayo clínico aleatorizado realizado en Suecia en la época anterior a los exámenes de detección con la prueba de PSA, se asignó al azar a 695 hombres con cáncer de próstata a someterse a prostatectomía radical vs. conducta expectante. El diagnóstico se determinó a partir de la detección con la prueba de PSA en solo el 5 % de los hombres del ensayo. Por lo tanto, estos hombres tenían una enfermedad local más extensa que lo característico para los casos de diagnóstico de cáncer de próstata en los Estados Unidos.[14-16]
- La mortalidad general acumulada a los 18 años fue del 46,1 % en el grupo de prostatectomía radical y del 52,7 % en el grupo de conducta expectante (diferencia absoluta, 12,7 %; intervalo de confianza [IC] 95 %, 5,1–20,3 puntos porcentuales; riesgo relativo [RR]de muerte 0,71; IC 95 %, 0,59–0,86).[16][Nivel de evidencia A1]
- La incidencia acumulada de mortalidad por cáncer de próstata a los 18 años fue del 17,7 % versus el 28,7 % (diferencia absoluta, 11,0 %; IC 95 %, 4,5–17,5 puntos porcentuales; RRde muerte por cáncer de próstata, 0,56; IC 95 %, 0,41–0,77).[16]
- En un análisis de subconjunto posterior, la mejoría en la mortalidad general y específica por cáncer de próstata relacionada con una prostatectomía radical se restringió a hombres menores de 65 años.
- El Prostate Intervention Versus Observation Trial (PIVOT-1 o VA-CSP-407) es un ensayo aleatorizado que se condujo en la era de exámenes de detección con la prueba de PSA en el que se comparaba de manera directa la prostatectomía radical y la conducta expectante. De noviembre de 1994 a enero de 2002, se asignó al azar a 731 hombres de 75 años o menos con cáncer de próstata localizado (estadio T1–2, NX, M0, y PSA sanguíneo <50 ng/ml) y una esperanza de vida de por lo menos 10 años a someterse a una prostatectomía radical o a conducta expectante.[17-19][Nivel de evidencia A1]
- Cerca del 50 % de los hombres tenían tumores palpables.
- Después de una mediana de seguimiento de 12,7 años (intervalo hasta cerca de 19,5 años), la mortalidad por cualquier causa fue del 61,3 % en el grupo de prostatectomía radical vs. el 66,8 % en el grupo de conducta expectante; la diferencia absoluta fue de 5,5 puntos porcentuales (IC 95 %, -1,5–12,4), y no fue estadísticamente significativa (cociente de riesgos instantáneos [CRI], 0,84; IC 95 %, 0,70–1,01). La mortalidad específica por cáncer de próstata fue del 7,4 % vs. el 11,4 %, y tampoco fue estadísticamente significativa (CRI, 0,63; IC 95 %, 0,3–1,02).
- Si bien el grupo de observación recibió de manera más frecuente tratamiento para la progresión de la enfermedad, en su mayoría fue para un progresión asintomática, local o bioquímica (PSA).
- Según lo previsto, la incontinencia urinaria y la disfunción eréctil o sexual fueron más frecuentes en el grupo de prostatectomía durante por lo menos 10 años de seguimiento. Las diferencias absolutas en el uso de toallas urinarias absorbentes notificado por los pacientes fueron más altas en el grupo de cirugía, con más de 30 puntos porcentuales en todos los momentos de evaluación durante por lo menos 10 años. Las limitaciones en las actividades de la vida diaria relacionadas con la enfermedad o el tratamiento fueron mayores para el grupo de cirugía que para el grupo de observación hasta 2 años después, pero luego fueron similares en ambos grupos de tratamiento.
- En el ensayo ProtecT (NCT02044172 y ISRCTN20141297), 82 429 hombres se sometieron a la prueba de PSA, y luego se diagnosticó cáncer de próstata clínicamente localizado a 2664 hombres. Entre los diagnosticados, 1643 (mediana de edad de 62 años, intervalo de 50 a 69 años) otorgaron consentimiento para una asignación al azar a grupos de comparación de seguimiento activo, prostatectomía radical (con conservación nerviosa, en lo posible) y radioterapia de haz externo conformada 3D (74 Gy en 37 fracciones). El criterio principal de valoración fue la mortalidad específica por cáncer de próstata.[20]
- Tras una mediana de seguimiento de 10 años, hubo 17 muertes por cáncer de próstata, sin diferencias estadísticamente significativas entre los 3 grupos del estudio (P = 0,48). Las tasas de supervivencia específica del cáncer de próstata a 10 años fueron del 98,8 % en el grupo de vigilancia activa, el 99,0 % en el grupo de prostatectomía radical y el 99,6 % en el grupo de radioterapia.[20][Nivel de evidencia A1]
- Del mismo modo, la tasa de mortalidad por cualquier causa fue casi idéntica en los 3 grupos del estudio: 10,9 muertes en el grupo de vigilancia activa, 10,1 en el grupo de prostatectomía radical y 10,3 en el grupo de radioterapia por 1000 años-persona (P = 0,87).[20][Nivel de evidencia A1]
- Hubo diferencias estadísticamente significativas en la progresión a enfermedad metastásica en los grupos de tratamiento (33 de los 545 hombres en el grupo de vigilancia activa; 13 de los 553 hombres en el grupo de prostatectomía radical; 16 de los 515 hombres en el grupo de radioterapia) que empezaron a emerger después de 4 años, pero estas diferencias no se tradujeron en diferencias en la mortalidad después de 10 años de seguimiento. A lo largo de los 10 años, el 52 % de los pacientes necesitaron algún tipo de intervención activa.
- Como se esperaba, hubo diferencias considerables en los desenlaces notificados por los pacientes entre los 3 abordajes terapéuticos.[21][Nivel de evidencia A3] En un estudio secundario sobre los desenlaces notificados por los pacientes hasta 6 años después de la aleatorización se revelaron los siguientes datos:
- Los hombres en el grupo de prostatectomía radical presentaron tasas considerables de incontinencia urinaria (por ejemplo, el 46 % notificaron el uso de una o más toallas absorbentes al día a los 6 meses y el 17 % a los 6 años); en los otros 2 grupos del estudio se notificaron muy pocos casos de incontinencia urinaria.
- El funcionamiento sexual también fue peor en el grupo de prostatectomía radical (por ejemplo, a los 6 meses, el 12 % de los hombres notificaron tener erecciones firmes para el coito, en comparación con el 22 % en el grupo de radioterapia y el 52 % en el grupo de vigilancia activa).
- El funcionamiento intestinal, sin embargo, fue peor en el grupo de radioterapia (por ejemplo, alrededor del 5 % notificó heces sanguinolentas al menos la mitad del tiempo a partir de los 2 años; esto no se notificó en el grupo de prostatectomía radical ni en el grupo de vigilancia activa).
Radioterapia de haz externo con terapia hormonal o sin esta
La radioterapia de haz externo (RHE) es otra opción de tratamiento que se usa a menudo con intención curativa.[22-26] La radioterapia definitiva se debe postergar hasta 4 a 6 semanas después de la RTUP para reducir la incidencia de estenosis.[27] Se debe considerar la terapia hormonal adyuvante para los pacientes con tumores voluminosos T2b o T2c.[28]
La Agency for Health Care Policy and Research (ahora Agency for Healthcare Research and Quality) analizó la función de la terapia hormonal adyuvante en pacientes con enfermedad localmente avanzada. La mayoría de los pacientes tenían una enfermedad más avanzada, pero los pacientes con tumores voluminosos T2b a T2c se incluyeron en los estudios en los que se reevaluó la utilidad de la terapia hormonal adyuvante en pacientes con enfermedad localmente avanzada.
Evidencia (RHE, con terapia hormonal adyuvante o sin esta):
- Ensayo 7706 del Radiation Therapy Oncology Group (RTOG) (RTOG-7706).[29][Nivel de evidencia A1]
- La radioterapia profiláctica dirigida a los ganglios linfáticos sin compromiso clínico ni patológico al parecer no mejora la SG ni la supervivencia específica por cáncer de próstata.
- Ensayo RTOG-9413 (RTOG-9413 [NCT00769548]).[30,31][Nivel de evidencia B1]
- Las tasas de SG y de recaída del PSA no fueron significativamente diferentes, aunque en el ensayo RTOG-9413 se observó aumento de la SSP a los 4 años para los pacientes con un riesgo estimado del 15 % de compromiso ganglionar que recibieron radioterapia pélvica total en comparación con radioterapia sola dirigida a la próstata.
- En un ensayo aleatorizado, se asignó a 875 hombres con cáncer de próstata no metastásico localmente avanzado (tumores T1b–T2 con diferenciación moderada o pobre, o tumores T3 de cualquier grado) a recibir durante 3 meses un agonista de la hormona liberadora de hormona luteinizante y flutamida a largo plazo (250 mg VO 3 veces al día), con RHE o sin esta.[32][Nivel de evidencia A1]
- Del grupo del estudio, el 19 % tenía un tumor en estadio T2 y el 78 % tenía un tumor en estadio T3. A los 10 años, tanto la mortalidad general (29,6 vs. 39,4 %; IC 95 % para la diferencia, 0,8–18,8 %) como la mortalidad específica por cáncer de próstata (11,9 vs. 23,9 %; IC 95 % para la diferencia, 4,9 –19,1 %) favorecieron la combinación de terapia hormonal y radioterapia.
- Aunque la flutamida quizás no se considere una monoterapia hormonal estándar en el entorno de tumores T2 o T3, la radioterapia produjo una supervivencia sin enfermedad o una ventaja de supervivencia específica del tumor incluso cuando se usó esta monoterapia. Este análisis se basa en la suposición de que la flutamida no acorta la esperanza de vida ni la supervivencia específica por cáncer. La radioterapia no se administró de acuerdo con los estándares actuales de dosis y técnica.
- En otro ensayo se comparó la terapia de privación androgénica (TPA, un agonista de la LH-RH u orquiectomía) y la TPA con radioterapia (65–69 Gy dirigidos a la próstata con una técnica de caja de 4 campos, incluso 45 Gy dirigidos a toda la pelvis, las vesículas seminales y los ganglios ilíacos externos o internos, a menos que el resultado del análisis histológico de los ganglios linfáticos fuera negativo). En este ensayo, NCIC (CTG PR.3/MRC UKPRO7 [NCT00002633]) del National Cancer Institute of Canada, se asignó al azar a 1205 pacientes de riesgo alto (PSA >40 ng/ml o PSA >20 ng/ml y puntaje de Gleason ≥8), T2 (12–13 % de los pacientes), T3 (83 % de los pacientes) y T4 (4–5 % de los pacientes) con enfermedad en estadios clínicos o patológico N0, M0.[33,34][Nivel de evidencia A1]
- En el momento de una mediana de seguimiento de 8 años (máximo, 13 años), la SG fue superior en el grupo de TPA y radioterapia (CRIde muerte 0,77; IC 95 %, 0,57–0,85; P = 0,001). La tasa de SG a los 10 años fue del 55 % para el grupo de TPA y radioterapia versus el 49 % para el grupo de TPA sola.
- Aunque la radioterapia produjo los efectos secundarios intestinales y urinarios previstos, la calidad de vida fue la misma en todos los grupos de estudio a los 24 meses y en adelante.[35]
- Se publicó un metanálisis de la evidencia de ensayos clínicos aleatorizados en el que se comparó la radioterapia sola y la radioterapia con privación androgénica prolongada. En el metanálisis se encontró una diferencia en la SG a 5 años a favor de la radioterapia con privación androgénica continua (un agonista de la LH-RH u orquiectomía) en comparación con la radioterapia sola (CRI, 0,631; IC 95 %, 0,479–0,831).[28][Nivel de evidencia A1]
- En un ensayo aleatorizado prospectivo, el tratamiento de privación androgénica con un agonista LH-RH durante 18 meses y 36 meses produjo resultados similares de SG y supervivencia específica de la enfermedad.[36][Nivel de evidencia A1] En un ensayo multicéntrico, 630 hombres con cáncer en estadios II a IVA (estadio clínico T3–T4, PSA >20 ng/ml o puntaje de Gleason >7) recibieron 70 Gy de radiación en 35 fracciones además de 18 o 36 meses acetato de goserelina.
- Al cabo de una mediana de seguimiento de 9,4 años, la SG fue casi idéntica en ambos grupos del estudio (62 % a los 10 años; CRIde muerte, 1,02; IC 95 %, 0,81–1,29; P = 0,8), al igual que la supervivencia específica del cáncer de próstata (CRIde muerte por cáncer de próstata, 0,95; IC 95 %, 0,58–0,55; P = 0,8).
- La calidad de vida general fue casi idéntica en ambos grupos del estudio, pero la actividad sexual y el interés sexual fue un poco mejor en el grupo de 18 meses.[36][Nivel de evidencia A3]
- En un metanálisis de 7 ensayos controlados aleatorizados de comparación de la terapia hormonal temprana (adyuvante o neoadyuvante) y la terapia hormonal diferida (agonista de la LH-RH o antiandrógenos) en pacientes con cáncer de próstata localmente avanzado tratados con prostatectomía, radioterapia, conducta expectante o vigilancia activa (seguimiento activo), se observó una mejora de la mortalidad general para los pacientes que recibieron tratamiento temprano (riesgo relativo, 0,86; IC 95 %; 0,82–0,91).[37][Nivel de evidencia A1]
- Se observó que la terapia androgénica neoadyuvante de corto plazo administrada antes y durante la radioterapia produjo un beneficio en por lo menos algunos pacientes de cáncer de próstata clínicamente localizado. En un ensayo aleatorizado sin anonimato (RTOG-9408 [NCT00002597]), 1979 hombres con tumores no metastásicos en estadios T1b–c, T2a o T2b y una concentración del PSA de 20 ng/ml o menor, se asignaron al azar a recibir radioterapia (dosis de 66,6 Gy dirigida a la próstata en fracciones diarias de 1,8 Gy) sin TPA, o radioterapia con 4 meses de TPA desde 2 meses antes de la radioterapia (flutamida, 250 mg VO 3 veces al día, y goserelina, 3,6 mg vía subcutánea [SC] mensual o leuprolida, 7,5 mg intramuscular). La mediana de seguimiento fue de 9 años.[38][Nivel de evidencia A1]
- La tasa de SG a los 10 años fue del 57 % en el grupo de radiación sola y del 62 % en el grupo de terapia combinada (CRIde muerte 1,17; IC 95 %, 1,01–1,35; P = 0,03).
- En un análisis posterior, no hubo una interacción estadísticamente significativa entre el efecto del tratamiento y la categoría inicial de riesgo de los pacientes. Sin embargo, se encontró un beneficio escaso o casi nulo del tratamiento combinado para los pacientes en la categoría de riesgo más bajo (puntaje de Gleason ≤6, PSA ≤10 ng/ml y estadio clínico ≤T2a).
- El beneficio en la SG fue más evidente para los hombres con tumores de riesgo intermedio (puntaje de Gleason 7; puntaje de Gleason ≤6 y PSA >10 ng/ml; o estadio clínico T2b).
- En un ensayo aleatorizado (TROG 96.01 [ACTRN12607000237482]), se evaluó la duración de la terapia hormonal neoadyuvante en 818 hombres con cáncer no metastásico localmente avanzado (T2b, T2c, T3 y T4) tratados con radioterapia (es decir, 66 Gy en fracciones diarias de 2 Gy dirigidos a la próstata y las vesículas seminales, pero sin incluir los ganglios linfáticos regionales).[39] En el marco de un diseño sin anonimato, los pacientes se asignaron al azar a recibir radioterapia sola, 3 meses de terapia de privación androgénica neoadyuvante (TPAN) (goserelina, 3,6 mg SC mensual y flutamida, 250 mg VO 3 veces al día) comenzando 2 meses antes de la radioterapia, o 6 meses de TPAN comenzando 5 meses antes de la radioterapia.[39][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 10,6 años, no hubo diferencias estadísticamente significativas entre el grupo de radiación sola y el grupo de radiación con 3 meses de TPAN.
- Sin embargo, en el grupo de 6 meses de TPAN la mortalidad específica por cáncer de próstata y la mortalidad por cualquier causa fueron mejores que en el grupo de radiación sola; la mortalidad por cualquier causa a 10 años fue del 29,2 % vs. el 42,5 % (CRI, 0,63; IC 95 %, 0,48–0,83; P = 0,0008).
- En otro ensayo (RTOG-9910 [NCT00005044]) se puso a prueba la duración de la terapia hormonal neoadyuvante. En este ensayo participaron 1489 hombres aptos con cáncer de próstata de riesgo intermedio (T1b–4, puntaje de Gleason 2–6 y PSA >10, pero ≤100 ng/ml; T1b–4, puntaje de Gleason 7 y PSA <20; o T1b–1c, puntaje de Gleason 8–10 y PSA <20) y sin indicios de metástasis. Los hombres se asignaron al azar a recibir un ciclo corto de privación androgénica neoadyuvante (un agonista de la LH-RH y bicalutamida o flutamida durante 8 semanas antes de la radioterapia y 8 semanas durante la radioterapia) o un ciclo prolongado de privación androgénica neoadyuvante (28 semanas antes de la radioterapia y 8 semanas durante la radioterapia). Ambos grupos recibieron 70,2 Gy de radiación dirigida a la próstata en 39 fracciones diarias y 46,8 Gy dirigidos a los ganglios linfáticos ilíacos.[40][Nivel de evidencia A1]
- Después de una mediana de 9,4 años, la mortalidad específica por cáncer de próstata a 10 años, que fue el criterio principal de valoración, fue baja en ambos grupos del estudio: el 5 % versus el 4 % (CRI, 0,81; IC 95 %, 0,48–1,39).[40][Nivel de evidencia A1]
- No se encontraron diferencias estadísticamente significativas en la mortalidad general o en la progresión locorregional de la enfermedad.[40][Nivel de evidencia A1]
- Tampoco hubo un efecto diferencial evidente de la duración de la privación androgénica en ninguno de los subconjuntos de grupos de riesgo.
- La adición de la terapia de privación androgénica a la RHE puede beneficiar a los hombres con riesgo elevado de recidiva de la enfermedad y de muerte por cáncer de próstata (RTOG-9202 [NCT00767286]).
Implante intersticial de radioisótopos
La colocación de un implante intersticial de radioisótopos (es decir yodo I 125 [125I], paladio e iridio) mediante una técnica transperineal guiada por ecografía o tomografía computarizada, se utiliza en pacientes con tumores T1 o T2a. Los resultados a corto plazo en estos pacientes son similares a los de la prostatectomía radical o la RHE.[41,42]; [43][Nivel de evidencia C3]
Los factores para considerar la utilización de los implantes intersticiales son los siguientes:
- La colocación del implante es una cirugía ambulatoria.
- Se notificaron tasas de conservación de la potencia sexual del 86 % al 92 %.[41,43] Por el contrario, las tasas de mantenimiento de la potencia sexual fueron del 10 % al 40 % con prostatectomía radical y del 40 % al 60 % con RHE.
- Los efectos secundarios característicos de los implantes intersticiales son transitorios, entre ellos, polaquiuria, urgencia miccional y, con menos frecuencia, retención urinaria.
- A veces se produce ulceración rectal.[41] En una serie, se observó una tasa actuarial a 2 años de complicaciones genitourinarias de grado 2 del 10 % y un riesgo de ulceración rectal del 12 %. Este riesgo disminuyó de manera inversa con la experiencia del cirujano y la modificación de la técnica de implantación.[44]
Es necesario un seguimiento a largo plazo de estos pacientes para evaluar la eficacia y los efectos secundarios del tratamiento.
La colocación manual de un implante retropúbico de 125I se relacionó con un aumento de fracaso terapéutico local y tasa de complicaciones; [44,45] en la actualidad este procedimiento es infrecuente.
Criocirugía percutánea guiada por ecografía
La criocirugía es una técnica quirúrgica que permite destruir las células cancerosas en el tejido prostático mediante el uso de criosondas que producen congelación y descongelación intermitentes.[46][Nivel de evidencia C1]; [47,48][Nivel de evidencia C3] El uso de criocirugía está menos arraigado que la prostatectomía estándar y sus resultados a largo plazo no se han establecido tan bien como los de la prostatectomía o la radioterapia. Los efectos tóxicos graves son los siguientes:
- Lesión infravesical.
- Incontinencia urinaria.
- Impotencia sexual.
- Lesión rectal.
La frecuencia de otros efectos secundarios y la probabilidad de control del cáncer a los 5 años de seguimiento varían en los centros notificadores; las series son pequeñas en comparación con las series de cirugía y radioterapia.[47,48]
Ecografía enfocada de alta intensidad
En series de casos se notificó que el uso de la ecografía enfocada de alta intensidad produce buen control local de la enfermedad. Sin embargo, no se comparó de manera directa con tratamiento más estándar, y la experiencia con esta técnica es más limitada.[49-51]
Radioterapia con haz de protones
Hay un interés creciente en el uso de la radioterapia con haz de protones para el tratamiento del cáncer de próstata. Aunque la distribución de la dosis de esta forma de radiación de partículas cargadas tiene el potencial de mejorar el cociente terapéutico de radiación dirigida a la próstata, lo que permite un aumento de la dosis para el tumor sin un aumento importante de efectos secundarios, no se han notificado ensayos controlados aleatorizados que comparen su eficacia y toxicidad con otras formas de radioterapia.
Terapia fotodinámica
La terapia fotodinámica vascular con un fotosensibilizador se probó en hombres con cáncer de próstata de riesgo bajo. En el ensayo aleatorizado sin anonimato CLIN1001 PCM301 (NCT01310894), se asignó al azar a 413 hombres con cáncer de próstata de riesgo bajo (tumor en estadio T1–T2c, PSA ≤10 ng/ml y, en general, puntaje de Gleason 3 + 3) para someterse a vigilancia activa o recibir un fotosensibilizador, padeliporfina (4 mg/kg intravenosos [IV] durante 10 minutos y fibras ópticas colocadas en el área objetivo de la próstata y activadas con rayo láser de 753 nm a 150 mW/cm durante 22 minutos y 15 segundos).[52] La mediana de tiempo hasta la progresión local de la enfermedad fue de 28,3 meses para los pacientes que recibieron padeliporfina y de 14,1 meses para los pacientes asignados al grupo de vigilancia activa (CRI, 0,34; IC 95 %, 0,24–0,46; P = 0,0001).[52][Nivel de evidencia B1] No obstante, es posible que la población de pacientes aptos para recibir terapia fotodinámica sea muy pequeña de modo que quizás se produce sobretratamiento de hombres con enfermedad de riesgo muy bajo e infratratamiento de hombres con enfermedad de riesgo más alto.[53]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Prostate. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 715–26.
- Zincke H, Bergstralh EJ, Blute ML, et al.: Radical prostatectomy for clinically localized prostate cancer: long-term results of 1,143 patients from a single institution. J Clin Oncol 12 (11): 2254-63, 1994. [PUBMED Abstract]
- Fall K, Garmo H, Andrén O, et al.: Prostate-specific antigen levels as a predictor of lethal prostate cancer. J Natl Cancer Inst 99 (7): 526-32, 2007. [PUBMED Abstract]
- Parekh DJ, Ankerst DP, Thompson IM: Prostate-specific antigen levels, prostate-specific antigen kinetics, and prostate cancer prognosis: a tocsin calling for prospective studies. J Natl Cancer Inst 99 (7): 496-7, 2007. [PUBMED Abstract]
- Mason MD, Sydes MR, Glaholm J, et al.: Oral sodium clodronate for nonmetastatic prostate cancer--results of a randomized double-blind placebo-controlled trial: Medical Research Council PR04 (ISRCTN61384873). J Natl Cancer Inst 99 (10): 765-76, 2007. [PUBMED Abstract]
- Chodak GW, Thisted RA, Gerber GS, et al.: Results of conservative management of clinically localized prostate cancer. N Engl J Med 330 (4): 242-8, 1994. [PUBMED Abstract]
- Whitmore WF: Expectant management of clinically localized prostatic cancer. Semin Oncol 21 (5): 560-8, 1994. [PUBMED Abstract]
- Shappley WV, Kenfield SA, Kasperzyk JL, et al.: Prospective study of determinants and outcomes of deferred treatment or watchful waiting among men with prostate cancer in a nationwide cohort. J Clin Oncol 27 (30): 4980-5, 2009. [PUBMED Abstract]
- Catalona WJ, Bigg SW: Nerve-sparing radical prostatectomy: evaluation of results after 250 patients. J Urol 143 (3): 538-43; discussion 544, 1990. [PUBMED Abstract]
- Catalona WJ, Basler JW: Return of erections and urinary continence following nerve sparing radical retropubic prostatectomy. J Urol 150 (3): 905-7, 1993. [PUBMED Abstract]
- Paulson DF, Moul JW, Walther PJ: Radical prostatectomy for clinical stage T1-2N0M0 prostatic adenocarcinoma: long-term results. J Urol 144 (5): 1180-4, 1990. [PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathologically advanced prostate cancer: a randomized clinical trial. JAMA 296 (19): 2329-35, 2006. [PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol 181 (3): 956-62, 2009. [PUBMED Abstract]
- Holmberg L, Bill-Axelson A, Helgesen F, et al.: A randomized trial comparing radical prostatectomy with watchful waiting in early prostate cancer. N Engl J Med 347 (11): 781-9, 2002. [PUBMED Abstract]
- Bill-Axelson A, Holmberg L, Ruutu M, et al.: Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 352 (19): 1977-84, 2005. [PUBMED Abstract]
- Bill-Axelson A, Holmberg L, Garmo H, et al.: Radical prostatectomy or watchful waiting in early prostate cancer. N Engl J Med 370 (10): 932-42, 2014. [PUBMED Abstract]
- Wilt TJ, Brawer MK, Jones KM, et al.: Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 367 (3): 203-13, 2012. [PUBMED Abstract]
- Wilt TJ: The Prostate Cancer Intervention Versus Observation Trial: VA/NCI/AHRQ Cooperative Studies Program #407 (PIVOT): design and baseline results of a randomized controlled trial comparing radical prostatectomy with watchful waiting for men with clinically localized prostate cancer. J Natl Cancer Inst Monogr 2012 (45): 184-90, 2012. [PUBMED Abstract]
- Wilt TJ, Jones KM, Barry MJ, et al.: Follow-up of Prostatectomy versus Observation for Early Prostate Cancer. N Engl J Med 377 (2): 132-142, 2017. [PUBMED Abstract]
- Hamdy FC, Donovan JL, Lane JA, et al.: 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 375 (15): 1415-1424, 2016. [PUBMED Abstract]
- Donovan JL, Hamdy FC, Lane JA, et al.: Patient-Reported Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. N Engl J Med 375 (15): 1425-1437, 2016. [PUBMED Abstract]
- Bagshaw MA: External radiation therapy of carcinoma of the prostate. Cancer 45 (7 Suppl): 1912-21, 1980. [PUBMED Abstract]
- Forman JD, Zinreich E, Lee DJ, et al.: Improving the therapeutic ratio of external beam irradiation for carcinoma of the prostate. Int J Radiat Oncol Biol Phys 11 (12): 2073-80, 1985. [PUBMED Abstract]
- Ploysongsang S, Aron BS, Shehata WM, et al.: Comparison of whole pelvis versus small-field radiation therapy for carcinoma of prostate. Urology 27 (1): 10-6, 1986. [PUBMED Abstract]
- Pilepich MV, Bagshaw MA, Asbell SO, et al.: Definitive radiotherapy in resectable (stage A2 and B) carcinoma of the prostate--results of a nationwide overview. Int J Radiat Oncol Biol Phys 13 (5): 659-63, 1987. [PUBMED Abstract]
- Amdur RJ, Parsons JT, Fitzgerald LT, et al.: The effect of overall treatment time on local control in patients with adenocarcinoma of the prostate treated with radiation therapy. Int J Radiat Oncol Biol Phys 19 (6): 1377-82, 1990. [PUBMED Abstract]
- Seymore CH, el-Mahdi AM, Schellhammer PF: The effect of prior transurethral resection of the prostate on post radiation urethral strictures and bladder neck contractures. Int J Radiat Oncol Biol Phys 12 (9): 1597-600, 1986. [PUBMED Abstract]
- Seidenfeld J, Samson DJ, Aronson N, et al.: Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer. Evid Rep Technol Assess (Summ) (4): i-x, 1-246, I1-36, passim, 1999. [PUBMED Abstract]
- Asbell SO, Martz KL, Shin KH, et al.: Impact of surgical staging in evaluating the radiotherapeutic outcome in RTOG #77-06, a phase III study for T1BN0M0 (A2) and T2N0M0 (B) prostate carcinoma. Int J Radiat Oncol Biol Phys 40 (4): 769-82, 1998. [PUBMED Abstract]
- Roach M, DeSilvio M, Lawton C, et al.: Phase III trial comparing whole-pelvic versus prostate-only radiotherapy and neoadjuvant versus adjuvant combined androgen suppression: Radiation Therapy Oncology Group 9413. J Clin Oncol 21 (10): 1904-11, 2003. [PUBMED Abstract]
- Pollack A: A call for more with a desire for less: pelvic radiotherapy with androgen deprivation in the treatment of prostate cancer. J Clin Oncol 21 (10): 1899-901, 2003. [PUBMED Abstract]
- Widmark A, Klepp O, Solberg A, et al.: Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial. Lancet 373 (9660): 301-8, 2009. [PUBMED Abstract]
- Warde P, Mason M, Ding K, et al.: Combined androgen deprivation therapy and radiation therapy for locally advanced prostate cancer: a randomised, phase 3 trial. Lancet 378 (9809): 2104-11, 2011. [PUBMED Abstract]
- Mason MD, Parulekar WR, Sydes MR, et al.: Final Report of the Intergroup Randomized Study of Combined Androgen-Deprivation Therapy Plus Radiotherapy Versus Androgen-Deprivation Therapy Alone in Locally Advanced Prostate Cancer. J Clin Oncol 33 (19): 2143-50, 2015. [PUBMED Abstract]
- Brundage M, Sydes MR, Parulekar WR, et al.: Impact of Radiotherapy When Added to Androgen-Deprivation Therapy for Locally Advanced Prostate Cancer: Long-Term Quality-of-Life Outcomes From the NCIC CTG PR3/MRC PR07 Randomized Trial. J Clin Oncol 33 (19): 2151-7, 2015. [PUBMED Abstract]
- Nabid A, Carrier N, Martin AG, et al.: Duration of Androgen Deprivation Therapy in High-risk Prostate Cancer: A Randomized Phase III Trial. Eur Urol 74 (4): 432-441, 2018. [PUBMED Abstract]
- Boustead G, Edwards SJ: Systematic review of early vs deferred hormonal treatment of locally advanced prostate cancer: a meta-analysis of randomized controlled trials. BJU Int 99 (6): 1383-9, 2007. [PUBMED Abstract]
- Jones CU, Hunt D, McGowan DG, et al.: Radiotherapy and short-term androgen deprivation for localized prostate cancer. N Engl J Med 365 (2): 107-18, 2011. [PUBMED Abstract]
- Denham JW, Steigler A, Lamb DS, et al.: Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 12 (5): 451-9, 2011. [PUBMED Abstract]
- Pisansky TM, Hunt D, Gomella LG, et al.: Duration of androgen suppression before radiotherapy for localized prostate cancer: radiation therapy oncology group randomized clinical trial 9910. J Clin Oncol 33 (4): 332-9, 2015. [PUBMED Abstract]
- Wallner K, Roy J, Harrison L: Tumor control and morbidity following transperineal iodine 125 implantation for stage T1/T2 prostatic carcinoma. J Clin Oncol 14 (2): 449-53, 1996. [PUBMED Abstract]
- D'Amico AV, Coleman CN: Role of interstitial radiotherapy in the management of clinically organ-confined prostate cancer: the jury is still out. J Clin Oncol 14 (1): 304-15, 1996. [PUBMED Abstract]
- Ragde H, Blasko JC, Grimm PD, et al.: Interstitial iodine-125 radiation without adjuvant therapy in the treatment of clinically localized prostate carcinoma. Cancer 80 (3): 442-53, 1997. [PUBMED Abstract]
- Kuban DA, el-Mahdi AM, Schellhammer PF: I-125 interstitial implantation for prostate cancer. What have we learned 10 years later? Cancer 63 (12): 2415-20, 1989. [PUBMED Abstract]
- Fuks Z, Leibel SA, Wallner KE, et al.: The effect of local control on metastatic dissemination in carcinoma of the prostate: long-term results in patients treated with 125I implantation. Int J Radiat Oncol Biol Phys 21 (3): 537-47, 1991. [PUBMED Abstract]
- Robinson JW, Saliken JC, Donnelly BJ, et al.: Quality-of-life outcomes for men treated with cryosurgery for localized prostate carcinoma. Cancer 86 (9): 1793-801, 1999. [PUBMED Abstract]
- Donnelly BJ, Saliken JC, Ernst DS, et al.: Prospective trial of cryosurgical ablation of the prostate: five-year results. Urology 60 (4): 645-9, 2002. [PUBMED Abstract]
- Aus G, Pileblad E, Hugosson J: Cryosurgical ablation of the prostate: 5-year follow-up of a prospective study. Eur Urol 42 (2): 133-8, 2002. [PUBMED Abstract]
- Blana A, Murat FJ, Walter B, et al.: First analysis of the long-term results with transrectal HIFU in patients with localised prostate cancer. Eur Urol 53 (6): 1194-201, 2008. [PUBMED Abstract]
- Ficarra V, Novara G: Editorial comment on: first analysis of the long-term results with transrectal HIFU in patients with localized prostate cancer. Eur Urol 53 (6): 1201-2, 2008. [PUBMED Abstract]
- Eastham JA: Editorial comment on: first analysis of the long-term results with transrectal HIFU in patients with localized prostate cancer. Eur Urol 53 (6): 1202-3, 2008. [PUBMED Abstract]
- Azzouzi AR, Vincendeau S, Barret E, et al.: Padeliporfin vascular-targeted photodynamic therapy versus active surveillance in men with low-risk prostate cancer (CLIN1001 PCM301): an open-label, phase 3, randomised controlled trial. Lancet Oncol 18 (2): 181-191, 2017. [PUBMED Abstract]
- Freedland SJ: Low-risk prostate cancer: to treat or not to treat. Lancet Oncol 18 (2): 156-157, 2017. [PUBMED Abstract]
Tratamiento del cáncer de próstata en estadio III
Aspectos generales
El sistema de clasificación TNM (tumor, ganglio linfático y metástasis) del American Joint Committee on Cancer define el cáncer de próstata en estadio III de la siguiente forma:[1]
Estadio IIIA
- T1–2, N0, M0, antígeno prostático específico (PSA) ≥20 ng/ml, Gleason ≤6–8.
Estadio IIIB
- T3–4, N0, M0, cualquier valor del PSA, Gleason ≤6–8.
Estadio IIIC
- Cualquier T, N0, M0, cualquier valor del PSA, Gleason 9 o 10.
La diseminación extraprostática con invasión microscópica del cuello vesical (T4) se incluye en T3a.
La terapia de haz externo (RHE), el implante intersticial de radioisótopos y la prostatectomía radical se usan para tratar el cáncer de próstata en estadio III.[2] El pronóstico cambia bastante de acuerdo con la evaluación de los ganglios linfáticos regionales y la comprobación de ausencia de compromiso ganglionar.
La RHE con acelerador lineal es el tratamiento más común para los pacientes con cáncer de próstata en estadio III y hay series grandes que respaldan su eficacia para lograr control local de la enfermedad y supervivencia sin enfermedad (SSE).[3,4] Los resultados de la prostatectomía radical en pacientes con cáncer de próstata en estadio III son muy inferiores a los resultados en pacientes con cáncer de próstata en estadio II. El implante intersticial de radioisótopos es técnicamente difícil cuando los tumores son grandes.
Se deben tener en cuenta los síntomas del paciente relacionados con el cáncer, la edad y las enfermedades concomitantes antes de decidir un plan de tratamiento. En una serie de 372 pacientes tratados con radioterapia a quienes se les dio seguimiento durante 20 años, el 47 % murieron por cáncer de próstata y el 44 % murieron por enfermedades intercurrentes sin indicios de cáncer de próstata.[4]
Opciones de tratamiento del cáncer de próstata en estadio III
Las opciones de tratamiento de los pacientes con cáncer de próstata en estadio III son las siguientes:
Radioterapia de haz externo con terapia hormonal o sin esta
Se debe considerar el uso de la radioterapia de haz externo (RHE) sola,[3-7] los agonistas de la hormona liberadora de hormona luteinizante (LH-RH) o de la orquiectomía acompañados de RHE.[8-16] La radioterapia definitiva se debe postergar hasta 4 a 6 semanas después de la resección transuretral para reducir la incidencia de estenosis.[17]
Se debe considerar el uso de la terapia hormonal con radioterapia, en especial para los hombres que no tienen comorbilidades subyacentes moderadas o graves.[8,9] En varios estudios se investigó su uso en pacientes con enfermedad localmente avanzada.
Evidencia (RHE con terapia hormonal o sin esta):
- Las tasas de supervivencia general (SG) y de recaída del PSA no fueron significativamente diferentes, aunque en el ensayo del Radiation Therapy Oncology Group (RTOG) RTOG-9413 se observó aumento de la SSP a los 4 años para los pacientes con un riesgo estimado del 15 % de compromiso ganglionar que recibieron radioterapia pélvica total en comparación con radioterapia sola dirigida a la próstata.[18]; [19][Nivel de evidencia B1]
- En un ensayo aleatorizado, se asignó a 875 hombres con cáncer de próstata no metastásico localmente avanzado (tumores T1b–T2 con diferenciación moderada o pobre, o tumores T3 de cualquier grado) a recibir durante 3 meses un agonista de la hormona liberadora de hormona luteinizante y flutamida a largo plazo (250 mg VO 3 veces al día), con RHE o sin esta. Del grupo del estudio, el 19 % tenía un tumor en estadio T2 y el 78 % tenía un tumor en estadio T3.[20][Nivel de evidencia A1]
- A los 10 años, tanto la mortalidad general (29,6 vs. 39,4 %; intervalo de confianza [IC] 95 % para la diferencia, 0,8–8,8 %) y la mortalidad específica por cáncer de próstata (11,9 vs. 23,9 %; IC 95 % para la diferencia, 4,9–19,1 %) favorecieron la combinación de terapia hormonal y radioterapia.
- Aunque la flutamida quizás no se considere una monoterapia hormonal estándar en el entorno de tumores T2 o T3, la radioterapia produjo una supervivencia sin enfermedad o una ventaja de supervivencia específica del tumor incluso cuando se usó esta monoterapia. Este análisis se basa en la suposición de que la flutamida no acorta la esperanza de vida ni la supervivencia específica por cáncer. La radioterapia no se administró de acuerdo con los estándares actuales de dosis y técnica.
- En otro ensayo se comparó la terapia de privación androgénica (TPA, un agonista de la LH-RH u orquiectomía) y la TPA con radioterapia (65–69 Gy dirigidos a la próstata con una técnica de caja de 4 campos, incluso 45 Gy dirigidos a toda la pelvis, las vesículas seminales y los ganglios ilíacos externos o internos, a menos que el resultado del análisis histológico de los ganglios linfáticos fuera negativo). En este ensayo, NCIC (CTG PR.3/MRC UKPRO7 [NCT00002633]) del National Cancer Institute of Canada, se asignó al azar a 1205 pacientes de riesgo alto (PSA >40 ng/ml o PSA >20 ng/ml y puntaje de Gleason ≥8), T2 (12–13 % de los pacientes), T3 (83 % de los pacientes) y T4 (4–5 % de los pacientes) con enfermedad en estadios clínicos o patológico N0, M0.[21,22][Nivel de evidencia A1]
- En el momento de una mediana de seguimiento de 8 años (máximo, 13 años), la SG fue superior en el grupo de TPA y radioterapia (cociente de riesgos instantáneos [CRI]de muerte 0,77; IC 95 %, 0,57–0,85; P = 0,001). La tasa de SG a los 10 años fue del 55 % para el grupo de TPA y radioterapia versus el 49 % para el grupo de TPA sola.
- Aunque la radioterapia produjo los efectos secundarios intestinales y urinarios previstos, la calidad de vida (CV) fue la misma en todos los grupos de estudio a los 24 meses y en adelante.[23]
- El RTOG realizó un ensayo aleatorizado prospectivo (RTOG-8531) en pacientes con enfermedad T3, N0 o cualquier T, N1, M0, que recibieron radioterapia pélvica o prostática y luego se asignaron al azar para recibir goserelina adyuvante inmediata u observación con la administración de goserelina en el momento de la recaída. En los pacientes asignados a recibir goserelina adyuvante, la administración del fármaco empezó durante la última semana del ciclo de radioterapia y continuó de manera indefinida o hasta la presentación de signos de progresión.[24][Nivel de evidencia A1]
- La tasa actuarial de SG a 10 años para la población evaluable de 945 pacientes fue del 49 % en el grupo adyuvante y del 39 % en el grupo de observación (P = 0,002). También mejoró la tasa actuarial de fracaso terapéutico local a 10 años (23 vs. 38 %, P = < 0,001).
- La European Organisation for Research and Treatment of Cancer (EORTC) también realizó un ensayo similar. Se asignó al azar a pacientes con enfermedad T1, T2 (grado 3 de la Organización Mundial de la Salud), N0–NX o T3, T4, N0 a recibir radioterapia pélvica o prostática, o radioterapia idéntica y goserelina adyuvante (con acetato de ciproterona durante 1 mes) que se inició al mismo tiempo que la radioterapia y se continuó durante 3 años. Se realizó el seguimiento de los 401 pacientes aptos para el análisis durante una mediana de 9,1 años.[10,25][Niveles de evidencia A1 y B1]
- Los cálculos de Kaplan-Meier de las tasas de SG a 10 años fueron del 58,1 % para el grupo de goserelina adyuvante y del 39,8 % (P = 0,0004) para el grupo de radiación sola. De modo semejante, las tasas de SSE a 10 años (47,7 vs. 22,7 %, P < 0,0001) y las tasas de control local (94,0 vs. 76,5 %, P < 0,001) a 10 años favorecieron al grupo de terapia adyuvante.[10,25]
- En 2 estudios más pequeños (78 y 91 pacientes) se observaron resultados similares.[26,27]
- La Agency for Health Care Policy and Research (AHCPR; ahora Agency for Healthcare Research and Quality) analizó la función de la terapia hormonal adyuvante en pacientes con enfermedad localmente avanzada. En un metanálisis de la evidencia de ensayos clínicos aleatorizados se comparó la radioterapia sola y la radioterapia con privación androgénica prolongada (terapia con un agonista de la LH-RH u orquiectomía). La mayoría de los pacientes presentaban enfermedad más avanzada, pero se incluyeron en el estudio los pacientes con tumores voluminosos T2b.[11][Nivel de evidencia A1]
- En el metanálisis se encontró una diferencia en la SG a 5 años a favor de la radioterapia con privación androgénica continua en comparación con la radioterapia sola (CRI, 0,631; IC 95 %, 0,479–0,831).[11]
- Además, el RTOG condujo un estudio (RTOG-8610) de pacientes con tumores voluminosos localizados (T2b, T2c, T3 o T4) y compromiso ganglionar por debajo de la cadena ilíaca común o sin este. Se asignó al azar a 456 hombres a recibir radioterapia sola o radioterapia con ablación androgénica, que se inició 8 semanas antes de la radioterapia y continuó por 16 semanas. En el ensayo se evaluó solo la terapia hormonal a corto plazo, no la terapia a largo plazo como se hizo en los estudios de la AHCPR.[12,28]
- A los 10 años, no hubo diferencias estadísticamente significativas en la SG; sin embargo, las tasas de mortalidad específica por la enfermedad (23 vs. 36 %) y las tasas de SSE (11 vs. 3 %) favorecieron el grupo de tratamiento combinado.[12][Nivel de evidencia A1]
- En un análisis de subconjunto de los ensayos RTOG-8610 y RTOG-8531, en el que participaron 575 pacientes con enfermedad T3, N0, M0, se indicó que el tratamiento hormonal a largo plazo mejora la tasa de SSE bioquímica y la supervivencia por causa específica en comparación con el tratamiento hormonal a corto plazo.[29]
- Este resultado se confirmó en el RTOG-9202 (NCT00767286), en el que se notificó que la radioterapia con 28 meses de privación androgénica produjo unas tasas de supervivencia específica por la enfermedad a 10 años más prolongadas (23 vs. 13 %; P < 0,0001) pero no mejoró la tasa de SG (53,9 vs. 51,6 %; P = 36).[13]
- En un análisis no programado de un subgrupo del estudio, se encontró mejora de la SG cuando se usó privación androgénica más prolongada (28 vs. 4 meses) (45 vs. 32 %; P = 0,0061) en hombres con cánceres de grado alto y puntajes de Gleason de 8 a 10.
- En un ensayo aleatorizado prospectivo, el tratamiento de privación androgénica con un agonista LH-RH durante 18 meses y 36 meses produjo resultados similares de SG y supervivencia específica de la enfermedad.[30] [Nivel de evidencia A1] En el ensayo, 630 hombres con cáncer en estadios II a IVA (estadio clínico T3–T4, PSA >20 ng/ml o puntaje de Gleason >7) recibieron 70 Gy de radiación en 35 fracciones además de 18 o 36 meses acetato de goserelina.
- Al cabo de una mediana de seguimiento de 9,4 años, la SG fue casi idéntica en ambos grupos del estudio (62 % a los 10 años; CRIde muerte, 1,02; IC 95 %, 0,81–1,29; P = 0,8), al igual que la supervivencia específica del cáncer de próstata (CRIde muerte por cáncer de próstata, 0,95; IC 95 %, 0,58–0,55; P = 0,8).
- La calidad de vida general fue casi idéntica en ambos grupos del estudio, pero la actividad sexual y el interés sexual fue un poco mejor en el grupo de 18 meses.[30][Nivel de evidencia A3]
- Del mismo modo, en un metanálisis de 7 ensayos controlados aleatorizados de comparación de la terapia hormonal temprana (adyuvante o neoadyuvante) y la terapia hormonal diferida (agonista de la LH-RH o antiandrógenos) en pacientes con cáncer de próstata localmente avanzado tratados con prostatectomía, radioterapia, conducta expectante o vigilancia activa (seguimiento activo), se observó una mejora de la mortalidad general para los pacientes que recibieron tratamiento temprano (riesgo relativo, 0,86; IC 95 %; 0,82–0,91).[31][Nivel de evidencia A1]
- En un ensayo aleatorizado (TROG 96.01 [ACTRN12607000237482]), se evaluó la duración de la terapia hormonal neoadyuvante en 818 hombres con cáncer no metastásico localmente avanzado (T2b, T2c, T3 y T4) tratados con radioterapia (es decir, 66 Gy en fracciones diarias de 2 Gy dirigidos a la próstata y las vesículas seminales, pero sin incluir los ganglios linfáticos regionales). En el marco de un diseño sin anonimato, los pacientes se asignaron al azar a radioterapia sola, 3 meses de terapia de privación androgénica neoadyuvante (TPAN) (goserelina, 3,6 mg subcutánea mensual y flutamida, 250 mg VO 3 veces al día) comenzando 2 meses antes de la radioterapia, o 6 meses de TPAN comenzando 5 meses antes de la radioterapia.[14][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 10,6 años, no hubo diferencias estadísticamente significativas entre el grupo de radiación sola y el grupo de radiación con tres meses de TPAN.
- Sin embargo, el grupo de 6 meses de TPAN mostró mejores resultados para la mortalidad específica por cáncer de próstata y la mortalidad por cualquier causa en comparación con el grupo de radiación sola; la mortalidad por cualquier causa a 10 años fue del 29,2 % vs. 42,5 % (CRI, 0,63; IC 95 %, 0,48–0,83; P = 0,0008).
- En otro ensayo (RTOG-9910 [NCT00005044]) se puso a prueba la duración de la terapia hormonal neoadyuvante. En este ensayo participaron 1489 hombres aptos con cáncer de próstata de riesgo intermedio (T1b–4, puntaje de Gleason 2–6 y PSA >10, pero ≤100 ng/ml; T1b–4, puntaje de Gleason 7 y PSA <20; o T1b–1c, puntaje de Gleason 8–10 y PSA <20) y sin indicios de metástasis. Los hombres se asignaron al azar a recibir un ciclo corto de privación androgénica neoadyuvante (un agonista de la LH-RH con bicalutamida o flutamida durante 8 semanas antes de la radioterapia y 8 semanas durante esta) o un ciclo prolongado de privación androgénica neoadyuvante (28 semanas antes de la radioterapia y 8 semanas durante esta). Ambos grupos recibieron 70,2 Gy de radiación dirigida a la próstata en 39 fracciones diarias y 46,8 Gy dirigidos a los ganglios linfáticos ilíacos.[32][Nivel de evidencia A1]
- Después de una mediana de 9,4 años, la mortalidad específica por cáncer de próstata a 10 años, que fue el criterio principal de valoración, fue baja en ambos grupos del estudio: el 5 % versus el 4 % (CRI, 0,81; IC 95 %, 0,48–1,39).[32][Nivel de evidencia A1]
- No se encontraron diferencias estadísticamente significativas en la mortalidad general o en la progresión locorregional de la enfermedad.[32][Nivel de evidencia A1]
- Tampoco hubo un efecto diferencial evidente de la duración de la privación androgénica en ninguno de los subconjuntos de grupos de riesgo.
Modificaciones hormonales con radioterapia o sin esta
Las modificaciones hormonales (orquiectomía o agonistas de la LH-RH) se pueden usar para el tratamiento del cáncer de próstata en estadio III.[33][Nivel de evidencia A1]
En algunos datos se indica que es posible mejorar la eficacia de la orquiectomía o los agonistas de LH-LH mediante la adición de acetato de abiraterona para los hombres con tumores localmente avanzados. En el ensayo aleatorizado sin anonimato STAMPEDE (NCT00268476), 1917 hombres (alrededor del 95 % con diagnóstico reciente; el 50 % con enfermedad metastásica y el 50 % con enfermedad localmente avanzada o enfermedad con compromiso ganglionar) se trataron con TPA sola o TPA con acetato de abiraterona (1000 mg VO al día) y prednisolona (5 mg por VO al día).[34] La radioterapia local se consideró obligatoria después de 6 a 9 meses para los hombres sin metástasis ni compromiso ganglionar, y opcional para los pacientes sin metástasis pero con compromiso ganglionar. La terapia hormonal se limitó a los 2 años o hasta el momento de progresión de la enfermedad. Se planeó la administración de radioterapia a cerca del 40 % de los participantes del estudio.
- Después de una mediana de seguimiento de 40 meses, la tasa de SG a 3 años fue del 83 % en el grupo de abiraterona en comparación con 76 % en el grupo que solo recibió TPA (CRIde muerte 0,63; IC 95 %, 0,52–0,76; P = 0,001).[34][Nivel de evidencia A1] Aunque no se identificó evidencia clara de heterogeneidad en las diferencias relativas del tratamiento de la enfermedad metastásica versus la enfermedad no metastásica, las diferencias absolutas fueron mucho más bajas para los hombres con enfermedad no metastásica y no fueron estadísticamente significativas, quizás por un seguimiento corto (CRIde muerte, 0,75; IC 95 %, 0,49-1,18).
- Las otras diferencias importantes de la toxicidad relacionada con la abiraterona en comparación con la TPA sola fueron la hipertensión (5 vs. 1 %), el aumento leve de las concentraciones sanguíneas de aminotransferasas (6 vs. <1 %) y los trastornos respiratorios (5 vs. 2 %).
La monoterapia antiandrogénica también se evaluó en hombres con cáncer de próstata localmente avanzado como una alternativa a la castración.
Evidencia (monoterapia antiandrogénica no esteroidea vs. castración quirúrgica o clínica):
- En una revisión sistemática de 11 ensayos aleatorizados, se comparó la monoterapia antiandrogénica no esteroidea y la castración quirúrgica o farmacológica en 3060 hombres con enfermedad localmente avanzada, metastásica o recidivante después de tratamiento local.[35] El uso de monoterapia con un antiandrógeno no esteroideo disminuyó la SG y aumentó la tasa de progresión tumoral clínica y fracaso del tratamiento.[35][Nivel de evidencia A1]
Evidencia (orquiectomía vs. agonistas de la LH-RH):
- En un estudio aleatorizado de equivalencia de 480 hombres con enfermedad localmente avanzada (T3 y T4), aquellos tratados con castración tuvieron una mediana de SG de 70 meses, mientras que los tratados con bicalutamida (150 mg al día) tuvieron una mediana de SG de 63,5 meses (CRI, 1,05, IC 95 %, 0,81–1,36), los resultados no cumplieron con los criterios predefinidos de equivalencia.[[36][Nivel de evidencia A1]
Terapia hormonal inmediata versus diferida
En los pacientes que no son aptos para someterse a una prostatectomía radical o radioterapia, o que no quiere recibir estos tratamientos, se comparó la terapia hormonal inmediata con la terapia diferida (es decir, conducta expectante o vigilancia activa [seguimiento activo] con terapia hormonal en el momento de la progresión).
Evidencia (terapia hormonal inmediata versus diferida):
- En un ensayo aleatorizado se analizó el tratamiento hormonal inmediato (orquiectomía o un análogo de la LH-RH) versus el tratamiento diferido en hombres con cáncer de próstata localmente avanzado o metastásico asintomático.[33][Nivel de evidencia A1]
- Los resultados iniciales mostraron mejores SG y supervivencia específica para el cáncer de próstata con el tratamiento inmediato. Posteriormente, se perdió la significación estadística cuando se registró en forma resumida.[37]
- La incidencia de fracturas patológicas, compresión de la médula espinal y obstrucción uretral también fueron menores en el grupo de tratamiento inmediato.
- En otro ensayo, 197 hombres con cáncer de próstata en estadio III o estadio IV se asignaron al azar para someterse a una orquiectomía bilateral en el momento del diagnóstico o en el momento de progresión sintomática (o nuevas metástasis con probabilidad de causar síntomas).[38][Nivel de evidencia A1]
- No se observó una diferencia estadísticamente significativa en la SG durante el período de seguimiento de 12 años.
- En el ensayo EORTC-30891 (NCT01819285), se asignó al azar a 985 pacientes con diagnóstico reciente de cáncer de próstata en estadio T0–4, N0–2, M0 y una mediana de edad de 73 años a someterse a privación androgénica, ya fuera inmediata o en el momento de la progresión sintomática de la enfermedad. El estudio se diseñó para demostrar la ausencia de inferioridad del tratamiento diferido en comparación con el tratamiento inmediato en relación con la SG.[39][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 7,8 años, alrededor del 50 % de los pacientes del grupo de tratamiento diferido comenzaron la terapia de privación androgénica.
- La mediana de SG en el grupo de tratamiento inmediato fue de 7,4 años y en el grupo de tratamiento diferido fue de 6,5 años, lo que correspondió a un CRI de mortalidad de 1,25 (IC 95 %, 1,05–1,48) que no cumplió con los criterios de ausencia de inferioridad.
Terapia hormonal continua versus intermitente
Cuando se usa como tratamiento primario para pacientes con cáncer de próstata en estadio III o estadio IV, la privación androgénica con terapia hormonal, por lo general, se administra de forma continua hasta la progresión de la enfermedad. Algunos investigadores propusieron la privación intermitente de andrógenos como una estrategia para lograr la máxima citorreducción tumoral, seguida de un período sin tratamiento para permitir la repoblación tumoral con células sensibles a las hormonas. En teoría, esta estrategia produciría mayor sensibilidad hormonal en el tumor durante un período más largo. En un modelo animal se observó que la privación intermitente de andrógenos (PIA) a veces prolonga la duración de la dependencia androgénica de los tumores sensibles a las hormonas.[40]
Evidencia (terapia hormonal continua versus intermitente):
- En una revisión sistemática de 15 ensayos aleatorizados de comparación de la privación continua de andrógenos versus la PIA en pacientes con cáncer de próstata avanzado o recidivante, no se encontraron diferencias significativas en la SG notificada en 8 ensayos (CRI, 1,02; IC 95 %, 0,93–1,11); la supervivencia específica del cáncer de próstata notificada en 5 ensayos (CRI, 1,02; IC 95 %, 0,87–1,19); o la supervivencia sin progresión notificada en 4 ensayos (CRI, 0,94; IC 95 %, 0,84–1,05). El metanálisis cumplió con los criterios predefinidos de ausencia de inferioridad de la SG (límite superior de 1,15 para el CRIde muerte 1,15).[41][Nivel de evidencia A1] Sin embargo, los 15 estudios, menos uno, tenían un riesgo alto o impreciso de sesgos de acuerdo con los criterios predefinidos.
- Se informó de una diferencia mínima en la CV notificada por los pacientes, pero en la mayoría de los ensayos se encontró mejor funcionamiento sexual y físico en los pacientes de los grupos de PIA.
Prostatectomía radical, con radioterapia de haz externo o sin esta
La prostatectomía radical se puede administrar con RHE o sin esta (en pacientes muy seleccionados).[42] Debido a que entre el 40 % y el 50 % de los hombres con enfermedad limitada al órgano en el examen clínico tienen diseminación más allá de la cápsula prostática o los márgenes quirúrgicos en el análisis patológico, se estudia la función de la radioterapia adyuvante después la prostatectomía.
Evidencia (prostatectomía radical con RHE o sin esta):
- En un ensayo aleatorizado de 425 hombres con enfermedad patológica T3, N0, M0, se comparó la RHE posquirúrgica (60–64 Gy dirigidos a la fosa prostática en 30–32 fracciones) y la observación.[43,44]
- Después de una mediana de seguimiento de alrededor de 12,5 años, la SG fue mejor en el grupo de radioterapia; CRIde muerte, 0,72; IC 95 %, 0,55–0,96; P = 0,23). Las tasas de supervivencia estimadas a 10 años fueron del 74 % en el grupo de radioterapia y del 66 % en el grupo de control.
- Las tasas de supervivencia sin metástasis estimadas a 10 años fueron del 73 % y el 65 % (P = 0,16).[44][Nivel de evidencia A1]
- Las tasas de complicaciones fueron mucho más altas en el grupo de radioterapia en comparación con el grupo de observación: complicaciones generales (23,8 vs. 11,9 %), complicaciones rectales (3,3 vs. 0 %) y tasas de estenosis uretral (17,8 vs. 9,5 %).
- No se ha establecido la función de la terapia hormonal preoperatoria (neoadyuvante).[45,46] Además, los cambios morfológicos inducidos por la ablación androgénica neoadyuvante a veces complican la evaluación de los márgenes quirúrgicos y el compromiso capsular.[47]
Conducta expectante o vigilancia activa (seguimiento activo)
La observación rigurosa sin tratamiento inmediato se puede utilizar para el tratamiento del cáncer de próstata en estadio III.[48,49]
Para los pacientes de edad avanzada asintomáticos o que tienen una enfermedad simultánea, se puede considerar un abordaje de observación rigurosa sin administrar un tratamiento activo inmediato.[50-52] La espera cautelosa, la observación, la conducta expectante, la actitud expectante, la vigilancia activa y el seguimiento activo son términos que indican una estrategia en la que no se utiliza un tratamiento inmediato con intención curativa. Para obtener más información, consultar la sección Aspectos generales de las opciones de tratamiento del cáncer de próstata.
Tratamiento de los síntomas
Debido a que muchos pacientes en estadio III presentan síntomas urinarios, el control sintomático es importante para determinar el tratamiento. Las siguientes modalidades de tratamiento se usan para mejorar el control local de la enfermedad y los síntomas derivados:
- Radioterapia.
- Modificación hormonal.
- Cirugía paliativa (resección transuretral de la próstata).
- Implante intersticial combinado con radioterapia de haz externo.
- Formas alternativas de radioterapia (en evaluación clínica).
- Criocirugía percutánea guiada por ecografía (en evaluación clínica).
Radioterapia
Es posible usar radioterapia.[3-6] La radioterapia de haz externo (RHE) diseñada para disminuir la exposición de los tejidos normales mediante métodos como la planificación conformada tridimensional con tomografía computarizada (TC) está en evaluación clínica.
Modificación hormonal
Las modificaciones hormonales utilizadas de manera eficaz como tratamiento inicial del cáncer de próstata son las siguientes:
- Orquiectomía.
- Leuprolida u otros agonistas de la LH-RH (es decir, goserelina) en preparaciones de administración diaria o de liberación prolongada. Estos medicamentos a veces producen exacerbación sintomática por crecimiento tumoral transitorio.
- Estrógenos (el dietilestilbestrol [DES] ya no está disponible en los Estados Unidos).
- Antiandrógenos no esteroideos (por ejemplo, flutamida, nilutamida y bicalutamida) o antiandrógenos esteroideos (por ejemplo, acetato de ciproterona).
En un metanálisis de ensayos aleatorizados en los que se compararon varias monoterapias hormonales en hombres con cáncer de próstata en estadio III o estadio IV (con predominio del estadio IV), se llegó a las siguientes conclusiones:[53][Nivel de evidencia A1]
- La tasa de SG a los 2 años con cualquiera de los agonistas de la LH-RH fue similar al tratamiento con orquiectomía o 3 mg diarios de DES (CRI, 1,26; IC 95 %, 0,92–1,39).
- Las tasas de supervivencia a los 2 años fueron similares o peores en el grupo de antiandrógenos no esteroideos que en el grupo de orquiectomía (CRI 1,22, IC 95 %, 0,99–1,50).
- La tasa de abandono del tratamiento, cuando se usa como criterio sustituto de efectos adversos fue más baja en el grupo de agonistas de la LH-RH (0–4 %) que en el grupo de antiandrógenos no esteroideos (4–10 %).
Implante intersticial combinado con radioterapia de haz externo
La implantación intersticial combinada con RHE se usa en pacientes T3 seleccionados, pero hay poca información disponible.[54]
Formas alternativas de radioterapia
Se emplean formas alternativas de radioterapia en los ensayos clínicos.
- En un ensayo aleatorizado del RTOG, se notificó mejor control local y supervivencia con radioterapia de haz mixto (neutrones y fotones) comparada con la radioterapia de fotones estándar.[55]
- En un estudio aleatorizado posterior del mismo grupo, se comparó la radioterapia de neutrones rápidos con la radioterapia de fotones estándar. El control locorregional mejoró con el tratamiento de neutrones, pero no se observó diferencia en la SG, aunque el seguimiento fue más corto en este ensayo. Se observaron menos complicaciones con el uso de un colimador multiláminas.[56]
La radioterapia con haz de protones también está en investigación.[57]
Criocirugía percutánea guiada por ecografía
La criocirugía percutánea guiada por ecografía está en evaluación clínica.
La criocirugía es una técnica quirúrgica en desarrollo que permite destruir las células cancerosas en el tejido prostático mediante el uso de criosondas que producen congelación y descongelación intermitentes.[58][Nivel de evidencia C1]; [59]; [60][Nivel de evidencia C3] El uso de criocirugía está menos arraigado que la prostatectomía estándar y sus resultados a largo plazo no se han establecido tan bien como los de la prostatectomía o la radioterapia. Los efectos tóxicos incluyen daño a la vejiga, incontinencia urinaria, impotencia sexual y lesión rectal. La técnica de criocirugía está en desarrollo. La impotencia es común. La frecuencia de otros efectos secundarios y la probabilidad de control del cáncer a los 5 años de seguimiento varían en los centros notificadores; las series son pequeñas en comparación con las series de cirugía y radioterapia.[59,60]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Prostate. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 715–26.
- Paulson DF: Management of prostate malignancy. In: deKernion JB, Paulson DF, eds.: Genitourinary Cancer Management. Lea and Febiger, 1987, pp 107-160.
- Babaian RJ, Zagars GK, Ayala AG: Radiation therapy of stage C prostate cancer: significance of Gleason grade to survival. Semin Urol 8 (4): 225-31, 1990. [PUBMED Abstract]
- del Regato JA, Trailins AH, Pittman DD: Twenty years follow-up of patients with inoperable cancer of the prostate (stage C) treated by radiotherapy: report of a national cooperative study. Int J Radiat Oncol Biol Phys 26 (2): 197-201, 1993. [PUBMED Abstract]
- Pilepich MV, Johnson RJ, Perez CA, et al.: Prognostic significance of nodal involvement in locally advanced (stage C) carcinoma of prostate--RTOG experience. Urology 30 (6): 535-40, 1987. [PUBMED Abstract]
- Perez CA, Garcia D, Simpson JR, et al.: Factors influencing outcome of definitive radiotherapy for localized carcinoma of the prostate. Radiother Oncol 16 (1): 1-21, 1989. [PUBMED Abstract]
- Freeman JA, Lieskovsky G, Cook DW, et al.: Radical retropubic prostatectomy and postoperative adjuvant radiation for pathological stage C (PcN0) prostate cancer from 1976 to 1989: intermediate findings. J Urol 149 (5): 1029-34, 1993. [PUBMED Abstract]
- Kumar S, Shelley M, Harrison C, et al.: Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. Cochrane Database Syst Rev (4): CD006019, 2006. [PUBMED Abstract]
- D'Amico AV, Chen MH, Renshaw AA, et al.: Androgen suppression and radiation vs radiation alone for prostate cancer: a randomized trial. JAMA 299 (3): 289-95, 2008. [PUBMED Abstract]
- Bolla M, Van Tienhoven G, Warde P, et al.: External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results of an EORTC randomised study. Lancet Oncol 11 (11): 1066-73, 2010. [PUBMED Abstract]
- Seidenfeld J, Samson DJ, Aronson N, et al.: Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer. Evid Rep Technol Assess (Summ) (4): i-x, 1-246, I1-36, passim, 1999. [PUBMED Abstract]
- Roach M, Bae K, Speight J, et al.: Short-term neoadjuvant androgen deprivation therapy and external-beam radiotherapy for locally advanced prostate cancer: long-term results of RTOG 8610. J Clin Oncol 26 (4): 585-91, 2008. [PUBMED Abstract]
- Horwitz EM, Bae K, Hanks GE, et al.: Ten-year follow-up of radiation therapy oncology group protocol 92-02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J Clin Oncol 26 (15): 2497-504, 2008. [PUBMED Abstract]
- Denham JW, Steigler A, Lamb DS, et al.: Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 12 (5): 451-9, 2011. [PUBMED Abstract]
- Pilepich MV, Caplan R, Byhardt RW, et al.: Phase III trial of androgen suppression using goserelin in unfavorable-prognosis carcinoma of the prostate treated with definitive radiotherapy: report of Radiation Therapy Oncology Group Protocol 85-31. J Clin Oncol 15 (3): 1013-21, 1997. [PUBMED Abstract]
- Bolla M, Gonzalez D, Warde P, et al.: Improved survival in patients with locally advanced prostate cancer treated with radiotherapy and goserelin. N Engl J Med 337 (5): 295-300, 1997. [PUBMED Abstract]
- Seymore CH, el-Mahdi AM, Schellhammer PF: The effect of prior transurethral resection of the prostate on post radiation urethral strictures and bladder neck contractures. Int J Radiat Oncol Biol Phys 12 (9): 1597-600, 1986. [PUBMED Abstract]
- Roach M, DeSilvio M, Lawton C, et al.: Phase III trial comparing whole-pelvic versus prostate-only radiotherapy and neoadjuvant versus adjuvant combined androgen suppression: Radiation Therapy Oncology Group 9413. J Clin Oncol 21 (10): 1904-11, 2003. [PUBMED Abstract]
- Pollack A: A call for more with a desire for less: pelvic radiotherapy with androgen deprivation in the treatment of prostate cancer. J Clin Oncol 21 (10): 1899-901, 2003. [PUBMED Abstract]
- Widmark A, Klepp O, Solberg A, et al.: Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial. Lancet 373 (9660): 301-8, 2009. [PUBMED Abstract]
- Warde P, Mason M, Ding K, et al.: Combined androgen deprivation therapy and radiation therapy for locally advanced prostate cancer: a randomised, phase 3 trial. Lancet 378 (9809): 2104-11, 2011. [PUBMED Abstract]
- Mason MD, Parulekar WR, Sydes MR, et al.: Final Report of the Intergroup Randomized Study of Combined Androgen-Deprivation Therapy Plus Radiotherapy Versus Androgen-Deprivation Therapy Alone in Locally Advanced Prostate Cancer. J Clin Oncol 33 (19): 2143-50, 2015. [PUBMED Abstract]
- Brundage M, Sydes MR, Parulekar WR, et al.: Impact of Radiotherapy When Added to Androgen-Deprivation Therapy for Locally Advanced Prostate Cancer: Long-Term Quality-of-Life Outcomes From the NCIC CTG PR3/MRC PR07 Randomized Trial. J Clin Oncol 33 (19): 2151-7, 2015. [PUBMED Abstract]
- Pilepich MV, Winter K, Lawton CA, et al.: Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma--long-term results of phase III RTOG 85-31. Int J Radiat Oncol Biol Phys 61 (5): 1285-90, 2005. [PUBMED Abstract]
- Bolla M, Collette L, Blank L, et al.: Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 360 (9327): 103-6, 2002. [PUBMED Abstract]
- Zagars GK, Johnson DE, von Eschenbach AC, et al.: Adjuvant estrogen following radiation therapy for stage C adenocarcinoma of the prostate: long-term results of a prospective randomized study. Int J Radiat Oncol Biol Phys 14 (6): 1085-91, 1988. [PUBMED Abstract]
- Granfors T, Modig H, Damber JE, et al.: Combined orchiectomy and external radiotherapy versus radiotherapy alone for nonmetastatic prostate cancer with or without pelvic lymph node involvement: a prospective randomized study. J Urol 159 (6): 2030-4, 1998. [PUBMED Abstract]
- Pilepich MV, Winter K, John MJ, et al.: Phase III radiation therapy oncology group (RTOG) trial 86-10 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Radiat Oncol Biol Phys 50 (5): 1243-52, 2001. [PUBMED Abstract]
- Horwitz EM, Winter K, Hanks GE, et al.: Subset analysis of RTOG 85-31 and 86-10 indicates an advantage for long-term vs. short-term adjuvant hormones for patients with locally advanced nonmetastatic prostate cancer treated with radiation therapy. Int J Radiat Oncol Biol Phys 49 (4): 947-56, 2001. [PUBMED Abstract]
- Nabid A, Carrier N, Martin AG, et al.: Duration of Androgen Deprivation Therapy in High-risk Prostate Cancer: A Randomized Phase III Trial. Eur Urol 74 (4): 432-441, 2018. [PUBMED Abstract]
- Boustead G, Edwards SJ: Systematic review of early vs deferred hormonal treatment of locally advanced prostate cancer: a meta-analysis of randomized controlled trials. BJU Int 99 (6): 1383-9, 2007. [PUBMED Abstract]
- Pisansky TM, Hunt D, Gomella LG, et al.: Duration of androgen suppression before radiotherapy for localized prostate cancer: radiation therapy oncology group randomized clinical trial 9910. J Clin Oncol 33 (4): 332-9, 2015. [PUBMED Abstract]
- Immediate versus deferred treatment for advanced prostatic cancer: initial results of the Medical Research Council Trial. The Medical Research Council Prostate Cancer Working Party Investigators Group. Br J Urol 79 (2): 235-46, 1997. [PUBMED Abstract]
- James ND, de Bono JS, Spears MR, et al.: Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy. N Engl J Med 377 (4): 338-351, 2017. [PUBMED Abstract]
- Kunath F, Grobe HR, Rücker G, et al.: Non-steroidal antiandrogen monotherapy compared with luteinising hormone-releasing hormone agonists or surgical castration monotherapy for advanced prostate cancer. Cochrane Database Syst Rev (6): CD009266, 2014. [PUBMED Abstract]
- Iversen P, Tyrrell CJ, Kaisary AV, et al.: Bicalutamide monotherapy compared with castration in patients with nonmetastatic locally advanced prostate cancer: 6.3 years of followup. J Urol 164 (5): 1579-82, 2000. [PUBMED Abstract]
- Kirk D: Immediate vs. deferred hormone treatment for prostate cancer: how safe is androgen deprivation? [Abstract] BJU Int 86 (Suppl 3): 218-58, 2000.
- Studer UE, Hauri D, Hanselmann S, et al.: Immediate versus deferred hormonal treatment for patients with prostate cancer who are not suitable for curative local treatment: results of the randomized trial SAKK 08/88. J Clin Oncol 22 (20): 4109-18, 2004. [PUBMED Abstract]
- Studer UE, Whelan P, Albrecht W, et al.: Immediate or deferred androgen deprivation for patients with prostate cancer not suitable for local treatment with curative intent: European Organisation for Research and Treatment of Cancer (EORTC) Trial 30891. J Clin Oncol 24 (12): 1868-76, 2006. [PUBMED Abstract]
- Tombal B: Intermittent androgen deprivation therapy: conventional wisdom versus evidence. Eur Urol 55 (6): 1278-80, 2009. [PUBMED Abstract]
- Magnan S, Zarychanski R, Pilote L, et al.: Intermittent vs Continuous Androgen Deprivation Therapy for Prostate Cancer: A Systematic Review and Meta-analysis. JAMA Oncol 1 (9): 1261-9, 2015. [PUBMED Abstract]
- Walsh PC, Jewett HJ: Radical surgery for prostatic cancer. Cancer 45 (7 Suppl): 1906-11, 1980. [PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathologically advanced prostate cancer: a randomized clinical trial. JAMA 296 (19): 2329-35, 2006. [PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol 181 (3): 956-62, 2009. [PUBMED Abstract]
- Witjes WP, Schulman CC, Debruyne FM: Preliminary results of a prospective randomized study comparing radical prostatectomy versus radical prostatectomy associated with neoadjuvant hormonal combination therapy in T2-3 N0 M0 prostatic carcinoma. The European Study Group on Neoadjuvant Treatment of Prostate Cancer. Urology 49 (3A Suppl): 65-9, 1997. [PUBMED Abstract]
- Fair WR, Cookson MS, Stroumbakis N, et al.: The indications, rationale, and results of neoadjuvant androgen deprivation in the treatment of prostatic cancer: Memorial Sloan-Kettering Cancer Center results. Urology 49 (3A Suppl): 46-55, 1997. [PUBMED Abstract]
- Bazinet M, Zheng W, Bégin LR, et al.: Morphologic changes induced by neoadjuvant androgen ablation may result in underdetection of positive surgical margins and capsular involvement by prostatic adenocarcinoma. Urology 49 (5): 721-5, 1997. [PUBMED Abstract]
- Adolfsson J: Deferred treatment of low grade stage T3 prostate cancer without distant metastases. J Urol 149 (2): 326-8; discussion 328-9, 1993. [PUBMED Abstract]
- Stattin P, Holmberg E, Johansson JE, et al.: Outcomes in localized prostate cancer: National Prostate Cancer Register of Sweden follow-up study. J Natl Cancer Inst 102 (13): 950-8, 2010. [PUBMED Abstract]
- Chodak GW, Thisted RA, Gerber GS, et al.: Results of conservative management of clinically localized prostate cancer. N Engl J Med 330 (4): 242-8, 1994. [PUBMED Abstract]
- Whitmore WF: Expectant management of clinically localized prostatic cancer. Semin Oncol 21 (5): 560-8, 1994. [PUBMED Abstract]
- Shappley WV, Kenfield SA, Kasperzyk JL, et al.: Prospective study of determinants and outcomes of deferred treatment or watchful waiting among men with prostate cancer in a nationwide cohort. J Clin Oncol 27 (30): 4980-5, 2009. [PUBMED Abstract]
- Seidenfeld J, Samson DJ, Hasselblad V, et al.: Single-therapy androgen suppression in men with advanced prostate cancer: a systematic review and meta-analysis. Ann Intern Med 132 (7): 566-77, 2000. [PUBMED Abstract]
- Blasko JC, Grimm PD, Ragde H: Brachytherapy and Organ Preservation in the Management of Carcinoma of the Prostate. Semin Radiat Oncol 3 (4): 240-249, 1993. [PUBMED Abstract]
- Laramore GE, Krall JM, Thomas FJ, et al.: Fast neutron radiotherapy for locally advanced prostate cancer. Final report of Radiation Therapy Oncology Group randomized clinical trial. Am J Clin Oncol 16 (2): 164-7, 1993. [PUBMED Abstract]
- Russell KJ, Caplan RJ, Laramore GE, et al.: Photon versus fast neutron external beam radiotherapy in the treatment of locally advanced prostate cancer: results of a randomized prospective trial. Int J Radiat Oncol Biol Phys 28 (1): 47-54, 1994. [PUBMED Abstract]
- Shipley WU, Verhey LJ, Munzenrider JE, et al.: Advanced prostate cancer: the results of a randomized comparative trial of high dose irradiation boosting with conformal protons compared with conventional dose irradiation using photons alone. Int J Radiat Oncol Biol Phys 32 (1): 3-12, 1995. [PUBMED Abstract]
- Robinson JW, Saliken JC, Donnelly BJ, et al.: Quality-of-life outcomes for men treated with cryosurgery for localized prostate carcinoma. Cancer 86 (9): 1793-801, 1999. [PUBMED Abstract]
- Donnelly BJ, Saliken JC, Ernst DS, et al.: Prospective trial of cryosurgical ablation of the prostate: five-year results. Urology 60 (4): 645-9, 2002. [PUBMED Abstract]
- Aus G, Pileblad E, Hugosson J: Cryosurgical ablation of the prostate: 5-year follow-up of a prospective study. Eur Urol 42 (2): 133-8, 2002. [PUBMED Abstract]
Tratamiento del cáncer de próstata en estadio IV
Aspectos generales
El sistema de clasificación TNM (tumor, ganglio linfático y metástasis) del American Joint Committee on Cancer define el cáncer de próstata en estadio IV de la siguiente forma:[1]
Estadio IVA
- Cualquier T, N1, M0, cualquier valor del antígeno prostático específico (PSA) y cualquier puntaje de Gleason.
Estadio IVB
- Cualquier T, N0, M1, cualquier valor del PSA y cualquier puntaje de Gleason.
La diseminación extraprostática con invasión microscópica del cuello vesical (T4) se incluye en T3a.
La selección del tratamiento depende de los siguientes factores:
- Edad.
- Enfermedades coexistentes.
- Síntomas.
- La presencia de metástasis a distancia (más a menudo, ósea) o solo un compromiso de los ganglios linfáticos regionales.
Los síntomas más comunes se originan en las vías urinarias o en las metástasis óseas. La paliación de los síntomas de las vías urinarias con la resección transuretral de la próstata (RTUP) o radioterapia, y la paliación de los síntomas de las metástasis óseas con radioterapia o terapia hormonal son una parte importante del tratamiento de estos pacientes. Los bisfosfonatos también se usan para el tratamiento de las metástasis óseas.[2]
Opciones de tratamiento del cáncer de próstata en estadio IV
Las opciones de tratamiento de los pacientes con cáncer de próstata en estadio IV son las siguientes:
- Modificaciones hormonales.
- Modificaciones hormonales con quimioterapia.
- Bisfosfonatos.
- Radioterapia de haz externo, con terapia hormonal o sin esta.
- Radioterapia paliativa.
- Cirugía paliativa con resección transuretral de la próstata.
- Conducta expectante o vigilancia activa (seguimiento activo).
- Prostatectomía radical con orquiectomía inmediata (en evaluación clínica).
Modificaciones hormonales
La terapia hormonal es el pilar del tratamiento para el cáncer de próstata metastásico. La cura es muy infrecuente, pero se producen respuestas subjetivas u objetivas sorprendentes en la mayoría de los pacientes. Lo esencial de la terapia hormonal para el cáncer de próstata es la castración médica o quirúrgica para detener la producción de testosterona en los testículos. A menudo esto se conoce como terapia de privación androgénica (TPA) y se logra con orquiectomía bilateral o mediante la administración de agonistas o antagonistas de la hormona liberadora de gonadotropina (GnRH). El abordaje exclusivamente hormonal más eficaz incluye una combinación de TPA y uno de los siguientes fármacos:
- Acetato de abiraterona, un inhibidor del citocromo P450c17 que es una enzima fundamental para la biosíntesis de andrógenos.
- Apalutamida, un antagonista del receptor de andrógeno.
- Enzalutamida, un antagonista del receptor de andrógeno.
En ensayos aleatorizados controlados se notificó que la terapia combinada con cualquiera de estos fármacos y TPA produce una supervivencia general más prolongada que la TPA sola.
- En un ensayo aleatorizado con enmascaramiento doble, LATITUDE (NCT01715285), a 1199 hombres con cáncer de próstata metastásico de riesgo alto sensible a la castración se les administró TPA, acetato de abiraterona (1000 mg por VO al día) y prednisona (5 mg VO al día) o TPA con placebos de abiraterona y prednisona.[3] La enfermedad de riesgo alto se definió por la presencia de por lo menos 2 de los 3 factores siguientes: Puntaje de Gleason de 8 o mayor; 3 o más lesiones óseas, o metástasis viscerales medibles.
- Después de una mediana de seguimiento de 30,4 meses, se interrumpió el ensayo porque se encontró un beneficio explícito de la supervivencia general (SG) en el grupo de estudio de abiraterona: mediana de supervivencia no alcanzada versus 34,7 meses (cociente de riesgos instantáneos [CRI], 0,62; intervalo de confianza [IC] 95 %, 0,51–0,76; P <0,001).[3][Nivel de evidencia A1]
- La terapia con abiraterona se toleró bien, pero aumentaron los efectos mineralocorticoides de hipertensión o hipopotasemia de grado 3 o 5 en comparación con el grupo de estudio de placebo.
- En un conjunto de desenlaces autonotificados e información sobre la calidad de vida relacionada con la salud (CVRS), se observaron beneficios clínicos en la progresión del dolor, los síntomas relacionados con el cáncer de próstata, la fatiga, el deterioro funcional y la CVRS general en el grupo de acetato de abiraterona en comparación con el grupo de placebo.[4][Nivel de evidencia A3]
- En el ensayo aleatorizado sin anonimato STAMPEDE (NCT00268476), 1917 hombres (alrededor del 95 % con diagnóstico reciente; del 50 % con enfermedad metastásica y del 50 % con enfermedad localmente avanzada o enfermedad con compromiso ganglionar) se trataron con TPA sola o TPA con acetato de abiraterona (1000 mg VO al día) y prednisolona (5 mg por VO al día).[5] La radioterapia local se consideró obligatoria después de 6 a 9 meses para los hombres sin metástasis ni compromiso ganglionar, y opcional para los pacientes sin metástasis pero con compromiso ganglionar. La terapia hormonal se limitó a los 2 años o hasta el momento de progresión de la enfermedad. Se planeó la administración de radioterapia a cerca del 40 % de los participantes del estudio.
- Después de una mediana de seguimiento de 40 meses, la tasa de SG a 3 años fue del 83 % en el grupo de abiraterona en comparación con el 76 % en el grupo que solo recibió TPA (CRIde muerte 0,63; IC 95 %, 0,52–0,76; P = 0,001).[5][Nivel de evidencia A1] Aunque no se identificó evidencia clara de heterogeneidad en las diferencias relativas del tratamiento de la enfermedad metastásica versus la enfermedad no metastásica, las diferencias absolutas fueron mucho más bajas para los hombres con enfermedad no metastásica y no fueron estadísticamente significativas, quizás por un seguimiento corto (CRIde muerte 0,75; IC 95 %, 0,49-1,18).
- Las otras diferencias importantes de la toxicidad relacionada con la abiraterona en comparación con la TPA sola fueron la hipertensión (5 vs. 1 %), el aumento leve de las concentraciones sanguíneas de aminotransferasas (6 vs. <1 %) y los trastornos respiratorios (5 vs. 2 %).
- En el ensayo aleatorizado controlado con enmascaramiento doble de fase III TITAN (NCT02489318), 1052 hombres con cáncer de próstata sensible a la castración se asignaron al azar a recibir TPA sola o TPA con apalutamida (240 mg VO al día) o placebo.[6]
- La tasa de SG a 2 años fue del 82,4 % en el grupo de apalutamida y del 73,5 % en el grupo de placebo (CRI, 0,67; IC 95 %, 0,51−0,89).
- La supervivencia sin progresión (SSP) radiográfica fue del 68,2 % en el grupo de apalutamida y del 47,5 % en el grupo de placebo (CRI, 0,48; IC 95 %, 0,39−0,60).
- Se notificaron efectos adversos de grado 3 o 4 en el 42,2 % de los pacientes del grupo de apalutamida y el 40,8 % de los pacientes del grupo de placebo.
- La apalutamida se relacionó con aumento del riesgo de crisis convulsivas, de manera que los hombres con antecedentes o predisposición a crisis convulsivas se excluyeron del este ensayo.
- En el ensayo aleatorizado controlado sin anonimato de fase III ENZAMET (NCT02446405), 1125 hombres con cáncer de próstata sensible a la castración se asignaron al azar a recibir TPA sola o TPA con enzalutamida (160 mg VO al día).[7]
- La tasa del SG a 3 años fue del 80 % en el grupo de terapia combinada y del 72 % en el grupo de monoterapia de TPA (CRI, 0,67; IC 95 %, 0,52−0,86).
- La SSP según PSA (CRI, 0,39, P < 0,001) y la SSP clínica (CRI, 0,40; P < 0,001) también fueron más prolongadas en el grupo de terapia combinada.
- Se notificaron efectos adversos graves en el 42 % de los pacientes del grupo de enzalutamida en comparación con el 34 % en el grupo de monoterapia.
- El tratamiento se discontinuó de manera más frecuente en el grupo de enzalutamida (33 vs. 14), y las crisis convulsivas y la fatiga fueron más comunes en el grupo de enzalutamida: 7 hombres (1 %) presentaron crisis convulsivas en el grupo de enzalutamida versus ninguno en el grupo de TPA sola.
- En el grupo de terapia combinada el 6 % notificó fatiga de grado 3 a 4 en comparación con el 1% en el grupo de TPA sola.
Las modificaciones hormonales utilizadas eficazmente como tratamiento inicial del cáncer de próstata son las siguientes:[8]
- Orquiectomía sola o con un bloqueador androgénico como se usó en el ensayo del Southwest Oncology Group (SWOG-8894).
- Agonistas de la hormona liberadora de la hormona luteinizante (LH-RH), como leuprolida en preparaciones de administración diaria o de liberación prolongada. Estos medicamentos a veces producen exacerbación sintomática por crecimiento tumoral transitorio; por lo tanto, se debe considerar el uso simultáneo de antiandrógenos cuando hay dolor hepático, obstrucción ureteral o compresión inminente de la médula espinal.[9-12][Nivel de evidencia A1]
- Leuprolida y flutamida;[13] sin embargo, no hay metanálisis en el que se demuestre eficacia de la adición de un antiandrógeno a la leuprolida para mejorar la supervivencia.[14]
- Estrógenos (dietilestilbestrol [DES], clorotrianiseno, etinilestradiol, estrógenos conjugados-USP y difosfato de dietilestilbestrol).
En algunas series, las concentraciones pretratamiento del PSA se relacionaron de manera inversa con el tiempo sin progresión de la enfermedad en los pacientes de cáncer de próstata metastásico que recibieron terapia hormonal. Después del inicio de la terapia hormonal, la reducción de PSA hasta una concentración indetectable proporciona información sobre la duración del estado sin progresión de la enfermedad; sin embargo, es posible que una disminución de PSA menor del 80 % no sea predictiva.[15]
La orquiectomía y los estrógenos producen resultados similares, y la selección de uno u otro depende de la preferencia del paciente y de la morbilidad relacionada con los efectos secundarios previstos. Los estrógenos se relacionan con el inicio o exacerbación de una enfermedad cardiovascular, en especial, cuando se usan en dosis altas. El DES en dosis de 1 mg al día no se relaciona con complicaciones cardiovasculares tan frecuentes como las que se presentan con dosis más altas; sin embargo, el uso de DES disminuyó a causa de la toxicidad cardiovascular.
Las consecuencias psicológicas de una orquiectomía son causa de rechazo de este tratamiento en muchos pacientes; muchos optarán por un tratamiento alternativo si es eficaz.[16] No se indicó el uso de orquiectomía combinada con estrógenos sea superior a cualquiera de los tratamientos solos.[17]
Una gran proporción de hombres presentan sofocos después de la orquiectomía bilateral o el tratamiento con agonistas de la LH-RH. Los sofocos pueden persistir por años.[18] Se notificaron diferentes grados de control sintomático con DES, clonidina, acetato de ciproterona o acetato de medroxiprogesterona.
Después de la progresión tumoral durante el tratamiento con una forma de modificación hormonal, es poco común que ocurra una respuesta tumoral objetiva con cualquier otra forma de modificación hormonal.[19] Sin embargo, en algunos estudios se indica que la interrupción de la flutamida (con administración de aminoglutetimida o sin esta) se relaciona con una disminución del PSA y que es necesario vigilar esta respuesta antes de iniciar un nuevo tratamiento.[20-22] Las dosis bajas de prednisona alivian los síntomas en alrededor del 33 % de los casos.[23] Hay abordajes de tratamiento hormonal nuevos, como la inhibición de los receptores androgénicos, que mejoraron la SG y la calidad de vida (CV) después de la progresión tumoral durante TPA. Para obtener más información, consultar la sección Tratamiento del cáncer de próstata recidivante sensible a las hormonas o resistente a estas.
Terapia hormonal inmediata versus diferida
Para algunos pacientes que permanecen asintomáticos quizás sea apropiado hacer una observación rigurosa sin tratamiento inmediato.
Evidencia (terapia hormonal inmediata versus diferida):
- En un metanálisis de 7 ensayos controlados aleatorizados en los que se comparó el tratamiento hormonal temprano (adyuvante o neoadyuvante) y el tratamiento hormonal diferido (agonistas de LH-RH o antiandrógenos) en pacientes con cáncer de próstata localmente avanzado tratados con prostatectomía, radioterapia, conducta expectante o vigilancia activa (seguimiento activo), se observó una mejoría de la mortalidad general con el tratamiento temprano (riesgo relativo: 0,86, IC 95 %, 0,82–0,91).[24][Nivel de evidencia A1]
- En un ensayo aleatorizado pequeño con 98 hombres sometidos a prostatectomía radical y linfadenectomía pélvica, en quienes se encontraron metástasis ganglionares (estadio T1–2, N1, M0), la terapia hormonal inmediata continua del agonista de la LH-RH goserelina y la orquiectomía se compararon con la terapia diferida hasta que se documentó una progresión de la enfermedad.[25][Nivel de evidencia A1]; [26]
- Después de una mediana de seguimiento de 11,9 años, la SG (P = 0,04) y la supervivencia específica por cáncer de próstata (P = 0,004) fueron superiores en el grupo de terapia adyuvante inmediata.
- A los 10 años, la tasa de supervivencia en el grupo de terapia inmediata fue del 80 % versus el 60 % en el grupo de terapia diferida.[27]
- En otro ensayo (RTOG-8531) con casi el doble de pacientes asignados al azar, no se encontró diferencia en la SG entre la modificación hormonal temprana y diferida.[28]
- La terapia hormonal inmediata con goserelina u orquiectomía también se comparó con la terapia hormonal diferida para la progresión de la enfermedad clínica en un ensayo aleatorizado (EORTC-30846) de hombres con compromiso ganglionar regional, pero sin indicios clínicos de metástasis (cualquier T, N+, M0). Ninguno de los 234 hombres se había sometido a prostatectomía o radioterapia prostática.[29][Nivel de evidencia A1]
- Luego de una mediana de seguimiento de 8,7 años, el CRI para la SG en el grupo de terapia hormonal diferida versus inmediata fue de 1,23 (IC 95 % 0,88–1,71).
- No se encontró una diferencia estadísticamente significativa en la SG entre la terapia hormonal diferida e inmediata, pero el ensayo no tuvo suficiente potencia como para detectar diferencias pequeñas o moderadas.
- En un estudio aleatorizado de hombres con cáncer de próstata metastásico localmente avanzado o metastásico asintomático, se evaluó el tratamiento hormonal inmediato (por ejemplo, orquiectomía o un análogo de la LH-RH) versus el tratamiento diferido (por ejemplo, conducta expectante y terapia hormonal en el momento de progresión de la enfermedad).[30][Nivel de evidencia A1]
- En los resultados iniciales se observó mejoría de la SG y la supervivencia específica por cáncer de próstata con el tratamiento inmediato.
- La incidencia de fracturas patológicas, compresión de la médula espinal y obstrucción uretral también fueron menores en el grupo de tratamiento inmediato.
- En otro ensayo, 197 hombres con cáncer de próstata en estadio III o estadio IV se asignaron al azar para someterse a una orquiectomía bilateral en el momento del diagnóstico o en el momento de progresión sintomática (o nuevas metástasis con probabilidad de causar síntomas).[31][Nivel de evidencia A1]
- Después de 12 años de seguimiento, no se observaron diferencias estadísticamente significativas en la SG.
Agonistas de la hormona liberadora de hormona luteinizante o antiandrógenos
Los abordajes que usan agonistas de la LH-RH o antiandrógenos en pacientes de cáncer de próstata en estadio IV produjeron tasas de respuesta similares a otros tratamientos hormonales.[9,32]
Evidencia (agonistas de la LH-RH o antiandrógenos):
- En un ensayo aleatorizado, el agonista de la LH-RH leuprolida (1 mg por vía subcutánea [SC] al día) fue tan eficaz como DES (3 mg VO al día) en pacientes con cualquier T, cualquier N, M1, pero produjo menos ginecomastia, náuseas, vómitos y tromboembolias.[10]
- En otros estudios aleatorizados, el agonista de la HL-HL goserelina de liberación prolongada fue tan eficaz como la orquiectomía [11,33,34] o el DES en dosis de 3 mg al día.[32] Una preparación de liberación prolongada de leuprolida con equivalencia terapéutica a la administración diaria de leuprolida está disponible para administración mensual o trimestral.
- En una revisión sistemática de 11 ensayos aleatorizados, se comparó la monoterapia antiandrogénica no esteroidea y la castración quirúrgica o farmacológica en 3060 hombres con enfermedad localmente avanzada, metastásica o recidivante después de tratamiento local.[35] El uso de monoterapia con un antiandrógeno no esteroideo disminuyó la SG y aumentó la tasa de progresión tumoral clínica y fracaso del tratamiento.[35][Nivel de evidencia A1]
- En un estudio aleatorizado pequeño en el que se comparó 1 mg de DES VO 3 veces al día con 250 mg de flutamida 3 veces al día en pacientes de cáncer de próstata metastásico, se observaron tasas de respuesta similares con ambos regímenes, pero la supervivencia fue más larga con DES. Hubo más episodios cardiovasculares y tromboembólicos en el grupo de DES, pero las diferencias estuvieron en el límite de significación estadística,[36][Nivel de evidencia A1] Se han probado varias combinaciones de terapia hormonal.
Bloqueo androgénico máximo
Sobre la base de que las glándulas suprarrenales continúan produciendo andrógenos después de la castración quirúrgica o farmacológica, se realizaron estudios de series de casos en los que se añadió terapia antiandrogénica a la castración. Los resultados de las series de casos fueron prometedores y condujeron al uso generalizado de la estrategia que se conoce como bloqueo androgénico máximo (BAM) o total. Sin embargo, los ensayos controlados aleatorizados posteriores ponen en duda la eficacia de añadir un antiandrógeno a la castración.
Evidencia (BAM):
- En un ensayo controlado aleatorizado grande en el que se comparó la orquiectomía bilateral con el antiandrógeno flutamida o un placebo, no se notificó diferencia en la SG.[37][Nivel de evidencia A1]
- Aunque se indicó que el BAM mejoraba el criterio de valoración más subjetivo de tasa de respuesta, en la evaluación prospectiva se encontró que la calidad de vida fue más precaria en el grupo de flutamida que en el grupo placebo, sobre todo debido a más diarrea y un funcionamiento emocional deficiente en el grupo tratado con flutamida.[38][Nivel de evidencia A3]
- En un metanálisis de 27 ensayos aleatorizados con 8275 pacientes en el que se comparó la castración quirúrgica o farmacológica convencional y la combinación de castración, BAM y uso prolongado de un antiandrógeno (flutamida, acetato de ciproterona o nilutamida), no se observó una mejoría estadísticamente significativa de la supervivencia relacionada con el BAM.[14][Nivel de evidencia A1]
Cuando en un análisis de subconjuntos se comparó la privación androgénica versus la combinación de privación androgénica y nilutamida o flutamida, se encontró que la tasa absoluta de supervivencia a 5 años fue mejor en el grupo de terapia combinada (2,9 % mejor, IC 95 %, 0,3–5,5); sin embargo, cuando se comparó la privación androgénica versus la combinación de privación androgénica y acetato de ciproterona, la tendencia absoluta de la supervivencia a los 5 años fue peor en el grupo de terapia combinada (2,8 % peor, IC 95 %, -7,6 a +2,0).[14]
- La Agency for Health Care Policy and Research (ahora Agency for Healthcare Research and Quality) condujo una revisión sistemática de la evidencia de los ensayos clínicos aleatorizados disponibles sobre monoterapias hormonales y bloqueo androgénico total, a cargo de un centro de medicina basada en la evidencia, el Technology Evaluation Center de la Blue Cross and Blue Shield Association. En un metanálisis de ensayos aleatorizados en los que se compararon varias monoterapias hormonales en hombres con cáncer de próstata en estadio III o estadio IV (con predominio del estadio IV), se llegó a las siguientes conclusiones:[39][Nivel de evidencia A1]
- La SG a los 2 años con cualquiera de los agonistas de la LH-RH fue similar al tratamiento con orquiectomía o 3 mg diarios de DES (CRI, 1,26, IC 95 %, 0,92–1,39).
- Las tasas de supervivencia a los 2 años fueron similares o peores en el grupo de antiandrógenos no esteroideos que en el grupo de orquiectomía (CRI 1,22, IC 95 %, 0,99–1,50).
- La tasa de abandono del tratamiento, cuando se usa como criterio sustituto de efectos adversos fue más baja en el grupo de agonistas de la LH-RH (0–4 %) que en el grupo de antiandrógenos no esteroideos (4–10 %).
El bloqueo androgénico total no mostró mayor utilidad que la terapia hormonal sola y el paciente lo tolero menos. Además, la evidencia se consideró insuficiente para determinar si los hombres con diagnóstico reciente de enfermedad metastásica asintomática se deben someter a terapia de privación androgénica inmediata o deberían posponer la terapia hasta que presenten signos o síntomas de progresión.[40]
Terapia hormonal continua versus intermitente
Cuando se usa como tratamiento primario para pacientes con cáncer de próstata en estadio III o estadio IV, la privación androgénica con terapia hormonal se administra a menudo de forma continua hasta la progresión de la enfermedad. Otra opción es usar la privación intermitente de andrógenos como una estrategia para lograr la máxima citorreducción tumoral, seguida de un período sin tratamiento para permitir fases de descanso farmacológico. Se ha propuesto la posibilidad de que esta estrategia produzca mayor sensibilidad hormonal en el tumor durante un período más largo. En un modelo animal se observó que la privación intermitente de andrógenos (PIA), a veces, prolonga la duración de la dependencia androgénica de los tumores sensibles a las hormonas.[41] Sin embargo, en los ensayos controlados aleatorizados en humanos no se ha logrado apoyar la hipótesis de que la PIA demoraría la aparición de la enfermedad resistente a la castración. Los beneficios de la PIA, si es que los hay, son del ámbito del funcionamiento físico y sexual.
Evidencia (terapia hormonal continua versus intermitente):
- En una revisión sistemática de 15 ensayos aleatorizados en los que se comparó la TPA continua y la PIA en pacientes con cáncer de próstata avanzado o recidivante, no se encontraron diferencias significativas en la SG notificada en 8 ensayos (CRI, 1,02; IC 95 %, 0,93–1,11); la supervivencia específica del cáncer de próstata notificada en 5 ensayos (CRI, 1,02; IC 95 %, 0,87–1,19); o la SSP notificada en 4 ensayos (CRI, 0,94; IC 95 %, 0,84–1,05). El metanálisis cumplió con los criterios predefinidos de ausencia de inferioridad de la SG (límite superior de 1,15 para el CRIde muerte 1,15).[42][Nivel de evidencia A1] Sin embargo, los 15 estudios, menos uno, tenían un riesgo alto o impreciso de sesgos de acuerdo con los criterios predefinidos.
- Se informó de una diferencia mínima en la CV notificada por los pacientes, pero en la mayoría de los ensayos se encontró mejor funcionamiento sexual y físico en los pacientes de los grupos de PIA.
Modificaciones hormonales con quimioterapia
En ensayos clínicos aleatorizados, se observó que la SG mejoró al agregar quimioterapia en comparación con el uso de TPA sola, con una eficacia comparable a la de la terapia hormonal de TPA y acetato de abiraterona. Sin embargo, los 2 abordajes no se han comparado de manera directa en un ensayo aleatorizado.
La adición de docetaxel se probó en combinación con terapia hormonal prolongada como tratamiento de primera línea del cáncer de próstata metastásico y se demostró que mejora los resultados más que la terapia hormonal sola. Esta información se resumió en una revisión sistemática y metanálisis de ensayos aleatorizados sobre cáncer de próstata metastásico sensible a las hormonas.[43]
Evidencia (modificaciones hormonales con quimioterapia):
- En el análisis de 3 ensayos aleatorizados (3206 hombres), el CRIde muerte relacionado con la adición de docetaxel a la atención estándar fue de 0,77 (IC 95 %, 0,68–0,87; P < 0,0001), lo que representa una mejora absoluta de la supervivencia a 4 años de 9 % (IC 95 %, 5–14).[43][Nivel de evidencia A1]
- En el estudio CHAARTED (NCT00309985), se asignó al azar a 790 hombres con cáncer de próstata metastásico resistente a las hormonas para recibir TPA con docetaxel (75 mg/m2 intravenoso [IV] cada 3 semanas durante 6 ciclos), o sin este.[44,45] Se permitió el antecedente de TPA adyuvante si se administró durante un máximo de 12 meses y la progresión se presentó dentro de los 12 meses de terminar esta terapia. Los pacientes se estratificaron de forma prospectiva en un grupo de enfermedad de volumen alto (metástasis viscerales o por lo menos 4 lesiones óseas, una de estas fuera la columna vertebral o la pelvis) y un grupo de enfermedad de volumen bajo. Según esta definición, el 65 % de los pacientes presentaban enfermedad de volumen alto.
- Luego de una mediana de seguimiento de 53,7 meses, la mediana de SG en el grupo de TPA y docetaxel fue de 57,6 meses, y en el grupo de TPA sola fue de 47,2 meses (CRIde muerte 0,72; IC del 95 %, 0,59–0,89; P = 0,018).[45][Nivel de evidencia A1]
- Solo se observó ventaja de supervivencia en pacientes con enfermedad de volumen alto. En el grupo de enfermedad de volumen alto, hubo una mejora inequívoca en la mediana de SG (61,2 vs. 34,4 meses) (CRI, 0,63; IC 95 %, 0,50–0,79; P < 0,001). Sin embargo, no se observó diferencia en la supervivencia de los hombres con enfermedad de volumen bajo (mediana de SG, 63,5 meses vs. no alcanzada) (CRI, 1,04; IC 95 %, 0,70–1,55; P = 0,86). La prueba de heterogeneidad de la eficacia fue estadísticamente significativa (P = 0,033).
- En la comparación de CV entre los dos grupos de estudio, medida mediante la escala Functional Assessment of Cancer Therapy-Prostate (FACT-P), no se encontró que la diferencia superara la diferencia mínima importante definida de forma prospectiva, en ningún punto de los 12 meses de evaluación planificada.[46]
Bisfosfonatos
Además de la terapia hormonal, también se evaluó el tratamiento adyuvante con bisfosfonatos.[47]
Evidencia (bisfosfonatos):
- En el ensayo MRC-PR05, 311 hombres con metástasis óseas que comenzaban a responder a la terapia hormonal estándar se asignaron al azar a clodronato de sodio oral (2080 mg al día) o placebo idéntico durante máximo de 3 años.[47][Nivel de evidencia A1]
- Al cabo de una mediana de seguimiento de 11,5 años, la SG fue mejor en el grupo de clodronato: CRIde muerte 0,77 (IC 95 %, 0,60–0,98; P = 0,032).
- Las tasas de supervivencia a 5 y 10 años fueron de 30 y 17 % en el grupo de clodronato versus 21 y 9 % en el grupo de placebo.
- En un estudio paralelo (MRC-PR04) de hombres con enfermedad localmente avanzada, pero no metastásica, no se observaron beneficios relacionados con el clodronato.
- El CALGB-90202 [NCT00079001] fue un ensayo controlado aleatorizado en el que se comparó el ácido zoledrónico (4 mg IV cada 4 semanas) y un placebo en 645 hombres con cáncer de próstata sensible a la privación androgénica que tenían metástasis óseas. Los pacientes con progresión de la enfermedad y resistencia a la terapia hormonal recibieron ácido zoledrónico sin enmascaramiento del tratamiento.[48][Nivel de evidencia B1]
- No hubo diferencia entre los dos grupos de estudio en cuanto al criterio principal de valoración de complicaciones óseas (definidas como fracturas clínicas, compresión de la médula espinal, los episodios que exigieran tratamiento paliativo de radiación o cirugía ósea y los casos de muerte por cáncer de próstata) después de un seguimiento máximo de 7 años.
- Tampoco hubo diferencias en la SSP ni en la SG.
- En otro ensayo aleatorizado de resultados nulos, (STAMPEDE [NCT00268476]), 1245 hombres con cáncer de próstata localmente avanzado (M0) o metastásico (M1) tratados al inicio con terapia hormonal a largo plazo, se asignaron al azar en una proporción 2:1:1 a 1 de 3 grupos: grupo de atención estándar, grupo de celecoxib (400 mg 2 veces al día durante 1 año) y grupo de celecoxib con ácido zoledrónico (4 mg IV durante 6 ciclos de 3 semanas y luego ciclos de 4 semanas durante 2 años).[49]
- Después de una mediana de seguimiento de 69 meses, no se detectó mejora en la supervivencia del grupo de celecoxib solo o celecoxib con ácido zoledrónico.
- Aunque la supervivencia fue mejor para los pacientes de enfermedad M que recibieron celecoxib y ácido zoledrónico en comparación con los pacientes de enfermedad M1 que recibieron la atención estándar (CRIde muerte 0,78; IC 95 %, 0,62–0,98), no se encontraron diferencias estadísticamente significativas en la prueba oficial de interacción del estado metastásico; por lo tanto, se contempla que este resultado inesperado genere nuevas hipótesis.
Bisfosfonatos y disminución del riesgo de metástasis óseas
Los pacientes con enfermedad localmente avanzada no metastásica (T2–T4, N0–N1 y M0) están en riesgo de presentar metástasis óseas y se estudia el uso de bisfosfonatos como estrategia para reducir este riesgo. Sin embargo, en un ensayo aleatorizado controlado con placebo (MRC-PR04) de un régimen de 5 años de tratamiento con el bisfosfonato de primera generación clodronato en dosis altas por vía oral (2080 mg diarios), no se encontró un efecto favorable en la supervivencia ni en el tiempo transcurrido hasta que se presentara una metástasis ósea sintomática.[50][Nivel de evidencia A1]
Radioterapia de haz externo con terapia hormonal o sin esta
La radioterapia de haz externo (RHE) se puede usar para intentar la curación de algunos pacientes en estadio M0 muy seleccionados.[51,52] La radioterapia definitiva se deberá postergar hasta 4 a 6 semanas después de la RTUP para reducir la incidencia de estenosis.[53]
Además de RHE, se deberá considerar el uso de terapia hormonal.[40,54]
Evidencia (radioterapia con terapia hormonal o sin esta):
- En un centro de medicina basada en la evidencia Blue Cross and Blue Shield Asociación Technology Evaluation Center de la Agency for Healthcare Research and Quality (AHRQ), se condujo una revisión sistemática de los ensayos clínicos aleatorizados disponibles en los que se compara la radioterapia sola y la combinación de radioterapia con privación androgénica prolongada.[40][Nivel de evidencia A1] En los grupos estudiados se incluyó a algunos pacientes con tumores voluminosos T2b.
- En el metanálisis se encontró una diferencia en la SG a 5 años a favor de la radioterapia con privación androgénica continua (un agonista de la LH-RH u orquiectomía) en comparación con la radioterapia sola (CRI, 0,63; IC 95 %, 0,48–0,83).
- En un ensayo aleatorizado prospectivo, el tratamiento de privación androgénica con un agonista LH-RH durante 18 meses y 36 meses produjo resultados similares de SG y supervivencia específica de la enfermedad.[55] [Nivel de evidencia A1] En el ensayo, 630 hombres con cáncer en estadios II a IVA (estadio clínico T3–T4, PSA >20 ng/ml o puntaje de Gleason >7) recibieron 70 Gy de radiación en 35 fracciones además de 18 o 36 meses acetato de goserelina.
- Al cabo de una mediana de seguimiento de 9,4 años, la SG fue casi idéntica en ambos grupos del estudio (62 % a los 10 años; CRIde muerte, 1,02; IC 95 %, 0,81–1,29; P = 0,8), al igual que la supervivencia específica del cáncer de próstata (CRIde muerte por cáncer de próstata, 0,95; IC 95 %, 0,58–0,55; P = 0,8).
- La calidad de vida general fue casi idéntica en ambos grupos del estudio, pero la actividad sexual y el interés sexual fue un poco mejor en el grupo de 18 meses.[55][Nivel de evidencia A3]
- La duración óptima de la terapia hormonal neoadyuvante se estudió en un ensayo aleatorizado (TROG 96.01 [ACTRN12607000237482]) en 818 hombres con cáncer no metastásico localmente avanzado (T2b, T2c, T3 y T4) tratados con radioterapia (es decir, 66 Gy en fracciones diarias de 2 Gy dirigidos a la próstata y las vesículas seminales, pero sin incluir los ganglios linfáticos regionales). Los pacientes se asignaron al azar a radioterapia sola, 3 meses de terapia de privación androgénica neoadyuvante (TPAN) (goserelina, 3,6 mg SC mensual y flutamida, 250 mg VO 3 veces al día) comenzando 2 meses antes de la radioterapia, o 6 meses de TPAN comenzando 5 meses antes de la radioterapia.[54][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 10,6 años, no hubo diferencias estadísticamente significativas entre el grupo de radiación sola y el grupo de radiación con 3 meses de TPAN.
- Sin embargo, el grupo de 6 meses de TPAN mostró mejores resultados para la mortalidad específica por cáncer de próstata y la mortalidad por cualquier causa en comparación con el grupo de radiación sola; la mortalidad por cualquier causa a 10 años fue de 29,2 vs. 42,5 % (CRI, 0,63; IC 95 %, 0,48–0,83; P = 0,0008).
- En otro ensayo (RTOG-9910 [NCT00005044]) se puso a prueba la duración de la terapia hormonal neoadyuvante. En este ensayo participaron 1489 hombres aptos con cáncer de próstata de riesgo intermedio (T1b–4, puntaje de Gleason 2–6 y PSA >10, pero ≤100 ng/ml; T1b–4, puntaje de Gleason 7 y PSA <20; o T1b–1c, puntaje de Gleason 8–10 y PSA <20) y sin indicios de metástasis. Los hombres se asignaron al azar a recibir un ciclo corto de privación androgénica neoadyuvante (un agonista de la LH-RH con bicalutamida o flutamida durante 8 semanas antes de la radioterapia y 8 semanas durante esta) o un ciclo prolongado de privación androgénica neoadyuvante (28 semanas antes de la radioterapia y 8 semanas durante esta). Ambos grupos recibieron 70,2 Gy de radiación dirigida a la próstata en 39 fracciones diarias y 46,8 Gy dirigidos a los ganglios linfáticos ilíacos.[56][Nivel de evidencia A1]
- Después de una mediana de 9,4 años, la mortalidad específica por cáncer de próstata a 10 años (criterio principal de valoración) fue baja en ambos grupos del estudio: el 5 % versus el 4 % (CRI, 0,81; IC 95 %, 0,48–1,39).[56][Nivel de evidencia A1]
- No se encontraron diferencias estadísticamente significativas en la mortalidad general o en la progresión locorregional de la enfermedad.[56][Nivel de evidencia A1]
- Tampoco hubo un efecto diferencial evidente de la duración de la privación androgénica en ninguno de los subconjuntos de grupos de riesgo.
Radioterapia paliativa
Una sola fracción de 8 Gy produjo beneficios similares en términos de alivio del dolor óseo y CV que las fracciones múltiples (3 Gy × 10), como se probó en el ensayo RTOG-9714 (NCT00003162).[57]; [58][Nivel de evidencia A3] Para obtener más información, consultar El dolor y el cáncer.
Cirugía paliativa con resección transuretral de la próstata
La resección transuretral de la próstata (RTUP) a veces es útil para aliviar una obstrucción urinaria como parte de la atención paliativa por un cáncer de próstata en estadio avanzado.
Conducta expectante o vigilancia activa (seguimiento activo)
Observación rigurosa sin tratamiento inmediato (para pacientes asintomáticos seleccionados).[59]
Prostatectomía radical con orquiectomía inmediata
En una revisión retrospectiva no controlada de una serie grande de pacientes con enfermedad T, N1–3, M0, tratados en la Mayo Clinic con prostatectomía radical y orquiectomía simultáneas, se encontró que el tratamiento se relacionó con intervalos de tiempo hasta la progresión local y a distancia; sin embargo, no se demostró mejora de la SG.[60] Los aspectos relacionados con la selección de pacientes dificultan la interpretación de estos estudios.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Prostate. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 715–26.
- Dearnaley DP, Sydes MR, Mason MD, et al.: A double-blind, placebo-controlled, randomized trial of oral sodium clodronate for metastatic prostate cancer (MRC PR05 Trial). J Natl Cancer Inst 95 (17): 1300-11, 2003. [PUBMED Abstract]
- Fizazi K, Tran N, Fein L, et al.: Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 377 (4): 352-360, 2017. [PUBMED Abstract]
- Chi KN, Protheroe A, Rodríguez-Antolín A, et al.: Patient-reported outcomes following abiraterone acetate plus prednisone added to androgen deprivation therapy in patients with newly diagnosed metastatic castration-naive prostate cancer (LATITUDE): an international, randomised phase 3 trial. Lancet Oncol 19 (2): 194-206, 2018. [PUBMED Abstract]
- James ND, de Bono JS, Spears MR, et al.: Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy. N Engl J Med 377 (4): 338-351, 2017. [PUBMED Abstract]
- Chi KN, Agarwal N, Bjartell A, et al.: Apalutamide for Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 381 (1): 13-24, 2019. [PUBMED Abstract]
- Davis ID, Martin AJ, Stockler MR, et al.: Enzalutamide with Standard First-Line Therapy in Metastatic Prostate Cancer. N Engl J Med 381 (2): 121-131, 2019. [PUBMED Abstract]
- Scott WW, Menon M, Walsh PC: Hormonal therapy of prostatic cancer. Cancer 45 (7 Suppl): 1929-36, 1980. [PUBMED Abstract]
- Parmar H, Edwards L, Phillips RH, et al.: Orchiectomy versus long-acting D-Trp-6-LHRH in advanced prostatic cancer. Br J Urol 59 (3): 248-54, 1987. [PUBMED Abstract]
- Leuprolide versus diethylstilbestrol for metastatic prostate cancer. The Leuprolide Study Group. N Engl J Med 311 (20): 1281-6, 1984. [PUBMED Abstract]
- Peeling WB: Phase III studies to compare goserelin (Zoladex) with orchiectomy and with diethylstilbestrol in treatment of prostatic carcinoma. Urology 33 (5 Suppl): 45-52, 1989. [PUBMED Abstract]
- Sharifi R, Soloway M: Clinical study of leuprolide depot formulation in the treatment of advanced prostate cancer.The Leuprolide Study Group. J Urol 143 (1): 68-71, 1990. [PUBMED Abstract]
- Crawford ED, Eisenberger MA, McLeod DG, et al.: A controlled trial of leuprolide with and without flutamide in prostatic carcinoma. N Engl J Med 321 (7): 419-24, 1989. [PUBMED Abstract]
- Maximum androgen blockade in advanced prostate cancer: an overview of the randomised trials. Prostate Cancer Trialists' Collaborative Group. Lancet 355 (9214): 1491-8, 2000. [PUBMED Abstract]
- Matzkin H, Eber P, Todd B, et al.: Prognostic significance of changes in prostate-specific markers after endocrine treatment of stage D2 prostatic cancer. Cancer 70 (9): 2302-9, 1992. [PUBMED Abstract]
- Cassileth BR, Soloway MS, Vogelzang NJ, et al.: Patients' choice of treatment in stage D prostate cancer. Urology 33 (5 Suppl): 57-62, 1989. [PUBMED Abstract]
- Byar DP: Proceedings: The Veterans Administration Cooperative Urological Research Group's studies of cancer of the prostate. Cancer 32 (5): 1126-30, 1973. [PUBMED Abstract]
- Karling P, Hammar M, Varenhorst E: Prevalence and duration of hot flushes after surgical or medical castration in men with prostatic carcinoma. J Urol 152 (4): 1170-3, 1994. [PUBMED Abstract]
- Small EJ, Vogelzang NJ: Second-line hormonal therapy for advanced prostate cancer: a shifting paradigm. J Clin Oncol 15 (1): 382-8, 1997. [PUBMED Abstract]
- Scher HI, Kelly WK: Flutamide withdrawal syndrome: its impact on clinical trials in hormone-refractory prostate cancer. J Clin Oncol 11 (8): 1566-72, 1993. [PUBMED Abstract]
- Sartor O, Cooper M, Weinberger M, et al.: Surprising activity of flutamide withdrawal, when combined with aminoglutethimide, in treatment of "hormone-refractory" prostate cancer. J Natl Cancer Inst 86 (3): 222-7, 1994. [PUBMED Abstract]
- Small EJ, Srinivas S: The antiandrogen withdrawal syndrome. Experience in a large cohort of unselected patients with advanced prostate cancer. Cancer 76 (8): 1428-34, 1995. [PUBMED Abstract]
- Tannock I, Gospodarowicz M, Meakin W, et al.: Treatment of metastatic prostatic cancer with low-dose prednisone: evaluation of pain and quality of life as pragmatic indices of response. J Clin Oncol 7 (5): 590-7, 1989. [PUBMED Abstract]
- Boustead G, Edwards SJ: Systematic review of early vs deferred hormonal treatment of locally advanced prostate cancer: a meta-analysis of randomized controlled trials. BJU Int 99 (6): 1383-9, 2007. [PUBMED Abstract]
- Messing EM, Manola J, Sarosdy M, et al.: Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. N Engl J Med 341 (24): 1781-8, 1999. [PUBMED Abstract]
- Eisenberger MA, Walsh PC: Early androgen deprivation for prostate cancer? N Engl J Med 341 (24): 1837-8, 1999. [PUBMED Abstract]
- Messing EM, Manola J, Yao J, et al.: Immediate versus deferred androgen deprivation treatment in patients with node-positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy. Lancet Oncol 7 (6): 472-9, 2006. [PUBMED Abstract]
- Lawton CA, Winter K, Grignon D, et al.: Androgen suppression plus radiation versus radiation alone for patients with stage D1/pathologic node-positive adenocarcinoma of the prostate: updated results based on national prospective randomized trial Radiation Therapy Oncology Group 85-31. J Clin Oncol 23 (4): 800-7, 2005. [PUBMED Abstract]
- Schröder FH, Kurth KH, Fosså SD, et al.: Early versus delayed endocrine treatment of pN1-3 M0 prostate cancer without local treatment of the primary tumor: results of European Organisation for the Research and Treatment of Cancer 30846--a phase III study. J Urol 172 (3): 923-7, 2004. [PUBMED Abstract]
- Immediate versus deferred treatment for advanced prostatic cancer: initial results of the Medical Research Council Trial. The Medical Research Council Prostate Cancer Working Party Investigators Group. Br J Urol 79 (2): 235-46, 1997. [PUBMED Abstract]
- Studer UE, Hauri D, Hanselmann S, et al.: Immediate versus deferred hormonal treatment for patients with prostate cancer who are not suitable for curative local treatment: results of the randomized trial SAKK 08/88. J Clin Oncol 22 (20): 4109-18, 2004. [PUBMED Abstract]
- Waymont B, Lynch TH, Dunn JA, et al.: Phase III randomised study of zoladex versus stilboestrol in the treatment of advanced prostate cancer. Br J Urol 69 (6): 614-20, 1992. [PUBMED Abstract]
- Vogelzang NJ, Chodak GW, Soloway MS, et al.: Goserelin versus orchiectomy in the treatment of advanced prostate cancer: final results of a randomized trial. Zoladex Prostate Study Group. Urology 46 (2): 220-6, 1995. [PUBMED Abstract]
- Kaisary AV, Tyrrell CJ, Peeling WB, et al.: Comparison of LHRH analogue (Zoladex) with orchiectomy in patients with metastatic prostatic carcinoma. Br J Urol 67 (5): 502-8, 1991. [PUBMED Abstract]
- Kunath F, Grobe HR, Rücker G, et al.: Non-steroidal antiandrogen monotherapy compared with luteinising hormone-releasing hormone agonists or surgical castration monotherapy for advanced prostate cancer. Cochrane Database Syst Rev (6): CD009266, 2014. [PUBMED Abstract]
- Chang A, Yeap B, Davis T, et al.: Double-blind, randomized study of primary hormonal treatment of stage D2 prostate carcinoma: flutamide versus diethylstilbestrol. J Clin Oncol 14 (8): 2250-7, 1996. [PUBMED Abstract]
- Eisenberger MA, Blumenstein BA, Crawford ED, et al.: Bilateral orchiectomy with or without flutamide for metastatic prostate cancer. N Engl J Med 339 (15): 1036-42, 1998. [PUBMED Abstract]
- Moinpour CM, Savage MJ, Troxel A, et al.: Quality of life in advanced prostate cancer: results of a randomized therapeutic trial. J Natl Cancer Inst 90 (20): 1537-44, 1998. [PUBMED Abstract]
- Seidenfeld J, Samson DJ, Hasselblad V, et al.: Single-therapy androgen suppression in men with advanced prostate cancer: a systematic review and meta-analysis. Ann Intern Med 132 (7): 566-77, 2000. [PUBMED Abstract]
- Seidenfeld J, Samson DJ, Aronson N, et al.: Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer. Evid Rep Technol Assess (Summ) (4): i-x, 1-246, I1-36, passim, 1999. [PUBMED Abstract]
- Calais da Silva FE, Bono AV, Whelan P, et al.: Intermittent androgen deprivation for locally advanced and metastatic prostate cancer: results from a randomised phase 3 study of the South European Uroncological Group. Eur Urol 55 (6): 1269-77, 2009. [PUBMED Abstract]
- Magnan S, Zarychanski R, Pilote L, et al.: Intermittent vs Continuous Androgen Deprivation Therapy for Prostate Cancer: A Systematic Review and Meta-analysis. JAMA Oncol 1 (9): 1261-9, 2015. [PUBMED Abstract]
- Vale CL, Burdett S, Rydzewska LH, et al.: Addition of docetaxel or bisphosphonates to standard of care in men with localised or metastatic, hormone-sensitive prostate cancer: a systematic review and meta-analyses of aggregate data. Lancet Oncol 17 (2): 243-56, 2016. [PUBMED Abstract]
- Sweeney CJ, Chen YH, Carducci M, et al.: Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer. N Engl J Med 373 (8): 737-46, 2015. [PUBMED Abstract]
- Kyriakopoulos CE, Chen YH, Carducci MA, et al.: Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer: Long-Term Survival Analysis of the Randomized Phase III E3805 CHAARTED Trial. J Clin Oncol 36 (11): 1080-1087, 2018. [PUBMED Abstract]
- Morgans AK, Chen YH, Sweeney CJ, et al.: Quality of Life During Treatment With Chemohormonal Therapy: Analysis of E3805 Chemohormonal Androgen Ablation Randomized Trial in Prostate Cancer. J Clin Oncol 36 (11): 1088-1095, 2018. [PUBMED Abstract]
- Dearnaley DP, Mason MD, Parmar MK, et al.: Adjuvant therapy with oral sodium clodronate in locally advanced and metastatic prostate cancer: long-term overall survival results from the MRC PR04 and PR05 randomised controlled trials. Lancet Oncol 10 (9): 872-6, 2009. [PUBMED Abstract]
- Smith MR, Halabi S, Ryan CJ, et al.: Randomized controlled trial of early zoledronic acid in men with castration-sensitive prostate cancer and bone metastases: results of CALGB 90202 (alliance). J Clin Oncol 32 (11): 1143-50, 2014. [PUBMED Abstract]
- Mason MD, Clarke NW, James ND, et al.: Adding Celecoxib With or Without Zoledronic Acid for Hormone-Naïve Prostate Cancer: Long-Term Survival Results From an Adaptive, Multiarm, Multistage, Platform, Randomized Controlled Trial. J Clin Oncol 35 (14): 1530-1541, 2017. [PUBMED Abstract]
- Mason MD, Sydes MR, Glaholm J, et al.: Oral sodium clodronate for nonmetastatic prostate cancer--results of a randomized double-blind placebo-controlled trial: Medical Research Council PR04 (ISRCTN61384873). J Natl Cancer Inst 99 (10): 765-76, 2007. [PUBMED Abstract]
- Bagshaw MA: External radiation therapy of carcinoma of the prostate. Cancer 45 (7 Suppl): 1912-21, 1980. [PUBMED Abstract]
- Ploysongsang S, Aron BS, Shehata WM, et al.: Comparison of whole pelvis versus small-field radiation therapy for carcinoma of prostate. Urology 27 (1): 10-6, 1986. [PUBMED Abstract]
- Seymore CH, el-Mahdi AM, Schellhammer PF: The effect of prior transurethral resection of the prostate on post radiation urethral strictures and bladder neck contractures. Int J Radiat Oncol Biol Phys 12 (9): 1597-600, 1986. [PUBMED Abstract]
- Denham JW, Steigler A, Lamb DS, et al.: Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 12 (5): 451-9, 2011. [PUBMED Abstract]
- Nabid A, Carrier N, Martin AG, et al.: Duration of Androgen Deprivation Therapy in High-risk Prostate Cancer: A Randomized Phase III Trial. Eur Urol 74 (4): 432-441, 2018. [PUBMED Abstract]
- Pisansky TM, Hunt D, Gomella LG, et al.: Duration of androgen suppression before radiotherapy for localized prostate cancer: radiation therapy oncology group randomized clinical trial 9910. J Clin Oncol 33 (4): 332-9, 2015. [PUBMED Abstract]
- Kaasa S, Brenne E, Lund JA, et al.: Prospective randomised multicenter trial on single fraction radiotherapy (8 Gy x 1) versus multiple fractions (3 Gy x 10) in the treatment of painful bone metastases. Radiother Oncol 79 (3): 278-84, 2006. [PUBMED Abstract]
- Chow E, Harris K, Fan G, et al.: Palliative radiotherapy trials for bone metastases: a systematic review. J Clin Oncol 25 (11): 1423-36, 2007. [PUBMED Abstract]
- Stattin P, Holmberg E, Johansson JE, et al.: Outcomes in localized prostate cancer: National Prostate Cancer Register of Sweden follow-up study. J Natl Cancer Inst 102 (13): 950-8, 2010. [PUBMED Abstract]
- Zincke H: Extended experience with surgical treatment of stage D1 adenocarcinoma of prostate. Significant influences of immediate adjuvant hormonal treatment (orchiectomy) on outcome. Urology 33 (5 Suppl): 27-36, 1989. [PUBMED Abstract]
Tratamiento del cáncer de próstata recidivante sensible a las hormonas o resistente a estas
Aspectos generales
El tratamiento del cáncer de próstata recidivante sensible a las hormonas o resistente a estas depende de muchos factores, como los siguientes:
- Tratamiento previo.
- Sitio de recidiva.
- Enfermedades coexistentes.
- Estado particular de cada paciente.
La radioterapia definitiva se puede administrar a los pacientes que con recidiva local de la enfermedad después de una prostatectomía.[1-4] En un ensayo aleatorizado (RTOG-9601 [NCT00002874]) se observó una mejora de la supervivencia general (SG) y la supervivencia específica al cáncer de próstata cuando se usó una combinación de dosis altas de bicalutamida y radioterapia, en comparación con radioterapia sola para hombres con cáncer de próstata y recidiva local después de una prostatectomía radical.[5]
- En el ensayo, 760 hombres tratados inicialmente con prostatectomía radical para tumores en estadios T2 o T3, con concentraciones detectables del antígeno prostático específico (PSA) de 0,2 a 4,0 ng/ml, pero sin indicios de metástasis, se asignaron al azar para recibir radiación (64,8 Gy en 36 fracciones) y bicalutamida (150 mg VO al día) o placebo durante 24 meses. La mediana del intervalo desde la cirugía hasta que el PSA fuera detectable fue de 1,4 años, y la mediana del intervalo desde la cirugía hasta la aleatorización fue de 2,1 años. La mediana de seguimiento fue de 13 años.
- La tasa actuarial de SG a 12 años fue del 76,3 % en el grupo de bicalutamida vs. el 71,3 % en el grupo de placebo (cociente de riesgos instantáneos [CRI], 0,77; intervalo de confianza [IC] 95 %, 0,59–0,99; P = 0,04).[5][Nivel de evidencia A1]
- La mortalidad específica por cáncer de próstata a los 12 años fue del 5,8 % (bicalutamida) versus el 13,4 % (placebo), (CRI, 0,49; IC 95 %, 0,32–0,74); P < 0,001).[5][Nivel de evidencia A1]
- La mayoría de los efectos tóxicos relacionados con el tratamiento fueron similares en ambos grupos, con excepción de la ginecomastia, que se presentó en el 69,7 % de los hombres que recibieron bicalutamida versus el 10,9 % en aquellos que recibieron placebo. Es posible mitigar este efecto secundario mediante la irradiación profiláctica de la mama, pero no se usó en este estudio debido al diseño con enmascaramiento doble.
Algunos pacientes que presentan recidiva local después de la radioterapia definitiva se recuperan con prostatectomía.[6] Sin embargo, solo el 10 % de los pacientes tratados inicialmente con radioterapia presentarán una recidiva local aislada. En estos pacientes, el control prolongado de la enfermedad a menudo se logra con terapia hormonal, con una mediana de supervivencia específica por cáncer de 6 años después del fracaso terapéutico local.[7]
Cuando la recidiva después de la radioterapia se trata con ablación crioquirúrgica es común que la tasa de complicaciones sea alta. Esta técnica todavía está en evaluación clínica.[8]
La terapia hormonal se utiliza para tratar a la mayoría de los pacientes que recaen con enfermedad diseminada y que recibieron inicialmente tratamiento locorregional con cirugía o radioterapia. Para obtener más información, consultar la sección Opciones de tratamiento estándar del cáncer de próstata en estadio IV.
Terapia hormonal inmediata versus diferida
Para obtener más información sobre el uso de la terapia hormonal inmediata (bicalutamida o agonistas de la hormona liberadora de hormona luteinizante [LH-RH]) y la radiación en pacientes de cáncer de próstata y recidiva local después de la prostatectomía radical, consultar la sección Aspectos generales de las opciones de tratamiento del cáncer de próstata.
El PSA se utiliza a menudo para controlar a los pacientes después del tratamiento inicial con intención curativa; el PSA elevado o en aumento es un desencadenante común de tratamiento adicional, incluso en los hombres asintomáticos. A pesar de que esta situación es muy común, no está claro si administrar tratamientos adicionales debido a una concentración del PSA en aumento en hombres con cáncer de próstata prolonga la SG. La calidad de la evidencia es limitada.
- Después de una prostatectomía radical, la detección de concentraciones del PSA permite identificar a los pacientes con riesgo elevado de fracaso terapéutico con recidiva local o enfermedad metastásica;[9] sin embargo, una proporción importante de pacientes con una concentración del PSA elevada o en aumento después de la cirugía, permanece sin síntomas clínicos durante períodos prolongados.[10] Por ejemplo, en un análisis retrospectivo de casi 2000 hombres sometidos a prostatectomía radical con intención curativa y en seguimiento durante una media de 5,3 años, se encontró que 315 hombres (15 %) tenían una concentración del PSA anormal de 0,2 ng/ml o más, que se considera un signo de recidiva bioquímica.[11]
- De estos 315 hombres, 103 (34 %) manifestaron una recidiva clínica.
- La mediana de tiempo hasta que se presentaran metástasis clínicas después de la recidiva bioquímica fue de 8 años.
- Después de que los hombres presentaron enfermedad metastásica, la mediana de tiempo hasta la muerte fue de 5 años adicionales.
- Del mismo modo, después de la radioterapia con intención curativa, el PSA elevado de manera persistente o en aumento a veces es un factor pronóstico de recidiva clínica de la enfermedad. Sin embargo, en las series de casos notificadas se usaron muchas definiciones de la recaída del PSA. El American Society for Therapeutic Radiology and Oncology Consensus Panel formuló criterios sobre este tema.[12,13] No se conocen las consecuencias en la SG de usar distintas definiciones de recaída del PSA y, al igual que ocurre en las series quirúrgicas, es posible que muchas recaídas bioquímicas (aumento del PSA solo) no se manifiesten clínicamente en los pacientes tratados con radioterapia.[14,15]
- En un ensayo aleatorizado (PMCC-VCOG-PR-0103 [NCT00110162 ]) de terapia de privación androgénica (TPA) en hombres que recibieron tratamiento curativo, pero que tenían concentraciones del PSA en aumento, se proporcionan evidencia de la mejora de la SG relacionada con la terapia inmediata versus la terapia diferida.[16] El estudio tuvo algunas limitaciones importantes.
- Dos grupos de hombres se asignaron al azar y sin anonimato a recibir TPA inmediata o TPA diferida (al menos 2 años de retraso):
- El grupo 1 incluyó a los hombres que presentaron recaída del PSA después del tratamiento curativo (89 % de la población del estudio).
- El grupo 2 incluyó a los hombres asintomáticos que no se consideraron aptos para el tratamiento curativo debido a la edad, comorbilidades o una enfermedad local avanzada (11 % de la población en estudio).
Se proyectó la inclusión de 750 pacientes; pero el ensayo se cerró con 293 pacientes debido a una inscripción lenta.
- En el análisis combinado de los grupos 1 y 2 realizado después de una mediana de seguimiento de 5 años, la tasa de SG a 5 años fue del 86,4 % en el grupo de TPA diferida versus el 91,2 % en el grupo de TPA inmediata (orden logarítmico P = 0,047).[16][Nivel de evidencia A1] Después de un ajuste completo de acuerdo con las características iniciales, el CRI de la SG fue de 0,54 (IC 95 %, 0,27–1,06; P = 0,074).
- En el análisis del grupo 1 solo (recidiva de TPA después del tratamiento curativo, N = 261), la tasa de supervivencia a 5 años estimada fue del 78,2 % versus el 84,3 % con TPA diferida versus inmediata (orden logarítmico P = 0,10; CRI con ajuste completo, 0,59; IC 95 %, 0,26–1,30, P = 0,19).
- La toxicidad fue más alta en el grupo de TPA inmediata comparado con el grupo de terapia diferida. Se notificaron efectos adversos graves (grado 4) en el 42 % de los pacientes del grupo de estudio de TPA inmediata versus el 31 % de los pacientes del grupo de terapia diferida. La calidad de vida (CV) se redujo hasta el 6,1 % (considerado un descenso pequeño pero clínicamente significativo) con la TPA inmediata vs. el 3 % con la TPA diferida (que se consideró un descenso insignificante); la diferencia no fue estadísticamente significativa (P = 0,14).[16] La actividad sexual fue más baja y los síntomas hormonales (sofocos y pezones hipersensibles o agrandados) fueron peores en el grupo de TPA inmediata en comparación con el grupo de TPA diferida; estas diferencias fueron significativas desde el punto de vista estadístico y clínico.[17]
- Dos grupos de hombres se asignaron al azar y sin anonimato a recibir TPA inmediata o TPA diferida (al menos 2 años de retraso):
Terapia hormonal para la enfermedad recidivante
Terapia hormonal continua versus intermitente
La mayoría de los hombres que reciben tratamiento para una recidiva después de la terapia local inicial son asintomáticos, y la recidiva se detecta por un aumento del PSA. Es posible que la terapia de privación intermitente de andrógenos (PIA) se utilice como una alternativa a la TPA continua (PAC) para mejorar la CV y disminuir la duración de los efectos secundarios de la terapia hormonal, sin disminuir la tasa de supervivencia.
- En un ensayo controlado aleatorizado con diseño de ausencia de inferioridad se abordó esta pregunta clínica con la participación de 1386 hombres que presentaban un aumento de las concentraciones del PSA (>3 ng/ml, y testosterona sérica >5 nmol/l) más de 1 año después de la radioterapia primaria o de rescate para cáncer de próstata localizado.[18][Niveles de evidencia A1 y A3]
- El grupo de TPA se sometió a ciclos de tratamiento de 8 meses con un agonista de la LH-RH (combinado con un antiandrógeno no esteroideo durante por lo menos las primeras 4 semanas), que se volvió a administrar si la concentración de PSA excedía 10 ng/ml. El estudio se diseñó con una potencia para detectar (95 % de confianza) una tasa de SG un 8 % más baja en el grupo de PIA que en el grupo de PAC a los 7 años.
- Tras una mediana de seguimiento de 6,9 años (seguimiento máximo de 11,2 años), la SG de los dos grupos fue casi idéntica y el estudio se interrumpió (mediana de supervivencia 8,8 vs. 9,1 años; CRIde muerte 1,02; IC 95 %, 0,86-1,21). Esto cumplió con el criterio prospectivo de ausencia de inferioridad.
- En un análisis retrospectivo, la mortalidad específica por cáncer de próstata también fue similar en los dos grupos (CRI, 1,18; IC 95 %, 0,90–1,55; P = 0,24). Además, la PIA fue estadísticamente mejor que la PAC en varios aspectos de la CV, como sofocos, deseo sexual y síntomas urinarios. Los pacientes del grupo de PIA recibieron tratamiento durante una mediana de 15,4 meses en comparación con 43,9 meses en el grupo de PAC.
- El estudio no evalúa si se extiende la supervivencia cuando se inicia cualquier tipo de TPA para un PSA elevado después del tratamiento local inicial en comparación con una TPA diferida hasta la progresión sintomática. Cabe destacar, que el 59 % de todas las muertes no se relacionaron con el cáncer de próstata y que el 14 % de todos los pacientes murieron por cáncer de próstata.
- En una revisión sistemática se analizaron 15 ensayos aleatorizados de comparación de la PAC en pacientes con cáncer de próstata avanzado o recidivante. No se encontraron diferencias significativas en la SG notificada en 8 ensayos (CRI, 1,02; IC 95 %, 0,93–1,11); la supervivencia específica del cáncer de próstata notificada en 5 ensayos (CRI, 1,02; IC 95 %, 0,87–1,19); o la supervivencia sin progresión notificada en 4 ensayos (CRI, 0,94; IC 95 %, 0,84–1,05). El metanálisis cumplió con los criterios predefinidos de ausencia de inferioridad de la SG (límite superior de 1,15 para el CRI de 1,15).[19][Nivel de evidencia A1] Sin embargo, los 15 estudios, menos uno, tenían un riesgo alto o impreciso de sesgos de acuerdo con los criterios predefinidos.
- Se informó de una diferencia mínima en la CV notificada por los pacientes, pero en la mayoría de los ensayos se encontró mejor funcionamiento sexual y físico en los pacientes de los grupos de PIA.
Terapia antiandrogénica no esteroide con terapia de privación androgénica o sin esta
La enzalutamida se probó con leuprolida, o sin esta, en pacientes con cáncer de próstata sensible a las hormonas, no metastásico desde el punto de vista clínico y riesgo alto de recidiva bioquímica (definida como un tiempo de duplicación del PSA ≤9 meses y un PSA >2 ng/ml por encima de la cifra mínima después de la radioterapia, o un PSA >1 ng/ml después de una prostatectomía radical con radioterapia posoperatoria o sin esta; M0 según las pruebas con imágenes convencionales). [Nota: En la práctica, se recomienda que estos pacientes se sometan a estadificación mediante tomografía por emisión de positrones-tomografía computada del antígeno prostático específico de membrana (PSMA).]
- En el ensayo de fase III EMBARK (NCT02319837) se incluyeron 1068 hombres. Los pacientes habían recibido tratamiento definitivo mediante prostatectomía radical o radioterapia con intención curativa, presentaron un rápido aumento del PSA y no eran aptos para la terapia de rescate dirigida a la pelvis. Los pacientes se asignaron al azar en una proporción 1:1:1 a recibir enzalutamida (160 mg por vía oral diarios) con enmascaramiento y leuprolida, placebo con enmascaramiento (por vía oral diarios) y leuprolida, o enzalutamida (160 mg por vía oral diarios) en monoterapia sin enmascaramiento.[20]
- Al cabo de 60,7 meses de seguimiento, la combinación de enzalutamida y leuprolida fue superior a la monoterapia de leuprolida para el criterio principal de valoración de supervivencia sin metástasis a 5 años (87,3 vs. 71,4 %; CRI, 0,42; IC 95 %, 0,30–0,61; P < 0,001). Al cabo de 60,7 meses de seguimiento, la monoterapia de enzalutamida fue superior a la monoterapia de leuprolida para un importante criterio de valoración secundario de supervivencia sin metástasis a 5 años (80,0 vs. 71,4 %; CRI, 0,63; IC 95 %, 0,46–0,87; P < 0,005).[20][Nivel de evidencia B1]
- Los datos de SG no eran definitivos, pero en el momento del informe, el 12 % de las muertes correspondían a la población general, el 3,4 % al grupo de la combinación de enzalutamida y leuprolida, el 6,1 % al grupo de monoterapia de leuprolida y el 5,4 % al grupo de monoterapia de enzalutamida.
- La interrupción del tratamiento en todos los grupos ocurrió en la semana 36, siempre y cuando el PSA alcanzara concentraciones indetectables (<0,2 ng/ml). El tratamiento se pudo reiniciar según los grupos de tratamiento asignados cuando el PSA aumentó a >2,0 ng/ml en los pacientes que se habían sometido a una prostatectomía previa, o >5,0 ng/ml en los pacientes que se habían sometido a radioterapia. En el grupo de la combinación de enzalutamida y leuprolida, el 90,9 % de los pacientes interrumpió el tratamiento durante una mediana de 20,2 meses. En el grupo de monoterapia de leuprolida, el 67,8 % de los pacientes suspendió el tratamiento durante una mediana de 16,8 meses. En el grupo de monoterapia de enzalutamida, el 85,9 % de los pacientes suspendió el tratamiento durante una mediana de 11,1 meses.
- No hubo diferencias importantes entre los grupos en las mediciones de CV.
- No se notificaron nuevos signos de toxicidad.
- Los efectos tóxicos de grado 3 o superior por cualquier efecto adverso fueron del 46,5 % en el grupo de la combinación de enzalutamida y leuprolida, del 42,7 % en el grupo de leuprolida en monoterapia y del 50,0 % en el grupo de enzalutamida en monoterapia.
- Los efectos adversos más frecuentes en el grupo de la combinación y en el grupo de leuprolida en monoterapia fueron los sofocos y la fatiga. Los efectos adversos más frecuentes en el grupo de enzalutamida en monoterapia fueron la ginecomastia, los sofocos y la fatiga.
- Los efectos adversos que despertaron especial interés incluyeron fracturas, deterioro cognitivo y de la memoria, y convulsiones. Tuvieron fracturas el 18,4 % de los pacientes en el grupo de la combinación, el 13,6 % de los pacientes en el grupo de leuprolida en monoterapia y el 11 % de los pacientes en el grupo de enzalutamida en monoterapia. Se observó deterioro cognitivo y de la memoria en el 15 % de los pacientes en el grupo de la combinación, el 6,5 % de los pacientes en el grupo de leuprolida en monoterapia y el 14,1 % de los pacientes en el grupo de enzalutamida en monoterapia. Presentaron convulsiones el 1,1 % de los pacientes en el grupo de la combinación, el 0 % de los pacientes en el grupo de leuprolida en monoterapia y el 0,8 % de los pacientes en el grupo de enzalutamida en monoterapia.
Monoterapia antiandrogénica no esteroidea versus castración quirúrgica o clínica
En una revisión sistemática de la evidencia, se comparó la monoterapia antiandrogénica no esteroidea y la castración quirúrgica o clínica con datos de 11 ensayos aleatorizados con 3060 hombres de enfermedad localmente avanzada, metastásica o recidivante después de tratamiento local.[21] La monoterapia de antiandrógenos no esteroideos disminuyó la SG y aumentó la tasa de progresión clínica y fracaso del tratamiento.[21][Nivel de evidencia A1]
Abordajes hormonales
Como se señaló anteriormente, en los estudios se demostró que la quimioterapia con docetaxel o cabazitaxel, y la inmunoterapia con sipuleucel-T prolongan la SG en pacientes de cáncer de próstata metastásico sensible a las hormonas o resistente a estas. Sin embargo, la terapia hormonal también demostró que mejora la supervivencia, incluso en hombres con progresión de la enfermedad después de otras formas de terapia hormonal o quimioterapia. Algunas formas de terapia hormonal son eficaces para el tratamiento del cáncer de próstata metastásico resistente a las hormonas.
Debido a que no se cuenta con estudios comparativos directos, no hay ensayos que ayuden a decidir cuál de estos fármacos se debe utilizar primero o en qué secuencia.
Incluso entre pacientes de cáncer de próstata metastásico resistente a las hormonas, se encontró cierta heterogeneidad en el pronóstico y en la retención de la sensibilidad hormonal. En estos pacientes con enfermedad ósea sintomática, varios factores se relacionan con un pronóstico deteriorado: estado funcional precario, fosfatasa alcalina elevada, creatinina sérica anormal y respuesta anterior breve (<1 año) a la terapia hormonal.[22] La concentración absoluta del PSA al inicio del tratamiento en pacientes con cáncer recidivante o resistentes a las hormonas no ha demostrado tener importancia pronóstica.[23]
Algunos pacientes cuya enfermedad progresó durante el bloqueo androgénico combinado responden a diversas terapias hormonales de segunda línea. La aminoglutetimida, la hidrocortisona, la privación con flutamida, la progesterona, el ketoconazol y combinaciones de estas terapias produjeron respuestas del PSA en entre el 14 % y el 60 % de los pacientes y, cuando se evaluaron las respuestas clínicas también produjeron respuestas en entre el 0 % y el 25 % de los casos. La duración de estas respuestas del PSA osciló entre 2 y 4 meses.[24] Las tasas de supervivencia son similares cuando el ketoconazol y la hidrocortisona se inician al mismo tiempo que se suspende la privación de andrógenos (por ejemplo, flutamida, bicalutamida o nilutamida) o cuando se inician en el momento de elevación del PSA después de un ensayo inicial de interrupción de los antiandrógenos, como se observó en el ensayo CLB-9583 (NCT00002760).[25][Nivel de evidencia A1] Los datos sobre el valor predictivo de los cambios en el PSA durante la administración de la quimioterapia son contradictorios.[23,26]
Los pacientes tratados con agonistas de la hormona luteinizante o estrógenos como tratamiento primario por lo general mantienen concentraciones de testosterona en el punto de castración. En un estudio del ECOG se observó una supervivencia superior cuando se mantuvo a los pacientes con privación androgénica primaria;[9] sin embargo, en otro estudio del SWOG (antes Southwest Oncology Group) no se observó una ventaja del bloqueo androgénico continuo.[27]
Evidencia (abordajes hormonales para la enfermedad progresiva resistente a la castración en pacientes que no han recibido quimioterapia):
- El acetato de abiraterona es un inhibidor de la biosíntesis de andrógenos que bloquea el citocromo P450c17 (CYP17). La abiraterona tiene efectos mineralocorticoides que aumentan la incidencia de retención hídrica y edema, hipopotasemia, hipertensión y disfunción cardíaca. Además, la abiraterona se relaciona con hepatotoxicidad.[28] Sin embargo, los efectos tóxicos de la abiraterona son leves cuando se comparan con otros tratamientos. En un ensayo con enmascaramiento doble y controlado con placebo, se administró prednisona (5 mg VO 2 veces al día) y acetato de abiraterona (1000 mg VO 1 vez al día) o placebo a 1088 hombres con enfermedad progresiva resistente a las hormonas (testosterona sérica <50 ng por decilitro durante el tratamiento antiandrogénico previo) sin quimioterapia previa y con estado funcional (EF) del ECOG de 0 a 1.[29,30][Nivel de evidencia A1] Los criterios coprimarios de valoración fueron la SSP radiológica y la SG. Se planearon cuatro análisis secuenciales.
- En el segundo análisis interino, después de una mediana de seguimiento de 22,2 meses, el estudio se detuvo y un comité de supervisión de datos lo desenmascaró tras la evaluación de la eficacia y la inocuidad agregadas. En ese momento, la SSP radiológica había alcanzado el límite de interrupción preespecificado a favor de la abiraterona (mediana de SSP de 16,5 vs. 8,3 meses CRI, 0,53; IC 95 %, 0,45–0,62; P < 0,001).
- En el cuarto y último análisis, en el momento de una mediana de seguimiento de 49,2 meses (60 meses como máximo), habían muerto el 65 % de los pacientes del grupo de acetato de abiraterona y el 71 % de los pacientes del grupo de placebo (CRI, 0,81; IC 95 %, 0,70–0,93; P = 0,033). La mediana de SG fue de 34,7 vs. 30.3 meses.[30][Nivel de evidencia A1]
- La mediana de tiempo hasta el deterioro de la CV relacionada con la salud fue prolongada en el grupo de estudio de abiraterona de acuerdo con el puntaje total de la evaluación del Functional Assessment of Cancer Therapy-Prostate Version 4 (FACT-P) (12,7 vs. 8,3 meses; CRI, 0,78; IC 95 %, 0,66–0,92; P = 0,003) y la subescala específica de cáncer de próstata (11,1 vs. 5,8 meses; CRI, 0,70; IC 95 %, 0,60–0,83; P < 0,0001).[31][Nivel de evidencia A3]
- Además, los pacientes en el grupo de estudio de abiraterona tuvieron medianas más largas, y estadísticamente significativas para los períodos de tiempo hasta el uso de opioides para el dolor, el inicio de la quimioterapia citotóxica o el empeoramiento del EF y el aumento de la concentración del PSA.[29,31][Niveles de evidencia A3 y B1]
- Se observó que la enzalutamida, un antagonista del receptor androgénico, aumenta la SG y la CV en pacientes con cáncer de próstata metastásico que progresó pese a la TPA. En el estudio PREVAIL (NCT01212991), se asignó al azar a 1717 hombres con cáncer de próstata, asintomáticos o con síntomas leves pese a la TPA, a recibir enzalutamida (160 mg VO al día) versus placebo.[32-34][Niveles de evidencia A1 y A3]
- Después de una mediana de seguimiento de 22 meses, se suspendió el estudio debido a beneficio de SG en el grupo de estudio de enzalutamida (CRI, 0,72; IC 95 %, 0,6–0,84; P < 0,001). La proporción de hombres que murió fue de 28 versus 35 %, y la mediana de SG fue de 32,4 versus 30,2 meses.
- La mediana de tiempo hasta el deterioro de la CV general, medida por el puntaje FACT-P fue de 11,3 en el grupo de enzalutamida y de 5,6 meses en el grupo de placebo (P < 0,001). También aumentó el tiempo hasta el primer episodio óseo que exigiera una intervención clínica.[32,33][Niveles de evidencia A3 y B1]
- Los efectos adversos de grado 3 o más graves fueron más frecuentes en el grupo de enzalutamida (43 vs. 37 %), principalmente debido a diferencias en hipertensión, fatiga y caídas. Debido a que los pacientes que recibieron enzalutamida se asignaron al tratamiento por un promedio de 1 año más que los que recibieron placebo, la duración de la respuesta fue más prolongada en los pacientes que recibieron enzalutamida; esta diferencia quizás contribuyó al aumento de efectos adversos.
- La enzalutamida también se estudió en pacientes de cáncer de próstata resistente a las hormonas sin metástasis clínicas (definido como tiempo de duplicación del PSA ≤10 meses durante terapia hormonal).[35]
- En el ensayo con enmascaramiento doble de fase III PROSPER (NCT02003924), 1401 hombres sin metástasis clínicas en las imágenes, pero con aumento rápido del PSA, se asignaron al azar en una proporción de 2:1 a recibir enzalutamida (160 mg VO al día) o un placebo. Después de un seguimiento de hasta 41 meses, la enzalutamida demostró superioridad en el criterio primario de valoración, supervivencia sin metástasis: 77 versus 51 % (mediana 36,6 vs. 14,7 meses; CRI, 0,29; IC 95 %, 0,24–0,35; P < 0,001).[35][Nivel de evidencia B1]
- Los datos de SG no estaban completos, pero al momento del informe, 11 % de los hombres habían muerto en el grupo de enzalutamida versus 13 % en el grupo de placebo.
- La tasa de disminución de la CV relacionada con la salud fue igual entre ambos grupos.
- Los efectos tóxicos de grado 3 o superior fueron más frecuentes en el grupo de enzalutamida: 31 versus 23 %.
- También se presentaron números excesivos en varios efectos adversos de interés especial porque se habían notificado antes en pacientes tratados con enzalutamida. Estos eventos incluyeron casos de hipertensión (12 vs. 5 %), episodios cardiovasculares mayores (5 vs. 3 %) y trastornos disfunción mental (5 vs. 2 %).
- El hecho de continuar la enzalutamida en pacientes que cambiaron a recibir abiraterona debido a progresión, y que tenían cáncer de próstata metastásico resistente a la castración y PSA en aumento mientras recibían enzalutamida, no mejoró la tasa de SSP o progresión clínica. Esta estrategia se probó en el ensayo aleatorizado PLATO (NCT01995513).[36][Nivel de evidencia B1]
- La apalutamida, un antagonista del receptor androgénico, se evaluó en pacientes con cáncer de próstata no metastásico resistente a la castración (definido como duplicación del PSA de ≤10 meses durante la privación de andrógenos).[37] En el ensayo, se asignó al azar a 1207 hombres, en una proporción 2:1, a recibir apalutamida (240 mg VO) o placebo. Todos los pacientes continuaron con su TPA previa.
- Luego de una mediana de seguimiento de 20,3 meses, la supervivencia sin metástasis fue de 40,5 meses en el grupo de apalutamida comparada con 16,2 meses en el grupo de placebo (CRI, 0,28; IC 95 %, 0,23–0,35; P < 0,001).[37][Nivel de evidencia B1]
- Se observó una tendencia a la mejora de la SG en el grupo de apalutamida, pero esta no alcanzó el nivel de significación estadística en el momento del informe (CRI, 0,70; IC 95 %, 0,47–1,04; P = 0,07).
- Aumentó el número de efectos tóxicos relacionados con el tratamiento de apalutamida, como los siguientes: fracturas óseas (11,7 vs. 6,5 %), hipotiroidismo (8,1 vs. 2,0 %), fatiga (30,4 vs. 21,1 %), hipertensión (24,8 vs. 19,8 %), exantema (23,8 vs. 5,5 %), diarrea (20,3 vs. 15,1 %), pérdida de peso (16,1 vs. 6,3 %), artralgias (15,9 vs. 7,5 %) y caídas (15,6 vs. 9,0 %).
- En un análisis exploratorio predeterminado, la CV en el tiempo fue similar en los grupos de apalutamida y placebo. La CV se evaluó de forma general y en todas las subescalas del cuestionario FACT-P y el cuestionario de EuroQol de 5 dimensiones y 3 niveles (EQ-5D-3L).[38][Nivel de evidencia A3]
- La darolutamida, otro antagonista del receptor de andrógeno, prolongó la supervivencia sin metástasis y la SG en hombres con cáncer de próstata resistente a la castración no metastásico.[39,40] Una característica distintiva de la darolutamida es su baja penetración en la barrera hematoencefálica. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó la darolutamida específicamente para el cáncer de próstata resistente a la castración no metastásico, una ficha técnica más limitada en comparación con la enzalutamida y la apalutamida.
En un ensayo controlado aleatorizado participaron 1509 hombres con cáncer de próstata resistente a la castración no metastásico, un PSA en aumento y un valor de testosterona en nivel de castración. Los pacientes fueron asignados al azar en una proporción de 2:1 para recibir darolutamida o placebo mientras continuaban con la TDA.[39,40]
- La tasa de SG a 3 años fue del 83 % para los pacientes que recibieron darolutamida (IC 95 %, 80–86 %) y del 77 % para los pacientes que recibieron placebo (IC 95 %, 72–81 %).[39,40][Nivel de evidencia A1]
- El grupo de darolutamida también se relacionó con una mayor supervivencia sin metástasis (CRI, 0,41; IC 95%, 0,34–0,50).
- La CV notificada por los pacientes fue similar en los 2 grupos y las diferencias favorecieron al grupo de darolutamida. Hubo diferencias estadísticamente significativas a favor de la darolutamida para las medidas de dolor, bienestar y síntomas urinarios, pero las diferencias no alcanzaron niveles clínicos significativos.
- En contraste con los estudios de enzalutamida y apalutamida, la darolutamida no se relacionó con una mayor incidencia de caídas o fracturas, hipertensión o efectos adversos relacionados con el sistema nervioso central en comparación con el placebo.
Evidencia (abordajes hormonales para la enfermedad progresiva en pacientes que recibieron quimioterapia):
- Los hombres con cáncer de próstata metastásico que presentaron progresión bioquímica o clínica después del tratamiento con docetaxel (N = 1195) se asignaron al azar en una proporción 2:1 a recibir acetato de abiraterona (1000 mg) (n = 797) o placebo (n = 398) por vía oral 1 vez al día (COU-AA-301 [NCT00638690]). Ambos grupos recibieron prednisona (5 mg VO 2 veces al día).[41][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 12,8 meses, el ensayo se interrumpió cuando en un análisis interino se observó una ventaja de la SG en el grupo de abiraterona. El informe final del ensayo se publicó después de una mediana de seguimiento de 20,2 meses.
- La mediana de SG fue de 15,8 meses en el grupo de abiraterona vs. 11,2 meses en el grupo de placebo (CRIde muerte 0,74; IC 95 %, 0,64–0,86; P < 0,0001).
- En comparación con el placebo, la abiraterona también se relacionó con una prolongación en la mediana de tiempo transcurrido hasta el deterioro del puntaje de CV FACT-P (59,9 vs. 36,1 semanas, P < 0,0001), y una mejora clínica importante en la CV de los hombres con deterioro del estado funcional al principio del ensayo (48 vs. 32 %, P < 0,0001).[42][Nivel de evidencia A3]
- La enzalutamida aumentó la supervivencia en pacientes de cáncer de próstata progresivo que recibieron TPA y docetaxel. En un ensayo con enmascaramiento doble controlado con placebo, se asignó al azar a 1129 hombres en una proporción 2:1 a recibir enzalutamida (160 mg VO al día) versus placebo.[43-46] Niveles de evidencia A1 y A3]
- Después de una mediana de seguimiento de 14,4 meses, el estudio se interrumpió en el momento del único análisis interino planificado porque en el grupo de enzalutamida se presentó una mejora de la SG, el criterio principal de valoración (mediana de SG, 18,4 meses; IC 95 %, 17,3 no alcanzado todavía vs. 13,6 meses; IC 95 %, 11,3–15,8; CRIde muerte 0,63; IC 95 %, 0,53–0,75; P < 0,001). Además, la CV, medida con el cuestionario FACT-P, fue superior en el grupo de enzalutamida, así como el tiempo hasta el primer episodio óseo relacionado.[44,46]
- Se notificó una crisis convulsiva en 5 de los 800 hombres del grupo de enzalutamida y ninguna en el grupo de placebo; sin embargo, no está clara su relación con la enzalutamida. De las crisis convulsivas notificadas, 2 pacientes presentaban metástasis encefálica, un paciente acababa de recibir lidocaína intravenosa (IV) y una crisis convulsiva no se presenció.
Prevención de las metástasis óseas
Las metástasis óseas dolorosas pueden ser un problema grave para los pacientes de cáncer de próstata. Se han estudiado muchas estrategias de paliación, como las siguientes:[47-51]
- Radioterapia de haz externo.
- Radionúclidos con afinidad por el tejido óseo (cloruro de estroncio Sr 89 [89Sr]).
- Denosumab (anticuerpo monoclonal que inhibe el funcionamiento de los osteoclastos).
- Analgésicos.
- Corticoesteroides.
- Bisfosfonatos.
Para obtener más información, consultar El dolor y el cáncer.
Evidencia (paliación de las metástasis óseas mediante radioterapia):
- La radioterapia de haz externo (RHE) puede ser muy útil para la paliación del dolor óseo. Una sola fracción de 8 Gy produjo beneficios similares en términos de alivio del dolor óseo y CV que las fracciones múltiples (3 Gy × 10), como en el ensayo RTOG-9714 (NCT00003162).[52,53][Nivel de evidencia A3]
Evidencia (paliación de las metástasis óseas con cloruro de estroncio):
El uso de radioisótopos, como el 89Sr, ha sido eficaz como tratamiento paliativo para algunos pacientes con metástasis osteoblásticas. El 89Sr en monoterapia disminuye el dolor óseo en 80 % de los pacientes tratados.[54]
- Se hizo un ensayo aleatorizado multicéntrico de una dosis IV única de 89Sr (150 MBq: 4 mCi) versus RHE paliativa en hombres con metástasis óseas dolorosas de cáncer de próstata, a pesar del tratamiento hormonal.[55][Nivel de evidencia A1]; [56]
- Se observaron tasas de respuesta subjetiva al dolor similares en ambos grupos: 34,7 % para el 89Sr vs. 33,3 % para la RHE sola.
- La SG fue mejor en el grupo de RHE que en el de 89Sr (P = 0,046; mediana de supervivencia, 11,0 vs. 7,2 meses).
- No se observaron diferencias estadísticamente significativas en el tiempo transcurrido hasta la progresión subjetiva o la SSP.
- Cuando se usó como un complemento de la RHE, el 89Sr logró retrasar la progresión de la enfermedad y reducir la necesidad de analgésicos, en comparación con la RHE sola.
Evidencia (paliación o prevención de las metástasis óseas con denosumab):
- En un ensayo aleatorizado controlado con placebo (NCT00321620) se comparó el denosumab con el ácido zoledrónico para la prevención de episodios óseos (fracturas patológicas, compresión de la médula espinal o la necesidad de radioterapia o cirugía óseas paliativas) en hombres con cáncer de próstata resistente al tratamiento hormonal que tenían por lo menos una metástasis ósea.[47]
- La mediana de tiempo hasta el primer episodio óseo fue de 20,7 meses en el grupo de denosumab y de 17,1 meses en el grupo de ácido zoledrónico (CRI, 0,82, IC 95 %, 0,71–0,95).
- Se notificaron efectos adversos graves en el 63 % de los pacientes que recibieron denosumab versus el 60 % de los pacientes que recibieron ácido zoledrónico. La incidencia acumulada de osteonecrosis mandibular fue baja en ambos grupos del estudio (2 % en el grupo de denosumab vs. 1 % en el grupo de ácido zoledrónico). Hubo toxicidad de grado 3 a 4 y no hubo diferencia en la supervivencia. La incidencia de hipocalcemia fue más alta en el grupo de denosumab (13 vs. 6 %).[57]
- En un ensayo aleatorizado controlado con placebo, se incluyó a 1432 hombres con cáncer de próstata resistente a la castración sin indicio de metástasis. Los pacientes recibieron denosumab (120 mg por vía subcutánea cada 4 semanas) para prevenir la metástasis ósea (sintomática o no sintomática).[57][Nivel de evidencia B1]
- Después de una mediana de seguimiento de 20 meses, la mediana de supervivencia sin metástasis ósea fue de 29,5 versus 25,2 meses en el grupo de denosumab vs. el grupo de placebo (CRI, 0,85; IC 95 %, 0,73–0,98; P = 0,028).
- Se notificaron metástasis óseas sintomáticas en 69 (10 %) pacientes del grupo de denosumab versus 96 (13 %) pacientes del grupo de placebo (CRI, 0,67; IC 95 %, 0,49–0,92; P = 0,01).
- No hubo diferencias en la SG entre los dos grupos.
- Se presentó osteonecrosis en 33 (5 %) de los hombres en el grupo de denosumab, pero no en el grupo de placebo. Se presentó hipocalcemia en 12 (2 %) de los hombres del grupo de denosumab versus 2 (<1 %) de los hombres del grupo de placebo, y se presentó retención urinaria en 54 (8 %) de los hombres del grupo de denosumab versus 31 (4 %) de los hombres del grupo de placebo.
Opciones de tratamiento del cáncer de próstata recidivante
Las opciones de tratamiento para los pacientes con cáncer de próstata recidivante son las siguientes:
- Quimioterapia para el cáncer de próstata sensible a las hormonas o resistente a estas.
- Inmunoterapia.
- Terapia radiofarmacéutica.
- Inhibidores de la poli (ADP-ribosa) polimerasa (PARP) para hombres con cáncer de próstata metastásico resistente a la castración y variantes de BRCA1, BRCA2 o ATM.
- Terapia hormonal con inhibidores de PARP para hombres con cáncer de próstata metastásico resistente a la castración y variantes de BRCA1, BRCA2 o ATM.
- Inhibidores de PARP como tratamiento de primera línea para hombres con cáncer de próstata metastásico resistente a la castración y variantes de BRCA1 o BRCA2.
- Inhibidores de PARP como tratamiento de primera línea para hombres con cáncer de próstata metastásico resistente a la castración y variantes de genes reparadores de la recombinación homóloga.
Quimioterapia para el cáncer de próstata sensible a las hormonas o resistente a estas
Evidencia (quimioterapia para el cáncer de próstata sensible a las hormonas o resistente a estas):
- En un ensayo aleatorizado se observó mejor control del dolor en pacientes con cáncer de próstata resistente a las hormonas tratados con mitoxantrona y prednisona en comparación con prednisona sola.[58] Las diferencias en la SG o la medida de CV general entre los dos tratamientos no fueron estadísticamente significativas.
- El docetaxel mejoró la SG en comparación con la mitoxantrona. En un ensayo aleatorizado de pacientes de cáncer de próstata resistente a las hormonas, se compararon tres grupos de tratamiento: docetaxel (75 mg/m2 cada 3 semanas), docetaxel (30 mg/m2 semanal durante 5 de cada 6 semanas) y mitoxantrona (12 mg/m2 cada 3 semanas). Todos los pacientes recibieron prednisona oral (5 mg, 2 veces al día). Los pacientes en los grupos de docetaxel también recibieron dosis altas de dexametasona como pretratamiento antes de cada administración de docetaxel (8 mg administrados 12 horas, 3 horas y 1 hora antes del régimen de 3 semanas; 8 mg administrados 1 hora antes del régimen de 5 de cada 6 semanas).[59]
- La SG a los 3 años en el grupo de docetaxel cada 3 semanas fue mejor (18,6 %) que en el grupo de mitoxantrona, y la diferencia fue estadísticamente significativa (13,5 %, CRIde muerte 0,79; IC 95 %, 0,67-0,93).
- Sin embargo, la tasa de SG para el régimen de docetaxel de 5 de cada 6 semanas fue del 16,8 %, que no fue mejor ni estadísticamente significativa que la SG de mitoxantrona.
- La CV también fue superior en el grupo de docetaxel que en el de mitoxantrona (P = 0,009).[60][Niveles de evidencia A1 y A3]
- En otro ensayo aleatorizado de pacientes con cáncer de próstata resistente a las hormonas, se comparó un régimen de 3 semanas de estramustina (280 mg VO 3 veces al día, los días 1 a 5, warfarina diaria y 325 mg de aspirina para prevenir la trombosis vascular), y docetaxel (60 mg/m2 por vía IV el día 2, precedidos por dexametasona [20 mg, 3 veces a partir de la noche anterior]) con régimen de mitoxantrona (12 mg/m2 IV cada 3 semanas) y prednisona (5 mg al día).[61][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 32 meses, la mediana de SG fue de 17,5 meses en el grupo de estramustina y docetaxel versus 15,6 meses en el grupo de mitoxantrona (CRIde muerte 0,80; IC 95 %, 0,67–0,97; P = 0,02).
- Las medidas de CV general y paliación del dolor fueron similares en los 2 grupos de tratamiento.[62][Nivel de evidencia A3]
- Se comparó un régimen de 2 semanas de docetaxel con un régimen de 3 semanas. La SG fue mejor en el régimen de 2 semanas y la toxicidad hematológica fue menor.[63][Nivel de evidencia A1]
- En el estudio, se asignó al azar a 361 hombres con cáncer de próstata metastásico resistente a las hormonas para recibir un régimen de 2 semanas de docetaxel (50 mg/m2 IV) o un régimen de 3 semanas (75 mg/m2 IV) hasta la progresión. Además, todos los pacientes recibieron prednisolona (10 mg VO al día) y dexametasona (7,5–8,0 mg al día), desde el día anterior a la dosis de docetaxel y durante 1 o 2 días más. Se excluyeron del análisis 15 de los pacientes asignados al azar (4,2 %), porque en retrospectiva se consideraron inadmisibles o retiraron su consentimiento.
- Después de una mediana de seguimiento de 18 meses, hubo una pequeña diferencia en el tiempo hasta el fracaso terapéutico, el criterio principal de valoración del estudio (5,6 meses [IC 95 %, 5,0–6,2] vs. 4,9 meses [IC 95 %, 4,5–5,4]; P = 0,014). Sin embargo, hubo una diferencia más grande en la mediana de SG, un criterio secundario de valoración, a favor del régimen de 2 semanas (19,5 meses [IC 95 %, 15,9–23,1] vs. 17,0 meses [IC 95 %, 15,0–19,1]; P = 0,02).
- Hubo una tasa más baja de neutropenia de grado 3 a 4 con el régimen de 2 semanas (36 vs. 53 %; P < 0,0001), así como una tasa más baja de neutropenia febril (4 vs. 14 %; P = 0,001).
- El uso de cabazitaxel y docetaxel produjo resultados similares de SG en los pacientes con cáncer de próstata metastásico resistente a la castración que no habían recibido quimioterapia previa.[64]
- En el estudio FIRSTANA (NCT00309985), se asignó al azar (proporción 1:1:1) a 1168 hombres con cáncer de próstata metastásico resistente a las hormonas para recibir cabazitaxel 20 mg/m2, cabazitaxel 25 mg/m2, o docetaxel 75 mg/m2 IV cada 3 semanas (y prednisona 10 mg VO al día) hasta la progresión de la enfermedad. La mediana de SG fue similar en los tres grupos de estudio, sin diferencias estadísticamente significativas (24,5 vs. 25,2 vs. 24,3 meses, respectivamente), con curvas de supervivencia prácticamente superpuestas.[64][Nivel de evidencia A1]
- No obstante, se presentaron efectos tóxicos diversos en los grupos de tratamiento; las tasas de efectos adversos que precisaron tratamiento urgente fueron del 41,2 %, 60,1 % y 46,0 %, respectivamente.
- En pacientes con cáncer de próstata metastásico resistente a la castración o a las hormonas cuya enfermedad progresión durante o después del tratamiento con docetaxel, el uso de cabazitaxel mejoró la supervivencia en comparación con la mitoxantrona en un ensayo aleatorizado (NCT00417079).[65] En este ensayo, se trató a 755 hombres con prednisona (10 mg VO al día) y se los asignó al azar a recibir cabazitaxel (25 mg/m2 IV) o mitoxantrona (12 mg/m2 IV) cada 3 semanas.[65][Nivel de evidencia A1]
- La mediana de SG fue de 15,1 meses en el grupo de cabazitaxel y de 12,7 meses en el grupo de mitoxantrona (CRIde muerte 0,70; IC 95 %, 0,59–0,83; P < 0,001).
- En un ensayo aleatorizado de ausencia de inferioridad se comparó el cabazitaxel (20 mg/m2 IV cada 3 semanas) y cabazitaxel (25 mg/m2 IV cada 3 semanas) en una población similar de 1200 hombres con cáncer de próstata metastásico resistente a la castración o a las hormonas que recibieron antes docetaxel. La dosis más baja de cabazitaxel cumplió con los criterios de ausencia de inferioridad con receptor a la SG (CRIde muerte, 1,024; límite superior del IC, 1,184), pero produjo menor toxicidad.[66][Nivel de evidencia A1]
Otros regímenes quimioterapéuticos que producen mejoría subjetiva de los síntomas y disminución en la concentración del PSA son los siguientes:[67][Nivel de evidencia C2]; [68]
- Paclitaxel.
- Estramustina y etopósido.
- Estramustina y vinblastina.
- Estramustina y paclitaxel.
En un estudio se indicó que los pacientes con tumores que exhiben diferenciación neuroendocrina responden mejor a la quimioterapia.[69]
Inmunoterapia
Se observó que el sipuleucel-T, una inmunoterapia celular activa, aumentó la SG en pacientes de cáncer de próstata metastásico resistente a las hormonas. El sipuleucel-T contiene células mononucleares de sangre periférica autógena expuestas ex vivo a una proteína de fusión recombinante (PA2024) compuesta de fosfatasa ácida prostática unida con un factor estimulante de colonias de granulocitos y macrófagos.
Los efectos secundarios suelen producirse por la liberación de citocinas e incluyen escalofríos, fiebre, cefalea, mialgia, sudoración y síntomas parecidos a la gripe, por lo general, en las primeras 24 horas de la infusión. No se ha observado un aumento de trastornos autoinmunitarios o de segundas neoplasias malignas.[70]
Evidencia (inmunoterapia):
- En el ensayo más grande (Immunotherapy for Prostate Adenocarcinoma Treatment: IMPACT [NCT00065442]), se asignó al azar en una proporción de 2:1 a 512 pacientes con enfermedad metastásica resistente a las hormonas a recibir sipuleucel-T (n = 341) versus placebo (n = 171) mediante una infusión IV de 60 minutos cada 2 semanas en 3 dosis.[71] Los pacientes con metástasis viscerales, fracturas óseas patológicas o estado funcional del Eastern Cooperative Oncology Group (ECOG) menor de 0–1 se excluyeron del estudio. En el momento en que se documentara la progresión de la enfermedad, los pacientes del grupo de placebo podían recibir, según el criterio del médico, infusiones elaboradas con las mismas especificaciones que el sipuleucel-T, pero con células crioconservadas en el momento en que se preparó el placebo (63,7 % de los pacientes tratados con placebo recibieron estas transfusiones). El tiempo transcurrido hasta la progresión de la enfermedad y el tiempo hasta el dolor relacionado con la enfermedad fueron los criterios principales de valoración iniciales, pero el criterio primario de valoración se cambió antes de desenmascararse el estudio debido a las diferencias de supervivencia en dos ensayos anteriores de diseño similar (que se describen más adelante).[71][Nivel de evidencia A1]
- Después de una mediana de seguimiento de 34,1 meses, la mortalidad general fue del 61,6 % en el grupo de sipuleucel-T versus el 70,8 % en el grupo placebo (CRIde muerte 0,78; IC 95 %, 0,61–0,98; P = 0,03). Sin embargo, la mejoría de la supervivencia no se acompañó de efectos antitumorales mensurables.
- No hubo diferencias entre los grupos de estudio en la tasa de progresión de la enfermedad. En 2011, el precio calculado de sipuleucel-T fue de 93 000 dólares para un curso de 1 mes de tratamiento. Esto se traduce en un costo calculado de unos 276 000 dólares por año de vida ganado.[72]
- Los mismos investigadores antes habían conducido 2 ensayos más pequeños (D9901 y D9902A [NCT00005947]) de diseño casi idéntico al estudio IMPACT.[73,74]
- Los resultados combinados de los 2 ensayos más pequeños con un total de 225 pacientes asignados al azar en una proporción de 2:1 a sipuleucel-T o a placebo fueron similares a los del ensayo IMPACT. El CRIde muerte fue de 0,67 (IC 95 % 0,49–0,91), pero las tasas de tiempo transcurrido hasta la progresión no fueron estadísticamente significativas.
Es posible que las dosis bajas de prednisona controlen los síntomas en algunos pacientes.[75]
Evidencia (dosis bajas de prednisona como paliativo):
- Se condujo una comparación aleatorizada de prednisona (5 mg 4 veces al día) y flutamida (250 mg 3 veces al día) con pacientes con progresión de la enfermedad después de la terapia de ablación de andrógenos (castración o un agonista de LH-RH).[76]
- La prednisona y la flutamida produjeron resultados similares de SG, respuesta sintomática, respuesta del PSA y tiempo transcurrido hasta la progresión. Sin embargo, no hubo diferencias estadísticamente significativas con respecto al dolor, las náuseas, los vómitos, y la diarrea en los pacientes tratados con prednisona. Para obtener más información, consultar El dolor y el cáncer, Náuseas y vómitos relacionados con el tratamiento del cáncer y Complicaciones gastrointestinales.
En los ensayos clínicos en curso se continúa explorando la utilidad de la quimioterapia para estos pacientes.[10-13,58,67-69]
Terapia radiofarmacéutica
Radioterapia de rayos α
El radio Ra 223 (223Ra) emite partículas α (es decir, 2 protones y 2 neutrones unidos, de forma idéntica a un núcleo de helio) con una semivida de 11,4 días. Se administra por vía intravenosa y se absorbe de manera selectiva por el estroma óseo recién formado. Las partículas α de alta energía tienen un alcance corto de menos de 100 mcM. Se observó que el 223Ra mejora la SG en pacientes de cáncer de próstata con metástasis ósea.
Evidencia (radiación de rayos α):
- En un ensayo controlado con placebo, 921 hombres de cáncer de próstata sintomático resistente a la castración, con 2 o más metástasis óseas, pero sin metástasis viscerales, se asignaron al azar en una proporción 2:1 a recibir 6 inyecciones de 223Ra en dosis de 50 kBq por kg de masa corporal cada 4 semanas, o un placebo. Todos los participantes del estudio habían recibido docetaxel antes, estaban demasiado enfermos como para recibirlo o rechazaron el tratamiento con docetaxel.[77,78]
- La mediana de SG fue de 14,9 meses en el grupo de 223Ra versus 11,3 meses en el grupo placebo (CRIde mortalidad , 0,70; IC 95 %, 0,58–0,83; P < 0,001).[77][Nivel de evidencia A1]
- Las tasas de episodios óseos sintomáticos (33 vs. 38 %) y compresión de la médula espinal (4 vs. 7 %) también mejoraron significativamente desde el punto de vista estadístico.
- La CV, medida de manera prospectiva también mejoró en el grupo de 223Ra (25 vs. 16 % de los pacientes presentaron ≥10 puntos de mejoría en una escala de 0 a 156; P = 0,02).[77][Nivel de evidencia A3]
- Con la administración de 6 inyecciones de 223Ra en dosis de 50 kBq por kg de peso corporal cada 4 semanas, los efectos secundarios fueron similares a los del grupo de placebo.
Radioterapia de rayos β
El lutecio Lu 177 vipivotida tetraxetán (177Lu-PSMA-617) emite partículas β. Es una sustancia terapéutica que tiene enlazada una fracción que se une al PSMA. Se administra por vía intravenosa en una dosis de 7,4 GBq (200 mCi) cada 6 semanas por un máximo de 6 dosis.
Evidencia (radioterapia de rayos β):
- En el estudio de fase III internacional sin enmascaramiento VISION (NCT03511664) se incluyeron 831 pacientes con cáncer de próstata metastásico resistente a la castración que ya se habían tratado con terapia dirigida para receptor de andrógeno y con quimioterapia a base de taxanos. Los pacientes aptos para participar debían tener al menos una lesión positiva para PSMA y no presentar una lesión metastásica negativa para PSMA dominante, mediante el uso de sustancias aprobadas para pruebas de imágenes con PSMA. Los pacientes se asignaron al azar en una proporción 2:1 para recibir 177Lu-PSMA-617 cada 6 semanas durante 4 a 6 ciclos con la atención estándar permitida por el protocolo, o solo atención estándar. Esta incluyó abiraterona, enzalutamida, bisfosfonatos, radioterapia, denosumab y glucocorticoides, y excluyó quimioterapia, inmunoterapia, 223Ra y medicamentos en etapa de investigación en el momento en el que se diseñó el ensayo (por ejemplo, olaparib). Los criterios de valoración principales sustitutos fueron la SSP evaluada mediante pruebas con imágenes y la SG.[79]
- La mediana de seguimiento fue de 20,9 meses. La mediana de SSP determinada mediante imágenes fue de 8,7 meses en el grupo de 177Lu-PSMA-617 con atención estándar y de 3,4 meses en el grupo de atención estándar sola (CRIprogresión o muerte, 0,40; 99,2 % IC, 0,29–0,57; P < 0,001). La mediana de SG fue de 15,3 meses en el grupo de 177Lu-PSMA-617 con atención estándar y de 11,3 meses en el grupo de atención estándar sola (CRImuerte, 0,62; IC 95 %, 0,52–0,74; P < 0,001).[79][Nivel de evidencia A1]
- Todos los criterios de evaluación secundarios favorecieron de manera significativa al grupo de 177Lu-PSMA-617 con atención estándar, incluso la mediana de tiempo hasta el primer evento óseo sintomático o la muerte (11,5 vs. 6,8 meses; CRI, 0,50; IC 95 %, 0,40–0,62; P < 0,001).
- Los eventos adversos más frecuentes en el grupo 177Lu-PSMA-617 con atención estándar fueron fatiga, boca seca y náuseas; y casi todos fueron de grado 1 o 2. Se presentaron eventos adversos de grado 3 o superior en el 52,7 % de los pacientes del grupo de 177Lu-PSMA-617 con atención estándar y en el 38 % de los pacientes en el grupo de atención estándar sola. El evento adverso de grado 3 o superior más común en el grupo de 177Lu-PSMA-617 con atención estándar fue la anemia (12,9 vs. 4,9 % en el grupo de atención estándar sola).
- Se observó un empeoramiento retardado de la CV relacionada con la salud en el grupo de 177Lu-PSMA-617 con atención estándar versus el grupo de atención estándar sola, incluso en los puntajes de FACT-P (CRI, 0,54; 0,45–0,66), puntajes de intensidad del dolor BPI-SF (CRI, 0,52; 0,42–0,63) y puntajes de utilidad EQ-5D-5L (CRI, 0,65; 0,54–0,78).[80]
La evidencia respalda el uso de 177Lu-PSMA-617 después del tratamiento con taxanos y después de la terapia de andrógenos. Su beneficio también se está evaluando en otros entornos.
Inhibidores de PARP para hombres con cáncer de próstata metastásico resistente a la castración y variantes de BRCA1, BRCA2 o ATM
Olaparib
Evidencia (olaparib):
- El inhibidor de PARP olaparib se probó en un ensayo abierto, controlado aleatorizado de fase III y sin anonimato en hombres con cáncer de próstata metastásico resistente a la castración y variantes de 1 de los 15 genes preespecificados relacionados con la reparación de la recombinación homóloga, como BRCA1 o BRCA2. Los hombres recibieron antes enzalutamida, abiraterona o ambos, con quimioterapia previa con taxanos o sin esta.[81] El ensayo incluyó a 387 hombres y los asignó al azar en una proporción de 2:1 para recibir olaparib (300 mg 2 veces al día) o la elección del médico de enzalutamida o abiraterona con prednisona.
La cohorte A incluyó 245 pacientes con al menos una variante de BRCA1, BRCA2 o ATM. La cohorte B incluyó a 142 pacientes con al menos una variante de uno de los otros 12 genes preespecificados.
- La mediana de SG en la cohorte A fue de 19,1 meses para los pacientes que recibieron olaparib y de 14,7 meses para los pacientes que recibieron el régimen de control (CRI, 0,69; IC 95 %, 0,50–0,97). Un análisis de sensibilidad que ajustó el cruce a olaparib en el grupo de control informó de un CRI de 0,42 (IC 95 %, 0,19–0,91).
- No hubo beneficio significativo en la SG en la cohorte B.
- No hubo beneficio significativo en la SG en la población general.
- Los efectos adversos más frecuentes en los pacientes que recibieron olaparib fueron anemia (50 %), náuseas (43 %) y fatiga o astenia (42 %).
Terapia hormonal con inhibidores de PARP para hombres con cáncer de próstata metastásico resistente a la castración y variantes de BRCA1, BRCA2 o ATM
Inhibidores de PARP como tratamiento de primera línea para hombres con cáncer de próstata metastásico resistente a la castración y variantes de BRCA1 o BRCA2
Evidencia (olaparib con abiraterona y prednisona [o prednisolona]):
- En el ensayo de fase III aleatorizado con doble enmascaramiento PROpel (NCT03732820) se estudió el inhibidor de PARP olaparib con abiraterona y prednisona (o prednisolona) como tratamiento de primera línea en pacientes con cáncer de próstata metastásico resistente a la castración. En el ensayo, 796 pacientes se asignaron al azar en una proporción 1:1 para recibir (1) olaparib (300 mg 2 veces al día) con abiraterona (1000 mg 1 vez al día) y prednisona o prednisolona (5 mg 2 veces al día) o (2) placebo con abiraterona (1000 mg 1 vez al día) y prednisona o prednisolona (5 mg 2 veces al día). Se excluyó el tratamiento sistémico previo para el cáncer de próstata metastásico resistente a la castración, pero se permitió el tratamiento previo con docetaxel para el cáncer de próstata metastásico sensible al tratamiento hormonal. La presencia de variantes de los genes reparadores de la recombinación homóloga de tumores (incluso BRCA) se determinó de manera retrospectiva usando tejido tumoral y DNA tumoral circulante (ctDNA). En el diseño del estudio no se evaluaron de manera retrospectiva las variantes de los genes reparadores de la recombinación homóloga ni de BRCA, tampoco se estratificó la aleatorización según el estado de los biomarcadores. El criterio principal de valoración fue la SSP radiográfica evaluada por el investigador.[82]
- En la población por intención de tratar (ITT), la mediana de SSP radiográfica fue de 24,8 meses en el grupo de olaparib y de 16,6 meses en el grupo de placebo (CRI, 0,66; IC 95 %, 0,54–0,81).
- En un análisis exploratorio del subgrupo de pacientes con enfermedad con alteraciones de BRCA (n = 85, 11 % de la población ITT), la mediana de SSP radiográfica observada no se alcanzó en el grupo de olaparib y fue de 8 meses en el grupo de placebo (CRISSP radiográfica,0,24; IC 95 %, 0,12–0,45; y CRISG, 0,30; IC 95 %, 0,74–1,14).[82,83][Nivel de evidencia B1]
- Los datos del análisis exploratorio indicaron que el beneficio de la SSP radiográfica de la población ITT se podía atribuir sobre todo al estado de alteración de BRCA. Por lo tanto, la FDA solo aprobó este medicamento para pacientes con enfermedad que presenta alteraciones de BRCA.
- La SG, un criterio secundario de valoración, no presentó diferencias significativas entre los grupos de tratamiento en el análisis final predefinido. La mediana de SG fue de 42,1 meses en el grupo de olaparib y de 36,5 meses en el grupo de placebo (CRI, 0,81; IC 95 %, 0,67–1,00; P = 0,054).[84]
- Se presentaron eventos adversos de grado 3 o superior en el 41 % de los pacientes del grupo de olaparib y en el 34 % de los pacientes del grupo de placebo. La anemia fue el evento adverso de grado 3 o superior más frecuente (presente en el 3 % de los pacientes del grupo de olaparib y en el 16 % del grupo de placebo). De los pacientes con anemia que necesitaron al menos una transfusión sanguínea, el 18 % pertenecía al grupo de olaparib y el 4 % al grupo de placebo.
- Los puntajes del cuestionario FACT-P fueron similares entre los grupos de tratamiento, lo que indica que no hubo un detrimento significativo en la CV relacionada con la salud de los pacientes al añadir olaparib con abiraterona.
Inhibidores de PARP como tratamiento de primera línea para hombres con cáncer de próstata metastásico resistente a la castración y variantes de genes reparadores de la recombinación homóloga
Evidencia (talazoparib con enzalutamida):
- En el estudio de fase III, con doble enmascaramiento, aleatorizado, de múltiples cohortes TALAPRO-2 (NCT03395197) se evaluó la combinación de un inhibidor de PARP, talazoparib, con enzalutamida como terapia de primera línea en hombres con cáncer de próstata metastásico resistente a la castración. En el ensayo se inscribieron dos cohortes en las que los pacientes se evaluaron prospectivamente para detectar variantes de los genes reparadores de la recombinación homóloga (ATM, ATR, BRCA1, BRCA2, CDK12, CHEK2, FANCA, MLH1, MRE11, NBN, PALB2 y RAD51C) en el tejido tumoral y en el ctDNA. Los pacientes se asignaron al azar en una proporción 1:1 para recibir talazoparib (0,5 mg 1 vez al día) o placebo con enzalutamida (160 mg 1 vez al día). Se excluyó el tratamiento sistémico previo para el cáncer de próstata metastásico resistente a la castración. Se permitió el tratamiento previo con docetaxel y abiraterona para el cáncer de próstata metastásico sensible a la castración. Los resultados de las cohortes combinadas de la población con alteraciones en genes reparadores de la recombinación homóloga incluyeron a 399 pacientes. El criterio principal de valoración fue la SSP radiográfica.[85,86]
- La mediana de SSP radiográfica no se alcanzó en el grupo de talazoparib con enzalutamida, y fue de 13,8 meses en el grupo de placebo con enzalutamida (CRI, 0,45;IC 95 %, 0,33–0,61; P < 0,0001). En los pacientes con cáncer de próstata metastásico resistente a la castración y alteración de BRCA (n = 155) el CRISSP radiográfica fue de 0,20 (IC 95 %, 0,11–0,36). La mediana de seguimiento para la SSP radiográfica fue de 17,5 meses en el grupo de talazoparib y de 16,8 meses en el grupo de placebo.[85,86][Nivel de evidencia B1]
- Se presentaron eventos adversos de grado 3 o superior en el 68 % de los pacientes del grupo de talazoparib con enzalutamida y en el 40 % de los pacientes del grupo de placebo con enzalutamida.
- El evento adverso de grado 3 o superior más frecuente fue anemia (41 % en el grupo de talazoparib y 5 % en el grupo placebo). El 39 % de los pacientes del grupo de talazoparib necesitó una transfusión.
- El tratamiento de talazoparib con enzalutamida prolongó de manera significativa el tiempo hasta el deterioro definitivo clínicamente significativo, en comparación con el tratamiento con placebo y enzalutamida (CRI, 0,69; IC 95 %, 0,49–0,97; P = 0,032).
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Trock BJ, Han M, Freedland SJ, et al.: Prostate cancer-specific survival following salvage radiotherapy vs observation in men with biochemical recurrence after radical prostatectomy. JAMA 299 (23): 2760-9, 2008. [PUBMED Abstract]
- Ray GR, Bagshaw MA, Freiha F: External beam radiation salvage for residual or recurrent local tumor following radical prostatectomy. J Urol 132 (5): 926-30, 1984. [PUBMED Abstract]
- Carter GE, Lieskovsky G, Skinner DG, et al.: Results of local and/or systemic adjuvant therapy in the management of pathological stage C or D1 prostate cancer following radical prostatectomy. J Urol 142 (5): 1266-70; discussion 1270-1, 1989. [PUBMED Abstract]
- Freeman JA, Lieskovsky G, Cook DW, et al.: Radical retropubic prostatectomy and postoperative adjuvant radiation for pathological stage C (PcN0) prostate cancer from 1976 to 1989: intermediate findings. J Urol 149 (5): 1029-34, 1993. [PUBMED Abstract]
- Shipley WU, Seiferheld W, Lukka HR, et al.: Radiation with or without Antiandrogen Therapy in Recurrent Prostate Cancer. N Engl J Med 376 (5): 417-428, 2017. [PUBMED Abstract]
- Moul JW, Paulson DF: The role of radical surgery in the management of radiation recurrent and large volume prostate cancer. Cancer 68 (6): 1265-71, 1991. [PUBMED Abstract]
- Schellhammer PF, Kuban DA, el-Mahdi AM: Treatment of clinical local failure after radiation therapy for prostate carcinoma. J Urol 150 (6): 1851-5, 1993. [PUBMED Abstract]
- Bales GT, Williams MJ, Sinner M, et al.: Short-term outcomes after cryosurgical ablation of the prostate in men with recurrent prostate carcinoma following radiation therapy. Urology 46 (5): 676-80, 1995. [PUBMED Abstract]
- Taylor CD, Elson P, Trump DL: Importance of continued testicular suppression in hormone-refractory prostate cancer. J Clin Oncol 11 (11): 2167-72, 1993. [PUBMED Abstract]
- Debruyne FJ, Murray R, Fradet Y, et al.: Liarozole--a novel treatment approach for advanced prostate cancer: results of a large randomized trial versus cyproterone acetate. Liarozole Study Group. Urology 52 (1): 72-81, 1998. [PUBMED Abstract]
- Eisenberger MA: Chemotherapy for prostate carcinoma. NCI Monogr (7): 151-63, 1988. [PUBMED Abstract]
- Pienta KJ, Redman B, Hussain M, et al.: Phase II evaluation of oral estramustine and oral etoposide in hormone-refractory adenocarcinoma of the prostate. J Clin Oncol 12 (10): 2005-12, 1994. [PUBMED Abstract]
- Hudes GR, Greenberg R, Krigel RL, et al.: Phase II study of estramustine and vinblastine, two microtubule inhibitors, in hormone-refractory prostate cancer. J Clin Oncol 10 (11): 1754-61, 1992. [PUBMED Abstract]
- Kuban DA, el-Mahdi AM, Schellhammer PF: Prostate-specific antigen for pretreatment prediction and posttreatment evaluation of outcome after definitive irradiation for prostate cancer. Int J Radiat Oncol Biol Phys 32 (2): 307-16, 1995. [PUBMED Abstract]
- Sandler HM, Dunn RL, McLaughlin PW, et al.: Overall survival after prostate-specific-antigen-detected recurrence following conformal radiation therapy. Int J Radiat Oncol Biol Phys 48 (3): 629-33, 2000. [PUBMED Abstract]
- Duchesne GM, Woo HH, Bassett JK, et al.: Timing of androgen-deprivation therapy in patients with prostate cancer with a rising PSA (TROG 03.06 and VCOG PR 01-03 [TOAD]): a randomised, multicentre, non-blinded, phase 3 trial. Lancet Oncol 17 (6): 727-37, 2016. [PUBMED Abstract]
- Duchesne GM, Woo HH, King M, et al.: Health-related quality of life for immediate versus delayed androgen-deprivation therapy in patients with asymptomatic, non-curable prostate cancer (TROG 03.06 and VCOG PR 01-03 [TOAD]): a randomised, multicentre, non-blinded, phase 3 trial. Lancet Oncol 18 (9): 1192-1201, 2017. [PUBMED Abstract]
- Crook JM, O'Callaghan CJ, Duncan G, et al.: Intermittent androgen suppression for rising PSA level after radiotherapy. N Engl J Med 367 (10): 895-903, 2012. [PUBMED Abstract]
- Magnan S, Zarychanski R, Pilote L, et al.: Intermittent vs Continuous Androgen Deprivation Therapy for Prostate Cancer: A Systematic Review and Meta-analysis. JAMA Oncol 1 (9): 1261-9, 2015. [PUBMED Abstract]
- Freedland SJ, de Almeida Luz M, De Giorgi U, et al.: Improved Outcomes with Enzalutamide in Biochemically Recurrent Prostate Cancer. N Engl J Med 389 (16): 1453-1465, 2023. [PUBMED Abstract]
- Kunath F, Grobe HR, Rücker G, et al.: Non-steroidal antiandrogen monotherapy compared with luteinising hormone-releasing hormone agonists or surgical castration monotherapy for advanced prostate cancer. Cochrane Database Syst Rev (6): CD009266, 2014. [PUBMED Abstract]
- Fosså SD, Dearnaley DP, Law M, et al.: Prognostic factors in hormone-resistant progressing cancer of the prostate. Ann Oncol 3 (5): 361-6, 1992. [PUBMED Abstract]
- Kelly WK, Scher HI, Mazumdar M, et al.: Prostate-specific antigen as a measure of disease outcome in metastatic hormone-refractory prostate cancer. J Clin Oncol 11 (4): 607-15, 1993. [PUBMED Abstract]
- Small EJ, Vogelzang NJ: Second-line hormonal therapy for advanced prostate cancer: a shifting paradigm. J Clin Oncol 15 (1): 382-8, 1997. [PUBMED Abstract]
- Small EJ, Halabi S, Dawson NA, et al.: Antiandrogen withdrawal alone or in combination with ketoconazole in androgen-independent prostate cancer patients: a phase III trial (CALGB 9583). J Clin Oncol 22 (6): 1025-33, 2004. [PUBMED Abstract]
- Sridhara R, Eisenberger MA, Sinibaldi VJ, et al.: Evaluation of prostate-specific antigen as a surrogate marker for response of hormone-refractory prostate cancer to suramin therapy. J Clin Oncol 13 (12): 2944-53, 1995. [PUBMED Abstract]
- Hussain M, Wolf M, Marshall E, et al.: Effects of continued androgen-deprivation therapy and other prognostic factors on response and survival in phase II chemotherapy trials for hormone-refractory prostate cancer: a Southwest Oncology Group report. J Clin Oncol 12 (9): 1868-75, 1994. [PUBMED Abstract]
- Sternberg CN, Castellano D, Daugaard G, et al.: Abiraterone acetate for patients with metastatic castration-resistant prostate cancer progressing after chemotherapy: final analysis of a multicentre, open-label, early-access protocol trial. Lancet Oncol 15 (11): 1263-8, 2014. [PUBMED Abstract]
- Ryan CJ, Smith MR, de Bono JS, et al.: Abiraterone in metastatic prostate cancer without previous chemotherapy. N Engl J Med 368 (2): 138-48, 2013. [PUBMED Abstract]
- Ryan CJ, Smith MR, Fizazi K, et al.: Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 16 (2): 152-60, 2015. [PUBMED Abstract]
- Basch E, Autio K, Ryan CJ, et al.: Abiraterone acetate plus prednisone versus prednisone alone in chemotherapy-naive men with metastatic castration-resistant prostate cancer: patient-reported outcome results of a randomised phase 3 trial. Lancet Oncol 14 (12): 1193-9, 2013. [PUBMED Abstract]
- Beer TM, Armstrong AJ, Rathkopf DE, et al.: Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 371 (5): 424-33, 2014. [PUBMED Abstract]
- Loriot Y, Miller K, Sternberg CN, et al.: Effect of enzalutamide on health-related quality of life, pain, and skeletal-related events in asymptomatic and minimally symptomatic, chemotherapy-naive patients with metastatic castration-resistant prostate cancer (PREVAIL): results from a randomised, phase 3 trial. Lancet Oncol 16 (5): 509-21, 2015. [PUBMED Abstract]
- Beer TM, Armstrong AJ, Rathkopf D, et al.: Enzalutamide in Men with Chemotherapy-naïve Metastatic Castration-resistant Prostate Cancer: Extended Analysis of the Phase 3 PREVAIL Study. Eur Urol 71 (2): 151-154, 2017. [PUBMED Abstract]
- Hussain M, Fizazi K, Saad F, et al.: Enzalutamide in Men with Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 378 (26): 2465-2474, 2018. [PUBMED Abstract]
- Attard G, Borre M, Gurney H, et al.: Abiraterone Alone or in Combination With Enzalutamide in Metastatic Castration-Resistant Prostate Cancer With Rising Prostate-Specific Antigen During Enzalutamide Treatment. J Clin Oncol 36 (25): 2639-2646, 2018. [PUBMED Abstract]
- Smith MR, Saad F, Chowdhury S, et al.: Apalutamide Treatment and Metastasis-free Survival in Prostate Cancer. N Engl J Med 378 (15): 1408-1418, 2018. [PUBMED Abstract]
- Saad F, Cella D, Basch E, et al.: Effect of apalutamide on health-related quality of life in patients with non-metastatic castration-resistant prostate cancer: an analysis of the SPARTAN randomised, placebo-controlled, phase 3 trial. Lancet Oncol 19 (10): 1404-1416, 2018. [PUBMED Abstract]
- Fizazi K, Shore N, Tammela TL, et al.: Darolutamide in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 380 (13): 1235-1246, 2019. [PUBMED Abstract]
- Fizazi K, Shore N, Tammela TL, et al.: Nonmetastatic, Castration-Resistant Prostate Cancer and Survival with Darolutamide. N Engl J Med 383 (11): 1040-1049, 2020. [PUBMED Abstract]
- de Bono JS, Logothetis CJ, Molina A, et al.: Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 364 (21): 1995-2005, 2011. [PUBMED Abstract]
- Harland S, Staffurth J, Molina A, et al.: Effect of abiraterone acetate treatment on the quality of life of patients with metastatic castration-resistant prostate cancer after failure of docetaxel chemotherapy. Eur J Cancer 49 (17): 3648-57, 2013. [PUBMED Abstract]
- Scher HI, Fizazi K, Saad F, et al.: Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 367 (13): 1187-97, 2012. [PUBMED Abstract]
- Fizazi K, Scher HI, Miller K, et al.: Effect of enzalutamide on time to first skeletal-related event, pain, and quality of life in men with castration-resistant prostate cancer: results from the randomised, phase 3 AFFIRM trial. Lancet Oncol 15 (10): 1147-56, 2014. [PUBMED Abstract]
- Sternberg CN, de Bono JS, Chi KN, et al.: Improved outcomes in elderly patients with metastatic castration-resistant prostate cancer treated with the androgen receptor inhibitor enzalutamide: results from the phase III AFFIRM trial. Ann Oncol 25 (2): 429-34, 2014. [PUBMED Abstract]
- Cella D, Ivanescu C, Holmstrom S, et al.: Impact of enzalutamide on quality of life in men with metastatic castration-resistant prostate cancer after chemotherapy: additional analyses from the AFFIRM randomized clinical trial. Ann Oncol 26 (1): 179-85, 2015. [PUBMED Abstract]
- Fizazi K, Carducci M, Smith M, et al.: Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet 377 (9768): 813-22, 2011. [PUBMED Abstract]
- Scher HI, Chung LW: Bone metastases: improving the therapeutic index. Semin Oncol 21 (5): 630-56, 1994. [PUBMED Abstract]
- Dearnaley DP, Sydes MR, Mason MD, et al.: A double-blind, placebo-controlled, randomized trial of oral sodium clodronate for metastatic prostate cancer (MRC PR05 Trial). J Natl Cancer Inst 95 (17): 1300-11, 2003. [PUBMED Abstract]
- Ernst DS, Tannock IF, Winquist EW, et al.: Randomized, double-blind, controlled trial of mitoxantrone/prednisone and clodronate versus mitoxantrone/prednisone and placebo in patients with hormone-refractory prostate cancer and pain. J Clin Oncol 21 (17): 3335-42, 2003. [PUBMED Abstract]
- Saad F, Gleason DM, Murray R, et al.: Long-term efficacy of zoledronic acid for the prevention of skeletal complications in patients with metastatic hormone-refractory prostate cancer. J Natl Cancer Inst 96 (11): 879-82, 2004. [PUBMED Abstract]
- Kaasa S, Brenne E, Lund JA, et al.: Prospective randomised multicenter trial on single fraction radiotherapy (8 Gy x 1) versus multiple fractions (3 Gy x 10) in the treatment of painful bone metastases. Radiother Oncol 79 (3): 278-84, 2006. [PUBMED Abstract]
- Chow E, Harris K, Fan G, et al.: Palliative radiotherapy trials for bone metastases: a systematic review. J Clin Oncol 25 (11): 1423-36, 2007. [PUBMED Abstract]
- Robinson RG: Strontium-89--precursor targeted therapy for pain relief of blastic metastatic disease. Cancer 72 (11 Suppl): 3433-5, 1993. [PUBMED Abstract]
- Oosterhof GO, Roberts JT, de Reijke TM, et al.: Strontium(89) chloride versus palliative local field radiotherapy in patients with hormonal escaped prostate cancer: a phase III study of the European Organisation for Research and Treatment of Cancer, Genitourinary Group. Eur Urol 44 (5): 519-26, 2003. [PUBMED Abstract]
- Porter AT, McEwan AJ, Powe JE, et al.: Results of a randomized phase-III trial to evaluate the efficacy of strontium-89 adjuvant to local field external beam irradiation in the management of endocrine resistant metastatic prostate cancer. Int J Radiat Oncol Biol Phys 25 (5): 805-13, 1993. [PUBMED Abstract]
- Smith MR, Saad F, Coleman R, et al.: Denosumab and bone-metastasis-free survival in men with castration-resistant prostate cancer: results of a phase 3, randomised, placebo-controlled trial. Lancet 379 (9810): 39-46, 2012. [PUBMED Abstract]
- Tannock IF, Osoba D, Stockler MR, et al.: Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer: a Canadian randomized trial with palliative end points. J Clin Oncol 14 (6): 1756-64, 1996. [PUBMED Abstract]
- Tannock IF, de Wit R, Berry WR, et al.: Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 351 (15): 1502-12, 2004. [PUBMED Abstract]
- Berthold DR, Pond GR, Soban F, et al.: Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer: updated survival in the TAX 327 study. J Clin Oncol 26 (2): 242-5, 2008. [PUBMED Abstract]
- Petrylak DP, Tangen CM, Hussain MH, et al.: Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. N Engl J Med 351 (15): 1513-20, 2004. [PUBMED Abstract]
- Berry DL, Moinpour CM, Jiang CS, et al.: Quality of life and pain in advanced stage prostate cancer: results of a Southwest Oncology Group randomized trial comparing docetaxel and estramustine to mitoxantrone and prednisone. J Clin Oncol 24 (18): 2828-35, 2006. [PUBMED Abstract]
- Kellokumpu-Lehtinen PL, Harmenberg U, Joensuu T, et al.: 2-Weekly versus 3-weekly docetaxel to treat castration-resistant advanced prostate cancer: a randomised, phase 3 trial. Lancet Oncol 14 (2): 117-24, 2013. [PUBMED Abstract]
- Oudard S, Fizazi K, Sengeløv L, et al.: Cabazitaxel Versus Docetaxel As First-Line Therapy for Patients With Metastatic Castration-Resistant Prostate Cancer: A Randomized Phase III Trial-FIRSTANA. J Clin Oncol 35 (28): 3189-3197, 2017. [PUBMED Abstract]
- de Bono JS, Oudard S, Ozguroglu M, et al.: Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 376 (9747): 1147-54, 2010. [PUBMED Abstract]
- Eisenberger M, Hardy-Bessard AC, Kim CS, et al.: Phase III Study Comparing a Reduced Dose of Cabazitaxel (20 mg/m(2)) and the Currently Approved Dose (25 mg/m(2)) in Postdocetaxel Patients With Metastatic Castration-Resistant Prostate Cancer-PROSELICA. J Clin Oncol 35 (28): 3198-3206, 2017. [PUBMED Abstract]
- Petrylak DP, Macarthur RB, O'Connor J, et al.: Phase I trial of docetaxel with estramustine in androgen-independent prostate cancer. J Clin Oncol 17 (3): 958-67, 1999. [PUBMED Abstract]
- Millikan RE: Chemotherapy of advanced prostatic carcinoma. Semin Oncol 26 (2): 185-91, 1999. [PUBMED Abstract]
- Amato RJ, Logothetis CJ, Hallinan R, et al.: Chemotherapy for small cell carcinoma of prostatic origin. J Urol 147 (3 Pt 2): 935-7, 1992. [PUBMED Abstract]
- Hall SJ, Klotz L, Pantuck AJ, et al.: Integrated safety data from 4 randomized, double-blind, controlled trials of autologous cellular immunotherapy with sipuleucel-T in patients with prostate cancer. J Urol 186 (3): 877-81, 2011. [PUBMED Abstract]
- Kantoff PW, Higano CS, Shore ND, et al.: Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med 363 (5): 411-22, 2010. [PUBMED Abstract]
- Longo DL: New therapies for castration-resistant prostate cancer. N Engl J Med 363 (5): 479-81, 2010. [PUBMED Abstract]
- Higano CS, Schellhammer PF, Small EJ, et al.: Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer. Cancer 115 (16): 3670-9, 2009. [PUBMED Abstract]
- Small EJ, Schellhammer PF, Higano CS, et al.: Placebo-controlled phase III trial of immunologic therapy with sipuleucel-T (APC8015) in patients with metastatic, asymptomatic hormone refractory prostate cancer. J Clin Oncol 24 (19): 3089-94, 2006. [PUBMED Abstract]
- Tannock I, Gospodarowicz M, Meakin W, et al.: Treatment of metastatic prostatic cancer with low-dose prednisone: evaluation of pain and quality of life as pragmatic indices of response. J Clin Oncol 7 (5): 590-7, 1989. [PUBMED Abstract]
- Fosså SD, Slee PH, Brausi M, et al.: Flutamide versus prednisone in patients with prostate cancer symptomatically progressing after androgen-ablative therapy: a phase III study of the European organization for research and treatment of cancer genitourinary group. J Clin Oncol 19 (1): 62-71, 2001. [PUBMED Abstract]
- Parker C, Nilsson S, Heinrich D, et al.: Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 369 (3): 213-23, 2013. [PUBMED Abstract]
- Sartor O, Coleman R, Nilsson S, et al.: Effect of radium-223 dichloride on symptomatic skeletal events in patients with castration-resistant prostate cancer and bone metastases: results from a phase 3, double-blind, randomised trial. Lancet Oncol 15 (7): 738-46, 2014. [PUBMED Abstract]
- Sartor O, de Bono J, Chi KN, et al.: Lutetium-177-PSMA-617 for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med 385 (12): 1091-1103, 2021. [PUBMED Abstract]
- Fizazi K, Herrmann K, Krause BJ, et al.: Health-related quality of life and pain outcomes with [177Lu]Lu-PSMA-617 plus standard of care versus standard of care in patients with metastatic castration-resistant prostate cancer (VISION): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 24 (6): 597-610, 2023. [PUBMED Abstract]
- Hussain M, Mateo J, Fizazi K, et al.: Survival with Olaparib in Metastatic Castration-Resistant Prostate Cancer. N Engl J Med 383 (24): 2345-2357, 2020. [PUBMED Abstract]
- Clarke NW, Armstrong AJ, Thiery-Vuillemin A, et al.: Abiraterone and Olaparib for Metastatic Castration-Resistant Prostate Cancer. NEJM Evid 1 (9): EVIDoa2200043, 2022. [PUBMED Abstract]
- Fallah J, Xu J, Weinstock C, et al.: FDA Approval Summary: Olaparib in Combination With Abiraterone for Treatment of Patients With BRCA-Mutated Metastatic Castration-Resistant Prostate Cancer. J Clin Oncol 42 (5): 605-613, 2024. [PUBMED Abstract]
- Saad F, Clarke NW, Oya M, et al.: Olaparib plus abiraterone versus placebo plus abiraterone in metastatic castration-resistant prostate cancer (PROpel): final prespecified overall survival results of a randomised, double-blind, phase 3 trial. Lancet Oncol 24 (10): 1094-1108, 2023. [PUBMED Abstract]
- Agarwal N, Azad AA, Carles J, et al.: Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial. Lancet 402 (10398): 291-303, 2023. [PUBMED Abstract]
- Fizazi K, Azad AA, Matsubara N, et al.: First-line talazoparib with enzalutamide in HRR-deficient metastatic castration-resistant prostate cancer: the phase 3 TALAPRO-2 trial. Nat Med 30 (1): 257-264, 2024. [PUBMED Abstract]
Referencias bibliográficas clave para el cáncer de próstata
Los miembros del Consejo Editorial del PDQ® sobre el tratamiento para adultos seleccionaron estas referencias bibliográficas por su importancia en el entorno del tratamiento del cáncer de próstata. Esta lista se proporciona para informar a los interesados sobre estudios importantes que han ayudado a conformar la comprensión actual sobre las opciones de tratamiento para el cáncer de próstata. A continuación, se indican las secciones del sumario en las que se citaron las referencias.
- Beer TM, Armstrong AJ, Rathkopf DE, et al.: Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 371 (5): 424-33, 2014.[PUBMED Abstract]
Citada en:
- Berthold DR, Pond GR, Soban F, et al.: Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer: updated survival in the TAX 327 study. J Clin Oncol 26 (2): 242-5, 2008.[PUBMED Abstract]
Citada en:
- Bill-Axelson A, Holmberg L, Garmo H, et al.: Radical prostatectomy or watchful waiting in early prostate cancer. N Engl J Med 370 (10): 932-42, 2014.[PUBMED Abstract]
Citada en:
- de Bono JS, Oudard S, Ozguroglu M, et al.: Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 376 (9747): 1147-54, 2010.[PUBMED Abstract]
Citada en:
- Lu-Yao GL, Albertsen PC, Moore DF, et al.: Outcomes of localized prostate cancer following conservative management. JAMA 302 (11): 1202-9, 2009.[PUBMED Abstract]
Citada en:
- Mason MD, Parulekar WR, Sydes MR, et al.: Final Report of the Intergroup Randomized Study of Combined Androgen-Deprivation Therapy Plus Radiotherapy Versus Androgen-Deprivation Therapy Alone in Locally Advanced Prostate Cancer. J Clin Oncol 33 (19): 2143-50, 2015.[PUBMED Abstract]
Citada en:
- Parker C, Nilsson S, Heinrich D, et al.: Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 369 (3): 213-23, 2013.[PUBMED Abstract]
Citada en:
- Potosky AL, Davis WW, Hoffman RM, et al.: Five-year outcomes after prostatectomy or radiotherapy for prostate cancer: the prostate cancer outcomes study. J Natl Cancer Inst 96 (18): 1358-67, 2004.[PUBMED Abstract]
Citada en:
- Pound CR, Partin AW, Eisenberger MA, et al.: Natural history of progression after PSA elevation following radical prostatectomy. JAMA 281 (17): 1591-7, 1999.[PUBMED Abstract]
Citada en:
- Ryan CJ, Smith MR, Fizazi K, et al.: Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 16 (2): 152-60, 2015.[PUBMED Abstract]
Citada en:
- Scher HI, Fizazi K, Saad F, et al.: Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 367 (13): 1187-97, 2012.[PUBMED Abstract]
Citada en:
- Seidenfeld J, Samson DJ, Aronson N, et al.: Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer. Evid Rep Technol Assess (Summ) (4): i-x, 1-246, I1-36, passim, 1999.[PUBMED Abstract]
Citada en:
- Sternberg CN, Castellano D, Daugaard G, et al.: Abiraterone acetate for patients with metastatic castration-resistant prostate cancer progressing after chemotherapy: final analysis of a multicentre, open-label, early-access protocol trial. Lancet Oncol 15 (11): 1263-8, 2014.[PUBMED Abstract]
Citada en:
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol 181 (3): 956-62, 2009.[PUBMED Abstract]
Citada en:
- Wilt TJ, Brawer MK, Jones KM, et al.: Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 367 (3): 203-13, 2012.[PUBMED Abstract]
Citada en:
Actualizaciones más recientes a este resumen (04/11/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Información general sobre el cáncer de próstata
Se revisó el texto para indicar que la tasa de supervivencia relativa a 5 años para los hombres con un diagnóstico en los Estados Unidos entre 2014 y 2020 de enfermedad local o regional superó el 99 % y en el caso de enfermedad a distancia, la tasa fue del 37 %.
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2025 (se citó a la American Cancer Society como referencia 2).
Aspectos generales de las opciones de tratamiento del cáncer de próstata
Se revisó el Cuadro 6, Opciones de tratamiento del cáncer de próstata por estadio, para incluir la terapia hormonal con inhibidores de poli-(ADP-ribosa)–polimerasa (PARP) para hombres con cáncer de próstata y variantes de BRCA1, BRCA2 o ATM como una opción de tratamiento para el cáncer de próstata recidivante.
Tratamiento del cáncer de próstata recidivante sensible a las hormonas o resistente a estas
Se revisó la lista de opciones de tratamiento para el cáncer de próstata recidivante.
Se añadió Radioterapia de rayos β como subsección nueva.
Se añadió Terapia hormonal con inhibidores de PARP para hombres con cáncer de próstata metastásico resistente a la castración y variantes de BRCA1, BRCA2 o ATM como subsección nueva.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de próstata. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de próstata son:
- Juskaran S. Chadha, DO (Moffitt Cancer Center)
- Jad Chahoud, MD, MPH (Moffitt Cancer Center)
- Timothy Gilligan, MD (Cleveland Clinic Taussig Cancer Institute)
- Joseph J. Park, MD (Duke University Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de próstata. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/prostata/pro/tratamiento-prostata-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.