Tratamiento del cáncer de piel (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de piel
Hay tres tipos principales de cáncer de piel:
- Carcinoma de células basales (CCB).
- Carcinoma de células escamosas (CCE).
- Melanoma.
Los CCB y los CCE son las formas más comunes de cáncer de piel y, en conjunto, se los denomina cánceres de piel no melanoma. En este resumen se aborda el tratamiento de los CCB y CCE de piel, así como la queratosis actínica, que es la lesión no invasiva relacionada. Para obtener información sobre el tratamiento del melanoma, consultar Tratamiento del melanoma.
Incidencia y mortalidad
El cáncer de piel no melanoma es el cáncer más común en los Estados Unidos. El CCB es el tipo más común de cáncer: representa cerca de tres cuartos de los cánceres de piel no melanoma.[1] Según parece, la incidencia del cáncer de piel no melanoma está en aumento en algunas áreas de los Estados Unidos,[2,3] pero no en todas. Es probable que las tasas de incidencia general en los Estados Unidos hayan estado en aumento desde hace varios años.[4] En parte, este aumento quizás se atribuya a una concientización mayor sobre el cáncer de piel y, como consecuencia, los exámenes y las biopsias de lesiones cutáneas.
No es posible calcular con precisión el número total y la tasa de incidencia de los cánceres de piel no melanomas porque no se exige la notificación a los registros del cáncer. Sin embargo, al extrapolar las tarifas de servicio de Medicare a la población de los Estados Unidos, se calculó que en 2012 se trataron alrededor de 3,3 millones de personas por cánceres de piel no melanomas.[5,6] Este número supera el cálculo de la American Cancer Society de todos los otros casos anuales nuevos de cáncer, que fue de alrededor de 2 millones.[6] Aunque el cáncer de piel no melanoma es la neoplasia maligna más común de todas, representa menos del 0,1 % de las defunciones por cáncer.
Características anatómicas
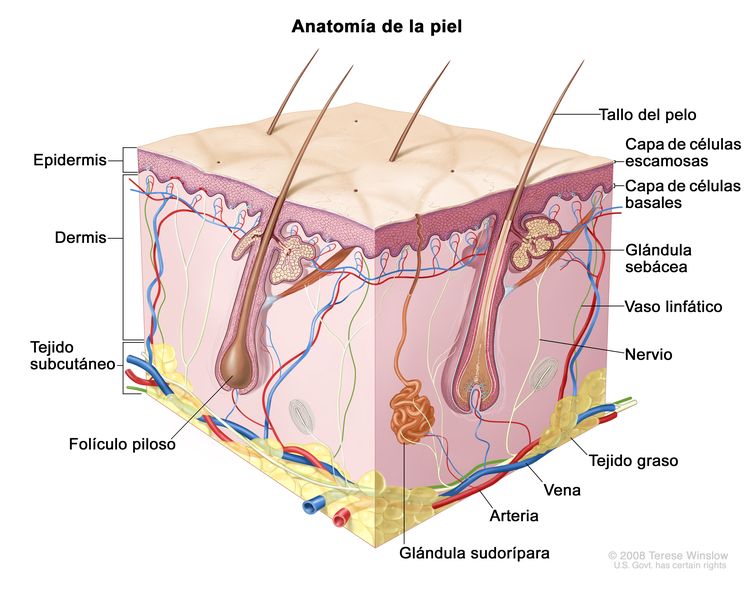
Factores de riesgo
Los factores de riesgo de cáncer de piel no melanoma son los siguientes:
- Exposición al sol y la radiación ultravioleta (UV) (incluso en cámaras de bronceado). La evidencia epidemiológica indica que la exposición acumulada a la radiación UV y la sensibilidad cutánea individual a esta radiación son factores de riesgo del cáncer de piel. Sin embargo, el tipo de exposición (exposición a una intensidad alta y de corta duración vs. exposición crónica) y la modalidad de exposición (patrón continuo vs. patrón intermitente) tal vez difiera entre los tres tipos principales de cáncer de piel.[7-9] Los cánceres de piel son más comunes en las latitudes meridionales del hemisferio norte.
- Antecedentes de quemaduras solares. Las personas que tuvieron quemaduras solares están predispuestas a presentar un CCE.
- Tez y ojos claros. Las personas con tez clara (piel clara con facilidad de presentar pecas y quemaduras), ojos claros (color azul, verde u otro color claro) y pelo claro (rojo o rubio) que se expusieron a mucha luz solar tienen un aumento de riesgo de presentar cáncer de piel no melanoma.
- Antecedentes familiares o personales de CCB, CCE, queratosis actínica, síndrome de nevo displásico familiar o nevo atípico.
- Inflamación cutánea crónica. Las personas con inflamación cutánea crónica, como se observa en las úlceras cutáneas de larga duración, están predispuestas a presentar CCE.
- Inmunodepresión. Los receptores de trasplantes de órganos que reciben fármacos inmunodepresores y las personas con enfermedades inmunodepresoras tienen un riesgo elevado de cánceres de piel, en particular de CCE.[1]
- Otras exposiciones ambientales. La exposición al arsénico también aumenta el riesgo de CCE cutáneo.[1]
Tipos de cáncer de piel
Este resumen basado en la evidencia trata sobre el carcinoma de células basales (CCB) y el carcinoma de células escamosas (CCE) de piel, así como sobre la queratosis actínica, lesión no invasiva que algunos patólogos consideran como variante del CCE in situ.[1] Tanto el CCB como el CCE son de origen epitelial. Aunque el CCB y el CCE son claramente los tipos más frecuentes de cánceres de piel no melanomas (con una amplia variabilidad de comportamientos clínicos), la categoría de cáncer de piel no melanoma incluye alrededor de 82 tipos de neoplasias malignas de la piel.[10]
Otros tipos de enfermedad maligna de la piel son los siguientes:
- Melanoma.
- Carcinoma de células de Merkel.
- Linfomas cutáneos de células T (por ejemplo, micosis fungoide).
- Sarcoma de Kaposi.
- Enfermedad de Paget extramamaria.
- Carcinoma apocrino de piel.
- Neoplasias malignas metastásicas de distintos sitios primarios.
Para obtener más información, consultar Tratamiento del melanoma, Tratamiento del carcinoma de células de Merkel, Tratamiento de la micosis fungoide y otros linfomas cutáneos de células T y Tratamiento del sarcoma de Kaposi.
Carcinoma de células basales
El CCB es por lo menos tres veces más común que el CCE en pacientes sin inmunodepresión. Por lo habitual, se presenta en las áreas de la piel expuestas al sol; la nariz es el sitio más frecuente. Aunque hay muchos cuadros clínicos diferentes de CCB, el tipo más característico es la lesión nodular asintomática o nodular ulcerosa que se eleva de la piel circundante, tiene aspecto nacarado y contiene vasos telangiectásicos.
Los CCB se componen de células no queratinizantes derivadas de la capa de células basales de la epidermis. Son de crecimiento lento y rara vez hacen metástasis. El CCB tiende a causar destrucción local y produce deformidad grave si se deja sin tratar o si las recidivas locales no se pueden extirpar por completo. Las zonas de riesgo alto para la recidiva tumoral después del tratamiento inicial son el centro de la cara (por ejemplo, región periorbitaria, párpados, surco nasogeniano o ángulo entre la nariz y la mejilla), la región posauricular, el pabellón auricular, el conducto auditivo externo, la frente y el cuero cabelludo.[11]
El tipo morfeiforme es un subtipo específico de CCB. Este subtipo aparece normalmente como una placa firme que se asemeja a una cicatriz. Debido a los márgenes tumorales imprecisos, el tipo morfeiforme es difícil de tratar de forma satisfactoria con los tratamientos tradicionales.[12]
Los CCB a menudo presentan una mutación característica en el gen supresor de tumores PTCH1, aunque el mecanismo de carcinogénesis no está claro.[1]
Carcinoma de células escamosas
Las personas con daño crónico por exposición al sol, antecedentes de quemaduras, exposición al arsénico, inflamación cutánea crónica (como se observa en úlceras de la piel de larga duración) y que ya recibieron radioterapia tienen predisposición a presentar un CCE. Los CCE tienden a aparecer en las partes de la piel expuestas al sol, como las orejas, el labio inferior y el dorso de las manos. Es menos probable que los CCE que comienzan como queratosis actínica en la piel expuesta al sol hagan metástasis y tienen un pronóstico mejor que los que aparecen de novo o que aparecen en la piel no expuesta al sol.[12]
Los CCE se componen de células queratinizantes. Estos tumores son más malignos que los CCB y varían en cuanto al potencial de crecimiento, invasión y metástasis. El pronóstico se relaciona con el grado de diferenciación y el grado tumoral se notifica como parte del sistema de estadificación.[10] Lo más común es utilizar un sistema de cuatro grados (G1–G4), pero también se usan sistemas de 2 y 3 grados.
Se notificaron mutaciones en el gen supresor de tumores PTCH1 en CCE extirpados de pacientes con antecedentes de CCB múltiples.[13]
El CCE in situ (también conocido como enfermedad de Bowen) es una lesión no invasiva. En ocasiones, es difícil distinguir las características patológicas de un CCE in situ y de un proceso inflamatorio benigno.[1] El riesgo de que se transforme en un CCE invasivo es bajo, al parecer, en el rango del 3 % al 4 %.[14]
Queratosis actínica
Las queratosis actínicas son posibles precursores de los CCE, pero la tasa de progresión es muy baja y la mayoría no se transforma en CCE. Estos parches normalmente rojos y escamosos suelen surgir en las áreas de la piel expuestas en forma crónica al sol y es común encontrarlos en la cara y el dorso de las manos.
Evaluación diagnóstica y estadificación
Por lo habitual, los CCB y los CCE se diagnostican a partir de un examen histopatológico de rutina con piezas de biopsia obtenidas mediante rasurado, sacabocado, incisión o escisión.[1]
En ocasiones, para diagnosticar y estadificar los CCB y los CCE se hacen otras pruebas y procedimientos como los siguientes:
- Examen físico que incluya un examen de la piel y antecedentes.
- Radiografía de tórax.
- Tomografía computarizada (TC) sola o combinada con una tomografía por emisión de positrones (TEP) de la cabeza y el cuello, o del tórax.
- Ultrasonografía de los ganglios linfáticos regionales.
- Biopsia de ganglio linfático.
Para diagnosticar y estadificar el carcinoma de párpado, se realiza un examen o evaluación oftálmica.
Bibliografía
- Reszko A, Aasi SZ, Wilson LD, et al.: Cancer of the skin. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1610-33.
- Athas WF, Hunt WC, Key CR: Changes in nonmelanoma skin cancer incidence between 1977-1978 and 1998-1999 in Northcentral New Mexico. Cancer Epidemiol Biomarkers Prev 12 (10): 1105-8, 2003. [PUBMED Abstract]
- Harris RB, Griffith K, Moon TE: Trends in the incidence of nonmelanoma skin cancers in southeastern Arizona, 1985-1996. J Am Acad Dermatol 45 (4): 528-36, 2001. [PUBMED Abstract]
- Rogers HW, Weinstock MA, Harris AR, et al.: Incidence estimate of nonmelanoma skin cancer in the United States, 2006. Arch Dermatol 146 (3): 283-7, 2010. [PUBMED Abstract]
- Rogers HW, Weinstock MA, Feldman SR, et al.: Incidence Estimate of Nonmelanoma Skin Cancer (Keratinocyte Carcinomas) in the U.S. Population, 2012. JAMA Dermatol 151 (10): 1081-6, 2015. [PUBMED Abstract]
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- Koh HK: Cutaneous melanoma. N Engl J Med 325 (3): 171-82, 1991. [PUBMED Abstract]
- Preston DS, Stern RS: Nonmelanoma cancers of the skin. N Engl J Med 327 (23): 1649-62, 1992. [PUBMED Abstract]
- English DR, Armstrong BK, Kricker A, et al.: Case-control study of sun exposure and squamous cell carcinoma of the skin. Int J Cancer 77 (3): 347-53, 1998. [PUBMED Abstract]
- Cutaneous carcinoma of the head and neck. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 171–81.
- Dubin N, Kopf AW: Multivariate risk score for recurrence of cutaneous basal cell carcinomas. Arch Dermatol 119 (5): 373-7, 1983. [PUBMED Abstract]
- Wagner RF, Casciato DA: Skin cancers. In: Casciato DA, Lowitz BB, eds.: Manual of Clinical Oncology. 4th ed. Lippincott, Williams, and Wilkins, 2000, pp 336-373.
- Ping XL, Ratner D, Zhang H, et al.: PTCH mutations in squamous cell carcinoma of the skin. J Invest Dermatol 116 (4): 614-6, 2001. [PUBMED Abstract]
- Kao GF: Carcinoma arising in Bowen's disease. Arch Dermatol 122 (10): 1124-6, 1986. [PUBMED Abstract]
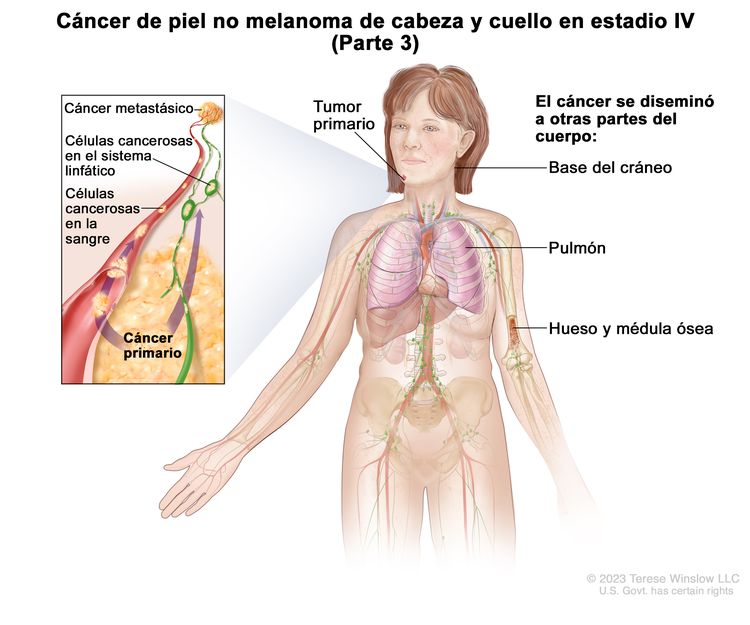
Información sobre los estadios del cáncer de piel
En la octava edición del AJCC Cancer Staging Manual del American Joint Committee on Cancer (AJCC), hay sistemas de estadificación separados para el carcinoma de párpado, y para el carcinoma cutáneo de cabeza y cuello. El sistema de estadificación para el carcinoma cutáneo aborda el carcinoma de células escamosas (CCE) y el carcinoma de células basales (CCB) cutáneos.[1,2] El sistema de estadificación para el carcinoma de párpado contempla los carcinomas de todas las características histológicas.
Se deberán examinar en forma rutinaria los ganglios linfáticos regionales en todos los casos de CCB, en especial, en los siguientes casos:
- Tumores de riesgo alto que aparecen en los labios, las orejas y las regiones perianal y perigenital.
- Áreas de la mano de riesgo alto.
- Sitios de ulceración o inflamación crónicas, o cicatrices de quemaduras.
- Sitios tratados antes con radioterapia.
Como el CCB rara vez hace metástasis, en general no se necesitan pruebas complementarias para determinar si hay metástasis.
Hay varios factores que se correlacionan con un pronóstico precario de recidiva o metástasis. Se aplican sobre todo a pacientes de CCE y a un subgrupo más maligno de carcinoma de piel no melanoma, pero rara vez a pacientes de CCB, e incluyen lo siguiente:[1]
- Diseminación extraganglionar.
- Diámetro del tumor.
- Profundidad del tumor.
- Sitio anatómico.
- Invasión perineural.
- Grado o diferenciación histopatológicos y desmoplasia.
- Diseminación a las estructuras óseas.
- Enfermedad ganglionar.
- Inmunodepresión y enfermedad en estadio avanzado.
- Estado general de salud.
- Comorbilidad.
- Factores relacionados con el estilo de vida.
- Consumo de tabaco.
Aunque el tumor sea pequeño, los CCE en pacientes inmunodeprimidos tienden a exhibir un comportamiento más maligno que los CCE en pacientes no inmunodeprimidos. A pesar de que la inmunodepresión no es una parte formal del sistema de estadificación del AJCC, se recomienda que los centros que realizan estudios prospectivos de los CCE registren la presencia y el tipo de inmunodepresión.
Estadificación del carcinoma cutáneo de cabeza y cuello (con exclusión de los carcinomas de párpado)
El AJCC designó los estadios mediante la clasificación TNM (tumor, ganglio linfático y metástasis) para definir el carcinoma cutáneo de cabeza y cuello, con exclusión de los carcinomas de párpado.[1]
| Categoría T | Criterios T |
|---|---|
| aReproducción autorizada de AJCC: Cutaneous carcinoma of the head and neck. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 171–81. | |
| bLa profundidad de la invasión se define como una invasión más allá de la grasa subcutánea o que mide >6 mm (medidos desde la capa granular de la epidermis normal adyacente hasta la base del tumor); la invasión perineural para la clasificación T3 se define como presencia de células tumorales dentro de la vaina nerviosa de un nervio que se encuentra más profundo que la dermis o que mide ≥0,1 mm de calibre, o que presenta compromiso clínico o radiográfico de los nervios sin invasión o sin traspasar la base del cráneo. | |
| TX | Tumor primario no identificable. |
| Tis | Carcinoma in situ. |
| T1 | Tumor que mide ≤2 cm en su mayor dimensión. |
| T2 | Tumor que mide >2 cm, pero ≤4 cm en su mayor dimensión. |
| T3 | Tumor que mide >4 cm en su mayor dimensión, o con poca erosión ósea, invasión perineural o invasión profunda.b |
| T4 | Tumor con invasión macroscópica del hueso cortical o la médula, invasión de la base del cráneo o invasión del foramen de la base del cráneo. |
| –T4a | Tumor con invasión macroscópica del hueso cortical o la médula. |
| –T4b | Tumor con invasión de la base del cráneo o compromiso del foramen de la base del cráneo. |
| Categoría N | Criterios N |
|---|---|
| ENE = diseminación extraganglionar. | |
| aReproducción autorizada de AJCC: Cutaneous carcinoma of the head and neck. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 171-81. | |
| bEn ocasiones, se usa una designación "U" o "L" para cualquier categoría N con el fin de indicar metástasis por encima del borde inferior del cricoides (U) o por debajo del borde inferior del cricoides (L). De modo similar, la ENE clínica o patológica se deberá registrar como sin ENE (ENE-) o con ENE (ENE+). | |
| NX | Ganglios linfáticos regionales no evaluables. |
| N0 | Sin metástasis en ganglios linfáticos regionales. |
| N1 | Metástasis en un solo ganglio linfático ipsilateral, que mide ≤3 cm en su mayor dimensión y ENE-. |
| N2 | Metástasis en un solo ganglio linfático ipsilateral, que mide ≤3 cm en su mayor dimensión y ENE+; o mide >3 cm, pero ≤6 cm en su mayor dimensión y ENE-; o metástasis en múltiples ganglios linfáticos ipsilaterales, ninguno mide >6 cm en su mayor dimensión y ENE-; o en uno o más ganglios linfáticos bilaterales o contralaterales, ninguno >6 cm en su mayor dimensión, ENE-. |
| –N2a | Metástasis en un solo ganglio linfático ipsilateral que mide ≤3 cm en su mayor dimensión y ENE+; o en un solo ganglio linfático ipsilateral que mide >3 cm, pero ≤6 cm en su mayor dimensión y ENE-. |
| –N2b | Metástasis en múltiples ganglios linfáticos ipsilaterales, ninguno mide >6 cm en su mayor dimensión y ENE-. |
| –N2c | Metástasis en uno o más ganglios linfáticos bilaterales o contralaterales, ninguno mide >6 cm en su mayor dimensión y ENE-. |
| N3 | Metástasis en un ganglio linfático que mide >6 cm en su mayor dimensión y ENE-; o en un solo ganglio linfático ipsilateral que mide >3 cm en su mayor dimensión y ENE+; o en múltiples ganglios linfáticos ipsilaterales, contralaterales o bilaterales, cualquiera con ENE+; o en un solo ganglio linfático contralateral de cualquier tamaño y ENE+. |
| –N3a | Metástasis en un ganglio linfático que mide >6 cm en su mayor dimensión y ENE-. |
| –N3b | Metástasis en un solo ganglio linfático ipsilateral que mide >3 cm en su mayor dimensión y ENE+; o en múltiples ganglios linfáticos ipsilaterales, contralaterales o bilaterales, cualquiera con ENE+; o en un solo ganglio linfático contralateral de cualquier tamaño y ENE+. |
| Categoría N | Criterios N |
|---|---|
| ENE = diseminación extraganglionar. | |
| aReproducción autorizada de AJCC: Cutaneous carcinoma of the head and neck. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 171–81. | |
| bEn ocasiones, se usa la designación "U" o "L" en cualquier categoría N para indicar metástasis por encima del borde inferior del cricoides (U) o por debajo del borde inferior del cricoides (L). De modo similar, la ENE clínica o patológica se deberá registrar como sin ENE (ENE-) o con ENE (ENE+). | |
| NX | Ganglios linfáticos regionales no evaluables. |
| N0 | Sin metástasis en ganglios linfáticos regionales. |
| N1 | Metástasis en un solo ganglio linfático ipsilateral, que mide ≤3 cm en su mayor dimensión y ENE-. |
| N2 | Metástasis en un solo ganglio linfático ipsilateral que mide >3 cm, pero ≤6 cm en su mayor dimensión y ENE-; o metástasis en múltiples ganglios linfáticos ipsilaterales, ninguno mide >6 cm en su mayor dimensión y ENE-; o en ganglios linfáticos bilaterales y contralaterales, ninguno mide >6 cm en su mayor dimensión y ENE-. |
| –N2a | Metástasis en un solo ganglio linfático ipsilateral que mide >3 cm, pero ≤6 cm en su mayor dimensión y ENE-. |
| –N2b | Metástasis en múltiples ganglios linfáticos ipsilaterales, ninguno mide >6 cm en su mayor dimensión y ENE-. |
| –N2c | Metástasis en ganglios linfáticos bilaterales o contralaterales, ninguno mide >6 cm en su mayor dimensión y ENE-. |
| N3 | Metástasis en un ganglio linfático que mide >6 cm en su mayor dimensión y ENE-; o metástasis en cualquier ganglio linfático y ENE manifiesta desde el punto de vista clínico (ENE+). |
| –N3a | Metástasis en un ganglio linfático que mide >6 cm en su mayor dimensión y ENE-. |
| –N3b | Metástasis en cualquier ganglio linfático y ENE+. |
| Categoría M | Criterios M |
|---|---|
| aReproducción autorizada de AJCC: Cutaneous carcinoma of the head and neck. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 171–81. | |
| M0 | Sin metástasis a distancia. |
| M1 | Metástasis a distancia. |
| Estadio | T | N | M | Imagen |
|---|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||||
| aReproducción autorizada de AJCC: Cutaneous carcinoma of the head and neck. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 171–81. | ||||
| 0 | Tis | N0 | M0 |
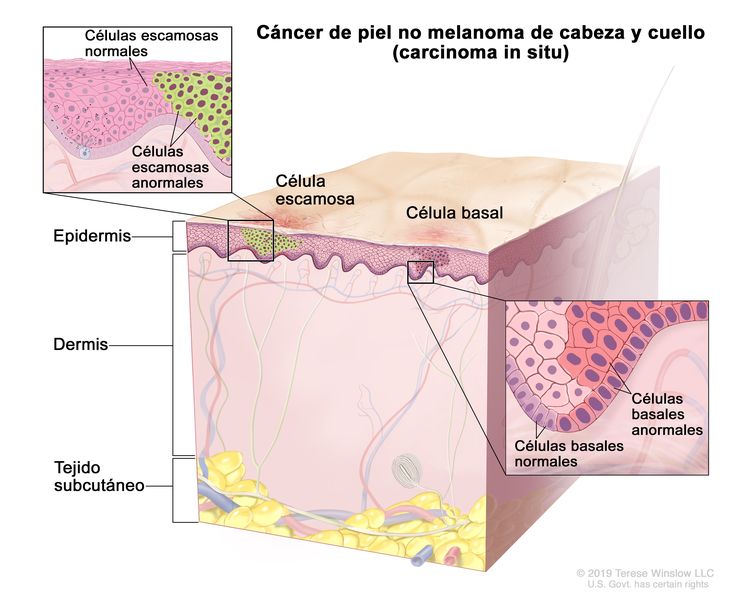 |
| I | T1 | N0 | M0 |
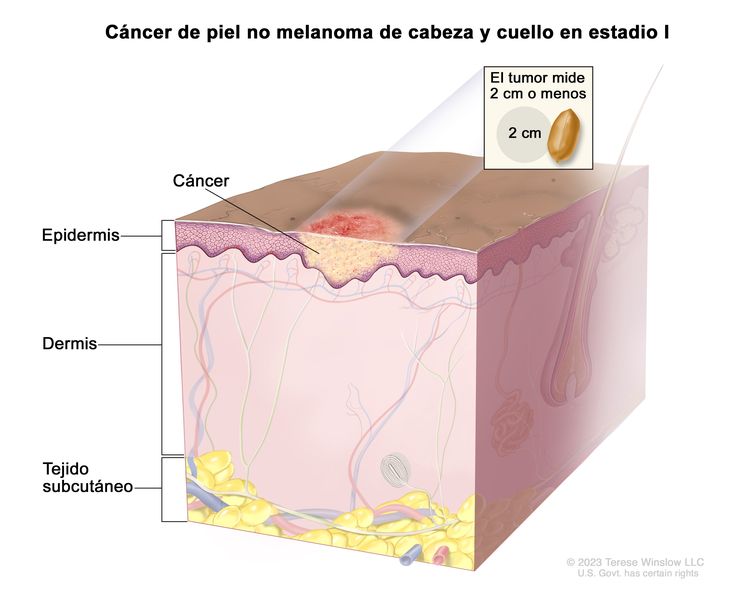 |
| II | T2 | N0 | M0 |
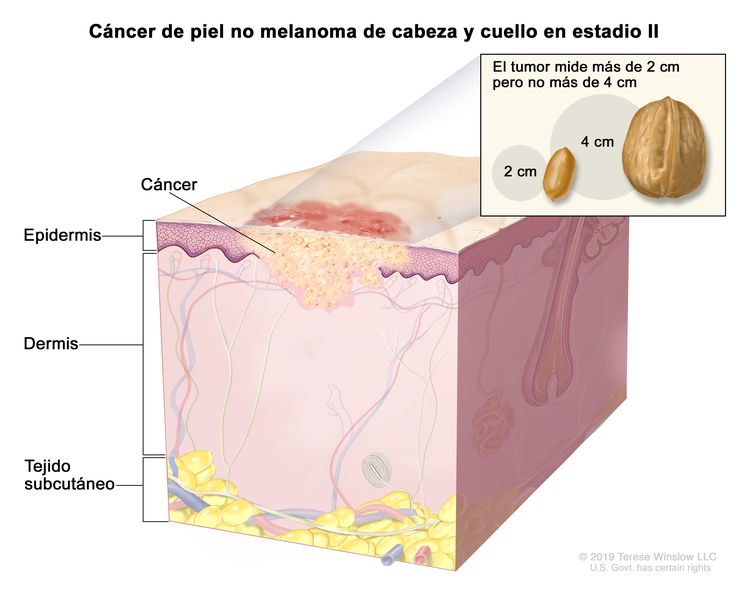 |
| III | T1 | N1 | M0 |
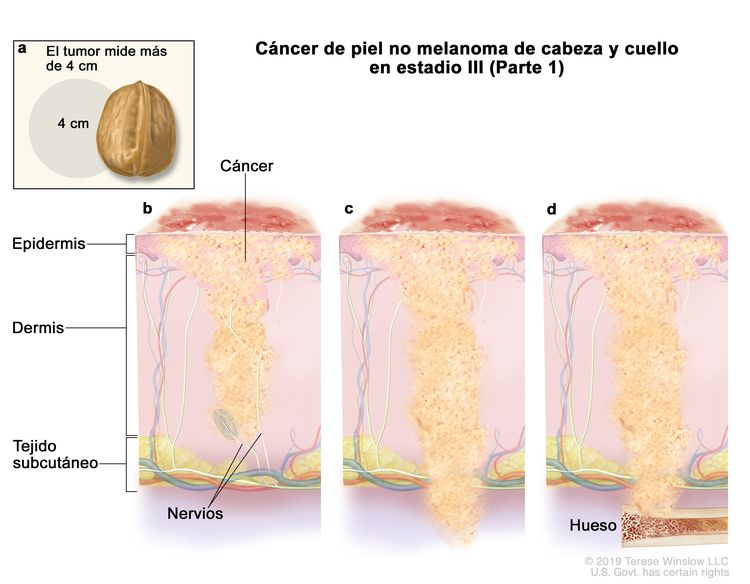 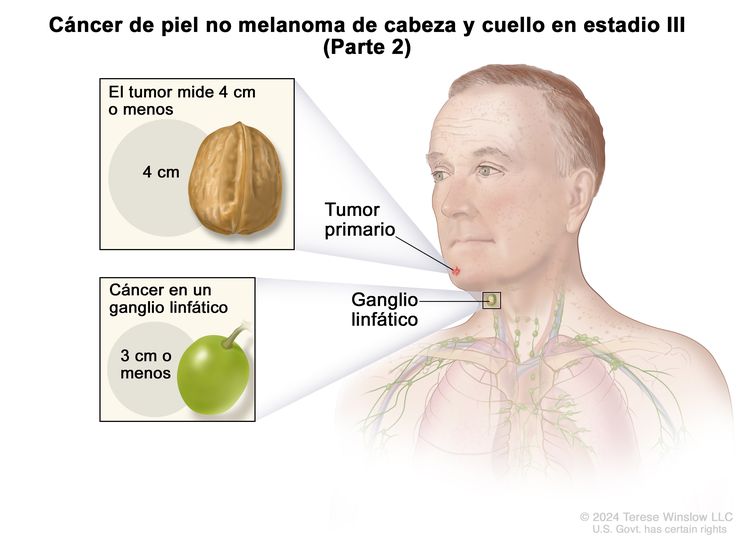 |
| T2 | N1 | M0 | ||
| T3 | N0 | M0 | ||
| T3 | N1 | M0 | ||
| IV | T1 | N2 | M0 |
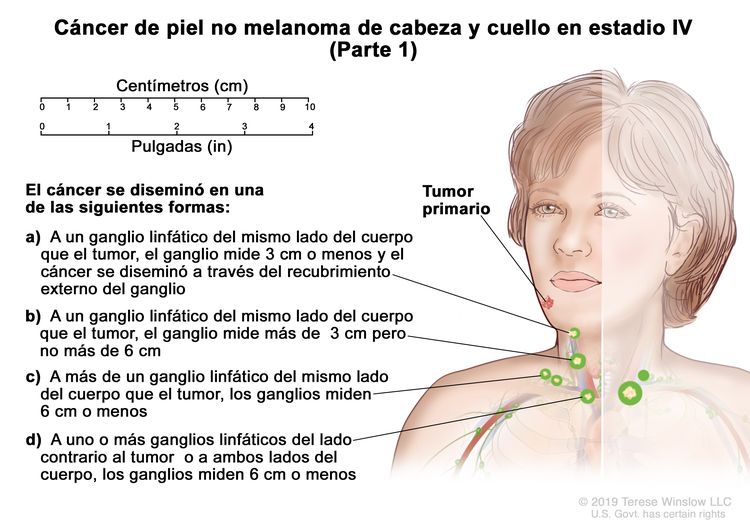 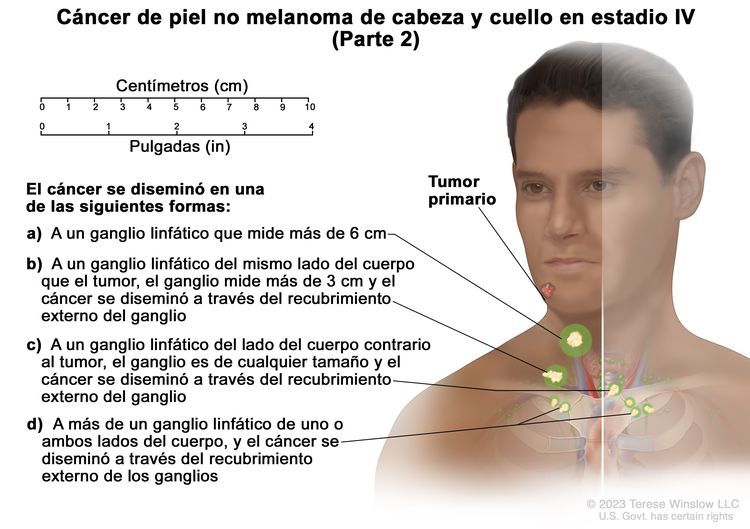 |
| T2 | N2 | M0 | ||
| T3 | N2 | M0 | ||
| T4 | Cualquier N | M0 | ||
| Cualquier T | N3 | M0 | ||
| Cualquier T | Cualquier N | M1 |
 |
|
Estadificación para los carcinomas de párpado
El AJCC designó los estadios mediante la clasificación TNM.[1] La clasificación TNM se usa para estadificar todos los tipos celulares del carcinoma de párpado, excepto el melanoma.
| Categoría T | Criterios T |
|---|---|
| aReproducción autorizada de AJCC: Eyelid carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 779-85. | |
| TX | Tumor primario no evaluable. |
| T0 | Sin indicios de tumor primario. |
| Tis | Carcinoma in situ. |
| T1 | Tumor que mide ≤10 mm en su mayor dimensión. |
| –T1a | Tumor sin invasión del tarso palpebral ni el margen del párpado. |
| –T1b | Tumor con invasión del tarso palpebral o el margen del párpado. |
| –T1c | Tumor con compromiso de todo el grosor del párpado. |
| T2 | Tumor que mide >10 mm, pero ≤20 mm en su mayor dimensión. |
| –T2a | Tumor sin invasión del tarso palpebral ni el margen del párpado. |
| –T2b | Tumor con invasión del tarso palpebral o el margen del párpado. |
| –T2c | Tumor con compromiso de todo el grosor del párpado. |
| T3 | Tumor que mide >20 mm, pero ≤30 mm en su mayor dimensión. |
| –T3a | Tumor sin invasión del tarso palpebral ni el margen del párpado. |
| –T3b | Tumor con invasión del tarso palpebral o el margen del párpado. |
| –T3c | Tumor con compromiso de todo el grosor del párpado. |
| T4 | Cualquier tumor del párpado con invasión de las estructuras oculares, orbitarias o faciales adyacentes. |
| –T4a | Tumor con invasión de las estructuras oculares o intraorbitarias. |
| –T4b | Tumor con invasión (o que erosiona a través de) de las paredes óseas de la órbita o con diseminación a los senos paranasales, o invasión del saco lagrimal, el conducto nasolagrimal o el encéfalo. |
| Categoría N | Criterios N |
|---|---|
| aReproducción autorizada de AJCC: Eyelid carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 779–85. | |
| NX | Ganglios linfáticos regionales no evaluables. |
| N0 | Sin indicios de compromiso de ganglios linfáticos. |
| N1 | Metástasis en un solo ganglio linfático regional ipsilateral, que mide ≤3 cm en su mayor dimensión. |
| –N1a | Metástasis en un solo ganglio linfático ipsilateral, según evaluación clínica o hallazgos en imágenes. |
| –N1b | Metástasis en un solo ganglio linfático ipsilateral, según una biopsia de ganglio linfático. |
| N2 | Metástasis en un solo ganglio linfático ipsilateral, que mide >3 cm en su mayor dimensión; o en ganglios linfáticos bilaterales o contralaterales. |
| –N2a | Metástasis documentada mediante evaluación clínica o hallazgos en imágenes. |
| –N2b | Metástasis documentada mediante hallazgos microscópicos en una biopsia de ganglio linfático. |
| Categoría M | Criterios M |
|---|---|
| aReproducción autorizada de AJCC: Eyelid carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 779–85. | |
| M0 | Sin metástasis a distancia. |
| M1 | Metástasis a distancia. |
| Estadio | T | N | M |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Eyelid carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 779–85. | |||
| 0 | Tis | N0 | M0 |
| IA | T1 | N0 | M0 |
| IB | T2a | N0 | M0 |
| IIA | T2b–c | N0 | M0 |
| T3 | N0 | M0 | |
| IIB | T4 | N0 | M0 |
| IIIA | Cualquier T | N1 | M0 |
| IIIB | Cualquier T | N2 | M0 |
| IV | Cualquier T | Cualquier N | M1 |
Bibliografía
- Cutaneous carcinoma of the head and neck. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 171–81.
- Esmaeli B, Dutton JJ, Graue GF, et al.: Eyelid carcinoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 779-85.
Aspectos generales de las opciones de tratamiento
Los tratamientos del carcinoma de células escamosas y el carcinoma de células basales se describen en el Cuadro 10.
Tratamiento del carcinoma de células basales de piel
Hay una gama amplia de abordajes de tratamiento del carcinoma de células basales de la piel (CCB), incluso escisión, radioterapia, criocirugía, electrodesecación y curetaje, exposición fotodinámica o exposición a la luz de rayo láser y terapias tópicas. Cada uno de estos abordajes es útil en situaciones clínicas específicas. Según la selección de casos, estos abordajes tienen tasas sin recidiva que oscilan entre el 85 % y el 95 %.[1-9]
Se publicó una revisión sistemática de 27 ensayos controlados aleatorizados en la que se compararon varios tratamientos para el CCB.[10] Se publicaron 18 estudios completos y 9 solo en forma de resumen. Se analizaron solo 19 de los 27 ensayos según los criterios de intención de tratamiento. Dado que la tasa de letalidad por CCB es tan baja, el criterio principal de valoración de la mayoría de los ensayos es respuesta completa o tasa de recidiva después del tratamiento. La mayoría de los estudios identificados no fueron de calidad alta y tuvieron períodos de seguimiento cortos que conducirán a una sobrestimación del control tumoral; solo un estudio tuvo un período de seguimiento de 4 años. En una revisión bibliográfica de tasas de recidiva en series de casos con seguimiento a largo plazo después del tratamiento de CCB, se indicó que solo el 50 % de las recidivas se presentaron en los 2 primeros años, el 66 % después de 3 años y el 18 % después de 5 años.[11] Un hallazgo común fue que las tasas de recidivas a 10 años fueron de cerca del doble de las tasas de recidiva a 2 años.
Tratamiento del carcinoma de células basales de piel (enfermedad localizada)
Las opciones de tratamiento para el CCB de la piel (enfermedad localizada) son las siguientes:
Escisión quirúrgica con evaluación de los márgenes
Este tratamiento quirúrgico tradicional suele depender de márgenes quirúrgicos que oscilen de 3 a 10 mm, según el diámetro del tumor. Es posible que sea necesaria una nueva escisión si se encuentra que el margen quirúrgico del corte en parafina es insuficiente. Por ejemplo, en un ensayo, se extirparon de modo incompleto 35 de 199 CCB primarios (18 %) durante la cirugía inicial y se sometieron a otra escisión.[12] Además, en muchos laboratorios se realiza un examen patológico de solo una pequeña fracción del margen total del tumor. En consecuencia, la indicación de márgenes sin compromiso tumoral puede estar sujeta a un error de muestreo.[13]
En ensayos clínicos, la escisión se comparó con radioterapia, cirugía micrográfica de Mohs, terapia fotodinámica (TFD) y criocirugía.
Evidencia (escisión quirúrgica con evaluación de los márgenes):
- En un ensayo de un solo centro, se asignó al azar a 360 pacientes de CCB faciales de menos de 4 cm de diámetro a escisión quirúrgica o radioterapia (55 % a braquiterapia intersticial, 33 % a radioterapia de contacto y 12 % a radioterapia de haz externo [RHE] convencional).[14][Nivel de evidencia B1] Los márgenes de escisión, evaluados mediante cortes congelados durante el procedimiento en el 91 % de casos, debían ser de por lo menos 2 mm, con una nueva escisión si era necesario. Trece pacientes no se trataron y se excluyeron del análisis.
- A los 4 años (mediana de seguimiento de 41 meses), las tasas actuariales de fracaso (confirmadas por un tumor persistente o recidivante) fueron de 0,7 en el grupo de cirugía y del 7,5 % en el grupo de radioterapia (P = 0,003).[15][Nivel de evidencia B1]
- Tanto los pacientes como los dermatólogos y tres profesionales independientes, clasificaron como mejores los resultados cosméticos después de la cirugía. A los 4 años, el 87 % de los pacientes sometidos a cirugía clasificaron el resultado cosmético como bueno en comparación con el 69 % de los pacientes sometidos a radioterapia.[15]
- En un análisis por intención de tratar llevado a cabo en dos centros, se asignó al azar a 374 pacientes con 408 CCB primarios faciales a someterse a escisión quirúrgica o cirugía micrográfica de Mohs con un mínimo de 3 mm de margen alrededor del tumor visible hasta que no hubiera márgenes positivos en ninguno de los casos.[12][Nivel de evidencia B1]
- Después de 30 meses de seguimiento, la tasa de recidiva fue de 5 de 171 tumores (3 %) en el grupo de escisión y de 3 de 160 tumores (2 %) en el grupo de cirugía micrográfica de Mohs (diferencia absoluta, 1 %; intervalo de confianza [IC] 95 %, -2,5 a +3,7 %; P = 0,724). No hubo diferencia en las tasas de complicaciones y los resultados cosméticos generales fueron similares.[12][Nivel de evidencia B1]
- Los costos operativos totales fueron casi dos veces más altos en el grupo de Mohs (405,79 euros vs. 216,86 euros (P < 0,001).
- En un ensayo multicéntrico aleatorizado se incluyeron 101 adultos sin tratamiento previo de CCB nodular de la piel, con exclusión de lesiones en la parte media de la cara, áreas orbitarias y orejas. Los pacientes se trataron con escisión (márgenes de por lo menos 5 mm) o TFD con crema de aminolevulinato de metilo tópico (160 mg/g) seguida de 2 exposiciones a luz roja (longitud de onda 570–670 nm, 75 J/cm22), con un intervalo de 7 días.[16][Nivel de evidencia B3] Se realizó un análisis por protocolo y por lesión de los 97 pacientes sometidos a escisión o por lo menos 1 ciclo de TFD.
- A los 3 meses, la tasa de respuesta completa (RC) en el grupo de cirugía fue del 98 % de las lesiones (51 de 52) versus el 91 % de las lesiones (48 de 53) en el grupo de TFD (P = 0,25). Las tasas de RC evaluadas a los 12 meses fueron del 96 % en el grupo de cirugía versus el 83 % en el grupo de TFD (P = 0,15).[16][Nivel de evidencia B3] Los investigadores interpretaron los resultados como que la TFD no fue inferior, pero la potencia del estudio tal vez fue insuficiente.
- Tanto los investigadores como los pacientes calificaron los resultados cosméticos como excelentes o buenos en una proporción más alta de tratamientos con TFD en cada momento del seguimiento. A los 12 meses, las calificaciones de los pacientes como excelentes o buenas fueron del 98 % en el grupo de TDF versus el 84 % en el grupo de cirugía (P = 0,03) y las calificaciones de los investigadores fueron de 79 versus el 38 % (P = 0,001).
- En un ensayo aleatorizado de un solo centro, se asignaron 96 CCB primarios (el número de pacientes no está claro) de menos de 2 cm de diámetro con compromiso del área de la cabeza y el cuello, a escisión con un margen de seguridad de 3 mm o a criocirugía (es decir, curetaje más dos ciclos de congelamiento y descongelamiento con un pulverizador de nitrógeno líquido).[17][Nivel de evidencia B3]
- Después de un año, no hubo recidivas en el grupo de escisión versus 3 recidivas en el grupo de criocirugía (P = NS [no significativa]), pero este es un período muy corto de seguimiento.[17][Nivel de evidencia B3]
- Los pacientes y cinco profesionales independientes que ignoraban el grupo de tratamiento clasificaron los resultados cosméticos. Las evaluaciones generales favorecieron la escisión.
Cirugía micrográfica de Mohs
La cirugía micrográfica de Mohs es una forma de escisión tumoral que incluye el seccionamiento radial progresivo y el examen en tiempo real de los márgenes de resección hasta lograr márgenes adecuados no comprometidos, evitando márgenes mayores que los necesarios. Se trata de una técnica especializada que se utiliza para lograr los márgenes más estrechos necesarios para evitar la recidiva tumoral y, al mismo tiempo, preservar al máximo el aspecto cosmético. El tumor se delinea al microscopio con resección radial seriada hasta que se elimina por completo a medida que se evalúan las secciones congeladas en tiempo real. En series de casos no controladas, se indicó que las tasas de control de la enfermedad fueron superiores a otros métodos de tratamiento para el CCB.[18-20] Sin embargo y, como se indicó en la sección Escisión quirúrgica con evaluación de los márgenes, no es evidente que la tasa de control de la enfermedad fue mejor cuando se la comparó directamente con la escisión quirúrgica de CCB faciales en un ensayo aleatorizado de CCB primarios.[12]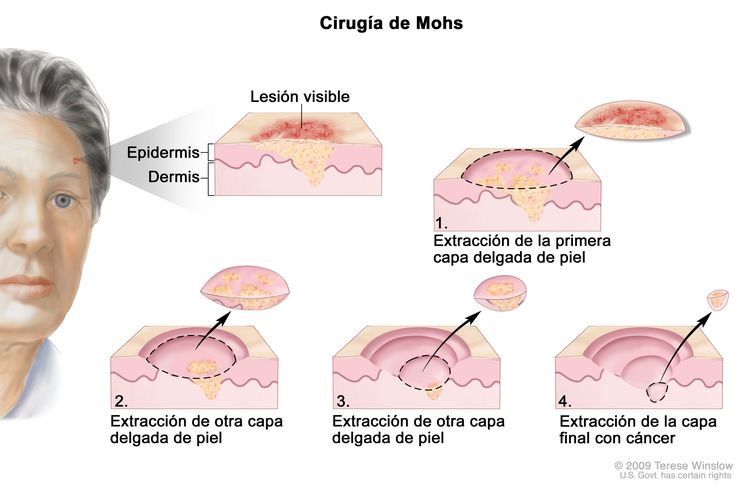
Esta cirugía es la más conveniente para el tratamiento de tumores que recidivaron después de la escisión inicial o que están en áreas cosméticas delicadas (por ejemplo, el área periorbitaria del párpado, el surco nasogeniano, el ángulo entre la nariz y la mejilla, el surco posterior de la mejilla, el pabellón auricular, el conducto auditivo externo, la frente, el cuero cabelludo, los dedos y los genitales).[19,21] También se usa para tratar tumores con bordes clínicos mal definidos.
Radioterapia
En particular, la radioterapia es útil para el tratamiento de pacientes con lesiones primarias que de otra forma necesitarían someterse a una cirugía difícil o extensa (por ejemplo, en la nariz y las orejas).[22] La radioterapia elimina la necesidad de un injerto de piel cuando la cirugía podría resultar en un defecto extenso. Los resultados cosméticos a menudo son buenos, con poca hipopigmentación o telangiectasia en la vía de tratamiento. La radioterapia también se puede usar para lesiones que recidivan después de un abordaje quirúrgico primario.[23]
Se evita administrar radioterapia a pacientes con afecciones que los predisponen a cánceres inducidos por radiación, como el xeroderma pigmentoso o el síndrome del nevo basocelular.
Evidencia (radioterapia):
- Como se indicó antes, se comparó la radioterapia con la escisión en un ensayo aleatorizado que mostró mejor respuesta y aspecto cosmético relacionados con la cirugía.[14,15][Nivel de evidencia B1]
- En un ensayo de un solo centro, se asignó al azar a 93 pacientes de CCB a recibir RHE (130 kw de rayos X, con dosimetría de acuerdo con el tamaño de la lesión) o crioterapia (dos ciclos de congelamiento-descongelamiento con un pulverizador de nitrógeno líquido). Se excluyó a los pacientes con lesiones en la nariz o la oreja debido a que los investigadores consideraron que la terapia con haz de electrones es el tratamiento preferido en estas localizaciones.[24][Nivel de evidencia B3]
- La radiación fue superior a la crioterapia en términos de control local a los 2 años.
- Después de 1 año, la tasa de recidiva fue del 4 % en el grupo de radiación y del 39 % en el grupo de crioterapia según un análisis de acuerdo con el protocolo. Los investigadores no realizaron un análisis estadístico, pero los autores de una revisión sistemática de la bibliografía calcularon un riesgo relativo de 0,11 en favor de la radiación (IC 95 %, 0,03–0,43).[10][Nivel de evidencia B3]
Curetaje y electrodesecación
El curetaje y la electrodesecación componen un método ampliamente empleado para extirpar CCB primarios; en particular, lesiones superficiales en el cuello, el tronco y las extremidades que se consideran que tienen riesgo bajo de recidiva. Se usa una cureta afilada para raspar completamente el tumor hasta su base, seguida de electrodesecación de la base de la lesión. Aunque es un método rápido de destrucción tumoral, lo adecuado del tratamiento no se puede evaluar de inmediato ya que el cirujano no puede detectar visualmente la profundidad de la invasión microscópica del tumor. Este procedimiento a veces se llama electrocirugía.
Evidencia (curetaje y electrodesecación):
- En una revisión sistemática de Cochrane Collaboration no se encontraron ensayos aleatorizados que compararan este método de tratamiento con otros abordajes.[10]
- En una serie de casos numerosos en un solo centro, la tasa de recidiva a 5 años de 2314 CCB del cuello, tronco y extremidades sin tratamiento previo tratados con curetaje y electrodesecación en una unidad importante de un centro de cáncer de piel fue del 3,3 %. Sin embargo, las tasas aumentaron mucho para los tumores mayores de 6 mm de diámetro en otros sitios anatómicos.[25][Nivel de evidencia C2]
Criocirugía
La criocirugía se considera en ocasiones para pacientes con tumores primarios pequeños, clínicamente bien definidos.[26-28] No se usa con frecuencia para el tratamiento de CCB, pero puede ser útil para pacientes con afecciones que impiden otros tipos de cirugía.[8,29-35] Las contraindicaciones para la criocirugía son las siguientes:
- Tolerancia anormal al frío.
- Crioglobulinemia o criofibrinogenemia.
- Enfermedad de Raynaud (para lesiones en las manos o los pies).
- Trastornos por deficiencia de plaquetas.
- Tumores en el cuero cabelludo, ala de la nariz, surco nasogeniano, trago, surco posauricular, margen libre del párpado, borde bermellón del labio superior y las piernas.
- Tumores cercanos a los nervios.
También se deberá tener cuidado antes de tratar una neoplasia nodular ulcerosa de más de 3 cm de diámetro, carcinomas fijados al hueso o cartílago subyacentes, tumores situados en los márgenes laterales de los dedos y en la fosa cubital del codo, o carcinomas recidivantes después de una escisión quirúrgica. Es inevitable la pérdida permanente de pigmento en el sitio de tratamiento, de modo que el tratamiento no es adecuado para pacientes de piel oscura.
El edema es común después del tratamiento, en especial alrededor de la región periorbitaria, la sien y la frente. Por lo general, los tumores tratados exudan material necrótico y después se forma una escara que persiste durante cerca de cuatro semanas. Se notificaron atrofia y cicatrización hipertrófica, así como casos de neuropatía motora y sensorial.
Evidencia (criocirugía):
- Como se indicó antes en la sección Radioterapia, en un ensayo pequeño con 93 pacientes en el que se comparó la criocirugía con la radioterapia, después de solo 1 año de seguimiento se observó una tasa de recidiva significativamente más alta con criocirugía que con radioterapia (39 vs. 4 %).[24][Nivel de evidencia B3]
- En un estudio aleatorizado pequeño realizado en un solo centro, se asignó a 88 pacientes a someterse a dos ciclos de criocirugía con congelamiento y descongelamiento, o a TFD con ácido aminolevulínico como fotosensibilizador y 635 nm de longitud de onda de luz con 60 J/cm2 de energía administrados con láser granate de itrio y aluminio dopado con neodimio (Nd:YAG).[36][Nivel de evidencia B1]
- La eficacia clínica general en las lesiones evaluables luego de un año fue similar (5 de 39 recidivas con criocirugía vs. 2 de 44 recidivas con TFD), pero fue necesario repetir el tratamiento con TFD para lograr respuestas completas.[36][Nivel de evidencia B1]
- Los resultados cosméticos favorecieron la TFD (93 % buenos o excelentes después de la TFD vs. 54 % después de la criocirugía, P < 0,001).
- En otro estudio aleatorizado de 118 pacientes, notificado en forma de resumen, se comparó la criocirugía con la TFD usando ácido aminolevulínico metílico.[37,38][Nivel de evidencia B3]
- Las tasas de control tumoral a 3 años fueron similares (74 %), pero los resultados cosméticos fueron mejores en el grupo de TFD. Estas comparaciones entre criocirugía y TFD se notificaron por protocolo y no por intención de tratar.[37,38][Nivel de evidencia B3]
Terapia fotodinámica
La terapia fotodinámica (TFD) con fotosensibilizadores se usa para el tratamiento de un grupo amplio de tumores epiteliales superficiales.[39] Se aplican en el tumor fotosensibilizadores tópicos como el 5-ácido aminolevulínico o el aminolevulinato de metilo y luego se expone a una luz de longitud de onda específica (ya sea láser o de banda ancha), según las características de absorción del fotosensibilizador. En el caso de CCB múltiples, se investigó el uso de fotosensibilizadores sistémicos de corta duración (intravenosos) como la verteporfina.[40] Una vez activado por la luz, el fotosensibilizador reacciona con el oxígeno del tejido para formar radicales de oxígeno de especie simple que produce la destrucción local de células.
Evidencia (terapia fotodinámica):
- En series de casos, la TFD se relacionó con tasas de RC iniciales altas. Sin embargo, se notificaron tasas importantes de rebrote de hasta el 50 % con un seguimiento a largo plazo.[39]
- En la sección Escisión quirúrgica con evaluación de los márgenes, se describe un ensayo aleatorizado de TFD versus escisión.[16]
- Dos ensayos pequeños, uno de ellos notificado en forma de resumen, en los que se comparó la TFD con la criocirugía se resumieron antes en la sección Criocirugía; en ambos ensayos se obtuvo una eficacia antitumoral similar, pero mejor aspecto cosmético con la TFD.[36-38]
Fluorouracilo tópico
El fluorouracilo (5-FU) tópico en forma de crema al 5 % resulta útil en circunstancias específicas limitadas. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó este tratamientos para CCB superficiales en pacientes para quienes no son prácticos los tratamientos convencionales; por ejemplo, personas con lesiones múltiples o con sitios de tratamiento difíciles. No se ha establecido la inocuidad o la eficacia para otras indicaciones.[41,42][Nivel de evidencia C3] Debido a la naturaleza superficial de los efectos del 5-FU tópico, es posible que persista el compromiso dérmico no visible, que da una falsa impresión de éxito del tratamiento. Además, la enérgica inflamación con la que se acompaña en ocasiones causa una toxicidad importante en la piel y malestar en una gran proporción de los pacientes.
Tratamiento tópico con imiquimod
El imiquimod es un agonista de los receptores tipo toll 7 u 8, que induce una cascada de citocinas de las células T auxiliares y producción de interferón. Según se informa, actúa como inmunomodulador.
Aunque la FDA aprobó el imiquimod para el tratamiento de los CCB superficiales, algunos investigadores en el campo no lo recomiendan como monoterapia inicial para el CCB. En ocasiones se reserva para pacientes con lesiones pequeñas en sitios de riesgo bajo que no pueden recibir tratamiento con terapias más establecidas.[42] El imiquimod en crema al 5 % se usa en cronogramas que oscilan entre 2 veces por semana y 2 veces por día durante 5 a 15 semanas. La mayor parte de la experiencia se limita a series de casos de CCB con un área menor de 2 cm2 y que no se encuentran en sitios de riesgo alto (por ejemplo, dentro de 1 cm de la línea del nacimiento del cabello, los ojos, la nariz, la boca o las orejas; o en la región anogenital, las manos o los pies).[42] Los períodos de seguimiento en general fueron cortos. Las tasas notificadas de RC varían mucho entre el 40 % y el 100 %.[42][Nivel de evidencia C3]
Se realizaron varios ensayos aleatorizados de imiquimod.[43-48] Sin embargo, los diseños de todos los ensayos hacen imposible interpretar su eficacia a largo plazo. La mayoría fueron estudios patrocinados por la industria para establecer las dosis, con números reducidos de pacientes que recibieron cualquiera de los regímenes administrados; además, solo se siguieron a los pacientes durante 6 a 12 semanas, momento en que se realizó la escisión para determinar la respuesta histológica.[42][Nivel de evidencia B3]
Rayos láser con dióxido de carbono
Este método se usa con muy poca frecuencia para el tratamiento de los CCB por su dificultad para controlar los márgenes tumorales.[49] Pocos médicos tienen una experiencia extensa con la técnica para el tratamiento de un CCB. No hay ensayos aleatorizados que lo comparen con otras modalidades.
Tratamiento del carcinoma de células basales metastásico (o de la enfermedad avanzada local no tratable con modalidades locales)
Las opciones de tratamiento del carcinoma de células basales metastásico de piel (o de la enfermedad avanzada local no tratable con modalidades locales) son las siguientes:
- Inhibidores de la vía de señalización del erizo sónico hedgehog.
- Vismodegib.
- Sonidegib.
- Quimioterapia.
Inhibidores de la vía de señalización del erizo sónico hedgehog
Es frecuente que los CCB exhiban una activación constitutiva de la vía de señalización del erizo sónico hedgehog/PTCH1. El vismodegib y el sonidegib son dos inhibidores de “smoothened”, una proteína transmembranaria que participa en la vía de señalización del erizo sónico hedgehog, que se aprobaron para el tratamiento de adultos con CCB metastásico, pacientes con CCB localmente avanzado que recidivó después de una cirugía y pacientes que no son aptos para someterse a cirugía o radioterapia.
Evidencia (vismodegib):
- La aprobación de la FDA se sustentó en un ensayo internacional, multicéntrico, sin enmascaramiento de 2 cohortes en el que se inscribieron 104 pacientes: 33 de CCB metastásico y 71 de CCB localmente avanzado con enfermedad inoperable o para quienes se contraindicó la cirugía. Los pacientes recibieron 150 mg de vismodegib por día.[50][Nivel de evidencia C3] El criterio principal de valoración fue la tasa de respuesta (TR) objetiva evaluada por un comité de revisión independiente. El tamaño del estudio se ajustó para comprobar mediante pruebas unilaterales binomiales exactas si la TR era mayor del 10 % en los pacientes con CCB metastásico y mayor del 20 % en pacientes con CCB localmente avanzado. De los 104 pacientes, en 96 se pudo evaluar la TR, mientras que se excluyó del análisis a 8 pacientes con CCB localmente avanzado luego de que un patólogo independiente no lograra identificar CCB en las piezas de biopsia. En ambas cohortes, la mediana de duración del tratamiento fue de 10,2 meses (intervalo, 0,7–18,7 meses).
- En 33 pacientes con CCB metastásico, la TR fue del 30 % (IC 95 %, 16–48; P = 0,001). En 63 pacientes con CCB localmente avanzado, la TR fue del 43 % (IC 95 %, 31–56; P < 0,001); entre ellos, 13 pacientes (21 %) con respuestas completas. En ambas cohortes, la mediana de duración de la respuesta fue de 7,6 meses.[50][Nivel de evidencia C3]
- Los efectos adversos más comunes fueron espasmos musculares, alopecia, disgeusia, pérdida de peso y fatiga. Los efectos adversos causaron la interrupción de vismodegib en el 12 % de los pacientes.
- Se presentaron efectos adversos mortales en 7 pacientes: 3 muertes por causas desconocidas, 1 muerte en cada grupo por choque hipovolémico, infarto del miocardio, enfermedad meníngea y accidente cerebrovascular isquémico. Se desconoce la relación entre el fármaco en estudio y las muertes.
Evidencia (sonidegib):
- En un ensayo multinacional de múltiples cohortes con enmascaramiento doble, se evaluaron 2 dosis de sonidegib en pacientes con CCB metastásico (n = 36) o CCB localmente avanzado (n = 194).[51]Nivel de evidencia B3] Los pacientes se asignaron al azar (en una proporción 2:1) para recibir ya sea 200 o 800 mg por vía oral, una vez por día. El criterio principal de valoración fue la TR, con datos recolectados hasta 6 meses después de la aleatorización del último paciente y se determinó por revisión central enmascarada. Se apuntó a obtener un tamaño muestral de 210 pacientes con el fin de garantizar que hubiera 150 pacientes para el análisis principal de eficacia, en el que se exigió que la enfermedad localmente avanzada se evaluara mediante los criterios Response Evaluation Criteria In Solid Tumors (RECIST). El éxito se especificó como una TR del 30 %.
- En la revisión central de la cohorte de 200 mg, se identificó una respuesta objetiva en 18 de 42 pacientes de CCB localmente avanzado (43 %; IC 95 %, 28–59 %) y en 2 de 13 pacientes con CCB metastásico (15 %; IC 95 %, 2–45 %), que eran aptos para el análisis principal de eficacia. No se alcanzó la mediana de duración de la respuesta. La TR fue similar en las cohortes de 2 dosis; como se presentaron menos efectos adversos con la dosis más baja, la FDA aprobó el uso de 1 sola dosis diaria de 200 mg.[51][Nivel de evidencia B3]
- Los efectos adversos frecuentes fueron, entre otros, espasmos musculares, alopecia, disgeusia, fatiga, náuseas, vómitos, disminución del peso, inapetencia, mialgia y dolor.
- En la cohorte de 800 mg, 4 pacientes murieron en el transcurso del estudio: 2 por muerte cardíaca y 2 por progresión de la enfermedad metastásica.
Quimioterapia
No se dispone de tratamientos estándar de quimioterapia y solo hay informes anecdóticos en la bibliografía.[52]
Debido a que no hay un tratamiento curativo para el CCB metastásico, es apropiada la participación en ensayos clínicos. Para obtener información sobre los ensayos clínicos en curso, consultar el portal de Internet del NCI.
Tratamiento del carcinoma de células basales de piel recidivante no metastásico
Después del tratamiento de un CCB, se debe hacer un seguimiento clínico a los pacientes y examinarlos de forma periódica. La mayoría de las recidivas se presentan dentro de los 5 años, pero cerca del 18 % de las recidivas se diagnostican después de ese período.[11]
Los pacientes que presentan un CCB primario también tienen un riesgo alto de cánceres primarios de piel posteriores debido a que su piel dañada por el sol es susceptible a otros cánceres.[53-55] Este efecto a veces se denomina carcinogénesis de campo. La edad en el momento del diagnóstico del primer CCB (<65 años), el pelo rojo y un CCB inicial en las extremidades superiores parecen estar relacionados con un riesgo más alto de nuevos CCB subsiguientes.[56]
Las opciones de tratamiento del CCB no metastásico recidivantes son las siguientes:
- Escisión quirúrgica.
- Cirugía micrográfica de Mohs.
La cirugía micrográfica de Mohs se usa por lo común para tratar las recidivas locales de los CCB.
Evidencia (escisión quirúrgica vs cirugía micrográfica de Mohs):
- En un grupo separado dentro de un ensayo aleatorizado en el que se comparó la escisión quirúrgica con la cirugía micrográfica de Mohs para CCB primarios, se asignó al azar a 204 pacientes de CCB recidivantes para someterse a escisión quirúrgica o cirugía micrográfica de Mohs.[12][Nivel de evidencia B1]
- Después de una mediana de seguimiento de 2,08 años, las tasas de recidiva correspondieron a 8 de 102 pacientes asignados a escisión y a 2 de 102 pacientes asignados a cirugía micrográfica de Mohs (P = NS).[12][Nivel de evidencia B1]
- Hubo más complicaciones posoperatorias, incluso infecciones en las heridas, necrosis en los injertos y hemorragias en el grupo de escisión que en el de cirugía de Mohs (19 vs. a 8 %, P = 0,021).
- Del mismo modo que para los tumores primarios, los costos operativos relacionados con la cirugía de Mohs fueron más altos que con la escisión (489,06 vs. 323,49 euros [P = 0,001]).
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Shokrollahi K, Javed M, Aeuyung K, et al.: Combined carbon dioxide laser with photodynamic therapy for nodular and superficial basal cell carcinoma. Ann Plast Surg 73 (5): 552-8, 2014. [PUBMED Abstract]
- Allen KJ, Cappel MA, Killian JM, et al.: Basosquamous carcinoma and metatypical basal cell carcinoma: a review of treatment with Mohs micrographic surgery. Int J Dermatol 53 (11): 1395-403, 2014. [PUBMED Abstract]
- Clark CM, Furniss M, Mackay-Wiggan JM: Basal cell carcinoma: an evidence-based treatment update. Am J Clin Dermatol 15 (3): 197-216, 2014. [PUBMED Abstract]
- Roozeboom MH, Arits AH, Nelemans PJ, et al.: Overall treatment success after treatment of primary superficial basal cell carcinoma: a systematic review and meta-analysis of randomized and nonrandomized trials. Br J Dermatol 167 (4): 733-56, 2012. [PUBMED Abstract]
- Betz CS, Rauschning W, Stranadko EP, et al.: Long-term outcomes following Foscan®-PDT of basal cell carcinomas. Lasers Surg Med 44 (7): 533-40, 2012. [PUBMED Abstract]
- Jebodhsingh KN, Calafati J, Farrokhyar F, et al.: Recurrence rates of basal cell carcinoma of the periocular skin: what to do with patients who have positive margins after resection. Can J Ophthalmol 47 (2): 181-4, 2012. [PUBMED Abstract]
- Paoli J, Daryoni S, Wennberg AM, et al.: 5-year recurrence rates of Mohs micrographic surgery for aggressive and recurrent facial basal cell carcinoma. Acta Derm Venereol 91 (6): 689-93, 2011. [PUBMED Abstract]
- Peikert JM: Prospective trial of curettage and cryosurgery in the management of non-facial, superficial, and minimally invasive basal and squamous cell carcinoma. Int J Dermatol 50 (9): 1135-8, 2011. [PUBMED Abstract]
- Maghami EG, Talbot SG, Patel SG, et al.: Craniofacial surgery for nonmelanoma skin malignancy: report of an international collaborative study. Head Neck 29 (12): 1136-43, 2007. [PUBMED Abstract]
- Bath-Hextall FJ, Perkins W, Bong J, et al.: Interventions for basal cell carcinoma of the skin. Cochrane Database Syst Rev (1): CD003412, 2007. [PUBMED Abstract]
- Rowe DE, Carroll RJ, Day CL: Long-term recurrence rates in previously untreated (primary) basal cell carcinoma: implications for patient follow-up. J Dermatol Surg Oncol 15 (3): 315-28, 1989. [PUBMED Abstract]
- Smeets NW, Krekels GA, Ostertag JU, et al.: Surgical excision vs Mohs' micrographic surgery for basal-cell carcinoma of the face: randomised controlled trial. Lancet 364 (9447): 1766-72, 2004 Nov 13-19. [PUBMED Abstract]
- Abide JM, Nahai F, Bennett RG: The meaning of surgical margins. Plast Reconstr Surg 73 (3): 492-7, 1984. [PUBMED Abstract]
- Avril MF, Auperin A, Margulis A, et al.: Basal cell carcinoma of the face: surgery or radiotherapy? Results of a randomized study. Br J Cancer 76 (1): 100-6, 1997. [PUBMED Abstract]
- Petit JY, Avril MF, Margulis A, et al.: Evaluation of cosmetic results of a randomized trial comparing surgery and radiotherapy in the treatment of basal cell carcinoma of the face. Plast Reconstr Surg 105 (7): 2544-51, 2000. [PUBMED Abstract]
- Rhodes LE, de Rie M, Enström Y, et al.: Photodynamic therapy using topical methyl aminolevulinate vs surgery for nodular basal cell carcinoma: results of a multicenter randomized prospective trial. Arch Dermatol 140 (1): 17-23, 2004. [PUBMED Abstract]
- Thissen MR, Nieman FH, Ideler AH, et al.: Cosmetic results of cryosurgery versus surgical excision for primary uncomplicated basal cell carcinomas of the head and neck. Dermatol Surg 26 (8): 759-64, 2000. [PUBMED Abstract]
- Malhotra R, Huilgol SC, Huynh NT, et al.: The Australian Mohs database, part II: periocular basal cell carcinoma outcome at 5-year follow-up. Ophthalmology 111 (4): 631-6, 2004. [PUBMED Abstract]
- Thomas RM, Amonette RA: Mohs micrographic surgery. Am Fam Physician 37 (3): 135-42, 1988. [PUBMED Abstract]
- Thissen MR, Neumann MH, Schouten LJ: A systematic review of treatment modalities for primary basal cell carcinomas. Arch Dermatol 135 (10): 1177-83, 1999. [PUBMED Abstract]
- Rowe DE, Carroll RJ, Day CL: Mohs surgery is the treatment of choice for recurrent (previously treated) basal cell carcinoma. J Dermatol Surg Oncol 15 (4): 424-31, 1989. [PUBMED Abstract]
- Caccialanza M, Piccinno R, Moretti D, et al.: Radiotherapy of carcinomas of the skin overlying the cartilage of the nose: results in 405 lesions. Eur J Dermatol 13 (5): 462-5, 2003 Sep-Oct. [PUBMED Abstract]
- Lovett RD, Perez CA, Shapiro SJ, et al.: External irradiation of epithelial skin cancer. Int J Radiat Oncol Biol Phys 19 (2): 235-42, 1990. [PUBMED Abstract]
- Hall VL, Leppard BJ, McGill J, et al.: Treatment of basal-cell carcinoma: comparison of radiotherapy and cryotherapy. Clin Radiol 37 (1): 33-4, 1986. [PUBMED Abstract]
- Silverman MK, Kopf AW, Grin CM, et al.: Recurrence rates of treated basal cell carcinomas. Part 2: Curettage-electrodesiccation. J Dermatol Surg Oncol 17 (9): 720-6, 1991. [PUBMED Abstract]
- Divine J, Stefaniwksy L, Reddy R, et al.: A comprehensive guide to the surgical management of nonmelanoma skin cancer. Curr Probl Cancer 39 (4): 216-25, 2015 Jul-Aug. [PUBMED Abstract]
- Weshahy AH, Abdel Hay RM, Metwally D, et al.: The efficacy of intralesional cryosurgery in the treatment of small- and medium-sized basal cell carcinoma: A pilot study. J Dermatolog Treat 26 (2): 147-50, 2015. [PUBMED Abstract]
- Gaitanis G, Bassukas ID: Immunocryosurgery for non-superficial basal cell carcinoma: a pro-spective, open-label phase III study for tumours ≤ 2 cm in diameter. Acta Derm Venereol 94 (1): 38-44, 2014. [PUBMED Abstract]
- Har-Shai Y, Sommer A, Gil T, et al.: Intralesional cryosurgery for the treatment of basal cell carcinoma of the lower extremities in elderly subjects: a feasibility study. Int J Dermatol 55 (3): 342-50, 2016. [PUBMED Abstract]
- Gaitanis G, Kalogeropoulos CD, Bassukas ID: Cryosurgery during Imiquimod (Immunocryosurgery) for Periocular Basal Cell Carcinomas: An Efficacious Minimally Invasive Treatment Alternative. Dermatology 232 (1): 17-21, 2016. [PUBMED Abstract]
- Samain A, Boullié MC, Duval-Modeste AB, et al.: Cryosurgery and curettage-cryosurgery for basal cell carcinomas of the mid-face. J Eur Acad Dermatol Venereol 29 (7): 1291-6, 2015. [PUBMED Abstract]
- Lindgren G, Larkö O: Cryosurgery of eyelid basal cell carcinomas including 781 cases treated over 30 years. Acta Ophthalmol 92 (8): 787-92, 2014. [PUBMED Abstract]
- Nakuçi M, Bassukas ID: Office-based treatment of basal cell carcinoma with immunocryosurgery: feasibility and efficacy. Acta Dermatovenerol Alp Pannonica Adriat 22 (2): 35-8, 2013. [PUBMED Abstract]
- Lindemalm-Lundstam B, Dalenbäck J: Prospective follow-up after curettage-cryosurgery for scalp and face skin cancers. Br J Dermatol 161 (3): 568-76, 2009. [PUBMED Abstract]
- Gaitanis G, Alexopoulos EC, Bassukas ID: Cryosurgery is more effective in the treatment of primary, non-superficial basal cell carcinomas when applied during and not prior to a five week imiquimod course: a randomized, prospective, open-label study. Eur J Dermatol 21 (6): 952-8, 2011 Nov-Dec. [PUBMED Abstract]
- Wang I, Bendsoe N, Klinteberg CA, et al.: Photodynamic therapy vs. cryosurgery of basal cell carcinomas: results of a phase III clinical trial. Br J Dermatol 144 (4): 832-40, 2001. [PUBMED Abstract]
- Basset-Séguin N, Ibbotson S, Emtestam L, et al.: Photodynamic therapy using methyl aminolaevulinate is as efficacious as cryotherapy in basal cell carcinoma, with better cosmetic results. [Abstract] Br J Dermatol 149 (Suppl 64): A-P-66, 46, 2003.
- Basset-Séguin N, Ibbotson S, Emtestam L, et al.: Methyl aminolaevulinate photodynamic therapy vs. cryotherapy in primary superficial basal cell carcinoma: results of a 36-month follow-up. [Abstract] Br J Dermatol 153 (Suppl 1): A-P-30, 29. 2005.
- Hsi RA, Rosenthal DI, Glatstein E: Photodynamic therapy in the treatment of cancer: current state of the art. Drugs 57 (5): 725-34, 1999. [PUBMED Abstract]
- Lui H, Hobbs L, Tope WD, et al.: Photodynamic therapy of multiple nonmelanoma skin cancers with verteporfin and red light-emitting diodes: two-year results evaluating tumor response and cosmetic outcomes. Arch Dermatol 140 (1): 26-32, 2004. [PUBMED Abstract]
- Efudex® (fluorouracil) cream, 5% [package insert]. Aliso Viejo, Ca: Valeant Pharmaceuticals International, 2005. Available online. Last accessed March 7, 2025.
- Love WE, Bernhard JD, Bordeaux JS: Topical imiquimod or fluorouracil therapy for basal and squamous cell carcinoma: a systematic review. Arch Dermatol 145 (12): 1431-8, 2009. [PUBMED Abstract]
- Beutner KR, Geisse JK, Helman D, et al.: Therapeutic response of basal cell carcinoma to the immune response modifier imiquimod 5% cream. J Am Acad Dermatol 41 (6): 1002-7, 1999. [PUBMED Abstract]
- Geisse JK, Rich P, Pandya A, et al.: Imiquimod 5% cream for the treatment of superficial basal cell carcinoma: a double-blind, randomized, vehicle-controlled study. J Am Acad Dermatol 47 (3): 390-8, 2002. [PUBMED Abstract]
- Geisse J, Caro I, Lindholm J, et al.: Imiquimod 5% cream for the treatment of superficial basal cell carcinoma: results from two phase III, randomized, vehicle-controlled studies. J Am Acad Dermatol 50 (5): 722-33, 2004. [PUBMED Abstract]
- Shumack S, Robinson J, Kossard S, et al.: Efficacy of topical 5% imiquimod cream for the treatment of nodular basal cell carcinoma: comparison of dosing regimens. Arch Dermatol 138 (9): 1165-71, 2002. [PUBMED Abstract]
- Marks R, Gebauer K, Shumack S, et al.: Imiquimod 5% cream in the treatment of superficial basal cell carcinoma: results of a multicenter 6-week dose-response trial. J Am Acad Dermatol 44 (5): 807-13, 2001. [PUBMED Abstract]
- Schulze HJ, Cribier B, Requena L, et al.: Imiquimod 5% cream for the treatment of superficial basal cell carcinoma: results from a randomized vehicle-controlled phase III study in Europe. Br J Dermatol 152 (5): 939-47, 2005. [PUBMED Abstract]
- Reszko A, Aasi SZ, Wilson LD, et al.: Cancer of the skin. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1610-33.
- Sekulic A, Migden MR, Oro AE, et al.: Efficacy and safety of vismodegib in advanced basal-cell carcinoma. N Engl J Med 366 (23): 2171-9, 2012. [PUBMED Abstract]
- Migden MR, Guminski A, Gutzmer R, et al.: Treatment with two different doses of sonidegib in patients with locally advanced or metastatic basal cell carcinoma (BOLT): a multicentre, randomised, double-blind phase 2 trial. Lancet Oncol 16 (6): 716-28, 2015. [PUBMED Abstract]
- Khandekar JD: Complete response of metastatic basal cell carcinoma to cisplatin chemotherapy: a report on two patients. Arch Dermatol 126 (12): 1660, 1990. [PUBMED Abstract]
- Robinson JK: Risk of developing another basal cell carcinoma. A 5-year prospective study. Cancer 60 (1): 118-20, 1987. [PUBMED Abstract]
- Karagas MR, Stukel TA, Greenberg ER, et al.: Risk of subsequent basal cell carcinoma and squamous cell carcinoma of the skin among patients with prior skin cancer. Skin Cancer Prevention Study Group. JAMA 267 (24): 3305-10, 1992. [PUBMED Abstract]
- Schinstine M, Goldman GD: Risk of synchronous and metachronous second nonmelanoma skin cancer when referred for Mohs micrographic surgery. J Am Acad Dermatol 44 (3): 497-9, 2001. [PUBMED Abstract]
- Kiiski V, de Vries E, Flohil SC, et al.: Risk factors for single and multiple basal cell carcinomas. Arch Dermatol 146 (8): 848-55, 2010. [PUBMED Abstract]
Tratamiento del carcinoma de células escamosas de piel
El carcinoma de células escamosas (CCE) localizado de piel es una enfermedad sumamente curable.[1] Hay una variedad de abordajes de tratamiento para los CCE localizados; por ejemplo, escisión, radioterapia, criocirugía, y electrodesecación y curetaje.
La evidencia es escasa o de calidad insuficiente como para permitir la comparación directa de los desenlaces para pacientes de CCE esporádicos, clínicamente localizados, tratados con terapias locales. En una revisión sistemática de la literatura, se encontró solo un ensayo controlado aleatorizado para el tratamiento de este tipo de pacientes; en ese ensayo se comparó el tratamiento adyuvante con la observación después del tratamiento local inicial en lugar de diferentes terapias locales.[2] En ese ensayo pequeño de un solo centro, 66 pacientes con CCE de riesgo alto y clínicamente localizado se asignaron al azar, después de la escisión quirúrgica del tumor primario (con radiación o sin esta, según la valoración clínica), para recibir isotretinoína combinada (1 mg/kg oral por día) e interferón α (3 × 106 U subcutáneas 3 veces por semana) durante 6 meses o a someterse a observación.[3] Después de una mediana de seguimiento de 21,5 meses a 65 pacientes evaluables, no hubo diferencia en el criterio de valoración combinado (primario) para la recidiva del CCE o un segundo tumor primario (45 vs. 38 %; cociente de riesgos instantáneos = 1,13; intervalo de confianza [IC] 95 %, 0,53–2,41), ni en cualquiera de los componentes individuales del criterio principal de valoración.[3][Nivel de evidencia B1]
El cemiplimab y el pembrolizumab, inhibidores del receptor de muerte programada 1 (PD-1), son las únicas terapias sistémicas para el tratamiento del CCE cutáneo localmente avanzado o metastásico. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó estos medicamentos a partir de las tasas de respuesta (TR) objetiva de estudios de fase temprana.[4-6][Nivel de evidencia C3] Se notificaron efectos tóxicos relacionados con los inhibidores de puntos de control, incluso la muerte. Se recomienda llevar a cabo ensayos clínicos para definir el tratamiento óptimo. Hay ensayos en curso que incluyen inhibidores de PD-1 en entornos de tratamiento neoadyuvante, adyuvante y avanzado/metastásico, en monoterapia y en combinaciones.
Tratamiento del carcinoma de células escamosas de piel (enfermedad localizada)
Las opciones de tratamiento del carcinoma de células escamosas de piel (enfermedad localizada) son las siguientes:
Escisión quirúrgica con evaluación de los márgenes
La escisión es quizás el tratamiento más común para un CCE.[7] Este tratamiento quirúrgico tradicional suele depender de márgenes quirúrgicos que oscilan entre 4 y 10 mm, según el diámetro del tumor y el grado de diferenciación. En una serie de casos prospectivos de 141 CCE, un margen de 4 mm fue adecuado para abarcar toda la diseminación tumoral microscópica subclínica en más del 95 % de los tumores bien diferenciados de hasta 19 mm de diámetro. Se necesitaron márgenes mayores de 6 a 10 mm para tumores más grandes y tumores menos diferenciados en localizaciones de riesgo alto (por ejemplo, cuero cabelludo, orejas, párpados, nariz y labios).[8] Es posible que sea necesario realizar otra escisión si el margen quirúrgico del corte en parafina no es suficiente.
Cirugía micrográfica de Mohs
La cirugía micrográfica de Mohs es una forma de escisión tumoral que incluye el seccionamiento radial progresivo y el examen en tiempo real de los márgenes de resección hasta lograr márgenes adecuados no comprometidos, evitando márgenes mayores que los necesarios. Se trata de una técnica especializada que se utiliza para lograr los márgenes más estrechos necesarios para evitar la recidiva tumoral y, al mismo tiempo, preservar al máximo el aspecto cosmético. El tumor se delinea al microscopio con resección radial seriada hasta que se elimina por completo a medida que se evalúan los cortes congelados en tiempo real. No obstante, ya que con esta técnica se elimina el tumor que crece en contigüidad, y en ocasiones se omiten las micrometástasis cutáneas en tránsito no contiguas, algunos profesionales eliminan un margen adicional de la piel en las lesiones de riesgo alto, incluso después de que el procedimiento quirúrgico de Mohs confirma que los márgenes no están comprometidos.[7][Nivel de evidencia C3] En series de casos, la cirugía de Mohs se relacionó con una tasa más baja de recidiva que con otras modalidades locales,[9] pero no se dispone de ensayos aleatorizados que permitan una comparación directa.[2]
Esta cirugía es más adecuada para el tratamiento de tumores en áreas cosméticamente sensibles (por ejemplo, área periorbitaria del párpado, surco nasogeniano, ángulo entre la nariz y la mejilla, surco posterior de la mejilla, pabellón auditivo, conducto auditivo, frente, cuero cabelludo, dedos y genitales) o para tumores que recidivaron después de la escisión inicial.[10,11] La cirugía micrográfica de Mohs también se usa a menudo para tratar tumores de riesgo alto con bordes clínicos pobremente definidos o con invasión perineural.
Radioterapia
La radioterapia es una elección lógica de tratamiento; en particular, para pacientes con lesiones primarias que exigen una cirugía más difícil o extensa (por ejemplo, lesiones en la nariz, los labios o las orejas).[7,12] La radioterapia elimina la necesidad de un injerto de piel cuando la cirugía podría resultar en un defecto extenso. Los resultados cosméticos en general son buenos, con una cantidad pequeña de hipopigmentación o telangiectasia en la vía de tratamiento. La radioterapia también se usa en ocasiones para lesiones que recidivan después de un abordaje quirúrgico primario.[13]
Se evita administrar radioterapia a pacientes con afecciones que los predisponen a cánceres inducidos por radiación, como el xeroderma pigmentoso o el síndrome del nevo basocelular.
Aunque la radioterapia, con escisión del tumor primario o sin esta, se utiliza para metástasis de ganglios linfáticos confirmadas clínicamente mediante pruebas histológicas y se relacionó con tasas favorables de supervivencia sin enfermedad, el carácter retrospectivo de estas series de casos hace que sea difícil conocer el efecto de la radiación ganglionar en la supervivencia.[14,15][Nivel de evidencia C2]
Curetaje y electrodesecación
El curetaje y la electrodesecación se usan para tratar el CCE de piel. Se usa una cureta afilada para raspar por completo el tumor hasta su base, y luego se aplica electrodesecación en la base de la lesión. Aunque el curetaje y la electrodesecación son un método rápido de destrucción tumoral, no es posible evaluar la idoneidad del tratamiento de inmediato ya que el cirujano no puede detectar visualmente la profundidad de la invasión microscópica del tumor. Su uso se limita a tumores pequeños (<1 cm), bien definidos y bien diferenciados.[7][Nivel de evidencia C2] Este procedimiento a veces recibe el nombre de electrocirugía.
Criocirugía
La criocirugía se considera a veces para pacientes con tumores primarios pequeños, clínicamente bien definidos. Es posible que sea útil para pacientes con afecciones que impiden otros tipos de cirugía.[16,17] Las contraindicaciones para la criocirugía son las siguientes:
- Tolerancia anormal al frío.
- Crioglobulinemia o criofibrinogenemia.
- Enfermedad de Raynaud (para lesiones en las manos o los pies).
- Trastornos por deficiencia de plaquetas.
- Tumores en el cuero cabelludo, ala de la nariz, surco nasogeniano, trago, surco posauricular, margen libre del párpado, borde bermellón del labio superior y las piernas.
- Tumores cercanos a los nervios.
También se deberá tener cuidado antes de tratar una neoplasia nodular ulcerosa de más de 3 cm de diámetro, carcinomas fijados al hueso o cartílago subyacentes, tumores situados en los márgenes laterales de los dedos y en la fosa cubital del codo, o carcinomas recidivantes después de una escisión quirúrgica. Es inevitable la pérdida permanente de pigmento en el sitio de tratamiento, de modo que el tratamiento no es muy adecuado para pacientes de piel oscura.
El edema es común después del tratamiento, en especial alrededor de la región periorbitaria, la sien y la frente. Por lo general, los tumores tratados exudan material necrótico, después de lo que se forma una escara que persiste durante cerca de 4 semanas. Se notificaron atrofia y cicatrización hipertrófica, así como casos de neuropatía motora y sensorial.
Tratamiento del carcinoma de células escamosas in situ (enfermedad de Bowen)
El tratamiento de un CCE in situ (enfermedad de Bowen) es similar al de un CCE de riesgo bajo. No obstante, dado que la enfermedad de Bowen no es invasiva, la escisión quirúrgica —incluso la cirugía micrográfica de Mohs— no suele ser necesaria. Además, se logran tasas altas de respuesta completa (RC) con terapia fotodinámica (TFD).
Evidencia (TFD):
- En un ensayo multicéntrico, 229 pacientes (209 evaluados mediante análisis por protocolo por lesión), se asignaron al azar para recibir TFD (aminolevulinato de metilo + 570–670 nm de luz roja; n = 91), placebo en crema con luz roja (n = 15) o tratamiento a elección del médico (crioterapia, n = 77, fluorouracilo [5-FU] tópico, n = 26).[18][Nivel de evidencia B1]
- Las tasas de respuesta clínica completa sostenida a los 12 meses fueron del 80 % en el grupo de TDF, del 67 % en el grupo de placebo en crema con luz roja y del 69 % para el grupo de tratamiento a elección del médico (P = 0,04 para la comparación entre los grupos de TFD y los grupos combinados de tratamiento a elección de los médicos).[18][Nivel de evidencia B1]
- Los resultados cosméticos fueron mejores en el grupo de TFD. (Con fines de comparación, las tasas de RC a los 3 meses fueron del 93 % para la TFD y del 21 % para el placebo/TFD).
Tratamiento del carcinoma de células escamosas metastásico (o de la enfermedad avanzada no tratable con modalidades locales)
Como en el caso de los carcinomas de células basales (CCB), no es habitual un CCE metastásico y en estadio muy avanzado; los informes de tratamiento sistémico se limitan a notificaciones de casos, series de casos pequeñas o ensayos de fase temprana, y la respuesta tumoral se usó como criterio de valoración.[Nivel de evidencia C3] La tasa de metástasis de tumores primarios en la piel expuesta al sol es del 5 %, del 9 % para los tumores del oído externo y del 14 % para los tumores del labio. Las metástasis se presentan en una tasa todavía más alta (cerca del 38 %) para los CCE primarios que surgen en los carcinomas de cicatrices o áreas no expuestas de la piel.[9] Cerca del 69 % de las metástasis se diagnostican dentro del año, el 91 % dentro de los 3 años y el 96 % dentro de los 5 años.
Inmunoterapia (inhibidores de PD-1)
La FDA aprobó dos inhibidores de PD-1, cemiplimab y pembrolizumab como tratamiento sistémico del CCE recidivante o metastásico que no es susceptible de curación con cirugía o radioterapia (cemiplimab, pembrolizumab), y el CCE localmente avanzado que no es susceptible de curación con cirugía (cemiplimab).
Cemiplimab
La FDA aprobó el cemiplimab para el tratamiento sistémico del CCE localmente avanzado o metastásico que no es susceptible de curación con cirugía o radioterapia. La aprobación se basó en los valores de la TR evaluados por un comité de revisión independiente que analizó dos ensayos multicéntricos sin enmascaramiento de fase temprana.[4,5][Nivel de evidencia C3] La dosis aprobada por la FDA es una dosis fija (350 mg en una infusión intravenosa [IV] de 30 minutos de duración que se administra cada 3 semanas) equivalente a la dosis administrada en el ensayo de 3 mg/kg IV durante 30 minutos cada 2 semanas. Se notificaron efectos tóxicos relacionados con los inhibidores de puntos de control, incluso la muerte.
Evidencia (cemiplimab):
- En un ensayo de cohorte en expansión de fase I (NCT02383212), en el que se exigió que los pacientes presentaran por lo menos una lesión medible, participaron pacientes con CCE metastásico (n = 16) o localmente avanzado (n = 10). Se administró el cemiplimab en una dosis de 3 mg/kg IV durante 30 minutos cada 2 semanas.[4]
- En la fase I no se incluyó una prueba de hipótesis oficial. Sin embargo, según la evaluación del comité de revisión independiente se observaron respuestas en 13 de 26 pacientes cuando se usaron los criterios Response Evaluation Criteria In Solid Tumors (RECIST) en las imágenes radiográficas.[4]
- En un ensayo de fase II (NCT02760498) participaron pacientes de una de dos cohortes: pacientes con CCE metastásico (ganglionar o a distancia; 59 pacientes) [4] o pacientes con CCE localmente avanzado que no eran aptos para cirugía local o radioterapia (78 pacientes).[5]
Se exigió que los pacientes presentaran por lo menos una lesión medible y se excluyeron aquellos con enfermedad autoinmunitaria que hubiesen recibido un tratamiento sistémico en los 5 años previos, terapia con inhibidores de puntos de control o un trasplante de órgano sólido; también se excluyeron aquellos con estado funcional del Eastern Cooperative Oncology Group inferior a 1, hepatitis o infección por el virus de la inmunodeficiencia humana (VIH). Los pacientes recibieron tratamiento con 3 mg/kg IV cada 2 semanas hasta que presentaran enfermedad progresiva. Un comité de revisión independiente evaluó la TR usando los criterios RECIST para las imágenes radiológicas y los criterios de la Organización Mundial de la Salud de fotografías médicas para respuesta compuesta. Las TR se evaluaron en los pacientes después de por lo menos 6 meses de seguimiento.
- Enfermedad metastásica: 28 de 59 pacientes presentaron respuesta (47 %; IC 95 % IC, 34−61%); 4 pacientes (7 %) presentaron una RC. La mediana de duración del seguimiento fue de 7,9 meses con una mediana de duración de la respuesta que no se alcanzó. Cuando se hizo un análisis agrupado de los resultados de 16 pacientes con enfermedad metastásica del estudio de fase I con los resultados de los 59 pacientes con enfermedad metastásica de la cohorte de fase II, la TR en 75 pacientes permaneció en el 47 % (IC 95 %, 35−59 %).
- Enfermedad localmente avanzada: participaron 78 pacientes con enfermedad local avanzada (es decir, sin metástasis ganglionar) en la cohorte de fase II. La TR fue del 44 % (34 pacientes; IC 95 %, 32−55), y se notificaron RC en 10 pacientes (13 %). La mediana de duración del seguimiento fue de 9,3 meses en el momento del momento límite para inclusión de los datos, y no se alcanzó la mediana de duración de la respuesta.
- El análisis inmunohistoquímico exploratorio no mostró un valor predictivo del PD-L1 inicial.
- Los efectos adversos fueron compatibles con los efectos de los inhibidores de PD-1. En el ensayo de fase II, entre el 7 % y el 8 % de los pacientes interrumpieron el tratamiento debido a efectos adversos y se notificaron 5 efectos adversos que surgieron durante el tratamiento y llevaron a la muerte.
Pembrolizumab
El pembrolizumab está aprobado para el tratamiento sistémico del CCE recidivante o metastásico no susceptible de cirugía o radioterapia. La aprobación se basó en la TR evaluada por un comité revisor independiente de un ensayo multicéntrico de fase II sin enmascaramiento con múltiples cohortes de pacientes de CCE recidivante o metastásico no susceptible de cirugía o radioterapia.[6][Nivel de evidencia C3] Todavía no se informó sobre la cohorte de pacientes con enfermedad localmente avanzada. Los pacientes recibieron 200 mg de pembrolizumab cada 3 semanas. Un régimen alternativo de dosificación de 400 mg de pembrolizumab cada 6 semanas se aprobó para todas las indicaciones para adultos sobre la base de modelos farmacocinéticos y análisis de exposición-respuesta.
Evidencia (pembrolizumab):
- En un ensayo de fase II de un solo grupo (KEYNOTE-629 [NCT03284424]) se inscribió a 105 pacientes en la cohorte de CCE recidivante o metastásico.[6] Se exigió que los pacientes tuvieran una enfermedad mensurable y se excluyó a aquellos con una enfermedad autoinmunitaria o una afección para la que se necesitara inmunodepresión o tuviera un grado superior a 1 según el Eastern Cooperative Oncology Group Performance Status. El tratamiento continuó hasta 2 años si no se presentó progresión de la enfermedad, efectos tóxicos inaceptables o la decisión del investigador o del paciente de retirase del ensayo. Si la enfermedad se mantenía estable, se permitió continuar con el tratamiento a los pacientes con pruebas radiológicas solas de progresión de la enfermedad en la primera evaluación hasta que se confirmó la progresión de la enfermedad. El criterio principal de valoración fue la TR según RECIST v1.1.
- En un análisis interino de seguimiento realizado a los 11 meses (intervalo, 0,4−16,3 meses), se demostró una TR del 34 % (IC 95 %, 25−44 %) con 4 RC. La mediana de duración de la respuesta no se había alcanzado (intervalo, 3−13± meses).
- El puntaje positivo combinado del análisis exploratorio del ligando de muerte programada 1 mediante inmunohistoquímica no pronosticó la respuesta al tratamiento.
- Los efectos adversos fueron compatibles con el uso de los inhibidores de PD-1. Los efectos adversos que emergieron durante el tratamiento condujeron a su interrupción por 13 pacientes (12 %); 5 efectos (5 %) se consideraron emergentes del tratamiento e incluyeron neumonitis, neuropatía de los pares craneales e insuficiencia renal. Los efectos adversos emergentes del tratamiento de grado 5 se presentaron en 12 pacientes (11 %) e incluyeron infecciones, insuficiencia cardíaca e insuficiencia respiratoria. Se consideró que una muerte por neuropatía de los pares craneales se relacionó con el tratamiento.
Debido a que las opciones de tratamiento y los resultados a largo plazo son limitados, se recomienda llevar a cabo ensayos clínicos. Las opciones de los ensayos incluyen el uso inhibidores de PD-1 y de cemiplimab en el entorno avanzado, así como en los entornos neoadyuvantes y adyuvantes; también se usan otros inhibidores de control, combinaciones de inhibidores de puntos de control y combinaciones de inhibidores del factor de crecimiento epidérmico.
Tratamiento del carcinoma de células escamosas de piel recidivante
Los CCE tienen un potencial metastásico confirmado y los pacientes se deberán controlar de forma periódica después del tratamiento inicial. En términos generales, las tasas de recidiva local después de tratamiento de CCE primarios oscilan entre el 3 % y el 23 %, según el sitio anatómico.[9] Alrededor del 58 % de las recidivas locales se manifiestan en el término de 1 año, el 83 % dentro de los 3 años y el 95 % dentro de los 5 años. Los tumores de 2 cm o más de diámetro, 4 mm o más en profundidad o pobremente diferenciados tienen un pronóstico relativamente precario [19] y tasas de recidiva local y metástasis todavía más altas que las mencionadas.[9] Las tasas de recidiva local notificadas también varían según la modalidad de tratamiento; las tasas más bajas se relacionan con la cirugía micrográfica de Mohs. Sin embargo, por lo menos parte de la variación tal vez se deba a los factores que se usan en la selección de pacientes. No hay ensayos no aleatorizados se comparen directamente las distintas modalidades de tratamiento local.
Las opciones de tratamiento del CCE recidivante no metastásico son las siguientes:
- Escisión quirúrgica.
- Cirugía micrográfica de Mohs.
- Radioterapia.
Los CCE recidivantes no metastásicos se consideran de riesgo alto y en general se tratan con escisión, a menudo mediante cirugía micrográfica de Mohs. La radioterapia se usa para lesiones que no se pueden resecar por completo.
Como en el caso de los CCB, los pacientes de CCE primarios también tienen un aumento de riesgo de cánceres de piel primarios subsiguientes.[20,21]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Preston DS, Stern RS: Nonmelanoma cancers of the skin. N Engl J Med 327 (23): 1649-62, 1992. [PUBMED Abstract]
- Lansbury L, Leonardi-Bee J, Perkins W, et al.: Interventions for non-metastatic squamous cell carcinoma of the skin. Cochrane Database Syst Rev (4): CD007869, 2010. [PUBMED Abstract]
- Brewster AM, Lee JJ, Clayman GL, et al.: Randomized trial of adjuvant 13-cis-retinoic acid and interferon alfa for patients with aggressive skin squamous cell carcinoma. J Clin Oncol 25 (15): 1974-8, 2007. [PUBMED Abstract]
- Migden MR, Rischin D, Schmults CD, et al.: PD-1 Blockade with Cemiplimab in Advanced Cutaneous Squamous-Cell Carcinoma. N Engl J Med 379 (4): 341-351, 2018. [PUBMED Abstract]
- Migden MR, Khushalani NI, Chang ALS, et al.: Cemiplimab in locally advanced cutaneous squamous cell carcinoma: results from an open-label, phase 2, single-arm trial. Lancet Oncol 21 (2): 294-305, 2020. [PUBMED Abstract]
- Grob JJ, Gonzalez R, Basset-Seguin N, et al.: Pembrolizumab Monotherapy for Recurrent or Metastatic Cutaneous Squamous Cell Carcinoma: A Single-Arm Phase II Trial (KEYNOTE-629). J Clin Oncol 38 (25): 2916-2925, 2020. [PUBMED Abstract]
- Motley R, Kersey P, Lawrence C, et al.: Multiprofessional guidelines for the management of the patient with primary cutaneous squamous cell carcinoma. Br J Dermatol 146 (1): 18-25, 2002. [PUBMED Abstract]
- Brodland DG, Zitelli JA: Surgical margins for excision of primary cutaneous squamous cell carcinoma. J Am Acad Dermatol 27 (2 Pt 1): 241-8, 1992. [PUBMED Abstract]
- Rowe DE, Carroll RJ, Day CL: Prognostic factors for local recurrence, metastasis, and survival rates in squamous cell carcinoma of the skin, ear, and lip. Implications for treatment modality selection. J Am Acad Dermatol 26 (6): 976-90, 1992. [PUBMED Abstract]
- Thomas RM, Amonette RA: Mohs micrographic surgery. Am Fam Physician 37 (3): 135-42, 1988. [PUBMED Abstract]
- Rowe DE, Carroll RJ, Day CL: Mohs surgery is the treatment of choice for recurrent (previously treated) basal cell carcinoma. J Dermatol Surg Oncol 15 (4): 424-31, 1989. [PUBMED Abstract]
- Caccialanza M, Piccinno R, Moretti D, et al.: Radiotherapy of carcinomas of the skin overlying the cartilage of the nose: results in 405 lesions. Eur J Dermatol 13 (5): 462-5, 2003 Sep-Oct. [PUBMED Abstract]
- Lovett RD, Perez CA, Shapiro SJ, et al.: External irradiation of epithelial skin cancer. Int J Radiat Oncol Biol Phys 19 (2): 235-42, 1990. [PUBMED Abstract]
- Shimm DS, Wilder RB: Radiation therapy for squamous cell carcinoma of the skin. Am J Clin Oncol 14 (5): 383-6, 1991. [PUBMED Abstract]
- Veness MJ, Palme CE, Smith M, et al.: Cutaneous head and neck squamous cell carcinoma metastatic to cervical lymph nodes (nonparotid): a better outcome with surgery and adjuvant radiotherapy. Laryngoscope 113 (10): 1827-33, 2003. [PUBMED Abstract]
- Gaitanis G, Bassukas ID: Immunocryosurgery - an effective combinational modality for Bowen's disease. Dermatol Ther 29 (5): 334-337, 2016. [PUBMED Abstract]
- Almeida Gonçalves JC: Advanced cancer of the extremities treated by cryosurgery. G Ital Dermatol Venereol 146 (4): 249-55, 2011. [PUBMED Abstract]
- Morton C, Horn M, Leman J, et al.: Comparison of topical methyl aminolevulinate photodynamic therapy with cryotherapy or Fluorouracil for treatment of squamous cell carcinoma in situ: Results of a multicenter randomized trial. Arch Dermatol 142 (6): 729-35, 2006. [PUBMED Abstract]
- Cherpelis BS, Marcusen C, Lang PG: Prognostic factors for metastasis in squamous cell carcinoma of the skin. Dermatol Surg 28 (3): 268-73, 2002. [PUBMED Abstract]
- Karagas MR, Stukel TA, Greenberg ER, et al.: Risk of subsequent basal cell carcinoma and squamous cell carcinoma of the skin among patients with prior skin cancer. Skin Cancer Prevention Study Group. JAMA 267 (24): 3305-10, 1992. [PUBMED Abstract]
- Schinstine M, Goldman GD: Risk of synchronous and metachronous second nonmelanoma skin cancer when referred for Mohs micrographic surgery. J Am Acad Dermatol 44 (3): 497-9, 2001. [PUBMED Abstract]
Tratamiento de la queratosis actínica
Las queratosis actínicas se suelen presentar en regiones de la piel expuestas en forma crónica al sol, como la cara y la parte dorsal de las manos. La queilitis actínica es una afección relacionada que se suele presentar en el labio inferior.[1] Estas afecciones representan una transformación epitelial temprana que, con el tiempo, quizás se convierta en un carcinoma de células escamosas (CCE) invasivo.
Las queratosis actínicas no son lesiones invasivas. La tasa de progresión es bajísima. Como en un estudio prospectivo la tasa de progresión de los CCE fue de menos de 1 en 1000 por año, se pone en duda la eficacia en función del costo del tratamiento de todas las queratosis actínicas para prevenir los CCE.[2] Por otro lado, en un estudio poblacional de tipo longitudinal, hubo una tasa de cerca del 26 % de regresión espontánea de queratosis solares dentro de 1 año de un examen de detección.[3] Por consiguiente, los estudios diseñados para probar la eficacia de cualquier tratamiento para la progresión de la queratosis actínica a un CCE son imprácticos (o imposibles). No obstante, se ha examinado una variedad de abordajes de tratamiento.[4]
Las opciones de tratamiento de las queratosis actínicas dependen de que las lesiones sean aisladas o de que haya lesiones múltiples en el mismo campo.
Las opciones de tratamiento de la queratosis actínica (que no se enumeran de forma jerárquica) son las siguientes:
- Sustancias tópicas.
- Fluorouracilo (5-FU).
- Imiquimod en crema.
- Diclofenaco sódico en gel al 3 %.
- Mebutato de ingenol.
- Exfoliación química.
- Ácido tricloroacético.
- Cirugía.
- Escisión quirúrgica.
- Escisión por rasurado.
- Curetaje con electrodesecación o sin esta.
- Dermoabrasión.
- Terapia fotodinámica.
- Terapia láser (láser con dióxido de carbono o granate de itrio y aluminio dopado con erbio (ER:YAG).
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Picascia DD, Robinson JK: Actinic cheilitis: a review of the etiology, differential diagnosis, and treatment. J Am Acad Dermatol 17 (2 Pt 1): 255-64, 1987. [PUBMED Abstract]
- Marks R, Rennie G, Selwood TS: Malignant transformation of solar keratoses to squamous cell carcinoma. Lancet 1 (8589): 795-7, 1988. [PUBMED Abstract]
- Marks R, Foley P, Goodman G, et al.: Spontaneous remission of solar keratoses: the case for conservative management. Br J Dermatol 115 (6): 649-55, 1986. [PUBMED Abstract]
- Berman B, ed.: Treatment of actinic keratosis. UpToDate Inc, 2021. Available online with free registration. Last accessed March 7, 2025.
Actualizaciones más recientes a este resumen (03/28/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes hechos a este resumen a partir de la fecha arriba indicada.
Información general sobre el cáncer de piel
Se actualizó la American Cancer Society como referencia 6.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de piel. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
El revisor principal del sumario sobre Tratamiento del cáncer de piel es:
- Shaheer A. Khan, DO (Columbia University Irving Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de piel. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/piel/pro/tratamiento-piel-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.