Tratamiento de los tumores del sistema nervioso central (PDQ®)–Versión para profesionales de salud
Información general sobre los tumores del sistema nervioso central
Incidencia y mortalidad
Los tumores de encéfalo (encefálicos o cerebrales), representan del 85 % al 90 % de todos los tumores primarios del sistema nervioso central (SNC).[1] Número estimado de casos nuevos y defunciones por tumores de encéfalo y otros tumores del sistema nervioso en los Estados Unidos en 2025:[2]
- Casos nuevos: 24 820.
- Defunciones: 18 330.
Según los datos de la base de datos del Surveillance, Epidemiology, and End Results (SEER) Program, de 2017 a 2021, se calculó que la incidencia combinada de tumores de encéfalo y otros tumores del SNC en los Estados Unidos fue de 6,2 casos por 100 000 personas por año. La tasa de mortalidad fue de 4,4 muertes por 100 000 personas por año, de acuerdo con las muertes ajustadas por edad desde 2018 hasta 2022.[3] A escala mundial, se diagnosticaron cerca de 321 476 casos nuevos de tumores de encéfalo y otros tumores del SNC en el año 2022, con un cálculo de 248 305 defunciones.[4]
En general, la incidencia de tumores primarios del SNC es más alta en personas blancas que en personas negras, y la mortalidad es más alta en los hombres que en las mujeres.[3]
Los tumores primarios de encéfalo son los siguientes en orden de frecuencia decreciente:[1]
- Astrocitomas anaplásicos y glioblastomas (38 % de los tumores primarios de encéfalo).
- Meningiomas y otros tumores mesenquimatosos (27 % de los tumores primarios de encéfalo).
- Tumores de hipófisis (hipofisarios).
- Schwannomas.
- Linfomas del SNC.
- Oligodendrogliomas.
- Ependimomas.
- Astrocitomas de grado bajo.
- Meduloblastomas.
Los tumores primarios de médula espinal son los siguientes en orden de frecuencia decreciente:
- Schwannomas, meningiomas y ependimomas (79 % de los tumores primarios de médula espinal).
- Sarcomas.
- Astrocitomas.
- Tumores vasculares.
- Cordomas.
Los tumores primarios de encéfalo casi nunca se diseminan a otras áreas del cuerpo, pero se pueden diseminar a otras partes del encéfalo y el eje raquídeo.
Características anatómicas
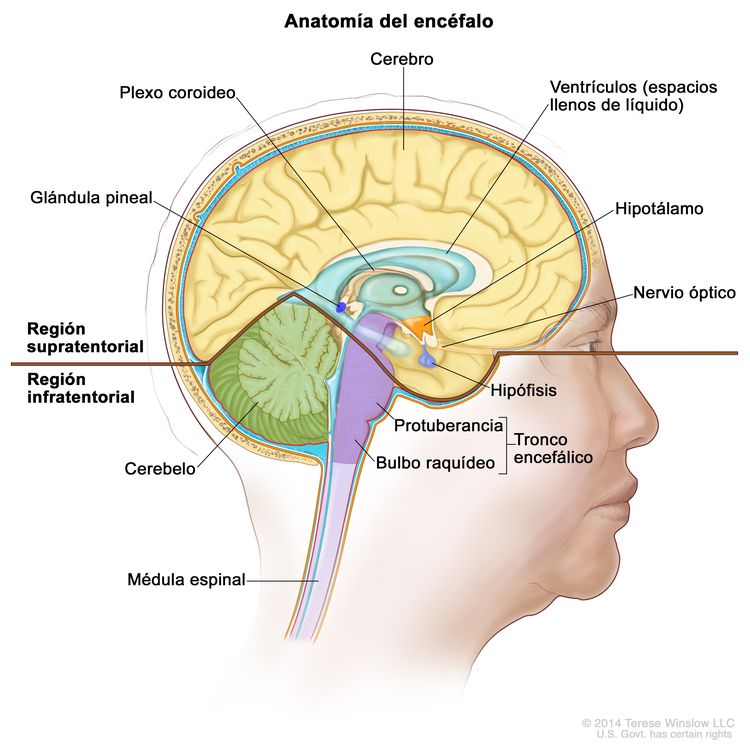
Factores de riesgo
Son pocas las observaciones definitivas sobre las causas ambientales u ocupacionales de los tumores primarios del SNC.[1]
Los siguientes son posibles factores de riesgo de este tipo de tumores:
- Es posible que la exposición al cloruro de vinilo sea un factor de riesgo de glioma.
- La infección por el virus de Epstein-Barr se ha relacionado con la etiopatogenia del linfoma primario del SNC.
- Las personas que reciben trasplantes y los pacientes con síndrome de inmunodeficiencia adquirida (SIDA) presentan un riesgo mucho más alto de linfoma primario del SNC.[1,5] Para obtener más información, consultar Tratamiento del linfoma primario del sistema nervioso central.
Los síndromes tumorales familiares y las anomalías cromosómicas que se relacionan con las neoplasias del SNC son las siguientes:[6,7]
- Neurofibromatosis de tipo 1 (17q11).
- Neurofibromatosis de tipo 2 (22q12).
- Enfermedad de Von Hippel-Lindau (3p25-26).
- Esclerosis tuberosa (9q34, 16p13).
- Síndrome de Li-Fraumeni (17p13).
- Síndrome de Turcot de tipo 1 (3p21, 7p22).
- Síndrome de Turcot de tipo 2 (5q21).
- Síndrome del carcinoma nevoide de células basales (9q22.3).
Características clínicas
El cuadro clínico inicial de varios tumores de encéfalo se entiende mejor al tener en cuenta el origen anatómico de los signos y los síntomas.[1]
Los signos y síntomas generales son los siguientes:
- Cefaleas.
- Convulsiones.
- Alteraciones visuales.
- Síntomas gastrointestinales como pérdida del apetito, náuseas y vómitos.
- Cambios en la personalidad, el estado de ánimo, la capacidad mental y la concentración.
Las convulsiones son el síntoma inicial del cuadro clínico en aproximadamente el 20 % de los pacientes que tienen tumores de encéfalo supratentoriales y es posible que precedan el diagnóstico clínico por meses o años en pacientes con tumores de crecimiento lento. Entre todos los pacientes con tumores de encéfalo, el 70 % de los que tienen tumores primarios parenquimatosos y el 40 % de los que tienen tumores metastásicos presentan convulsiones en algún momento de la evolución clínica.[8]
Evaluación diagnóstica
Para todos los tumores de encéfalo (ya sean primarios, metastásicos, malignos o benignos) se debe establecer el diagnóstico diferencial de otras lesiones compresivas con manifestaciones clínicas parecidas, como abscesos, anomalías arteriovenosas e infartos.[9]
Pruebas con imágenes
La tomografía computarizada (TC) contrastada y las imágenes por resonancia magnética (IRM) tienen funciones complementarias en el diagnóstico de las neoplasias del SNC.[1,9,10]
- La rapidez con que se puede realizar la TC es conveniente para evaluar a los pacientes inestables desde el punto de vista clínico. La TC es mejor para detectar calcificaciones, lesiones en el cráneo y hemorragias hiperagudas (sangrado de menos de 24 horas de evolución) y contribuye con el diagnóstico diferencial y el tratamiento inmediato.
- La IRM ofrece mejor resolución de los tejidos blandos. La IRM es mejor para detectar lesiones isodensas, realces tumorales y otras manifestaciones relacionadas como edema, todas las fases de los estados hemorrágicos (excepto la fase hiperaguda) y los infartos. La IRM de calidad alta es la prueba diagnóstica de elección para la evaluación intra y extramedular de las lesiones de médula espinal.[1]
La tomografía computarizada por emisión de fotón único (TCEFU) y la tomografía por emisión de positrones (TEP) pueden ser útiles para diferenciar la recidiva tumoral de la necrosis por radiación.[9]
Biopsia
Es fundamental llevar a cabo la confirmación por biopsia a fin de corroborar la presunción diagnóstica de un tumor primario de encéfalo, ya sea antes de la cirugía mediante una biopsia con aguja o en el momento de la resección quirúrgica. La excepción son los casos en los que la evidencia clínica y radiológica señala con claridad la presencia de un tumor benigno, cuyo abordaje puede incorporar vigilancia activa sin biopsia ni tratamiento. En otros casos, los patrones radiológicos son engañosos y se necesita una biopsia confirmatoria para descartar otras causas de lesiones compresivas, como un cáncer metastásico o una infección.
Es posible utilizar técnicas estereotácticas guiadas por TC o IRM para colocar una aguja, de forma inocua y precisa, en casi todos las partes del encéfalo.
Factores pronósticos
Se han identificado varias anomalías genéticas que son factores pronósticos importantes de los gliomas difusos (astrocitoma, oligodendroglioma, glioma mixto y glioblastoma), y estas alteraciones pueden servir de orientación para el tratamiento de los pacientes. Las alteraciones específicas son las siguientes:
- Metilación del DNA del promotor del gen MGMT.
- Variantes del gen IDH1 o el gen IDH2.
- Codeleción de los cromosomas 1p y 19q.
Otros factores pronósticos que confieren un pronóstico precario son los siguientes:[11,12]
- Edad mayor de 40 años.
- Enfermedad progresiva.
- Tamaño del tumor mayor a 5 cm.
- Tumor que cruza la línea media.
- Realce con contraste en la IRM.
- Estado funcional según la Organización Mundial de la Salud (≥1).
- Síntomas neurológicos.
- Resección macroscópica incompleta.
En un análisis exploratorio de 318 pacientes con glioma de grado bajo tratados con radioterapia sola o quimioterapia con temozolomida sola, se notificaron los siguientes resultados para pacientes con una combinación de estos factores pronósticos:[11]
- Supervivencia sin progresión (SSP) más prolongada en pacientes con variantes de IDH, sin la codeleción 1p/19q cuando recibieron radioterapia (cociente de riesgos instantáneos, 1,86; intervalo de confianza 95 %, 1,21–2,87; orden logarítmico, P = 0,0043).
- No hubo diferencias significativas relacionadas con el tratamiento en la SSP de los pacientes con variantes de IDH y la codeleción 1p/19q, ni de los pacientes que tenían tumores con IDH natural.
- Los pacientes que tenían tumores con IDH natural presentaron el pronóstico más precario con independencia del tipo de tratamiento.
- Los pacientes con tumores que exhibían variantes de IDH y la codeleción 1p/19q tuvieron el mejor pronóstico.
- En los tumores de grado bajo, el promotor de la O6-metilguanina-ADN– metiltransferasa (MGMT) estaba metilado en los siguientes casos:
- Todas las variantes de IDH con codeleción 1p/19q (45/45).
- La mayoría, aunque no todas (86 %, 62/72), las variantes de IDH sin la codeleción 1p/19q.
- El 56 % (5/9) de los casos con IDH natural.
Para obtener más información, consultar la sección Tratamiento de los tumores primarios del sistema nervioso central según el tipo de tumor.
Bibliografía
- Mehta M, Vogelbaum MA, Chang S, et al.: Neoplasms of the central nervous system. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1700-49.
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- National Cancer Institute: SEER Cancer Stat Facts: Brain and Other Nervous System Cancer. Bethesda, Md: National Cancer Institute. Available online. Last accessed January 24, 2025.
- Bray F, Laversanne M, Sung H, et al.: Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 74 (3): 229-263, 2024. [PUBMED Abstract]
- Schabet M: Epidemiology of primary CNS lymphoma. J Neurooncol 43 (3): 199-201, 1999. [PUBMED Abstract]
- Behin A, Hoang-Xuan K, Carpentier AF, et al.: Primary brain tumours in adults. Lancet 361 (9354): 323-31, 2003. [PUBMED Abstract]
- Kleihues P, Cavenee WK, eds.: Pathology and Genetics of Tumours of the Nervous System. International Agency for Research on Cancer, 2000.
- Cloughesy T, Selch MT, Liau L: Brain. In: Haskell CM: Cancer Treatment. 5th ed. WB Saunders Co, 2001, pp 1106-42.
- Hutter A, Schwetye KE, Bierhals AJ, et al.: Brain neoplasms: epidemiology, diagnosis, and prospects for cost-effective imaging. Neuroimaging Clin N Am 13 (2): 237-50, x-xi, 2003. [PUBMED Abstract]
- Ricci PE: Imaging of adult brain tumors. Neuroimaging Clin N Am 9 (4): 651-69, 1999. [PUBMED Abstract]
- Baumert BG, Hegi ME, van den Bent MJ, et al.: Temozolomide chemotherapy versus radiotherapy in high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 17 (11): 1521-1532, 2016. [PUBMED Abstract]
- Reijneveld JC, Taphoorn MJ, Coens C, et al.: Health-related quality of life in patients with high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 17 (11): 1533-1542, 2016. [PUBMED Abstract]
Clasificación de la Organización Mundial de la Salud de los tumores primarios del sistema nervioso central
Esta clasificación parte de la clasificación de la Organización Mundial de la Salud (OMS) de los tumores del sistema nervioso central (SNC).[1] El sistema de la OMS incorpora e interrelaciona las características morfológicas, citogenéticas, de genética molecular y los marcadores inmunológicos en un intento por formular una clasificación celular que aplique en forma universal y que sea válida para el pronóstico. Se dejaron de lado los intentos anteriores para crear una clasificación TNM (tumor, ganglio, metástasis) debido a los siguientes motivos:[2]
- El tamaño del tumor (T) es menos relevante que sus características histológicas y ubicación.
- El estado ganglionar (N) no corresponde porque no hay sistema linfático en el encéfalo ni en la médula espinal.
- La diseminación por metástasis (M) casi nunca se corresponde debido a que la mayoría de pacientes con neoplasias del SNC no viven lo suficiente como para presentar enfermedad metastásica.
La clasificación de la OMS de los tumores del SNC establece una escala de grados de malignidad de acuerdo con las características histológicas del tumor.[3]
- Grado I de la OMS. Incluye lesiones de bajo potencial proliferativo, con frecuencia, su naturaleza es de perfil bajo y es posible la cura mediante resección quirúrgica sola.
- Grado II de la OMS. Incluye lesiones que por lo general son infiltrantes y de actividad mitótica baja, pero recidivan con mayor frecuencia que los tumores malignos de grado I después del tratamiento local. Algunos tipos de tumores tienden a progresar a grados más altos de malignidad.
- Grado III de la OMS. Incluye lesiones con hallazgos histológicos de neoplasia maligna, incluso atipia nuclear y aumento de la actividad mitótica. Estas lesiones tienen características histológicas anaplásicas y capacidad de infiltración. Por lo habitual, se tratan con terapia adyuvante intensiva.
- Grado IV de la OMS. Incluye lesiones con actividad mitótica, propensas a necrosis y, en general, se relacionan con progresión rápida antes y después de la cirugía y con desenlaces mortales. Estas lesiones por lo habitual se tratan con terapia adyuvante intensiva.
En el Cuadro 1 se indican los tipos y grados tumorales.[4] No se incluyen los tumores limitados al sistema nervioso periférico. Las características histopatológicas, los métodos de clasificación, la incidencia y lo que se sabe sobre las causas específicas de cada tipo de tumor se describen en detalle en otro lugar.[4,5]
| I | II | III | IV | |
|---|---|---|---|---|
| aReproducción autorizada de Louis, DN, Ohgaki H, Wiestler, OD, Cavenee, WK. World Health Organization Classification of Tumours of the Central Nervous System. IARC, Lyon, 2007. | ||||
| Tumores astrocíticos | ||||
| Astrocitoma subependimario de células gigantes | X | |||
| Astrocitoma pilocítico | X | |||
| Astrocitoma pilomixoide | X | |||
| Astrocitoma difuso | X | |||
| Xantoastrocitoma pleomórfico | X | |||
| Astrocitoma anaplásico | X | |||
| Glioblastoma | X | |||
| Glioblastoma de células gigantes | X | |||
| Gliosarcoma | X | |||
| Tumores oligodendrogliales | ||||
| Oligodendroglioma | X | |||
| Oligodendroglioma anaplásico | X | |||
| Tumores oligoastrocíticos | ||||
| Oligoastrocitoma | X | |||
| Oligoastrocitoma anaplásico | X | |||
| Tumores ependimarios | ||||
| Subependimoma | X | |||
| Ependimoma mixopapilar | X | |||
| Ependimoma | X | |||
| Ependimoma anaplásico | X | |||
| Tumores de plexo coroideo | ||||
| Papilomas de plexo coroideo | X | |||
| Papiloma atípico de plexo coroideo | X | |||
| Carcinoma de plexo coroideo | X | |||
| Otros tumores neuroepiteliales | ||||
| Glioma angiocéntrico | X | |||
| Glioma cordoide del tercer ventrículo | X | |||
| Tumores neuronales y glioneurales mixtos | ||||
| Gangliocitoma | X | |||
| Ganglioglioma | X | |||
| Ganglioma anaplásico | X | |||
| Astrocitoma desmoplásico infantil y ganglioglioma | X | |||
| Tumor neuroepitelial disembrioplásico | X | |||
| Neurocitoma central | X | |||
| Neurocitoma extraventricular | X | |||
| Liponeurocitoma cerebeloso | X | |||
| Paraganglioma de la médula espinal | X | |||
| Tumor glioneuronal papilar | X | |||
| Tumor glioneuronal formador de rosetas del cuarto ventrículo | X | |||
| Tumores pineales | ||||
| Pineocitoma | X | |||
| Tumor del parénquima pineal de diferenciación intermedia | X | X | ||
| Pineoblastoma | X | |||
| Tumor papilar de la región pineal | X | X | ||
| Tumores embrionarios | ||||
| Meduloblastoma | X | |||
| Tumor neuroectodérmico primitivo del SNC | X | |||
| Tumor teratoide rabdoide atípico | X | |||
| Tumores de los nervios craneales y raquídeos | ||||
| Schwannoma | X | |||
| Neurofibroma | X | |||
| Perineurioma | X | X | X | |
| Tumor maligno de vaina de nervio periférico | X | X | X | |
| Tumores meníngeos | ||||
| Meningioma | X | |||
| Meningioma atípico | X | |||
| Meningioma anaplásico o maligno | X | |||
| Hemangiopericitoma | X | |||
| Hemangiopericitoma anaplásico | X | |||
| Hemangioblastoma | X | |||
| Tumores de la región selar | ||||
| Craneofaringioma | X | |||
| Tumor de células granulares de la neurohipófisis | X | |||
| Pituicitoma | X | |||
| Oncocitoma de células fusiformes de la adenohipófisis | X | |||
Alteraciones genómicas
Las alteraciones en los genes BRAF, IDH1 e IDH2, y la codeleción genómica 1p/19q son anomalías características en ciertos subtipos de gliomas. La evaluación de la presencia de estas variantes contribuye con el diagnóstico y el pronóstico y la presencia de la codeleción 1p/19q predice la respuesta a la quimioterapia.
En los astrocitomas pilocíticos (grado I de la OMS), la duplicación en tándem en 7q34, que lleva a la fusión génica KIAA1549::BRAF, se encuentra en cerca del 70 % de los astrocitomas pilocíticos.[6-8] En otro 5 % al 9 % de estos tumores, se encuentran variantes de un solo nucleótido activadoras de BRAF (V600E). En general, las anomalías de RAF se presentan en casi el 80 % de los astrocitomas pilocíticos.
Se observan variantes BRAFV600E (en casi un 60 %) en otros gliomas benignos, como el xantoastrocitoma pleomórfico y el ganglioglioma, mientras que las duplicaciones en tándem de BRAF no se encuentran en estas variantes de gliomas.[9-11]
La mayoría de los gliomas difusos de grados II y III de la OMS (astrocitomas, oligodendrogliomas y oligoastrocitomas) y del 5 % al 10 % de los glioblastomas (grado IV de la OMS) tienen variantes de un solo nucleótido en la posición R132 de (IDH1) o, muy raras veces, en el codón análogo en IDH2 (R172).[12-16] La presencia de una variante de IDH1 o IDH2 es un factor pronóstico bien establecido. Los pacientes con este tipo de variantes tumorales tienen una supervivencia significativamente más prolongada, con independencia del grado de la OMS o el subtipo histológico.
Las deleciones de los cromosomas 1p y 19q ocurren por translocación [17] y son frecuentes en los oligodendrogliomas. La codeleción 1p/19q es un factor pronóstico poderoso que a veces permite predecir la respuesta a la quimioterapia. Para obtener más información, consultar la sección Tratamiento de los oligodendrogliomas anaplásicos.
Estas anomalías genéticas tienen una posible utilidad diagnóstica. La presencia de variantes de IDH1 y IDH2 permitiría diferenciar los gliomas difusos de otros gliomas, que con frecuencia, presentan alteraciones genéticas en BRAF, y de la astrocitosis reactiva benigna.[18] La mayoría (90 %) de las variantes de IDH en los gliomas producen una substitución de R132H, que se puede detectar con un anticuerpo monoclonal con sensibilidad y especificidad altas. Una prueba de inmunohistoquímica rápida con el anticuerpo específico para la variante de IDH1 facilita el análisis diagnóstico.[19]
Otros tumores del SNC se relacionan con patrones característicos de oncogenes alterados, anormalidades en los genes supresores de tumores y anomalías cromosómicas. Los síndromes tumorales familiares con anomalías cromosómicas definidas se relacionan con gliomas.
Bibliografía
- Kleihues P, Cavenee WK, eds.: Pathology and Genetics of Tumours of the Nervous System. International Agency for Research on Cancer, 2000.
- Brain and Spinal Cord. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 857–69.
- Kleihues P, Burger PC, Scheithauer BW: The new WHO classification of brain tumours. Brain Pathol 3 (3): 255-68, 1993. [PUBMED Abstract]
- Louis DN, Ohgaki H, Wiestler OD, et al.: The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 114 (2): 97-109, 2007. [PUBMED Abstract]
- Louis DN, Ohgaki H, Wiestler OD, et al., eds.: WHO Classification of Tumours of the Central Nervous System. 4th ed. IARC Press, 2007.
- Sievert AJ, Jackson EM, Gai X, et al.: Duplication of 7q34 in pediatric low-grade astrocytomas detected by high-density single-nucleotide polymorphism-based genotype arrays results in a novel BRAF fusion gene. Brain Pathol 19 (3): 449-58, 2009. [PUBMED Abstract]
- Pfister S, Janzarik WG, Remke M, et al.: BRAF gene duplication constitutes a mechanism of MAPK pathway activation in low-grade astrocytomas. J Clin Invest 118 (5): 1739-49, 2008. [PUBMED Abstract]
- Jones DT, Kocialkowski S, Liu L, et al.: Tandem duplication producing a novel oncogenic BRAF fusion gene defines the majority of pilocytic astrocytomas. Cancer Res 68 (21): 8673-7, 2008. [PUBMED Abstract]
- Dias-Santagata D, Lam Q, Vernovsky K, et al.: BRAF V600E mutations are common in pleomorphic xanthoastrocytoma: diagnostic and therapeutic implications. PLoS One 6 (3): e17948, 2011. [PUBMED Abstract]
- MacConaill LE, Campbell CD, Kehoe SM, et al.: Profiling critical cancer gene mutations in clinical tumor samples. PLoS One 4 (11): e7887, 2009. [PUBMED Abstract]
- Parsons DW, Jones S, Zhang X, et al.: An integrated genomic analysis of human glioblastoma multiforme. Science 321 (5897): 1807-12, 2008. [PUBMED Abstract]
- Yan H, Parsons DW, Jin G, et al.: IDH1 and IDH2 mutations in gliomas. N Engl J Med 360 (8): 765-73, 2009. [PUBMED Abstract]
- Dubbink HJ, Taal W, van Marion R, et al.: IDH1 mutations in low-grade astrocytomas predict survival but not response to temozolomide. Neurology 73 (21): 1792-5, 2009. [PUBMED Abstract]
- Sanson M, Marie Y, Paris S, et al.: Isocitrate dehydrogenase 1 codon 132 mutation is an important prognostic biomarker in gliomas. J Clin Oncol 27 (25): 4150-4, 2009. [PUBMED Abstract]
- Hartmann C, Hentschel B, Wick W, et al.: Patients with IDH1 wild type anaplastic astrocytomas exhibit worse prognosis than IDH1-mutated glioblastomas, and IDH1 mutation status accounts for the unfavorable prognostic effect of higher age: implications for classification of gliomas. Acta Neuropathol 120 (6): 707-18, 2010. [PUBMED Abstract]
- Hartmann C, Meyer J, Balss J, et al.: Type and frequency of IDH1 and IDH2 mutations are related to astrocytic and oligodendroglial differentiation and age: a study of 1,010 diffuse gliomas. Acta Neuropathol 118 (4): 469-74, 2009. [PUBMED Abstract]
- Jenkins RB, Blair H, Ballman KV, et al.: A t(1;19)(q10;p10) mediates the combined deletions of 1p and 19q and predicts a better prognosis of patients with oligodendroglioma. Cancer Res 66 (20): 9852-61, 2006. [PUBMED Abstract]
- Camelo-Piragua S, Jansen M, Ganguly A, et al.: A sensitive and specific diagnostic panel to distinguish diffuse astrocytoma from astrocytosis: chromosome 7 gain with mutant isocitrate dehydrogenase 1 and p53. J Neuropathol Exp Neurol 70 (2): 110-5, 2011. [PUBMED Abstract]
- Capper D, Weissert S, Balss J, et al.: Characterization of R132H mutation-specific IDH1 antibody binding in brain tumors. Brain Pathol 20 (1): 245-54, 2010. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento de los tumores primarios del sistema nervioso central
Tumores primarios del sistema nervioso central
En esta sección se explican las modalidades generales de tratamiento para los tumores primarios del sistema nervioso central (SNC). Para obtener una descripción de las opciones de tratamiento específicas para cada tipo de tumor, consultar la sección Tratamiento de los tumores primarios del sistema nervioso central según el tipo de tumor.
Las opciones de radioterapia y quimioterapia varían según las características histológicas y la ubicación anatómica del tumor en el SNC. En el caso del glioblastoma, el tratamiento estándar es la modalidad combinada de extirpación, radiación y quimioterapia. Los astrocitomas, oligodendrogliomas y oligoastrocitomas anaplásicos representan solo una proporción pequeña de los gliomas del SNC; por lo tanto, los ensayos clínicos de fase III circunscritos a este tipo de tumores en general no son prácticos. La evolución natural de este tipo de tumores es variable de acuerdo con factores histológicos y moleculares; por lo tanto, las directrices de tratamiento para estos tumores están en evolución. El tratamiento con implantación quirúrgica de obleas de polímero impregnadas con carmustina combinado con radioterapia de haz externo (RHE) posoperatoria tal vez desempeñe una función terapéutica en algunos pacientes con gliomas de grado alto (grados III y IV).[1]
Las opciones de tratamiento para los tumores primarios del sistema nervioso central son las siguientes:
Cirugía
Por lo general, se intenta la resección quirúrgica total o parcial, en la mayoría de los tipos de tumores del SNC y en casi todas las localizaciones, teniendo en cuenta las limitaciones de conservar el funcionamiento neurológico y la salud general del paciente. Esta práctica se fundamenta en la evidencia observacional que indica que la supervivencia es mejor en pacientes sometidos a resección tumoral que en aquellos sometidos a una biopsia cerrada sola.[2,3] No se ha evaluado el beneficio de la resección en ensayos aleatorizados. Es posible que se presente un sesgo de selección en los estudios de observación a pesar de los esfuerzos por ajustar las diferencias de los pacientes con el fin de orientar la decisión de resecar el tumor; por lo tanto la diferencia real entre el desenlace de la cirugía radical y la biopsia sola quizás no sea tan grande como se observó en los estudios retrospectivos.[3]
Una excepción para la resección es el caso de tumores de localización muy profunda como los gliomas de la protuberancia, que se diagnostican por las manifestaciones clínicas y se tratan sin cirugía inicial casi el 50 % de las veces. Sin embargo, en la mayoría de los casos se prefiere el diagnóstico mediante biopsia. La biopsia estereotáctica a veces se emplea para las lesiones que son difíciles de alcanzar y resecar.
Los objetivos principales de la resección quirúrgica son los siguientes:[4]
- Establecer el diagnóstico histológico.
- Disminuir la presión intracraneal al extirpar la mayor cantidad de tumor posible de forma inocua con el fin de conservar el funcionamiento neurológico.
Casi nunca se pueden resecar por completo los tumores malignos intraparenquimatosos primarios mediante cirugía sola. Por lo tanto, se han creado técnicas intraoperatorias para lograr un equilibrio entre la mayor extirpación posible del tumor en la medida en que sea práctico y la conservación del estado funcional. Por ejemplo, es posible realizar craneotomías y resecciones estereotácticas de los gliomas primarios en pacientes que cooperan mientras están despiertos, con una evaluación en tiempo real del funcionamiento neurológico.[5] Los siguientes son ejemplos de evaluaciones neurológicas intraoperatorias:
- La resección avanza hasta que se observe una señal de anormalidad en la imagen por resonancia magnética (IRM) que se utiliza para controlar el alcance de la cirugía y lograr la resección completa, o continúa hasta que se manifieste una disfunción neurológica sutil (por ejemplo, una disminución leve en los movimientos motores alternantes rápidos o anomia).
- Cuando el tumor está ubicado en los centros del lenguaje de la corteza o cerca de ellos, es posible realizar una cartografía intraoperatoria del lenguaje mediante una interrupción del discurso inducida por una descarga de electrodos mientras se le pide al paciente que cuente o lea algo.[6]
Como suele ocurrir con varias operaciones especializadas [7,8] en las que hay relación entre la mortalidad posoperatoria y el número de procedimientos realizados, la mortalidad posoperatoria de los pacientes sometidos a cirugía de tumores primarios de encéfalo quizás esté relacionada con el volumen de casos en el hospital o del cirujano.[9] Un equipo de investigadores analizó la base de datos sobre alta hospitalaria de la Nationwide Inpatient Sample de los años de 1988 a 2000, que incluyó un 20 % de hospitalizaciones en instituciones no federales de los Estados Unidos, y notificó lo siguiente:[9]
- Los hospitales con un volumen alto de pacientes tienen tasas de mortalidad intrahospitalaria inferiores después de craneotomías por tumores primarios de encéfalo (oportunidad relativa [OR], 0,75 para un número de casos 10 veces mayor; intervalo de confianza [IC] 95 %, 0,62–0,90) y después de biopsias con aguja (OR, 0,54; IC 95 %, 0,35–0,83).
- Aunque no hubo un umbral específico definido para los desenlaces de mortalidad por todas las causas entre los hospitales de volumen bajo de casos y los de volumen alto de casos, la mortalidad intrahospitalaria relacionada con una craneotomía fue del 4,5 % en los hospitales con 5 procedimientos o menos por año y, fue del 1,5 % en hospitales con 42 procedimientos como mínimo por año.
- Las tasas de mortalidad intrahospitalaria disminuyeron durante los años de estudio (quizás porque la proporción de operaciones electivas, que no eran urgentes, aumentó del 45 % al 57 %), pero la disminución fue más rápida en los hospitales con volumen alto de casos que en los hospitales con un volumen bajo de casos.
- Los pacientes de cirujanos con un volumen alto de casos tuvieron tasas de mortalidad intrahospitalaria inferiores después de la craneotomía (OR, 0,60; IC 95 %, 0,45–0,79).
Del mismo modo que en cualquier estudio de la relación entre el volumen de casos y los desenlaces, es posible que estos resultados no sean causales a pesar del ajuste por variables múltiples. Esto se debe a factores de confusión residuales como los patrones de derivación, los seguros médicos privados y la elección de los pacientes.
Radioterapia
Tumores de grado alto
La radioterapia cumple una función importante en el tratamiento de los pacientes con gliomas de grado alto.
Evidencia (radioterapia posoperatoria [RTPO]):
- En una revisión sistemática y metanálisis de 5 ensayos aleatorizados (más un ensayo con distribución por fecha de nacimiento) se comparó la RTPO con el tratamiento sin radioterapia y se observó que la radioterapia presentó una ventaja de supervivencia estadísticamente significativa (cociente de riesgos, 0,81; IC 95 %, 0,74–0,88).[10][Nivel de evidencia A1]
- En un ensayo aleatorizado en el que se comparó 60 Gy (30 fracciones en 6 semanas) con 45 Gy (25 fracciones en 4 semanas), se observó que la supervivencia en el primer grupo fue mejor (mediana de supervivencia de 12 meses vs. 9 meses; cociente de riesgos instantáneos [CRI], 0,81; IC 95 %, 0,66–0,99). La dosis estándar aceptada de RHE para los gliomas malignos es de 60 Gy.[11][Nivel de evidencia A1]
La RHE que utiliza radioterapia conformada tridimensional (RTC-3D) o radioterapia de intensidad modulada (RTIM) se considera una técnica aceptada de administración de radioterapia. Se acostumbra utilizar márgenes de 2 cm a 3 cm en los volúmenes de IRM (potenciada en T1 y con recuperación de la inversión atenuada de fluido [FLAIR]) para configurar el volumen de tratamiento planificado.
El aumento gradual en la dosis mediante radiocirugía no ha mejorado los desenlaces. En un ensayo aleatorizado se probó la radiocirugía como un refuerzo que se añadió a la RHE estándar, pero en el ensayo no se encontró mejora de la supervivencia, la calidad de vida o el patrón de recaídas, en comparación con la RHE sin dicho refuerzo.[12,13]
La braquiterapia se ha utilizado para administrar dosis altas de radiación local dirigida al tumor mientras que se protege el tejido encefálico normal. No obstante, este método es exigente desde el punto de vista técnico y se usa menos debido al advenimiento de la RCT-3D y la RTIM.
Tumores de grado bajo
Las opciones de tratamiento para pacientes con gliomas de grado bajo (es decir, astrocitoma de grado bajo, oligodendrogliomas y oligoastrocitomas mixtos) no están tan claras como en el caso de los tumores de grado alto e incluyen la observación, la RTPO y la quimioterapia con temozolomida.
Evidencia (RTPO vs. observación):
- La European Organisation for Research and Treatment of Cancer (EORTC) aleatorizó a 311 pacientes con gliomas de grado bajo para someterse a radiación u observación en el ensayo EORTC-22845.[14,15] En la revisión centralizada de patología, se informó que cerca del 25 % de pacientes en el ensayo tenía tumores de grado alto. La mayoría de pacientes del grupo de control recibieron radioterapia en el momento de la progresión.
- Después de una mediana de seguimiento de 93 meses, la mediana de supervivencia sin progresión (SSP) fue de 5,3 años en el grupo de radiación versus 3,4 años en el grupo de control (CRI, 0,59; IC 95 %, 0,45–0,77).[14,15][Nivel de evidencia B1]
- No se observó diferencia en la supervivencia general (SG). La mediana de supervivencia fue de 7,4 años en el grupo de radiación y de 7,2 años en el grupo de control (CRI, 0,97; IC 95 %, 0,71–1,34; P = 0,87).[14,15][Nivel de evidencia A1] La causa fue una supervivencia más larga después de la progresión en el grupo de control (3,4 años) que en el grupo de radiación (1,0 año) (P < 0,0001).
- En la investigación no se recopilaron mediciones confiables sobre la calidad de vida, por lo que no está claro si el retraso en la recaída inicial del grupo de radioterapia implica una mejora del funcionamiento o de la calidad de vida.
Evidencia (RTPO versus temozolomida para pacientes con tumores de grado bajo, grado II de la Organización Mundial de la Salud (OMS) con al menos una característica de riesgo alto):
- En el ensayo EORTC 22033-26033 (NCT00182819) participaron 707 pacientes con glioma de grado bajo (astrocitoma, oligoastrocitoma u oligodendroglioma de grado II de la OMS) y al menos una característica de riesgo alto (edad >40 años, enfermedad progresiva, tamaño del tumor >5 cm, tumor que cruza la línea media o síntomas neurológicos). Los pacientes se asignaron al azar para recibir radioterapia (n = 240) o quimioterapia con temozolomida (n = 237). La radioterapia consistió en el tratamiento conformado (hasta 50,4 Gy; 28 dosis de 1,8 Gy diarios, 5 días por semana, hasta por 6,5 semanas). La quimioterapia fue dosis densas de temozolomida oral (75 mg/m2 diarias por 21 días, repetidas cada 28 días [1 ciclo], por un máximo de 12 ciclos).[16,17]
- No hubo diferencias significativas en la SSP (criterio principal de valoración) ni en la calidad de vida relacionada con la salud (criterio secundario de valoración).
- Al cabo de una mediana de seguimiento de 48 meses, (intervalo intercuartílico, 31–56) la mediana de SSP fue de 39 meses (IC 95 %, 35–44) en el grupo de temozolomida y de 46 meses (IC 95 %, 40–56) en el grupo de radioterapia (CRI no ajustado, 1,16; IC 95 %, 0,9–1,5; P = 0,22).[16][Nivel de evidencia B1]
- En un análisis exploratorio de 318 pacientes definidos de forma molecular, se encontró que los pacientes con variantes del gen IDH sin la codeleción 1p/19q exhibieron una SSP significativamente más prolongada cuando recibieron radioterapia (CRI, 1,86; IC 95 %, 1,21–2,87; orden logarítmico; P = 0,0043).
- No hubo diferencias significativas relacionadas con el tratamiento en la SSP de los pacientes con variantes de IDH y la codeleción 1p/19q, y tumores con IDH natural.
- Los pacientes que tenían tumores con IDH natural presentaron el pronóstico más precario con independencia del tipo de tratamiento.
- Los pacientes con tumores que exhibían variantes de IDH y la codeleción 1p/19q tuvieron el mejor pronóstico.
- El estado del promotor de la O6-metilguanina-ADN–metiltransferasa (MGMT) estaba metilado en los siguientes casos:
- Todas las variantes de IDH con codeleción 1p/19q (45/45).
- En 62 de 72 (86 %) variantes de IDH sin la codeleción 1p/19q.
- En 59 (56 %) de los casos con IDH natural.
Progresión de la enfermedad, neoplasias secundarias o recidivas
No se cuenta con ensayos aleatorizados que permitan delimitar la función de repetir la radiación después de la progresión de la enfermedad o la formación de cánceres causados por la radiación. La bibliografía se limita a series de casos retrospectivos pequeñas, lo que dificulta la interpretación.[18] Hay que tener cautela cuando se toma la decisión de repetir la radiación debido al riesgo de alteraciones neurocognitivas y necrosis causada por radiación. Una ventaja de la radiocirugía es que mediante esta se pueden administrar dosis terapéuticas a los tumores recidivantes para los que se necesitaría irradiar de nuevo, con dosis que superan los límites tolerables, al tejido encefálico ya irradiado con anterioridad.
Quimioterapia
Quimioterapia sistémica
Durante muchos años, la nitrosourea carmustina ([biscloroetilnitrosourea] BCNU) fue el fármaco de quimioterapia estándar que se adicionaba a la cirugía y radioterapia para los gliomas malignos, de acuerdo con un ensayo aleatorizado (RTOG-8302) del Therapy Oncology Group (RTOG).[19][Nivel de evidencia A1] En un metanálisis de datos individuales de pacientes provenientes de 12 ensayos aleatorizados, se confirmó un efecto pequeño en la supervivencia gracias al uso de regímenes quimioterapéuticos con nitrosoureas en los gliomas malignos (CRI combinadode muerte, 0,85; IC 95 %, 0,78–0,91).[20]
En un ensayo multicéntrico grande (NCT00006353) de pacientes con glioblastoma, llevado a cabo por el EORTC-National Cancer Institute of Canada, se informó de una ventaja en la supervivencia cuando se administró la temozolomida en adición a radioterapia.[21,22][Nivel de evidencia A1] A partir de estos resultados, la temozolomida oral reemplazó a BCNU como la quimioterapia sistémica estándar para los gliomas malignos. Para obtener más información, consultar la sección Tratamiento de los glioblastomas.
Los resultados a largo plazo de los ensayos aleatorizados de gliomas de riesgo alto y grado bajo (grado II de la OMS) [23][Nivel de evidencia A1] y de tumores oligodendrogliales anaplásicos (grado III de la OMS) [24,25][Nivel de evidencia A1] mostraron que la adición de quimioterapia con procarbazina, lomustina y vincristina (PCV) a la radioterapia después de una cirugía prolonga la supervivencia. Se debe tener en cuenta la radiación y la quimioterapia con PCV en los pacientes aptos para recibir tratamiento. Para obtener más información, consultar la sección Tratamiento de los tumores primarios del sistema nervioso central según el tipo de tumor.
Quimioterapia localizada (oblea de carmustina)
La idea de administrar dosis altas de quimioterapia, al mismo tiempo que se evita la toxicidad sistémica, es atractiva debido a que la mortalidad de los gliomas malignos casi siempre resulta por la incapacidad para controlar la enfermedad intracraneal y no por las metástasis a distancia. Con este fin se creó una oblea de carmustina biodegradable. Las obleas contienen 3,85 % de carmustina, y se puede implantar hasta 8 obleas en el lecho tumoral durante la resección abierta con el fin de administrar una dosis total de 7,7 mg por oblea (máximo 61,6 mg por paciente) en el transcurso de 2 a 3 semanas.
En 2 ensayos aleatorizados y controlados con placebo sobre este método de administración focalizada de un fármaco, se observó una ventaja para la SG que se relacionó con las obleas de carmustina versus radioterapia sola. En ambos ensayos, el límite superior de edad de los pacientes fue de 65 años.
Evidencia (oblea de carmustina):
- Se cerró un ensayo pequeño debido a la falta de continuidad en la disponibilidad de las obleas de carmustina, después de la inscripción de 32 pacientes con gliomas de grado alto.[26]
- Aunque la SG fue mejor en el grupo de oblea de carmustina (mediana de 58,1 vs. 39,9 semanas; P = 0,012), los grupos del estudio estaban desequilibrados (solo 11 de 16 pacientes del grupo de oblea de carmustina vs. 16 de 16 pacientes del grupo de oblea placebo tenían glioblastomas de grado IV).
- Un estudio multicéntrico de 240 pacientes con gliomas primarios malignos, 207 de los cuales presentaban glioblastoma, resultó ser más informativo.[27,28] En el momento de la cirugía inicial, los pacientes recibieron obleas de carmustina u obleas de placebo, seguidas de radioterapia (55–60 Gy). No se permitió el tratamiento sistémico hasta que se presentara una recidiva, con excepción de los casos de oligodendrogliomas anaplásicos (n = 9). A diferencia del primer ensayo, las características de los pacientes estaban bien distribuidas entre los grupos del estudio.
- La mediana de supervivencia en los 2 grupos fue de 13,8 meses en aquellos pacientes tratados con obleas de carmustina versus 11,6 meses en los pacientes tratados con placebo (CRI, 0,73; IC 95 %, 0,56–0,96; P = 0,017).
- En una revisión sistemática donde se combinaron ambos estudios [26-28] se calculó un CRI de mortalidad general de 0,65; IC 95 %, 0,48–0,86; P = 0,003.[29][Nivel de evidencia A1]
Vigilancia activa
La vigilancia activa es adecuada en determinadas circunstancias. Dado el uso creciente de métodos sensibles de neuroimaginología, ha aumentado la detección de los meningiomas asintomáticos de grado bajo; la mayoría exhiben un crecimiento mínimo y a menudo es posible observarlos con inocuidad, mientras se pospone el tratamiento, hasta que crezcan o produzcan síntomas.[30,31]
Tratamiento complementario
Se ha utilizado la dexametasona, el manitol y la furosemida para tratar el edema peritumoral de los tumores encefálicos. La administración de anticonvulsivos es obligatoria en los pacientes con convulsiones.[4]
Bibliografía
- Lallana EC, Abrey LE: Update on the therapeutic approaches to brain tumors. Expert Rev Anticancer Ther 3 (5): 655-70, 2003. [PUBMED Abstract]
- Laws ER, Parney IF, Huang W, et al.: Survival following surgery and prognostic factors for recently diagnosed malignant glioma: data from the Glioma Outcomes Project. J Neurosurg 99 (3): 467-73, 2003. [PUBMED Abstract]
- Chang SM, Parney IF, Huang W, et al.: Patterns of care for adults with newly diagnosed malignant glioma. JAMA 293 (5): 557-64, 2005. [PUBMED Abstract]
- Cloughesy T, Selch MT, Liau L: Brain. In: Haskell CM: Cancer Treatment. 5th ed. WB Saunders Co, 2001, pp 1106-42.
- Meyer FB, Bates LM, Goerss SJ, et al.: Awake craniotomy for aggressive resection of primary gliomas located in eloquent brain. Mayo Clin Proc 76 (7): 677-87, 2001. [PUBMED Abstract]
- Sanai N, Mirzadeh Z, Berger MS: Functional outcome after language mapping for glioma resection. N Engl J Med 358 (1): 18-27, 2008. [PUBMED Abstract]
- Begg CB, Cramer LD, Hoskins WJ, et al.: Impact of hospital volume on operative mortality for major cancer surgery. JAMA 280 (20): 1747-51, 1998. [PUBMED Abstract]
- Birkmeyer JD, Finlayson EV, Birkmeyer CM: Volume standards for high-risk surgical procedures: potential benefits of the Leapfrog initiative. Surgery 130 (3): 415-22, 2001. [PUBMED Abstract]
- Barker FG, Curry WT, Carter BS: Surgery for primary supratentorial brain tumors in the United States, 1988 to 2000: the effect of provider caseload and centralization of care. Neuro Oncol 7 (1): 49-63, 2005. [PUBMED Abstract]
- Laperriere N, Zuraw L, Cairncross G, et al.: Radiotherapy for newly diagnosed malignant glioma in adults: a systematic review. Radiother Oncol 64 (3): 259-73, 2002. [PUBMED Abstract]
- Bleehen NM, Stenning SP: A Medical Research Council trial of two radiotherapy doses in the treatment of grades 3 and 4 astrocytoma. The Medical Research Council Brain Tumour Working Party. Br J Cancer 64 (4): 769-74, 1991. [PUBMED Abstract]
- Tsao MN, Mehta MP, Whelan TJ, et al.: The American Society for Therapeutic Radiology and Oncology (ASTRO) evidence-based review of the role of radiosurgery for malignant glioma. Int J Radiat Oncol Biol Phys 63 (1): 47-55, 2005. [PUBMED Abstract]
- Souhami L, Seiferheld W, Brachman D, et al.: Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme: report of Radiation Therapy Oncology Group 93-05 protocol. Int J Radiat Oncol Biol Phys 60 (3): 853-60, 2004. [PUBMED Abstract]
- Karim AB, Afra D, Cornu P, et al.: Randomized trial on the efficacy of radiotherapy for cerebral low-grade glioma in the adult: European Organization for Research and Treatment of Cancer Study 22845 with the Medical Research Council study BRO4: an interim analysis. Int J Radiat Oncol Biol Phys 52 (2): 316-24, 2002. [PUBMED Abstract]
- van den Bent MJ, Afra D, de Witte O, et al.: Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet 366 (9490): 985-90, 2005. [PUBMED Abstract]
- Baumert BG, Hegi ME, van den Bent MJ, et al.: Temozolomide chemotherapy versus radiotherapy in high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 17 (11): 1521-1532, 2016. [PUBMED Abstract]
- Reijneveld JC, Taphoorn MJ, Coens C, et al.: Health-related quality of life in patients with high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 17 (11): 1533-1542, 2016. [PUBMED Abstract]
- Paulino AC, Mai WY, Chintagumpala M, et al.: Radiation-induced malignant gliomas: is there a role for reirradiation? Int J Radiat Oncol Biol Phys 71 (5): 1381-7, 2008. [PUBMED Abstract]
- Walker MD, Green SB, Byar DP, et al.: Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery. N Engl J Med 303 (23): 1323-9, 1980. [PUBMED Abstract]
- Stewart LA: Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomised trials. Lancet 359 (9311): 1011-8, 2002. [PUBMED Abstract]
- Stupp R, Mason WP, van den Bent MJ, et al.: Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 352 (10): 987-96, 2005. [PUBMED Abstract]
- Stupp R, Hegi ME, Mason WP, et al.: Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol 10 (5): 459-66, 2009. [PUBMED Abstract]
- Buckner JC, Pugh SL, Shaw EG, et al.: Phase III study of radiation therapy with or without procarbazine, CCNU, and vincristine (PCV) in low-grade glioma: RTOG 9802 with Alliance, ECOG, and SWOG. [Abstract] J Clin Oncol 32 (Suppl 5): A-2000, 2014.
- van den Bent MJ, Brandes AA, Taphoorn MJ, et al.: Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol 31 (3): 344-50, 2013. [PUBMED Abstract]
- Cairncross G, Wang M, Shaw E, et al.: Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol 31 (3): 337-43, 2013. [PUBMED Abstract]
- Valtonen S, Timonen U, Toivanen P, et al.: Interstitial chemotherapy with carmustine-loaded polymers for high-grade gliomas: a randomized double-blind study. Neurosurgery 41 (1): 44-8; discussion 48-9, 1997. [PUBMED Abstract]
- Westphal M, Hilt DC, Bortey E, et al.: A phase 3 trial of local chemotherapy with biodegradable carmustine (BCNU) wafers (Gliadel wafers) in patients with primary malignant glioma. Neuro-oncol 5 (2): 79-88, 2003. [PUBMED Abstract]
- Westphal M, Ram Z, Riddle V, et al.: Gliadel wafer in initial surgery for malignant glioma: long-term follow-up of a multicenter controlled trial. Acta Neurochir (Wien) 148 (3): 269-75; discussion 275, 2006. [PUBMED Abstract]
- Hart MG, Grant R, Garside R, et al.: Chemotherapeutic wafers for high grade glioma. Cochrane Database Syst Rev (3): CD007294, 2008. [PUBMED Abstract]
- Nakamura M, Roser F, Michel J, et al.: The natural history of incidental meningiomas. Neurosurgery 53 (1): 62-70; discussion 70-1, 2003. [PUBMED Abstract]
- Yano S, Kuratsu J; Kumamoto Brain Tumor Research Group: Indications for surgery in patients with asymptomatic meningiomas based on an extensive experience. J Neurosurg 105 (4): 538-43, 2006. [PUBMED Abstract]
Tratamiento de los tumores primarios del sistema nervioso central según el tipo de tumor
Tratamiento de los tumores astrocíticos
Tratamiento de los gliomas del tronco encefálico
Los pacientes con gliomas del tronco encefálico tienen pronósticos relativamente precarios que se relacionan con las características histológicas (cuando se realizan biopsias), la ubicación y el alcance del tumor. En los estudios, la mediana de supervivencia general de los pacientes osciló entre 44 a 74 semanas.
La opción de tratamiento para los gliomas del tronco encefálico es la siguiente:
- Radioterapia.
Tratamiento de los tumores astrocíticos pineales
Según el grado de anaplasia, los pacientes con astrocitomas pineales tienen pronósticos variables. Los pacientes con tumores de grados más altos tienen pronósticos más precarios.
Las opciones de tratamiento para los tumores astrocíticos pineales son las siguientes:
- Cirugía con radioterapia para el astrocitoma pineal.
- Cirugía con radioterapia y quimioterapia para los tumores de grado más alto.
Tratamiento de los astrocitomas pilocíticos
Este tipo de tumor astrocítico se clasifica como de grado I según la Organización Mundial de la Salud (OMS) y, a menudo, es curable.
Las opciones de tratamiento para los astrocitomas pilocíticos son las siguientes:
- Cirugía sola si el tumor se puede resecar por completo.
- Cirugía seguida de radioterapia cuando se sabe que hay tumor residual o hay indicios de que lo hay.
Tratamiento de los astrocitomas difusos
Este tumor astrocítico de grado II de la OMS se cura con menor frecuencia que el astrocitoma pilocítico.
Las opciones de tratamiento para los astrocitomas difusos (grado II de la OMS) son las siguientes:
- Cirugía con radioterapia, o sin esta.
- Cirugía seguida de radioterapia y quimioterapia.
Hay polémica en cuanto al momento oportuno de la radioterapia después de una cirugía. Para obtener más información, consultar la sección Tumores de grado bajo.
- La radioterapia mejoró la supervivencia sin progresión (SSP) en los pacientes que recibieron radioterapia temprana en el ensayo EORTC-22845 de la European Organisation for Research and Treatment of Cancer (EORTC). Para obtener más información, consultar la sección Tratamiento de los oligodendrogliomas.[1][Nivel de evidencia A1]
- En el mismo ensayo, no se encontró diferencia en la supervivencia general (SG) de los pacientes que recibieron radioterapia después de una cirugía y los que recibieron radioterapia en el momento de la progresión de la enfermedad.[1][Nivel de evidencia A1]
Algunos médicos utilizan la cirugía sola si un paciente presenta factores clínicos que representan un riesgo bajo, como edad menor de 40 años y falta de realce con contraste en una tomografía computarizada.[2]
Evidencia (cirugía seguida de radioterapia y quimioterapia):
- En los pacientes con tumores de grado bajo (grado II de la OMS), que se consideran de riesgo alto, se recomienda la radioterapia seguida de 6 ciclos de quimioterapia con vincristina (PCV). Esta recomendación surge a partir de los resultados de un seguimiento a largo plazo de un ensayo del Radiation Therapy Oncology Group (RTOG) que empezó en 1986, el ensayo aleatorizado (RTOG 9802 [NCT00003375]).[3][Nivel de evidencia A1] En este ensayo, se definió a los pacientes con glioma de grado bajo y riesgo alto como aquellos entre 18 y 39 años sometidos a biopsia o resección subtotal, o pacientes de 40 años o más. Estos pacientes se asignaron al azar para recibir 54 Gy de radioterapia o radioterapia seguida de 6 ciclos de quimioterapia con PCV.
- Al complementar la radioterapia con PCV se logró aumentar la mediana de SSP de 4,0 a 10,4 años (cociente de riesgos instantáneos [CRI], 0,50; P = 0,002) y la mediana de SG de 7,8 a 13,3 años (CRI, 0,59; P = 0,03).
- Es de destacar que en el estudio RTOG 9802 participaron pacientes con diversos tipos de tumores, como astrocitomas, oligodendrogliomas y oligoastrocitomas mixtos.
- En un análisis multivariante ajustado según el riesgo, se describió que la mejor supervivencia se presentó en aquellos pacientes tratados con PCV y que tenían características histológicas oligodendrogliales. En un análisis de subgrupos según el tipo histológico se indicó que la adición de PCV benefició principalmente a los pacientes con tumores oligodendrogliales, aunque estos datos no se han validado.[4]
- La mediana de SG del grupo de PCV versus el de control no se logró, en comparación con 10,8 años en los oligodendrogliomas (P = 0,008), 11,4 años versus 5,9 años en los oligoastrocitomas (P = 0,05), y 7,7 años versus 4,4 años en los astrocitomas (P = 0,31).
El descubrimiento de las variantes de IDH1 y IDH2 en los gliomas difusos ha sido de gran ayuda para identificar aquellos pacientes con enfermedad de riesgo alto. En estudios retrospectivos grandes se ha observado que las variantes de IDH1 y IDH2 son factores pronósticos independientes decisivos de la mejora en la supervivencia.[5-9] La mayoría de los gliomas de grados II y III de la OMS tienen variantes de IDH1 y IDH2,[6,10,11] por lo tanto, esas variantes se deben incluir en la evaluación de los pacientes de riesgo alto. No se ha presentado la información sobre la correlación molecular del ensayo RTOG 98-02, que podría aclarar cuáles pacientes se benefician más de la adición de PCV.
Tratamiento de los astrocitomas anaplásicos
Los pacientes con astrocitomas anaplásicos (grado III de la OMS) tienen una tasa de curación baja con el tratamiento estándar local.
Las opciones de tratamiento para los astrocitomas anaplásicos son las siguientes:
- Cirugía y radioterapia, con quimioterapia o sin esta.
- Cirugía con quimioterapia.
Un subgrupo de astrocitomas anaplásicos es de gran malignidad; con frecuencia, estos tumores se tratan de la misma forma que los glioblastomas, con cirugía y radiación y, a menudo, con quimioterapia. No obstante, no se ha establecido el tratamiento óptimo para estos tumores. Están en curso 2 ensayos aleatorizados de fase III solo para pacientes con gliomas anaplásicos (NCT00626990 y NCT00887146); aunque la información de eficacia no está disponible. No se conoce si la mejora de la supervivencia de los pacientes con glioblastomas tratados con quimioterapia se puede extrapolar a los pacientes con astrocitomas anaplásicos.
Entre el 50 % y el 70 % de los astrocitomas anaplásicos presentan variantes de IDH1 y IDH2 que se relacionan en forma independiente con mejora significativa de la supervivencia.[6,9] La evaluación del estado de las variantes de IDH1 y IDH2 puede orientar la toma de decisiones sobre las opciones de tratamiento.
Evidencia (cirugía con radioterapia o quimioterapia):
- La radiación posoperatoria sola se comparó con la quimioterapia posoperatoria sola en pacientes con gliomas anaplásicos (entre estos, 144 astrocitomas, 91 oligoastrocitomas y 39 oligodendrogliomas), quienes cambiaron a otras modalidades de tratamiento en el momento en que presentaron progresión tumoral. De los 139 pacientes aleatorizados para someterse a radioterapia, se asignó al azar a 135 para recibir quimioterapia con PCV o temozolomida en monoterapia (aleatorización de 2:1:1) durante 32 semanas.[12][Niveles de evidencia A1 y B1]
- El orden de administración de las modalidades no afectó la SG, ni el tiempo hasta el fracaso del tratamiento (TFT).
- No se presentaron diferencias en el TFT ni la SG de los grupos de tratamiento.
Los pacientes con astrocitomas anaplásicos son aptos para participar en ensayos clínicos diseñados para mejorar el control local mediante la incorporación de modalidades terapéuticas nuevas al tratamiento estándar. Para obtener información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
Tratamiento de los glioblastomas
En los pacientes con glioblastoma (grado IV de la OMS), la tasa de curación del tratamiento local estándar es muy baja.
La metilación del promotor del gen de la enzima reparadora del DNA MGMT es un factor pronóstico independiente de la mejora en la supervivencia de pacientes con glioblastoma de diagnóstico reciente.[13,14] La metilación del promotor MGMT y la inactivación concomitante de la actividad de reparación enzimática del DNA también permiten pronosticar la respuesta a la quimioterapia con temozolomida.[13] No obstante, los datos clínicos sobre la función pronóstica de la metilación del promotor de MGMT no son definitivos.
Las opciones de tratamiento para pacientes con glioblastoma recién diagnosticado son las siguientes:
- Cirugía con radioterapia y quimioterapia.
- Cirugía con radioterapia.
- Implantación de polímero impregnado con carmustina en la cirugía inicial.
- Radioterapia y quimioterapia simultánea.
El tratamiento estándar para pacientes con diagnóstico reciente de glioblastoma es cirugía seguida de radioterapia simultánea y temozolomida diaria y, luego, 6 ciclos de temozolomida. La adición de bevacizumab a la radioterapia y temozolomida no mejoró la SG.
Evidencia (cirugía con radioterapia y quimioterapia):
- El tratamiento estándar se basó en un ensayo aleatorizado multicéntrico (NCT00006353) grande llevado a cabo por la EORTC y el National Cancer Institute of Canada (NCIC). En este ensayo se informó sobre un beneficio en la supervivencia con la administración simultánea de radioterapia y temozolomida, en comparación con la radioterapia sola.[15,16][Nivel de evidencia A1] En este estudio, 573 pacientes con glioblastoma se asignaron al azar para recibir radiación estándar sola (60 Gy, 2 Gy por fracción, en 6 semanas) dirigida a un volumen tumoral con márgenes de 2 cm a 3 cm o con temozolomida (75 mg/m2 oral diarios durante la radioterapia y hasta por 49 días, seguida de una interrupción de 4 semanas y, luego, hasta 6 ciclos de 5 dosis diarias cada 28 días, con dosis de 150 mg/m2, que se aumentaron hasta 200 mg/m2 después del primer ciclo).
- La SG fue mejor, de manera estadísticamente significativa, en el grupo de radioterapia combinada con temozolomida (CRIde muerte, 0,6; intervalo de confianza [IC] 95 %, 0,5–0,7; la tasa de SG a 3 años fue del 16,0 % en el grupo de radioterapia con temozolomida vs. 4,4 % en el grupo de radioterapia sola).
- Se llevó a cabo un estudio complementario del ensayo EORTC-NCIC para hacer una correlación molecular en un estudio de subgrupos y se encontró evidencia sólida de la relación entre la inactivación epigenética del gen de reparación del DNA MGMT causada por la metilación del DNA del promotor, y el aumento de la SG en pacientes con diagnóstico nuevo de glioblastoma.[13]
- La metilación del promotor de MGMT fue un factor independiente de pronóstico favorable (CRI, 0,45; IC 95 %, 0,32–0,61; P de orden logarítmico < 0,001).
- La mediana de SG para los pacientes con metilación de MGMT fue de 18,2 meses (IC 95 %, 15,5–22,0), comparada con 12,2 meses (IC 95 %, 11,4–13,5) en los pacientes sin metilación de MGMT.
- Con el fin de evaluar si la temozolomida prolongada (dosis densa) mejoraba la reacción al tratamiento en pacientes con diagnóstico nuevo de glioblastoma, la RTOG, la EORTC y el North Central Cancer Therapy Group llevaron a cabo un ensayo aleatorizado, multicéntrico, de fase III denominado RTOG 0525 (NCT00304031), en el que se comparó el tratamiento estándar adyuvante con temozolomida (días 1–5 de un ciclo de 28 días) con un esquema de dosis densa (días 1–21 de un ciclo de 28 días). Se trató a todos los pacientes con cirugía seguida de radioterapia y temozolomida diaria de forma simultánea. Los pacientes se asignaron al azar para recibir temozolomida estándar adyuvante o la temozolomida en dosis densas.[14][Nivel de evidencia A1]
- En los 833 pacientes aleatorizados no se observaron diferencias estadísticamente significativas entre la temozolomida estándar y de dosis densa en cuanto a la mediana de SG (16,6 meses de temozolomida estándar vs. 14,9 meses de dosis densas de temozolomida; CRI, 1,03; P = 0,63) o en la mediana de SSP (5,5 vs. 6,7 meses; CRI, 0,87; P = 0,06).
- Se pronosticó que la temozolomida prolongada, que reduce el MGMT intracelular, tendría mayor eficacia en los tumores con metilación del promotor de MGMT. Para evaluar esto en forma retrospectiva, el estado del MGMT se definió en el 86 % de los pacientes aleatorizados. No se observaron diferencias de eficacia en los subgrupos de MGMT metilado o MGMT sin metilación. No hubo beneficio de supervivencia al utilizar la temozolomida en dosis densas versus dosis estándar en pacientes con diagnóstico reciente de glioblastoma, con independencia del estado de MGMT. Sin embargo, en este estudio se confirmó el importante efecto pronóstico de la metilación de MGMT porque la mediana de SG fue de 21,2 meses (IC 95 %, 17,9–24,8) en pacientes con metilación versus 14 meses (CRI, 1,74; IC 95 %, 12,9–14,7; P < 0,001) en aquellos sin metilación.
- No obstante, todavía hace falta determinar la eficacia de las dosis densas de temozolomida en los pacientes con glioblastoma recidivante.
Evidencia (cirugía y quimiorradioterapia con bevacizumab, o sin este):
En 2013, se publicaron los datos definitivos de 2 ensayos aleatorizados de fase III, controlados con placebo, con enmascaramiento doble y multicéntricos de bevacizumab en pacientes con un diagnóstico nuevo de glioblastoma: RTOG 0825 (NCT00884741) y el ensayo auspiciado por Roche, AVAglio (NCT00943826).[17,18][Nivel de evidencia A1] El bevacizumab no mejoró la SG en ningún ensayo.
Se presentó un cruce significativo en ambos ensayos. Alrededor del 40 % de los pacientes de RTOG 0825 y cerca del 30 % de los pacientes de AVAglio recibieron bevacizumab en el momento en que manifestaron el primer indicio de progresión de la enfermedad.
- RTOG 0825 (NCT00884741): los pacientes se asignaron al azar para recibir tratamiento estándar (quimiorradiación con temozolomida) o tratamiento estándar con bevacizumab. Los criterios de valoración coprimarios fueron la SG y la SSP.[17][Nivel de evidencia A1]
- El bevacizumab no mejoró la SG (la mediana de SG fue de 16–17 meses en cada grupo). Sin embargo, aumentó la mediana de SSP (10,7 meses en el grupo de bevacizumab vs. 7,3 meses en el grupo de placebo; CRI, 0,79; P = 0,007).
- El resultado de SSP en el ensayo RTOG 0825 no alcanzó el nivel de significación predeterminado (P = 0,004).
- AVAglio (NCT00943826): los pacientes se asignaron al azar para recibir tratamiento estándar (quimiorradioterapia con temozolomida) o tratamiento estándar con bevacizumab. Los criterios de valoración coprimarios fueron la SG y la SSP.[18][Nivel de evidencia A1]
- El bevacizumab no mejoró la SG (la mediana de SG fue de 16–17 meses en cada grupo). Sin embargo, mejoró la mediana de SSP (10,6 meses en el grupo de bevacizumab vs. 6,2 meses en el grupo placebo; CRI, 0,64; P < 0,0001).
- El resultado de la SSP fue estadísticamente significativo y se relacionó con un beneficio clínico porque los pacientes que recibieron bevacizumab continuaron funcionando en forma independiente durante más tiempo (9,0 meses en el grupo de bevacizumab vs. 6,0 meses en el grupo de tratamiento estándar) y el tiempo transcurrido hasta el deterioro, según la escala de rendimiento de Karnofsky, fue mayor (CRI, 0,65; P < 0,0001).
- Los pacientes que recibieron bevacizumab también se demoraron más en iniciar corticoesteroides (12,3 meses vs. 3,7 meses; CRI, 0,71; P = 0,002), y en aquellos que ya estaban recibiendo estos medicamentos, un mayor número de pacientes pudo suspenderlos (66 % en el grupo de bevacizumab vs. 47 % en el grupo de tratamiento estándar).
Los 2 ensayos presentaron resultados contradictorios en la calidad de vida relacionada con la salud (CVRS) y los desenlaces neurocognitivos. En las pruebas obligatorias sobre la CVRS del ensayo AVAglio, se encontró que los pacientes tratados con bevacizumab presentaron mejora en la CVRS; pero en las pruebas opcionales del RTOG 0825 los pacientes tratados con bevacizumab presentaron mayor deterioro de la CVRS notificada por el paciente, así como del funcionamiento neurocognitivo. No están claras las razones para estas discrepancias.
Según estos resultados, no hay evidencia definitiva que indique que la adición de bevacizumab al tratamiento estándar beneficie a todos los pacientes con diagnóstico nuevo de glioblastoma. Determinados subgrupos podrían beneficiarse de la adición de bevacizumab, pero esto todavía se desconoce.
Los pacientes con glioblastomas son aptos para participar en ensayos clínicos diseñados para mejorar el control local mediante la inclusión de modalidades terapéuticas nuevas en el tratamiento estándar. Para obtener información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
Tratamiento de los tumores oligodendrogliales
Tratamiento de los oligodendrogliomas
Por lo general, los pacientes que tienen oligodendrogliomas (grado II de la OMS) tienen pronósticos más favorables que los pacientes con astrocitomas difusos. En particular, la supervivencia es mucho más larga en aquellos pacientes que tienen oligodendrogliomas con la codeleción 1p/19q.[3] La mayor parte de los oligodendrogliomas progresan con el tiempo.
Las opciones de tratamiento para los oligodendrogliomas son las siguientes:
- Cirugía con radioterapia, o sin esta.
- Cirugía con radioterapia y quimioterapia.
Hay polémica sobre el momento apropiado de administrar la radioterapia después de una cirugía. En un estudio (EORTC-22845) de 300 pacientes con gliomas de grado bajo sometidos a cirugía, se asignaron los pacientes al azar a radioterapia o a espera vigilante. No se observó diferencia en la SG entre los 2 grupos.[1][Nivel de evidencia A1] Para obtener más información, consultar la sección Tumores de grado bajo.
Para los tumores de grado bajo (grado II de la OMS) considerados de riesgo alto, se recomienda la opción de radioterapia seguida por 6 ciclos de quimioterapia PCV a partir de los resultados del seguimiento a largo plazo de RTOG-9802, un ensayo aleatorizado de gliomas de grado bajo y riesgo alto.[3][Nivel de evidencia A1] Cabe destacar que en el RTOG-9802 se inscribieron pacientes con una variedad de tumores, entre ellos, astrocitomas, oligodendrogliomas y oligoastrocitomas mixtos. En un análisis de subgrupos retrospectivo la adición de PCV solo benefició a los pacientes con tumores oligodendrogliales.[4] Para obtener más información, consultar la sección Tratamiento de los astrocitomas difusos.
El descubrimiento de las variantes de IDH1 e IDH2, que son factores pronósticos independientes de mejora significativa en la supervivencia en los casos de gliomas difusos, ha ayudado mucho a identificar pacientes con enfermedad de riesgo alto. Para obtener más información, consultar la sección Tratamiento de los astrocitomas difusos. Además, una proporción alta de los oligodendrogliomas de grado II de la OMS presentan la codeleción 1p/19q, que es un factor pronóstico decisivo de mejora en la supervivencia.[19-21] Por lo tanto, la presencia de variantes de IDH1 y IDH2 y la codeleción 1p/19q se deben incluir en la evaluación del riesgo alto. No se ha presentado la información sobre la correlación molecular del ensayo RTOG-9802, esta podría aclarar cuáles pacientes se benefician más de la adición de PCV.
Tratamiento de los oligodendrogliomas anaplásicos
Los pacientes con oligodendrogliomas anaplásicos (grado III de la OMS) tienen una tasa de curación baja con el tratamiento estándar local, pero, por lo general, su pronóstico es mejor que el de los pacientes con astrocitomas anaplásicos. El pronóstico es mejor, de modo particular, en los pacientes con la codeleción 1p/19q, la cual se presenta en la mayoría de estos tumores. Están en curso 2 ensayos aleatorizados de fase III solo para pacientes con gliomas anaplásicos (NCT00626990 y NCT00887146); aunque, la información de eficacia todavía no está disponible. Para obtener más información, consultar la sección Tratamiento de los astrocitomas anaplásicos. Estos pacientes son aptos para participar en ensayos clínicos diseñados para mejorar el control local mediante la inclusión de modalidades terapéuticas nuevas.
Para obtener información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
La opción de tratamiento para los oligodendrogliomas anaplásicos es la siguiente:
- Cirugía y radioterapia, con quimioterapia o sin esta.[22]
Evidencia (cirugía seguida de radioterapia con quimioterapia, o sin esta):
- En los resultados definitivos del EORTC Brain Tumor Group Study 26951 (NCT00002840), un estudio aleatorizado de fase III con 11,7 años de seguimiento, se observó aumento de la SG y SSP en pacientes con tumores oligodendrogliales anaplásicos y tratamiento de 6 ciclos de quimioterapia adyuvante con PCV después de la radioterapia, en comparación con la radioterapia sola.[23][Nivel de evidencia A1]
- La SG fue significativamente más prolongada en el grupo de radioterapia y PCV (42,3 meses vs. 30,6 meses; CRI, 0,75; IC 95 %, 0,60–0,95).
- Los pacientes que tenían tumores con la codeleción 1p/19q obtuvieron más beneficio de la quimioterapia adyuvante con PCV que aquellos con tumores sin la codeleción 1p/19q.[23]
- Por el contrario, en el ensayo RTOG (RTOG-9402 [NCT00002569]) no se observaron diferencias en la mediana de supervivencia según el grupo de tratamiento en la comparación de un régimen de quimioterapia intensiva de 8 semanas con PCV seguida inmediatamente de radioterapia dirigida al campo comprometido y radioterapia sola.[24]
- En un análisis de subgrupos no planificado, los pacientes con oligodendrogliomas anaplásicos y astrocitomas anaplásicos mixtos y la codeleción 1p/19q tuvieron una mediana de supervivencia de 14,7 años versus 7,3 años (CRI, 0,59; IC 95 %, 0,37–0,95; P = 0,03).
- En los pacientes con tumores que no presentaban la codeleción, no se observaron diferencias en la mediana de supervivencia según el grupo de tratamiento (2,6 vs. 2,7 años; CRI, 0,85; IC 95 %, 0,58–1,23; P = 0,39).[24][Nivel de evidencia A1]
- La radioterapia posoperatoria sola se comparó con la quimioterapia posoperatoria sola en pacientes con gliomas anaplásicos (entre estos, 144 astrocitomas, 91 oligoastrocitomas y 39 oligodendrogliomas), quienes cambiaron a otras modalidades de tratamiento en el momento en que presentaron progresión tumoral. De los 139 pacientes aleatorizados para someterse a radioterapia, se asignó al azar a 135 para recibir quimioterapia con PCV o temozolomida en monoterapia (aleatorización de 2:1:1) durante 32 semanas.[12][Niveles de evidencia A1 y B1].
- En los grupos de tratamiento no se presentaron diferencias en la TFT o SG y estas tampoco resultaron afectadas por el orden de las modalidades de tratamiento.
A partir de estos datos, el estudio CODEL (NCT00887146) se canceló de manera anticipada. En este estudio los pacientes se asignaron al azar para recibir radioterapia sola (grupo de control), radioterapia con temozolomida y temozolomida sola (grupo exploratorio), porque la radioterapia sola dejó de considerarse un tratamiento adecuado para los pacientes con oligodendrogliomas anaplásicos y la codeleción 1p/19q.[25] No se ha comparado la temozolomida con la quimioterapia PCV para los oligodendrogliomas anaplásicos, aunque en el contexto de los gliomas anaplásicos de grado III no se observó diferencia en la supervivencia entre la quimioterapia PCV y la temozolomida.[12,26]
No se sabe si la combinación de radiación y quimioterapia produce mejores desenlaces que la modalidad de tratamiento secuencial.
Una proporción alta de los oligodendrogliomas anaplásicos presenta variantes de IDH1 y IDH2 y la codeleción 1p/19q; ambos son factores pronósticos decisivos de mejora de la supervivencia. Para obtener más información, consultar la sección Tratamiento de los astrocitomas difusos.[23,24] Además, en el análisis retrospectivo de los ensayos de fase III descritos antes, se observó que la quimioterapia PCV permite pronosticar desenlaces. Por lo tanto, la evaluación de estos marcadores moleculares puede facilitar las decisiones de tratamiento en pacientes con oligodendrogliomas anaplásicos.
Tratamiento de los gliomas mixtos
Los pacientes con tumores neurogliales mixtos, como oligoastrocitomas (grado II de la OMS) y oligoastrocitomas anaplásicos (grado III de la OMS), tienen un pronóstico muy variable que depende del estado de los genes IDH1 y IDH2 y de los cromosomas 1p/19q.[27-29] Por lo tanto, el tratamiento óptimo para estos tumores como grupo es incierto. A menudo, se tratan en forma semejante a los tumores astrocíticos porque un subgrupo de estos tumores tiene desenlaces parecidos a los tumores astrocíticos de grado III de la OMS o los glioblastomas de grado IV de la OMS. Se deben hacer pruebas con estos marcadores moleculares que tienen importancia pronóstica bien establecida, lo cual puede facilitar la orientación de la evaluación del riesgo y el tratamiento subsiguiente.
La opción de tratamiento para los gliomas mixtos es la siguiente:
- Cirugía más radioterapia, con quimioterapia o sin esta.
Para obtener más información sobre los tumores astrocíticos, consultar la sección Tratamiento de los tumores astrocíticos.
Tratamiento de los tumores ependimarios
Es frecuente que se logre la curación de los tumores ependimarios (grado I de la OMS) y ependimomas (grado II de la OMS), es decir, subependimomas y ependimomas mixopapilares.
Las opciones de tratamiento para los tumores ependimarios de grados I y II son las siguientes:
- Cirugía sola si el tumor se puede resecar por completo.
- Cirugía seguida de radioterapia cuando se sabe que hay tumor residual o hay indicios de que lo hay.
Los pacientes con ependimomas anaplásicos (grado III de la OMS) tienen un pronóstico variable que depende de la localización y el alcance de la enfermedad. A menudo, aunque no siempre, los pacientes con ependimomas anaplásicos tienen pronósticos más precarios que aquellos con tumores ependimarios de grado bajo.
La opción de tratamiento para los ependimomas anaplásicos es la siguiente:
- Cirugía con radioterapia.[30]
Tratamiento de los tumores de células embrionarias (meduloblastomas)
El meduloblastoma se produce principalmente en niños, pero puede presentarse.[31] Para obtener más información, consultar Tratamiento del meduloblastoma y otros tumores embrionarios del sistema nervioso central infantil.
Las opciones de tratamiento para los meduloblastomas son las siguientes:
Tratamiento de los tumores de parénquima pineal
Los pineocitomas (grado II de la OMS), los pineoblastomas (grado IV de la OMS) y los tumores de parénquima pineal de diferenciación intermedia son tumores diversos que necesitan de consideraciones especiales. Los pineocitomas son tumores de crecimiento lento con pronóstico variable.
Los pineoblastomas crecen más rápido y los pacientes con estos tumores tienen pronósticos más precarios. Los tumores de parénquima pineal con diferenciación intermedia presentan crecimiento y comportamiento clínico impredecibles.
Las opciones de tratamiento para los tumores de parénquima pineal son las siguientes:
- Cirugía con radioterapia para pineocitoma.
- Cirugía con radioterapia y quimioterapia para pineoblastoma.
Tratamiento de los tumores meníngeos
Por lo general, los meningiomas de grado I de la OMS son curables cuando se pueden resecar. Dado el uso creciente de métodos sensibles de neuroimaginología, ha aumentado la detección de los meningiomas asintomáticos de grado bajo. La mayoría exhiben un crecimiento mínimo y a menudo es posible observarlos con inocuidad, mientras se pospone el tratamiento, hasta que crezcan o produzcan síntomas.[33,34]
Las opciones de tratamiento para los tumores meníngeos son las siguientes:
- Vigilancia activa con tratamiento diferido, en especial para los tumores asintomáticos descubiertos por casualidad.[33,34]
- Cirugía.
- Radiocirugía estereotáctica para los tumores menores de 3 cm.
- Cirugía con radioterapia en casos determinados, como en pacientes con enfermedad residual o indicios de esta, o en quienes presentan recidiva tras una cirugía anterior.
- Radioterapia fraccionada en pacientes con tumores irresecables.[35]
El pronóstico es más precario para los pacientes con meningiomas de grado II de la OMS (atípico, de células claras y cordoide), meningiomas de grado III de la OMS (anaplásico/maligno, rabdoide y papilar) y hemangiopericitomas, que el pronóstico de pacientes con meningiomas de grado bajo debido a que es menos frecuente que sea posible la resección total, y la capacidad de proliferación es mayor.
La opción de tratamiento para los meningiomas de grados II y III y los hemangiopericitomas es la siguiente:
- Cirugía con radioterapia.
Tratamiento de los tumores de células germinativas
El pronóstico y tratamiento de los pacientes con tumores de células germinativas (que incluye a germinomas, carcinomas embrionarios, coriocarcinomas y teratomas) depende de las características histológicas del tumor, la ubicación del mismo, la presencia y concentración de marcadores biológicos, así como la factibilidad de la resección quirúrgica.
Tratamiento de los tumores de la región selar
Es frecuente que los craneofaringiomas (grado I de la OMS) sean curables.
Las opciones de tratamiento para los craneofaringiomas son las siguientes:
- Cirugía sola si el tumor se puede resecar por completo.
- Citorreducción quirúrgica con radioterapia si el tumor es irresecable.
Opciones de tratamiento en evaluación clínica para los tumores primarios del sistema nervioso central
Los pacientes con tumores del sistema nervioso central (SNC) que casi nunca son curables o que son irresecables deben considerar la participación en ensayos clínicos. Para obtener información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
La radiación de partículas pesadas, como el tratamiento con haz de protones, tiene la ventaja teórica de administrar dosis altas de radiación ionizante al lecho tumoral, mientras que evita el tejido encefálico circundante. Los datos de esta técnica en investigación son preliminares y no están disponibles en forma generalizada.
Las terapias biológicas nuevas en evaluación clínica para pacientes con tumores del sistema nervioso central son las siguientes:[36]
- Vacunación con células dendríticas.[37]
- Inhibidores de receptores tirosina–cinasa.[38]
- Inhibidores de la farnesil–transferasa.
- Tratamiento génico viral.[39,40]
- Virus oncolíticos.
- Inhibidores del receptor de factor de crecimiento epidérmico.
- Inhibidores del factor de crecimiento endotelial vascular.[36]
- Otros fármacos antiangiogénicos.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- van den Bent MJ, Afra D, de Witte O, et al.: Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet 366 (9490): 985-90, 2005. [PUBMED Abstract]
- Kaye AH, Walker DG: Low grade astrocytomas: controversies in management. J Clin Neurosci 7 (6): 475-83, 2000. [PUBMED Abstract]
- Buckner JC, Pugh SL, Shaw EG, et al.: Phase III study of radiation therapy with or without procarbazine, CCNU, and vincristine (PCV) in low-grade glioma: RTOG 9802 with Alliance, ECOG, and SWOG. [Abstract] J Clin Oncol 32 (Suppl 5): A-2000, 2014.
- Buckner JC, Shaw E, Pugh S, et al.: R9802: Phase III study of radiation therapy with or without procarbazine, CCNU, and vincristine (PCV) in low-grade glioma: Results by histologic type. [Abstract] Neuro Oncol 16 (Suppl 5): A-AT-13, v11, 2014.
- Parsons DW, Jones S, Zhang X, et al.: An integrated genomic analysis of human glioblastoma multiforme. Science 321 (5897): 1807-12, 2008. [PUBMED Abstract]
- Yan H, Parsons DW, Jin G, et al.: IDH1 and IDH2 mutations in gliomas. N Engl J Med 360 (8): 765-73, 2009. [PUBMED Abstract]
- Dubbink HJ, Taal W, van Marion R, et al.: IDH1 mutations in low-grade astrocytomas predict survival but not response to temozolomide. Neurology 73 (21): 1792-5, 2009. [PUBMED Abstract]
- Sanson M, Marie Y, Paris S, et al.: Isocitrate dehydrogenase 1 codon 132 mutation is an important prognostic biomarker in gliomas. J Clin Oncol 27 (25): 4150-4, 2009. [PUBMED Abstract]
- Hartmann C, Hentschel B, Wick W, et al.: Patients with IDH1 wild type anaplastic astrocytomas exhibit worse prognosis than IDH1-mutated glioblastomas, and IDH1 mutation status accounts for the unfavorable prognostic effect of higher age: implications for classification of gliomas. Acta Neuropathol 120 (6): 707-18, 2010. [PUBMED Abstract]
- Hartmann C, Meyer J, Balss J, et al.: Type and frequency of IDH1 and IDH2 mutations are related to astrocytic and oligodendroglial differentiation and age: a study of 1,010 diffuse gliomas. Acta Neuropathol 118 (4): 469-74, 2009. [PUBMED Abstract]
- Watanabe T, Nobusawa S, Kleihues P, et al.: IDH1 mutations are early events in the development of astrocytomas and oligodendrogliomas. Am J Pathol 174 (4): 1149-53, 2009. [PUBMED Abstract]
- Wick W, Hartmann C, Engel C, et al.: NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with procarbazine, lomustine, and vincristine or temozolomide. J Clin Oncol 27 (35): 5874-80, 2009. [PUBMED Abstract]
- Hegi ME, Diserens AC, Gorlia T, et al.: MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med 352 (10): 997-1003, 2005. [PUBMED Abstract]
- Gilbert MR, Wang M, Aldape KD, et al.: Dose-dense temozolomide for newly diagnosed glioblastoma: a randomized phase III clinical trial. J Clin Oncol 31 (32): 4085-91, 2013. [PUBMED Abstract]
- Stupp R, Mason WP, van den Bent MJ, et al.: Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 352 (10): 987-96, 2005. [PUBMED Abstract]
- Stupp R, Hegi ME, Mason WP, et al.: Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol 10 (5): 459-66, 2009. [PUBMED Abstract]
- Gilbert MR, Dignam JJ, Armstrong TS, et al.: A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med 370 (8): 699-708, 2014. [PUBMED Abstract]
- Chinot OL, Wick W, Mason W, et al.: Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med 370 (8): 709-22, 2014. [PUBMED Abstract]
- Fallon KB, Palmer CA, Roth KA, et al.: Prognostic value of 1p, 19q, 9p, 10q, and EGFR-FISH analyses in recurrent oligodendrogliomas. J Neuropathol Exp Neurol 63 (4): 314-22, 2004. [PUBMED Abstract]
- Smith JS, Perry A, Borell TJ, et al.: Alterations of chromosome arms 1p and 19q as predictors of survival in oligodendrogliomas, astrocytomas, and mixed oligoastrocytomas. J Clin Oncol 18 (3): 636-45, 2000. [PUBMED Abstract]
- Okamoto Y, Di Patre PL, Burkhard C, et al.: Population-based study on incidence, survival rates, and genetic alterations of low-grade diffuse astrocytomas and oligodendrogliomas. Acta Neuropathol 108 (1): 49-56, 2004. [PUBMED Abstract]
- van den Bent MJ, Chinot O, Boogerd W, et al.: Second-line chemotherapy with temozolomide in recurrent oligodendroglioma after PCV (procarbazine, lomustine and vincristine) chemotherapy: EORTC Brain Tumor Group phase II study 26972. Ann Oncol 14 (4): 599-602, 2003. [PUBMED Abstract]
- van den Bent MJ, Brandes AA, Taphoorn MJ, et al.: Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol 31 (3): 344-50, 2013. [PUBMED Abstract]
- Cairncross G, Wang M, Shaw E, et al.: Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol 31 (3): 337-43, 2013. [PUBMED Abstract]
- Gilbert MR: Minding the Ps and Qs: perseverance and quality studies lead to major advances in patients with anaplastic oligodendroglioma. J Clin Oncol 31 (3): 299-300, 2013. [PUBMED Abstract]
- Brada M, Stenning S, Gabe R, et al.: Temozolomide versus procarbazine, lomustine, and vincristine in recurrent high-grade glioma. J Clin Oncol 28 (30): 4601-8, 2010. [PUBMED Abstract]
- Jiao Y, Killela PJ, Reitman ZJ, et al.: Frequent ATRX, CIC, FUBP1 and IDH1 mutations refine the classification of malignant gliomas. Oncotarget 3 (7): 709-22, 2012. [PUBMED Abstract]
- Killela PJ, Reitman ZJ, Jiao Y, et al.: TERT promoter mutations occur frequently in gliomas and a subset of tumors derived from cells with low rates of self-renewal. Proc Natl Acad Sci U S A 110 (15): 6021-6, 2013. [PUBMED Abstract]
- Killela PJ, Pirozzi CJ, Healy P, et al.: Mutations in IDH1, IDH2, and in the TERT promoter define clinically distinct subgroups of adult malignant gliomas. Oncotarget 5 (6): 1515-25, 2014. [PUBMED Abstract]
- Oya N, Shibamoto Y, Nagata Y, et al.: Postoperative radiotherapy for intracranial ependymoma: analysis of prognostic factors and patterns of failure. J Neurooncol 56 (1): 87-94, 2002. [PUBMED Abstract]
- Brandes AA, Ermani M, Amista P, et al.: The treatment of adults with medulloblastoma: a prospective study. Int J Radiat Oncol Biol Phys 57 (3): 755-61, 2003. [PUBMED Abstract]
- Brandes AA, Franceschi E, Tosoni A, et al.: Long-term results of a prospective study on the treatment of medulloblastoma in adults. Cancer 110 (9): 2035-41, 2007. [PUBMED Abstract]
- Nakamura M, Roser F, Michel J, et al.: The natural history of incidental meningiomas. Neurosurgery 53 (1): 62-70; discussion 70-1, 2003. [PUBMED Abstract]
- Yano S, Kuratsu J; Kumamoto Brain Tumor Research Group: Indications for surgery in patients with asymptomatic meningiomas based on an extensive experience. J Neurosurg 105 (4): 538-43, 2006. [PUBMED Abstract]
- Debus J, Wuendrich M, Pirzkall A, et al.: High efficacy of fractionated stereotactic radiotherapy of large base-of-skull meningiomas: long-term results. J Clin Oncol 19 (15): 3547-53, 2001. [PUBMED Abstract]
- Fine HA: Promising new therapies for malignant gliomas. Cancer J 13 (6): 349-54, 2007 Nov-Dec. [PUBMED Abstract]
- Fecci PE, Mitchell DA, Archer GE, et al.: The history, evolution, and clinical use of dendritic cell-based immunization strategies in the therapy of brain tumors. J Neurooncol 64 (1-2): 161-76, 2003 Aug-Sep. [PUBMED Abstract]
- Newton HB: Molecular neuro-oncology and development of targeted therapeutic strategies for brain tumors. Part 1: Growth factor and Ras signaling pathways. Expert Rev Anticancer Ther 3 (5): 595-614, 2003. [PUBMED Abstract]
- Kew Y, Levin VA: Advances in gene therapy and immunotherapy for brain tumors. Curr Opin Neurol 16 (6): 665-70, 2003. [PUBMED Abstract]
- Chiocca EA, Aghi M, Fulci G: Viral therapy for glioblastoma. Cancer J 9 (3): 167-79, 2003 May-Jun. [PUBMED Abstract]
Tratamiento de los tumores primarios de la médula espinal
La cirugía y radioterapia son las modalidades principales de tratamiento utilizadas para los tumores de la médula espinal. Las opciones terapéuticas varían de acuerdo con las características histológicas del tumor.[1] La experiencia en cuanto a la quimioterapia para los tumores primarios de la médula espinal es limitada. No se cuenta con informes de ensayos clínicos controlados para este tipo de tumores.[1,2] La quimioterapia se indica en la mayoría de los pacientes con tumores primarios o metastásicos con compromiso leptomeníngeo y prueba citológica positiva en el líquido cefalorraquídeo.[1] La mayoría de los pacientes necesita tratamiento con corticoesteroides, en especial, si reciben radioterapia.
Los pacientes con tumores del eje raquídeo que casi nunca son curables o que son irresecables deben considerar la participación en ensayos clínicos. Para obtener información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
Bibliografía
- Cloughesy T, Selch MT, Liau L: Brain. In: Haskell CM: Cancer Treatment. 5th ed. WB Saunders Co, 2001, pp 1106-42.
- Mehta M, Vogelbaum MA, Chang S, et al.: Neoplasms of the central nervous system. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1700-49.
Tumores metastásicos encefálicos
Información general sobre los tumores metastásicos encefálicos
Las metástasis encefálicas superan a las neoplasias primarias en una relación de por lo menos 10 a 1, y se presentan en un 20 % a un 40 % de los pacientes con cáncer, con una mediana de supervivencia que, por lo general, es de menos de 6 meses.[1] Se desconoce la incidencia exacta porque no hay un registro nacional de cáncer que documente metástasis encefálicas, pero se calculó que se diagnostican cada año entre 98 000 y 170 000 casos nuevos en los Estados Unidos.[2,3] Esta cifra quizás está en aumento a raíz de la capacidad de las imágenes por resonancia magnética (IRM) para detectar metástasis pequeñas y por la disponibilidad de mejores tratamientos sistémicos que aumentan la supervivencia.[1,2]
Los tumores primarios que con mayor frecuencia producen metástasis encefálicas y el porcentaje de pacientes afectados se presentan a continuación:[1,2]
- Pulmón (18–64 %).
- Mama (2–21 %).
- Cáncer de sitio primario desconocido (1–18 %).
- Melanoma (4–16 %).
- Colon y recto (2–12 %).
- Riñón (1–8 %).
El 80 % de las metástasis encefálicas están en los hemisferios cerebrales, el 15 % en el cerebelo y el 5 % en el tronco encefálico.[2] Las metástasis encefálicas son múltiples en más del 70 % de los casos, pero también se presentan metástasis únicas.[1]
Los cánceres de la región nasofaríngea pueden causar compromiso encefálico por extensión directa a lo largo de los nervios craneales o por los orificios de la base del cráneo. Las metástasis durales dan cuenta de hasta el 9 % del total de las metástasis encefálicas.
Características clínicas
El diagnóstico de las metástasis encefálicas en los pacientes con cáncer se fundamenta en los siguientes aspectos:
- Antecedentes del paciente.
- Examen neurológico.
- Procedimientos diagnósticos, entre ellos, la IRM contrastada del encéfalo.
Los pacientes describen cualquiera de las siguientes manifestaciones:
- Cefaleas.
- Debilidad o adinamia.
- Convulsiones.
- Alteraciones sensoriales.
- Alteraciones de la marcha.
A menudo, los familiares o amigos observan las siguientes manifestaciones:
- Letargo.
- Labilidad emocional.
- Cambios en la personalidad.
Evaluación diagnóstica
En el examen físico se pueden encontrar manifestaciones neurológicas objetivas o solo cambios cognitivos leves. La presencia de lesiones múltiples y la predisposición del tumor primario a causar metástasis quizás sea suficiente para establecer el diagnóstico de metástasis encefálicas.
No se debe asumir que una lesión en el encéfalo es una metástasis solo porque un paciente ha tenido cáncer; dicha suposición puede llevar a que se pase por alto el tratamiento adecuado para un tumor curable.
Pruebas con imágenes
Las imágenes obtenidas por tomografía computarizada con contraste o IRM con gadolinio son muy sensibles para el diagnóstico de metástasis. La tomografía por emisión de positrones y la evaluación espectroscópica son estrategias nuevas para diagnosticar las metástasis cerebrales y diferenciarlas de otras lesiones intracraneales.[4]
Biopsia
Cuando hay una lesión única o se duda de la relación con un tumor primario, puede que se necesite una biopsia de encéfalo (mediante resección o biopsia estereotáctica).
Tratamiento de los tumores metastásicos encefálicos
El tratamiento óptimo para los pacientes con metástasis encefálicas está en constante evolución.[1,2,5] Las siguientes opciones se utilizan en el tratamiento de los tumores metastásicos encefálicos:
- Radioterapia.
- Radiocirugía.
- Resección quirúrgica.
- Corticoesteroides.
- Anticonvulsivos.
Debido a que la mayor parte de las metástasis encefálicas son múltiples, tradicionalmente el tratamiento de elección ha sido la radioterapia total del encéfalo (RTTC). No obstante, la radiocirugía estereotáctica cada vez se usa más. Todavía queda por determinarse la función de la radiocirugía. Se evaluó la radiocirugía estereotáctica en combinación RTTC.
La cirugía está indicada cuando se necesita obtener tejido de una metástasis de un tumor primario desconocido o para descomprimir una lesión dominante sintomática que esté causando un efecto de masa importante.
Por lo general, la quimioterapia no es el tratamiento inicial para la mayor parte de los pacientes; no obstante, puede cumplir una función en el tratamiento de pacientes con metástasis encefálicas de tumores quimiosensibles e incluso puede ser curativa al combinarla con radiación en los tumores metastásicos de células germinativas de testículo.[1,6] La quimioterapia intratecal también se utiliza para la diseminación meníngea de los tumores metastásicos.
Tratamiento de pacientes con 1 a 4 metástasis
Opciones de tratamiento para pacientes con 1 a 4 metástasis
Entre el 10 % y el 15 % de los pacientes con cáncer presentarán una metástasis encefálica única. La radioterapia es el componente principal de la paliación en estos pacientes. El alcance de la enfermedad extracraneal puede influir en el tratamiento de las lesiones encefálicas. Cuando hay enfermedad sistémica activa y extensa, la cirugía ofrece poco beneficio en cuanto a la supervivencia general (SG). En pacientes con enfermedad extracraneal mínima y estable, es posible considerar una modalidad de tratamiento combinado de resección quirúrgica seguida de radioterapia. Sin embargo, la bibliografía publicada no ofrece una orientación clara.
Las opciones de tratamiento para pacientes con 1 a 4 metástasis son las siguientes:
- RTTC con resección quirúrgica, o sin esta.
- RTTC con radiocirugía estereotáctica, o sin esta.
- Tratamiento focal solo (resección quirúrgica o radiocirugía estereotáctica).
Evidencia (tratamiento de 1 a 4 metástasis):
- En 3 ensayos aleatorizados se examinó la resección de una metástasis encefálica única seguida de RTTC versus RTTC sola en 195 pacientes asignados al azar.[7-9] El proceso necesario para seleccionar a los pacientes idóneos para someterse a resección quirúrgica podría explicar los números bajos en cada ensayo. El primer ensayo[7][Nivel de evidencia B1] que se llevó a cabo en un solo centro, un cirujano seleccionó e intervino a todos los pacientes.
- En los 2 primeros ensayos se observó una mejora de la supervivencia en el grupo de cirugía,[7,8] pero en el tercero se observó una tendencia a favor del grupo de RTTC sola.[9]
- Los 3 ensayos se combinaron en un metanálisis con datos individuales de cada ensayo.[10]
- En el análisis combinado no se encontró una diferencia estadísticamente significativa en la SG (cociente de riesgos instantáneos [CRI] = 0,72; intervalo de confianza [IC] 95 %, 0,34–1,53; P = 0,4); ni en las defunciones por causas neurológicas (riesgo relativode muerte, 0,68; IC 95 %, 0,43–1,09; P = 0,11).[10]
- En uno de los ensayos se informó que el tratamiento combinado aumentó la duración de la supervivencia con independencia funcional.[7][Nivel de evidencia B1]
- En ninguno de los ensayos se informó sobre la calidad de vida.
- Se estudió la necesidad de RTTC después de la extirpación de una metástasis encefálica única.[11] Los pacientes se asignaron al azar a recibir RTTC posoperatoria o a no recibir tratamiento adicional después de la resección.
- Fue menos probable que los pacientes del grupo RTTC presentaran progresión tumoral en el encéfalo y también fue significativamente menos probable que murieran por causas neurológicas.
- La SG fue la misma en cada grupo, y no hubo diferencia en la duración de la independencia funcional.
- Otro estudio aleatorizado de observación versus RTTC después de una cirugía o una radiocirugía estereotáctica para metástasis encefálicas únicas, se cerró después de la inscripción de 19 pacientes, debido a que no se inscribieron suficientes pacientes a tiempo; por lo tanto, es muy poco lo que se puede deducir de este ensayo.[12]
- En un estudio del Radiation Therapy Oncology Group (RTOG) (RTOG-9508) se asignaron al azar a 333 pacientes, con 1 a 3 metástasis de diámetro máximo de 4 cm, a recibir RTTC (37,5 Gy en 3 semanas) con refuerzo estereotáctico, o sin este.[13] Se excluyó a los pacientes con enfermedad sistémica activa que necesitaban tratamiento para dicha enfermedad. El criterio principal de valoración fue la SG con hipótesis predefinidas tanto en la población completa del estudio como en los 186 pacientes que tenían metástasis única (no se llevó a cabo ajuste estadístico de los valores de P para cada hipótesis por separado).[13][Niveles de evidencia B1 en la población completa del estudio y A1 en los pacientes con metástasis únicas]
- La media de la SG en el grupo de tratamiento combinado fue de 5,7 meses y la media de la SG en el grupo de RTTC sola fue de 6,5 meses (P = 0,14).
- En el subgrupo de metástasis únicas, la SG fue mejor que en el grupo de tratamiento combinado (6,5 meses vs. 4,9 meses; P = 0,039 en el análisis univariante; P = 0,053 en el análisis multivariante ajustado de acuerdo con los factores pronósticos iniciales).
- En pacientes con metástasis múltiples, la supervivencia fue de 5,8 meses en el grupo de tratamiento combinado versus 6,7 meses en el grupo de RTTC sola (P = 0,98).
- El grupo de tratamiento combinado tuvo una ventaja de supervivencia de 2,5 meses en los pacientes con metástasis únicas, pero no en los pacientes con lesiones múltiples.
- El control local fue mejor en la población total de tratamiento combinado.
- A los 6 meses de seguimiento, la escala de rendimiento de Karnofsky (considerada como un criterio de valoración inexacto debido a que es impreciso y subjetivo) fue mejor en el grupo de tratamiento combinado, aunque no hubo diferencia en el estado mental en los grupos de tratamiento. Los efectos tóxicos agudos y tardíos fueron semejantes en ambos grupos de tratamiento. No se evaluó la calidad de vida.
- La media de la SG en el grupo de tratamiento combinado fue de 5,7 meses y la media de la SG en el grupo de RTTC sola fue de 6,5 meses (P = 0,14).
- En un ensayo aleatorizado de fase III se comparó la RTTC adyuvante con la observación después de la cirugía o radiocirugía de un número limitado de metástasis encefálicas en pacientes con tumores sólidos estables.[14][Nivel de evidencia A3]
- La calidad de vida relacionada con la salud mejoró en el grupo sometido a observación sola en comparación con el que se sometió a RTTC.
- Los pacientes del grupo de observación presentaron puntuaciones mejores en el funcionamiento físico, el desempeño y el funcionamiento cognitivo a los 9 meses.
- En un análisis exploratorio, se observó que los pacientes sometidos a RTTC, en comparación con los sometidos a observación sola, presentaron puntuaciones más precarias y estadísticamente significativas en los siguientes aspectos: control vesical, alteraciones de comunicación, somnolencia, alopecia, disfunción motriz, debilidad en las piernas, pérdida de apetito, estreñimiento, náuseas o vómitos, dolor y funcionamiento social.
- En un metanálisis de 2 ensayos con 358 participantes, no se encontraron diferencias estadísticamente significativas en la SG del grupo de RTTC con radiocirugía estereotáctica y en la del grupo de RTTC sola (CRI, 0,82; IC 95 %, 0,65–1,02).[15][Nivel de evidencia B1]
- Los pacientes en el grupo de RTTC con radiocirugía estereotáctica presentaron reducción en el fracaso local en comparación con los pacientes sometidos a RTTC sola (CRI, 0,27; IC 95 %, 0,14–0,52).
- Después de 6 meses, se observó una escala de rendimiento de Karnofsky sin cambio, o que mejoró, en el 43 % de los pacientes del grupo de tratamiento combinado versus el 28 % del grupo de RTTC sola (P = 0,03).
El Data and Safety Monitoring Board suspendió un estudio debido a desenlaces más precarios en el grupo de RTTC. Este estudio tenía como criterio principal de valoración el aprendizaje y la neurocognición medidos con una prueba estandarizada de memoria total.[16][Nivel de evidencia B1]
Teniendo en cuenta este conjunto de información, las opciones terapéuticas razonables abarcan el tratamiento focal con RTTC o el tratamiento focal solo con un seguimiento minucioso mediante IRM seriada y tratamiento de rescate cuando haya indicación clínica. Debe hablarse con el paciente sobre los pros y contras de cada método.
Se llevaron a cabo varios ensayos aleatorizados cuyo diseño incluyó diversos criterios principales de valoración con el fin de evaluar si se necesita RTTC después del tratamiento focal. Estos resultados se resumen a continuación:[16-18]
- En los estudios se describe en forma congruente que la adición de RTTC al tratamiento focal disminuye el riesgo de progresión y de nuevas metástasis encefálicas.
- La adición de RTTC no mejora la SG.
- La reducción del riesgo de progresión de la enfermedad intracraneal no se traduce en una mejora del estado funcional o neurológico, tampoco parece disminuir el riesgo de muerte por deterioro neurológico.
- Casi la mitad, o más, de los pacientes sometidos a tratamiento focal solo, eventualmente necesitan tratamiento de rescate, como RTTC o radiocirugía, en comparación con casi un cuarto de los pacientes sometidos a RTTC inicial.
- El efecto sobre la calidad de vida del mejor control local relacionado con la RTTC no se ha notificado y sigue sin conocerse.
Carcinomatosis leptomeníngea
La carcinomatosis leptomeníngea (CL) se presenta en cerca del 5 % de todos los pacientes con cáncer. Los tipos más comunes de cáncer que se diseminan a las leptomeninges son los siguientes:
- Tumores de mama (35 %).
- Tumores de pulmón (24 %).
- Neoplasias hematológicas (16 %).
El diagnóstico incluye una combinación de imágenes del eje neuroespinal y prueba citológica del líquido cefalorraquídeo (LCR). La mediana de SG oscila entre 10 y 12 semanas.
El tratamiento de la CL incluye las siguientes opciones:
- Quimioterapia intratecal.
- Quimioterapia intratecal y sistémica.
- Quimioterapia intratecal y radioterapia
- Cuidados médicos de apoyo.
En una serie de 149 pacientes con carcinoma metastásico de pulmón de células no pequeñas, se encontró que los factores pronósticos de supervivencia significativamente más corta fueron los siguientes: CL comprobada mediante prueba citológica, estado funcional precario, concentraciones elevadas de proteínas en el LCR y un número inicial alto de glóbulos blancos en el LCR.[19] Los pacientes recibieron tratamiento activo que incluyó quimioterapia intratecal, RTTC o inhibidores de la tirosina–cinasa del receptor del factor de crecimiento epidérmico, o fueron sometidos a un procedimiento de derivación ventriculoperitoneal.
En una serie retrospectiva de 38 pacientes con cáncer de mama metastásico y CL, la proporción de casos de CL varió según el subtipo de cáncer de mama, de la siguiente manera:[20]
- Luminal A (18,4 %).
- Luminal B (31,6 %).
- Positivo para el receptor 2 del factor de crecimiento epidérmico humano (HER2) (26,3 %).
- Subtipo de cáncer de mama triple negativo (23,7 %).
Los pacientes con cáncer de mama triple negativo presentaron un intervalo más corto entre el diagnóstico de cáncer de mama metastásico y la presentación de CL. La mediana de supervivencia no fue diferente entre los subtipos de cáncer de mama. En informes de casos también se consideró administrar por vía intratecal trastuzumab en pacientes con CL positiva para HER2.[21]
Bibliografía
- Patchell RA: The management of brain metastases. Cancer Treat Rev 29 (6): 533-40, 2003. [PUBMED Abstract]
- Mehta M, Vogelbaum MA, Chang S, et al.: Neoplasms of the central nervous system. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Lippincott Williams & Wilkins, 2011, pp 1700-49.
- Hutter A, Schwetye KE, Bierhals AJ, et al.: Brain neoplasms: epidemiology, diagnosis, and prospects for cost-effective imaging. Neuroimaging Clin N Am 13 (2): 237-50, x-xi, 2003. [PUBMED Abstract]
- Schaefer PW, Budzik RF, Gonzalez RG: Imaging of cerebral metastases. Neurosurg Clin N Am 7 (3): 393-423, 1996. [PUBMED Abstract]
- Soffietti R, Cornu P, Delattre JY, et al.: EFNS Guidelines on diagnosis and treatment of brain metastases: report of an EFNS Task Force. Eur J Neurol 13 (7): 674-81, 2006. [PUBMED Abstract]
- Ogawa K, Yoshii Y, Nishimaki T, et al.: Treatment and prognosis of brain metastases from breast cancer. J Neurooncol 86 (2): 231-8, 2008. [PUBMED Abstract]
- Patchell RA, Tibbs PA, Walsh JW, et al.: A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med 322 (8): 494-500, 1990. [PUBMED Abstract]
- Vecht CJ, Haaxma-Reiche H, Noordijk EM, et al.: Treatment of single brain metastasis: radiotherapy alone or combined with neurosurgery? Ann Neurol 33 (6): 583-90, 1993. [PUBMED Abstract]
- Mintz AH, Kestle J, Rathbone MP, et al.: A randomized trial to assess the efficacy of surgery in addition to radiotherapy in patients with a single cerebral metastasis. Cancer 78 (7): 1470-6, 1996. [PUBMED Abstract]
- Hart MG, Grant R, Garside R, et al.: Chemotherapeutic wafers for high grade glioma. Cochrane Database Syst Rev (3): CD007294, 2008. [PUBMED Abstract]
- Patchell RA, Tibbs PA, Regine WF, et al.: Postoperative radiotherapy in the treatment of single metastases to the brain: a randomized trial. JAMA 280 (17): 1485-9, 1998. [PUBMED Abstract]
- Roos DE, Wirth A, Burmeister BH, et al.: Whole brain irradiation following surgery or radiosurgery for solitary brain metastases: mature results of a prematurely closed randomized Trans-Tasman Radiation Oncology Group trial (TROG 98.05). Radiother Oncol 80 (3): 318-22, 2006. [PUBMED Abstract]
- Andrews DW, Scott CB, Sperduto PW, et al.: Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase III results of the RTOG 9508 randomised trial. Lancet 363 (9422): 1665-72, 2004. [PUBMED Abstract]
- Soffietti R, Kocher M, Abacioglu UM, et al.: A European Organisation for Research and Treatment of Cancer phase III trial of adjuvant whole-brain radiotherapy versus observation in patients with one to three brain metastases from solid tumors after surgical resection or radiosurgery: quality-of-life results. J Clin Oncol 31 (1): 65-72, 2013. [PUBMED Abstract]
- Patil CG, Pricola K, Sarmiento JM, et al.: Whole brain radiation therapy (WBRT) alone versus WBRT and radiosurgery for the treatment of brain metastases. Cochrane Database Syst Rev 9: CD006121, 2012. [PUBMED Abstract]
- Chang EL, Wefel JS, Hess KR, et al.: Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation: a randomised controlled trial. Lancet Oncol 10 (11): 1037-44, 2009. [PUBMED Abstract]
- Aoyama H, Shirato H, Tago M, et al.: Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases: a randomized controlled trial. JAMA 295 (21): 2483-91, 2006. [PUBMED Abstract]
- Kocher M, Soffietti R, Abacioglu U, et al.: Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 study. J Clin Oncol 29 (2): 134-41, 2011. [PUBMED Abstract]
- Lee SJ, Lee JI, Nam DH, et al.: Leptomeningeal carcinomatosis in non-small-cell lung cancer patients: impact on survival and correlated prognostic factors. J Thorac Oncol 8 (2): 185-91, 2013. [PUBMED Abstract]
- Torrejón D, Oliveira M, Cortes J, et al.: Implication of breast cancer phenotype for patients with leptomeningeal carcinomatosis. Breast 22 (1): 19-23, 2013. [PUBMED Abstract]
- Bartsch R, Berghoff AS, Preusser M: Optimal management of brain metastases from breast cancer. Issues and considerations. CNS Drugs 27 (2): 121-34, 2013. [PUBMED Abstract]
Tratamiento de los tumores recidivantes del sistema nervioso central
Los pacientes con tumores recidivantes del sistema nervioso central casi nunca se pueden curar deben considerar la participación en ensayos clínicos. Para obtener información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
Las opciones de tratamiento para los tumores recidivantes del SNC son las siguientes:
Quimioterapia
Quimioterapia localizada (oblea de carmustina)
Se investigó el uso de obleas de carmustina para el tratamiento de los gliomas malignos recidivantes, pero el efecto sobre la supervivencia es menos claro que en el momento del diagnóstico y resección iniciales.
Evidencia (quimioterapia localizada):
- En un ensayo aleatorizado multicéntrico controlado con placebo, se asignaron al azar a 222 pacientes con recidiva de tumores primarios malignos de encéfalo que necesitaban una cirugía nueva para recibir implantes de obleas de carmustina o de obleas biodegradables como placebo.[1][Nivel de evidencia A1] Aproximadamente la mitad de los pacientes habían recibido quimioterapia sistémica antes. Los 2 grupos de tratamiento estaban bien equilibrados al inicio del estudio.
- La mediana de supervivencia fue de 31 semanas en el grupo que recibió obleas de carmustina versus 23 semanas en el grupo que recibió obleas placebo. La significación estadística de las 2 curvas de supervivencia general dependió del método de análisis.
- El cociente de riesgos instantáneos (CRI) para el riesgo de muerte en la comparación directa por intención de tratar entre los 2 grupos fue de 0,83 (intervalo de confianza [IC] 95 %, 0,63–1,10; P = 0,19). Las características iniciales fueron semejantes entre los 2 grupos, pero durante la investigación se llevó a cabo un análisis adicional con ajuste por factores pronósticos, debido a que se consideró que incluso las diferencias pequeñas en las características iniciales podían tener una influencia potente en los desenlaces. En el modelo de riesgos instantáneos proporcionales ajustados, el CRI para el riesgo de muerte fue de 0,67 (IC 95 %, 0,51–0,90, P = 0,006). Los investigadores enfatizaron este último análisis y notificaron el ensayo como positivo.[1][Nivel de evidencia A1]
- En una revisión sistemática de la Colaboración Cochrane de las obleas quimioterapéuticas para el glioma de grado alto se hizo énfasis en el análisis sin ajuste y se consideró este ensayo como negativo.[2]
Quimioterapia sistémica
El tratamiento sistémico (por ejemplo, temozolomida, lomustina o la combinación de procarbazina, una nitrosourea y vincristina (PCV) en pacientes que no recibieron estos fármacos antes) se ha utilizado en el momento de la recidiva de tumores primarios malignos de encéfalo. Sin embargo, este enfoque no se ha sometido a pruebas en estudios controlados. Los factores relacionados con la selección de los pacientes probablemente cumplen una función importante para determinar los desenlaces, por lo tanto, no está claro el efecto del tratamiento sobre la supervivencia.
Tratamiento antiangiogénico
En 2009, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) concedió la aprobación acelerada de la monoterapia con bevacizumab para pacientes con glioblastoma progresivo. Esta indicación fue concedida mediante el programa de aprobación acelerada de la FDA que permite utilizar determinados criterios de valoración indirectos o un efecto sobre un criterio de valoración clínico diferente a la supervivencia o la morbilidad irreversible, como fundamentos para la aprobación de productos destinados a enfermedades o afecciones graves o potencialmente mortales.
La aprobación se fundamentó en la manifestación de una mejora en las tasas de respuesta objetiva observadas en 2 ensayos de un solo grupo con controles históricos o de ensayos de fase II no comparativos.[3,4][Nivel de evidencia C3] A partir de estos datos y de la aprobación de la FDA, el bevacizumab en monoterapia se convirtió en el tratamiento estándar del glioblastoma recidivante.
Evidencia (tratamiento antiangiogénico):
- La FDA revisó de manera independiente un estudio no comparativo multicéntrico sin enmascaramiento de fase II, en el que se asignó al azar a 167 pacientes con glioblastoma multiforme (GMB) recidivante para recibir bevacizumab solo o bevacizumab en combinación con irinotecán.[3] No obstante, solo se utilizaron los datos de eficacia del grupo de bevacizumab en monoterapia (n = 85) para respaldar la aprobación del fármaco.
- Se observó respuesta tumoral en un 26 % de los pacientes tratados con bevacizumab solo, y la mediana de duración de esta respuesta en los pacientes fue de 4,2 meses.
- De acuerdo con este ensayo de control externo, la incidencia de efectos adversos relacionados con bevacizumab no parece haber aumentado de manera significativa en los pacientes con GBM.
- La FDA evaluó de manera independiente otro ensayo de un solo grupo, llevado a cabo en una sola institución en el que se trató con bevacizumab a 56 pacientes con glioblastoma recidivante.[4]
- Se observaron respuestas en un 20 % de los pacientes, y la mediana de duración de la respuesta fue de 3,9 meses.
No se cuenta con datos de ensayos aleatorizados, prospectivos y controlados que demuestren mejoras en los desenlaces de salud, como en los síntomas relacionados con la enfermedad o el aumento de la supervivencia por el uso de bevacizumab en el tratamiento del glioblastoma.
Radioterapia
Debido a que no hay ensayos aleatorizados, no se ha determinado con claridad la función de repetir la radiación después de que progresa la enfermedad ni tampoco si se presenta cáncer inducido por radiación. La interpretación es difícil porque la bibliografía se limita a series de casos retrospectivas pequeñas.[5] Hay que tener cautela cuando se toman decisiones debido al riesgo de alteraciones neurocognitivas y necrosis causada por radiación.
Cirugía
Para algunos pacientes, una nueva resección de un tumor recidivante del SNC es una opción. No obstante, la mayoría de los pacientes no son aptos debido al deterioro de la afección o porque los tumores son técnicamente inoperables. La evidencia se limita a estudios no controlados y series de casos de pacientes que están lo suficientemente sanos o que tienen tumores bastante pequeños para que técnicamente se les pueda someter a citorreducción. Se desconoce el efecto de una cirugía nueva sobre la supervivencia versus la selección de pacientes.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Brem H, Piantadosi S, Burger PC, et al.: Placebo-controlled trial of safety and efficacy of intraoperative controlled delivery by biodegradable polymers of chemotherapy for recurrent gliomas. The Polymer-brain Tumor Treatment Group. Lancet 345 (8956): 1008-12, 1995. [PUBMED Abstract]
- Hart MG, Grant R, Garside R, et al.: Chemotherapeutic wafers for high grade glioma. Cochrane Database Syst Rev (3): CD007294, 2008. [PUBMED Abstract]
- Friedman HS, Prados MD, Wen PY, et al.: Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma. J Clin Oncol 27 (28): 4733-40, 2009. [PUBMED Abstract]
- Kreisl TN, Kim L, Moore K, et al.: Phase II trial of single-agent bevacizumab followed by bevacizumab plus irinotecan at tumor progression in recurrent glioblastoma. J Clin Oncol 27 (5): 740-5, 2009. [PUBMED Abstract]
- Paulino AC, Mai WY, Chintagumpala M, et al.: Radiation-induced malignant gliomas: is there a role for reirradiation? Int J Radiat Oncol Biol Phys 71 (5): 1381-7, 2008. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (05/15/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se cambió el título de este resumen.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento de los tumores del sistema nervioso central en adultos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento de los tumores del sistema nervioso central son:
- Solmaz Sahebjam, MD (Johns Hopkins at Sibley Memorial Hospital)
- Minh Tam Truong, MD (Boston University Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento de los tumores del sistema nervioso central. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/cerebro/pro/tratamiento-cerebro-adultos-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.