Adaptación al cáncer: ansiedad y sufrimiento (PDQ®)–Versión para profesionales de salud
Aspectos generales
En los estudios de la prevalencia de los trastornos mentales en los pacientes con cáncer,[1,2] se observa que la mayoría de los pacientes no satisfacen los criterios diagnósticos de ningún trastorno mental específico; no obstante, muchos pacientes experimentan una variedad de respuestas emocionales difíciles.[3]
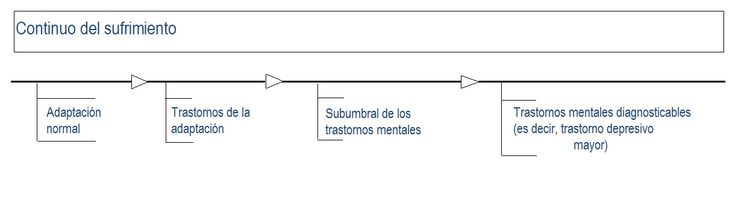
El sufrimiento psicológico se presenta a lo largo de un continuo (consultar la figura a continuación) que abarca desde aspectos de la adaptación normal hasta los trastornos de adaptación de la quinta edición del Manual Diagnóstico y Estadístico de los Trastornos Mentales;[4]. Este resumen se enfoca principalmente en el extremo de menor gravedad del siguiente continuo:[5]
- Aspectos de la adaptación normal.
- Sufrimiento psicosocial.
- Trastornos de adaptación.
- Trastornos de ansiedad relacionada con el cáncer.
Para obtener más información, consultar Depresión y Estrés postraumático relacionado con el cáncer.
La ansiedad se presenta a menudo en diversos momentos: durante la detección, el diagnóstico, el tratamiento y la recidiva del cáncer. También puede afectar la conducta de salud de personas, contribuyendo a acciones que podrían prevenir el cáncer.[6-8] Por ejemplo, cuando las mujeres con grados altos de ansiedad se enteran de que tienen un riesgo genéticamente más alto de presentar cáncer de mama que lo que creían antes, se podrían realizar el autoexamen de mama con menos frecuencia.[9]
Para los pacientes sometidos a tratamiento del cáncer, la ansiedad también quizás aumente la expectativa de dolor,[10-12] otros síntomas de sufrimiento y perturbaciones del sueño, y puede ser un factor importante de náuseas y vómitos anticipatorios. La ansiedad, independientemente de su gravedad, puede interferir de modo significativo en la calidad de vida de los pacientes de cáncer y sus familias: se deberá evaluar y tratar.[13-16]
En este resumen, a menos que se indique lo contrario, se tratan temas relacionados con la evidencia científica y las prácticas referidas a los adultos. La evidencia y la aplicación a la práctica referida a los niños a veces difieren bastante de la información pertinente a los adultos. Cuando la información específica sobre la atención de los niños esté disponible, se resumirá bajo su propio encabezado.
Bibliografía
- Derogatis LR, Morrow GR, Fetting J, et al.: The prevalence of psychiatric disorders among cancer patients. JAMA 249 (6): 751-7, 1983. [PUBMED Abstract]
- Massie MJ, Holland JC: Overview of normal reactions and prevalence of psychiatric disorders. In: Holland JC, Rowland JH, eds.: Handbook of Psychooncology: Psychological Care of the Patient With Cancer. Oxford University Press, 1989, pp 273-82.
- Bisson JI, Chubb HL, Bennett S, et al.: The prevalence and predictors of psychological distress in patients with early localized prostate cancer. BJU Int 90 (1): 56-61, 2002. [PUBMED Abstract]
- American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders: DSM-5. 5th ed. American Psychiatric Association, 2013.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Distress Management. Version 1.2025. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2024. Available online with free registration. Last accessed Feb. 26, 2025.
- Lauver D, Ho CH: Explaining delay in care seeking for breast cancer symptoms. J Appl Soc Psychol 23 (21): 1806-25, 1993.
- MacFarlane ME, Sony SD: Women, breast lump discovery, and associated stress. Health Care Women Int 13 (1): 23-32, 1992 Jan-Mar. [PUBMED Abstract]
- Gram IT, Slenker SE: Cancer anxiety and attitudes toward mammography among screening attenders, nonattenders, and women never invited. Am J Public Health 82 (2): 249-51, 1992. [PUBMED Abstract]
- Lerman C, Kash K, Stefanek M: Younger women at increased risk for breast cancer: perceived risk, psychological well-being, and surveillance behavior. J Natl Cancer Inst Monogr (16): 171-6, 1994. [PUBMED Abstract]
- Velikova G, Selby PJ, Snaith PR, et al.: The relationship of cancer pain to anxiety. Psychother Psychosom 63 (3-4): 181-4, 1995. [PUBMED Abstract]
- Glover J, Dibble SL, Dodd MJ, et al.: Mood states of oncology outpatients: does pain make a difference? J Pain Symptom Manage 10 (2): 120-8, 1995. [PUBMED Abstract]
- Ferrell-Torry AT, Glick OJ: The use of therapeutic massage as a nursing intervention to modify anxiety and the perception of cancer pain. Cancer Nurs 16 (2): 93-101, 1993. [PUBMED Abstract]
- Davis-Ali SH, Chesler MA, Chesney BK: Recognizing cancer as a family disease: worries and support reported by patients and spouses. Soc Work Health Care 19 (2): 45-65, 1993. [PUBMED Abstract]
- Dahlquist LM, Czyzewski DI, Copeland KG, et al.: Parents of children newly diagnosed with cancer: anxiety, coping, and marital distress. J Pediatr Psychol 18 (3): 365-76, 1993. [PUBMED Abstract]
- Payne SA: A study of quality of life in cancer patients receiving palliative chemotherapy. Soc Sci Med 35 (12): 1505-9, 1992. [PUBMED Abstract]
- Nakamura ZM, Deal AM, Nyrop KA, et al.: Serial Assessment of Depression and Anxiety by Patients and Providers in Women Receiving Chemotherapy for Early Breast Cancer. Oncologist 26 (2): 147-156, 2021. [PUBMED Abstract]
Definiciones
Para lograr que coincidan eficazmente las necesidades del paciente con cáncer con las intervenciones de tratamiento, los profesionales de atención de la salud deben ser capaces de distinguir las dificultades periódicas que caracterizan la adaptación normal de los trastornos mentales más graves. Para ayudar en esta evaluación, los profesionales de la salud deben entender las diferencias entre una variedad de conceptos relacionados.
Adaptación normal: el ajuste o la adaptación psicosocial al cáncer se definió como un proceso constante durante el que cada paciente trata de manejar el sufrimiento emocional, solucionar problemas específicos relacionados con el cáncer, y dominar o controlar los acontecimientos vitales relacionados con el cáncer.[1-3] La adaptación al cáncer no es una situación unitaria y simple sino, más bien, una serie de respuestas constantes para enfrentar las muchas tareas que impone el hecho de vivir con cáncer. Para obtener más información, consultar la sección Adaptación normal.
Sufrimiento psicosocial: el sufrimiento en el entorno del cáncer se definió como “una experiencia multifactorial desagradable de naturaleza psicológica (es decir, cognitiva, conductual y emocional), social, espiritual o física que a veces interfiere con la capacidad de la persona de enfrentar el cáncer, los síntomas físicos y su tratamiento de manera eficaz. El sufrimiento se extiende a lo largo de un continuo que va desde los sentimientos normales comunes de vulnerabilidad, tristeza y temor hasta problemas que se pueden tornar incapacitantes, como la depresión, la ansiedad, el pánico, el aislamiento social, y la crisis existencial y espiritual”.[4,5] Para obtener más información, consultar la sección Sufrimiento psicosocial.
Trastornos de adaptación: los trastornos de adaptación, categoría diagnóstica de la quinta edición del Manual Diagnóstico y Estadístico de los Trastornos Mentales de la American Psychiatric Association (DSM-5),[6] se caracterizan por la presencia de síntomas conductuales o emocionales importantes desde el punto de vista clínico que resultan en un sufrimiento marcado o un deterioro significativo en áreas de funcionamiento social, ocupacional u otras que sean importantes. Los síntomas que se presentan en respuesta a un factor psicosocial identificable de estrés psicosocial (por ejemplo, un diagnóstico de cáncer) son menos graves que en los trastornos mentales diagnosticados como trastorno depresivo mayor o un trastorno de ansiedad generalizada, y no representan un duelo normal. Para obtener más información, consultar la sección Trastornos de adaptación.
Trastornos de ansiedad: los trastornos de ansiedad son un grupo de trastornos mentales cuyos síntomas comunes incluyen ansiedad excesiva, preocupación, miedo, aprensión o temor. Aunque cierta ansiedad puede ser adaptativa, particularmente en respuesta a factores de estrés, como el cáncer, los trastornos de ansiedad reflejan miedos, preocupaciones y terrores a menudo ilógicos e injustificados. Entre los tipos de trastornos de ansiedad del DSM-5 se incluyen el trastorno de ansiedad generalizada, el trastorno de angustia, la agorafobia, el trastorno de ansiedad social, la fobia específica, el trastorno obsesivo compulsivo y el trastorno de estrés postraumático.[6] Para obtener más información, consultar la sección Trastornos de ansiedad: descripción y etiología.
Bibliografía
- Brennan J: Adjustment to cancer - coping or personal transition? Psychooncology 10 (1): 1-18, 2001 Jan-Feb. [PUBMED Abstract]
- Folkman S, Greer S: Promoting psychological well-being in the face of serious illness: when theory, research and practice inform each other. Psychooncology 9 (1): 11-9, 2000 Jan-Feb. [PUBMED Abstract]
- Nicholas DR, Veach TA: The psychosocial assessment of the adult cancer patient. Prof Psychol 31 (2): 206-15, 2000.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Distress Management. Version 1.2025. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2024. Available online with free registration. Last accessed Feb. 26, 2025.
- Fashoyin-Aje LA, Martinez KA, Dy SM: New patient-centered care standards from the commission on cancer: opportunities and challenges. J Support Oncol 10 (3): 107-11, 2012 May-Jun. [PUBMED Abstract]
- American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders: DSM-5. 5th ed. American Psychiatric Association, 2013.
Factores de riesgo: prevalencia y factores pronósticos de sufrimiento
En unos cuantos estudios se investigó la prevalencia del sufrimiento medido por el National Comprehensive Cancer Network Distress Thermometer (DT) u otros instrumentos de detección, como el Brief Symptom Inventory.[1-6] Las tasas de prevalencia en pacientes de cáncer oscilan entre el 22 % y 58 %.[7]
Los resultados conjuntos de estudios múltiples indican que aproximadamente 40 % de los pacientes de cáncer informan sentir mucho sufrimiento.[7] Los pacientes de cánceres de pulmón, páncreas y encéfalo parecen más proclives a notificar sufrimiento; sin embargo y en general, el tipo de cáncer solo se relaciona en forma modesta con el sufrimiento. Entre los diferentes tipos de cáncer, los factores pronósticos más fuertes de sufrimiento son los siguientes:[7]
- Incapacidad.
- Calidad de vida inferior.
- Necesidades psicológicas constantes insatisfechas.
Con respecto a la prevalencia del sufrimiento, en un estudio de 236 mujeres con cáncer de mama recién diagnosticado (que esperaban su consulta inicial con un cirujano oncólogo), se determinó que el 41 % notificaron puntajes de sufrimiento superiores a 5 en el DT. En este mismo grupo de mujeres, el 11 % notificaron síntomas indicativos de depresión mayor y el 10 % dieron cuenta de síntomas de estrés postraumático.[8]
Se han identificado factores pronósticos del sufrimiento. En una muestra grande (N = 380) de pacientes con distintos diagnósticos de cáncer, fue más probable que los pacientes que notificaron un puntaje de 4 o más en el DT fuesen mujeres, tuviesen un estado funcional más precario (escala de desempeño de Karnofsky autonotificada) y hubiesen notificado (en una lista de verificación de problemas que se adjunta al DT) problemas relacionados con la vivienda, el trato con los niños, el trato con la pareja, la depresión, los miedos, el nerviosismo, la tristeza, la preocupación y 14 de 20 dolencias físicas.[2]
En cuanto a los factores pronósticos de sufrimiento después del tratamiento, en un estudio longitudinal de 224 pacientes con cáncer de cabeza y cuello se observó que los participantes eran más propensos a presentar un trastorno de ansiedad inmediatamente después del tratamiento cuando se les diagnosticaba un cáncer en estadio avanzado o habían sufrido abusos en la infancia.[9][Nivel de evidencia: II] En un estudio longitudinal de observación de 151 mujeres con cáncer de mama en estadio temprano, se halló que los síntomas físicos y los efectos secundarios experimentados durante el tratamiento pronosticaban sufrimiento posterior al tratamiento que ascendió a un 6 % del 24 % del total de la varianza calculada.[10] Además, las variables demográficas vinculadas con este sufrimiento después del tratamiento del cáncer incluyeron las siguientes:
- Edad más joven.
- Raza diferente a la blanca.
- Menos escolaridad formal.
Las variables clínicas relacionadas con el sufrimiento postratamiento fueron las siguientes:
- Haberse sometido a una mastectomía en lugar de una lumpectomía.
- Haber recibido tratamiento hormonal.
- Presentar un trastorno mental diagnosticable en el momento de la inscripción en el estudio.
En un análisis integral de estudios prospectivos se investigaron factores pronósticos del sufrimiento a más largo plazo (≥12 meses desde el momento del diagnóstico).[4] En este análisis, se estableció que un nivel más alto de sufrimiento en el momento del diagnóstico es el factor pronóstico más confiable de sufrimiento a más largo plazo más intenso.
Bibliografía
- Hoffman BM, Zevon MA, D'Arrigo MC, et al.: Screening for distress in cancer patients: the NCCN rapid-screening measure. Psychooncology 13 (11): 792-9, 2004. [PUBMED Abstract]
- Jacobsen PB, Donovan KA, Trask PC, et al.: Screening for psychologic distress in ambulatory cancer patients. Cancer 103 (7): 1494-502, 2005. [PUBMED Abstract]
- Akizuki N, Akechi T, Nakanishi T, et al.: Development of a brief screening interview for adjustment disorders and major depression in patients with cancer. Cancer 97 (10): 2605-13, 2003. [PUBMED Abstract]
- Cook SA, Salmon P, Hayes G, et al.: Predictors of emotional distress a year or more after diagnosis of cancer: A systematic review of the literature. Psychooncology 27 (3): 791-801, 2018. [PUBMED Abstract]
- Syrowatka A, Motulsky A, Kurteva S, et al.: Predictors of distress in female breast cancer survivors: a systematic review. Breast Cancer Res Treat 165 (2): 229-245, 2017. [PUBMED Abstract]
- Trask PC, Paterson A, Riba M, et al.: Assessment of psychological distress in prospective bone marrow transplant patients. Bone Marrow Transplant 29 (11): 917-25, 2002. [PUBMED Abstract]
- Carlson LE, Waller A, Mitchell AJ: Screening for distress and unmet needs in patients with cancer: review and recommendations. J Clin Oncol 30 (11): 1160-77, 2012. [PUBMED Abstract]
- Hegel MT, Moore CP, Collins ED, et al.: Distress, psychiatric syndromes, and impairment of function in women with newly diagnosed breast cancer. Cancer 107 (12): 2924-31, 2006. [PUBMED Abstract]
- Henry M, Sargi E, Frenkiel S, et al.: Longitudinal study indicating antecedent psychosocial vulnerability as predictor of anxiety disorders post-treatment in people with head and neck cancer. Psychooncology 30 (11): 1910-1919, 2021. [PUBMED Abstract]
- Jim HS, Andrykowski MA, Munster PN, et al.: Physical symptoms/side effects during breast cancer treatment predict posttreatment distress. Ann Behav Med 34 (2): 200-8, 2007 Sep-Oct. [PUBMED Abstract]
Detección y evaluación
La detección y la evaluación de los trastornos psicosociales se consideran dos procesos distintos.[1,2] La detección es un método rápido para identificar a pacientes con sufrimiento psicosocial y la suelen realizar profesionales de la salud que no pertenecen al campo de la salud mental, mediante cuestionarios de autonotificación que permiten determinar si una persona necesita ser derivada para una evaluación más exhaustiva.[3] La evaluación psicosocial de un paciente de cáncer es una entrevista clínica más profunda enfocada en factores relacionados con la capacidad de enfrentar situaciones difíciles y de adaptación. Los profesionales de salud mental realizan la entrevista de evaluación para determinar si el paciente se está adaptando bien al cáncer.[1]
Instrumentos de autonotificación para la detección
En los estudios, se probó la capacidad de mediciones de un solo ítem para identificar de manera precisa a los pacientes que sufren.[4-8] En general, los métodos de detección muy breves, como el Distress Thermometer (DT), han demostrado solo una exactitud general moderada. Estos métodos de detección son mejores para descartar el sufrimiento, la ansiedad y la depresión, pero no tan buenos para confirmarlos.
Distress Thermometer
El Distress Thermometer (DT) es un instrumento de la National Comprehensive Cancer Network (NCCN) de un solo ítem para la detección rápida. En el DT se solicita a los pacientes que califiquen su sufrimiento en una escala de 0 a 10, donde 10 representa sufrimiento extremo. En una lista de verificación adjunta, se pide a los pacientes que indiquen lo que fue un problema para ellos durante la última semana.[9] A pesar de que se han probado muchos instrumentos de detección con pacientes de cáncer, el DT es el que se ha investigado más ampliamente. Se analizaron las propiedades psicométricas del DT (escala analógica visual de 0 a 10, en forma de termómetro rotulado Sin sufrimiento, 0, y Sufrimiento extremo, 10.[4]
Se determinó que la medición tenía validez convergente y divergente razonable cuando se la comparó con dos listas de síntomas multidimensionales bien establecidos. El DT tiene una capacidad moderada para detectar de manera exacta el sufrimiento, tal como se define con puntajes indicativos para establecer el diagnóstico de un caso en las listas de dos síntomas. En una revisión sistemática y metanálisis de 42 estudios sobre el sufrimiento en personas con diferentes tipos de cáncer, se encontró que un puntaje de corte de DT de 4 o más potencia la sensibilidad y la especificidad de la medida para identificar el sufrimiento.[10] Los autores observaron que un puntaje de DT de 4 o más se correlacionaba con síntomas clínicamente significativos de ansiedad y sufrimiento medidos por la Hospital Anxiety and Depression Scale.[10] Un puntaje de DT de 4 o más debería motivar la conversación con un miembro del equipo de oncología para determinar los recursos o derivaciones que abordarán mejor las necesidades del paciente.[9,11] Cabe destacar que una validación multinacional del DT entre 288 adolescentes y adultos jóvenes con cáncer determinó que un puntaje de 5 o más era el corte óptimo en este grupo etario.[12] Sin embargo, se necesita investigación adicional para confirmar estos hallazgos.
Otros instrumentos de autonotificación para la detección
Se han utilizado muchos otros cuestionarios de autonotificación como instrumentos de detección (consultar el Cuadro 1); en general, también son mejores para descartar el sufrimiento y no tan buenos para confirmarlo. Por tanto, la mayoría de los instrumentos de detección darán como resultado un número alto de positivos falsos y se deben controlar con una entrevista de evaluación psicosocial más completa.
| Título | Número de puntos | Tiempo (minutos) | Conceptos medidos |
|---|---|---|---|
| Brief Symptom Inventory (BSI) [13] | 53 | 7–10 | Somatización, ansiedad, sensibilidad interpersonal, depresión, hostilidad, ansiedad fóbica, ideación paranoica, psicosis y características obsesivo compulsivas |
| Brief Symptom Inventory-18 (BSI-18) [14] | 18 | 3–5 | Somatización, depresión, ansiedad y sufrimiento general |
| Distress Thermometer (DT) y lista de problemas [2,15] | Varía | 2–3 | Sufrimiento y problemas relacionados con el sufrimiento |
| Functional Assessment of Chronic Illness Therapy (FACIT; anteriormente Functional Assessment of Cancer Therapy [FACT]) [16] | 27 | 5–10 | Cuatro dominios de calidad de vida: físico, funcional, social o familiar, y bienestar emocional |
| Hospital Anxiety and Depression Scale (HADS) [17-19] | 14 | 5–10 | Síntomas emocionales y cognitivos de depresión y ansiedad clínicas sin síntomas neurovegetativos |
| Detecciones del Patient-Reported Outcomes Measurement Information System (PROMIS) [20] | Hasta 88 (8–15 por dominio) | Varía | Normas clínicas basadas en edad, estadio del cáncer y tipo de cáncer en ocho dominios (ansiedad, depresión, interferencia del dolor, fatiga, perturbación del sueño, funcionamiento físico, funcionamiento social y funcionamiento cognitivo); cada dominio se puede administrar por separado |
| Profile of Mood States (POMS) [21] | 65 | 10–25 | Seis estados de ánimo: ansiedad, fatiga, confusión, depresión, ira y vigor |
| Zung Self-Rating Depression Scale [22] | 20 | 5–10 | Síntomas de depresión |
Los instrumentos de autonotificación para la detección se deben calificar, evaluar y analizar con cada paciente. La priorización —el proceso de comunicar los resultados del examen de detección, analizar las necesidades de cada paciente y determinar el mejor curso de acción— es clave para el uso exitoso de la detección. En realidad, la detección sin disponibilidad de recursos apropiados para el tratamiento no se considera ética. El equipo primario de oncología (oncólogo, enfermero, especialista en cuidados paliativos, trabajador social y consejero) es responsable por la priorización exitosa. En algunos estudios, un porcentaje significativo de pacientes que dan cuenta de grados de sufrimiento moderados a altos rehúsan someterse a evaluaciones adicionales.[23-26] El equipo primario de oncología debe considerar la mejor manera de presentar la necesidad de evaluación psicosocial adicional.
Las normas de atención del NCCN [9] indican que el sufrimiento calificado como moderado podría ocasionar una derivación a un grupo de autoayuda local o al tratamiento por parte del equipo primario de oncología solamente. El sufrimiento calificado como moderado a grave justifica una derivación a otros profesionales apropiados (psicólogos, psiquiatras, trabajadores sociales, especialistas en cuidados paliativos o consejeros pastorales) según la naturaleza del sufrimiento.
Evaluación psicosocial
Cuando en la evaluación se identifica sufrimiento, se debe evaluar la adaptación psicosocial luego de la detección. La evaluación suele ser una entrevista semiestructurada durante la que el profesional evalúa el grado de adaptación del paciente, la familia y las otras personas importantes en su vida, a las demandas actuales de la enfermedad. En general, este proceso de evaluación da cuenta de una variedad amplia de factores importantes para la adaptación en general.[1] Para obtener más información, consultar la sección Factores generales que influyen en la adaptación.
Una transición exitosa desde la detección hasta la evaluación involucra la comunicación clara entre el equipo de oncología y el paciente. A pesar de que no existe un modo ideal único para hablar con los pacientes sobre las necesidades psicosociales, la experiencia clínica indica algunos conceptos importantes. En primer lugar, la mayoría de los pacientes responderá a las recomendaciones de profesionales de atención de la salud que muestran confiabilidad, experiencia, calidez y preocupación por el paciente.
Es importante la elección de las palabras. Se deben evitar palabras que indiquen la estigmatización propia de enfermedad mental grave, como psiquiátrico, psicológico, trastorno mental, adaptación inadecuada o enfermedad mental, y optar por palabras como sufrimiento, preocupaciones, inquietudes, incertidumbres o factores estresantes a raíz de la enfermedad o su tratamiento. Entre las sugerencias para la elección de palabras se incluyen las siguientes:
- El cuestionario que contestó nos ayuda a entender su persona como un todo, y deseamos ofrecerle la mejor atención física, emocional, social y espiritual posible.
- Como usted sabe, una enfermedad grave puede afectar su calidad de vida de muchas maneras (emocional, social, financiera, así como en los ámbitos del trabajo, las relaciones y la energía). Este cáncer incluye muchos otros aspectos, además del meramente físico, y queremos asegurarnos de abordar estas otras dimensiones de su vida.
- Sus preocupaciones e inquietudes son comprensibles dada su enfermedad y su tratamiento. No queremos ignorar los aspectos emocionales, sociales y espirituales de su experiencia en este momento.
- Hemos establecido que muchos pacientes se benefician en gran medida de la oportunidad de hablar más sobre sus preocupaciones con un profesional de atención de la salud (trabajador social, profesional de salud mental, especialista en cuidados paliativos o consejero pastoral) y nos gustaría programarle una cita.
- Le sugerimos una entrevista de aproximadamente 45 minutos con un profesional que:
- Lo escuchará atentamente.
- Querrá conocer sus experiencias sobre la enfermedad.
- Le preguntará sobre usted, su familia y amigos, y otras personas que lo apoyan.
- Le preguntará cómo se ha adaptado a su enfermedad y es posible que lo aliente a continuar (y le dé su opinión) con las estrategias satisfactorias que usted ya utiliza para enfrentar una situación difícil.
- Sugerirá otras maneras de abordar sus preocupaciones.
Programas modelo de detección
En varios centros integrales de cáncer se formularon modelos para detectar el sufrimiento psicosocial. Aunque hay diferencias notables, la mayoría de los modelos incluyen las siguientes etapas consecutivas:
- Administración de exámenes de detección.
- Puntaje y evaluación.
- Derivación.
La mayoría de los exámenes de detección del sufrimiento psicosocial se enfocan en el paciente; sin embargo, se están formulando algunos procedimientos de detección enfocados en la familia.[27]
La administración de un instrumento de detección supone un proceso de 5 a 10 minutos durante el que el paciente responde a una serie de preguntas simples y directas sobre el sufrimiento, ya sea de forma oral o por medio de un cuestionario de autonotificación en papel o computadora. Las respuestas reciben un puntaje y se evalúan sobre la base de criterios determinados con anterioridad. Si los puntajes se encuentran por encima de los criterios definidos, entonces se realiza una derivación formal a profesionales de la disciplina apropiada (trabajo social, psicología, psiquiatría, cuidados paliativos o atención pastoral). Luego comienza el tratamiento del sufrimiento con una entrevista de evaluación psicosocial más amplia y en persona [1] a cargo de un profesional de atención de la salud especializado en los aspectos identificados.
El éxito de los programas de detección se puede medir en términos de los siguientes resultados:
- Identificación exacta de los pacientes que experimentan un sufrimiento psicosocial importante.
- Mejora de la derivación de pacientes a profesionales de atención de la salud especializados para abordar el sufrimiento clínicamente importante.
- Aceptación de las derivaciones por los pacientes.
- Mejora de la comunicación médico-paciente, con conversaciones frecuentes sobre aspectos de la calidad de vida durante las visitas de los pacientes.
- Disminución del grado de sufrimiento y mejor calidad de vida como resultado del programa de detección.
En algunos estudios empíricos se evaluó el efecto de los programas de detección estructurados en los que se usan estos resultados. La intervención en la mayoría de estos estudios incluyó seguimiento telefónico de los resultados de la detección, con derivaciones o conversaciones personales con médicos, capacitados o no en la detección. Los diseños de los estudios han diferido en cuanto a las herramientas de detección (herramientas de detección breves o minuciosas), los componentes de intervención (médicos capacitados en la detección o inexpertos) y los resultados del estudio. Los diseños de los estudios también han diferido en sus controles; por ejemplo, los grupos de control en algunos estudios no se sometieron a detección,[28] mientras que otros incluyeron exámenes de detección para los pacientes, pero sin comunicar los resultados a los médicos.[29]
Los resultados de estos estudios de detección han sido desiguales, según la estructura de los programas de detección y los resultados evaluados. En dos estudios no se encontraron diferencias importantes entre los grupos de control y de intervención en cuanto a sufrimiento, calidad de vida o necesidades relacionadas con el cáncer.[28,29] La baja aceptación de los pacientes de los servicios de derivación psicosocial fue una de las limitaciones que se identificaron en estos estudios.[29]
En un estudio, un subgrupo de pacientes con depresión moderada a grave exhibió una reducción significativa de la depresión después de la intervención,[29] mientras que en otro estudio se concluyó que el mejor factor pronóstico de la disminución de la ansiedad o la depresión fue la derivación a servicios psicosociales.[30] En otro estudio, se observó la viabilidad de la aplicación de un programa de trato personalizado y un programa de detección computarizada, para una población grande de pacientes (N = 3133) en un centro oncológico terciario.[31]
Teniendo en cuenta estos resultados desiguales, se torna necesaria una evaluación empírica adicional de la efectividad de los programas de detección. Los siguientes ejemplos ilustran el proceso.
En el Memorial Sloan-Kettering Cancer Center se experimentó con el DT, diseñado sobre la base de las herramientas utilizadas en la medición del dolor.[9] Los puntos de anclaje descriptivos del DT son los siguientes:
- Sin sufrimiento, puntaje 0.
- Sufrimiento extremo, puntaje 10.
Se solicita a los pacientes que califiquen el sufrimiento padecido durante la última semana, incluso en el día de la detección, en una escala de 0 a 10. Con el DT se adjunta una lista de verificación de los problemas para ayudar a identificar las fuentes posibles de estrés. Se le pide al paciente que elija los problemas más importantes. Entre las categorías de problemas se incluyen los siguientes:
- Prácticos (por ejemplo, vivienda, seguro o transporte).
- Físicos (por ejemplo, dolor, náuseas o fatiga).
- Sociales (por ejemplo, pareja, hijos o amigos).
- Emocionales (por ejemplo, inquietudes, tristeza, depresión o ira).
- Espirituales o religiosos (por ejemplo, relacionados con Dios o con la pérdida de la fe).
El equipo primario de oncología (oncólogo, enfermero, especialista en cuidados paliativos y trabajador social) es responsable de administrar este breve examen de detección, analizar la respuesta del paciente y organizar una derivación, cuando sea necesaria. En las pruebas preliminares de este procedimiento, se utilizó un puntaje de corte de 4 o más como determinante de la necesidad de evaluación adicional. Las evaluaciones iniciales de las necesidades mostraron que el 20 % al 62 % de los pacientes notifican grados importantes de sufrimiento.[9]
En el Johns Hopkins Cancer Center, todos los pacientes nuevos reciben una versión de 18 puntos del Brief Symptom Inventory,[14] que enumera 18 problemas que la gente quizás experimente algunas veces (por ejemplo, sentir que se desmayan o marean, no tener interés por las cosas, soledad, o náuseas o malestar estomacal). Se les pregunta cuánto sufrieron por cada uno de los 18 problemas durante los últimos 7 días, incluso el día del examen de detección. El procedimiento automatizado utiliza a personal administrativo y de apoyo para distribuir y recuperar la lista durante la primera o segunda consulta.[2] El personal profesional participa cuando se presentan más ofertas de servicios. Los pacientes en los que se detectan grados altos de sufrimiento se derivan a un trabajador social para un seguimiento inmediato; las personas en las que se detectan niveles bajos de sufrimiento se derivan al programa de orientación psicosocial, un programa educativo estructurado diseñado para mejorar la adaptación de los pacientes proporcionándoles información sobre una amplia gama de programas psicosociales (por ejemplo, grupos de apoyo para enfermedades específicas o presentaciones psicoeducativas).
El grupo Oncology Symptom Control Research del Community Cancer Care suele utilizar la Zung Self-Rating Depression Scale (ZSDS) para la detección en todos los pacientes que ingresan.[32,33] La ZSDS es un examen autonotificado de 20 puntos que se ha utilizado para identificar la depresión y el sufrimiento más general; también se usan puntos únicos para detectar afecciones como la fatiga.[34] Por lo general, los miembros del personal administran el examen de detección mientras los pacientes están en la sala de espera. Los puntajes se analizan inmediatamente después de terminar la prueba para informar a los oncólogos sobre los aspectos pertinentes. Además, se identifica a los pacientes con puntajes dentro del intervalo moderado o más alto para un seguimiento adicional y entrevistas más extensas, así como una evaluación del psiquiatra o el psicólogo del equipo. Asimismo, los pacientes que desencadenan elementos de interés únicos, tales como fatiga, se entrevistan y vigilan para su posible inclusión en una serie de ensayos de investigación para el control de los síntomas.
Bibliografía
- Nicholas DR, Veach TA: The psychosocial assessment of the adult cancer patient. Prof Psychol 31 (2): 206-15, 2000.
- Zabora JR: Screening procedures for psychosocial distress. In: Holland JC, Breitbart W, Jacobsen PB, et al., eds.: Psycho-oncology. Oxford University Press, 1998, pp 653-61.
- Zabora JR, Smith-Wilson R, Fetting JH, et al.: An efficient method for psychosocial screening of cancer patients. Psychosomatics 31 (2): 192-6, 1990 Spring. [PUBMED Abstract]
- Hoffman BM, Zevon MA, D'Arrigo MC, et al.: Screening for distress in cancer patients: the NCCN rapid-screening measure. Psychooncology 13 (11): 792-9, 2004. [PUBMED Abstract]
- Jacobsen PB, Donovan KA, Trask PC, et al.: Screening for psychologic distress in ambulatory cancer patients. Cancer 103 (7): 1494-502, 2005. [PUBMED Abstract]
- Akizuki N, Akechi T, Nakanishi T, et al.: Development of a brief screening interview for adjustment disorders and major depression in patients with cancer. Cancer 97 (10): 2605-13, 2003. [PUBMED Abstract]
- Dabrowski M, Boucher K, Ward JH, et al.: Clinical experience with the NCCN distress thermometer in breast cancer patients. J Natl Compr Canc Netw 5 (1): 104-11, 2007. [PUBMED Abstract]
- Keir ST, Calhoun-Eagan RD, Swartz JJ, et al.: Screening for distress in patients with brain cancer using the NCCN's rapid screening measure. Psychooncology 17 (6): 621-5, 2008. [PUBMED Abstract]
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Distress Management. Version 1.2025. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2024. Available online with free registration. Last accessed Feb. 26, 2025.
- Ma X, Zhang J, Zhong W, et al.: The diagnostic role of a short screening tool--the distress thermometer: a meta-analysis. Support Care Cancer 22 (7): 1741-55, 2014. [PUBMED Abstract]
- Riba MB, Donovan KA, Andersen B, et al.: Distress Management, Version 3.2019, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 17 (10): 1229-1249, 2019. [PUBMED Abstract]
- Patterson P, D'Agostino NM, McDonald FEJ, et al.: Screening for distress and needs: Findings from a multinational validation of the Adolescent and Young Adult Psycho-Oncology Screening Tool with newly diagnosed patients. Psychooncology 30 (11): 1849-1858, 2021. [PUBMED Abstract]
- Derogatis LR, Melisaratos N: The Brief Symptom Inventory: an introductory report. Psychol Med 13 (3): 595-605, 1983. [PUBMED Abstract]
- Derogatis LR: BSI-18: Brief Symptom Inventory 18. Administration, Scoring and Procedures Manual. NCS Pearson, 2001.
- Hegel MT, Collins ED, Kearing S, et al.: Sensitivity and specificity of the Distress Thermometer for depression in newly diagnosed breast cancer patients. Psychooncology 17 (6): 556-60, 2008. [PUBMED Abstract]
- Webster K, Cella D, Yost K: The Functional Assessment of Chronic Illness Therapy (FACIT) Measurement System: properties, applications, and interpretation. Health Qual Life Outcomes 1: 79, 2003. [PUBMED Abstract]
- Kugaya A, Akechi T, Okuyama T, et al.: Prevalence, predictive factors, and screening for psychologic distress in patients with newly diagnosed head and neck cancer. Cancer 88 (12): 2817-23, 2000. [PUBMED Abstract]
- Zigmond AS, Snaith RP: The hospital anxiety and depression scale. Acta Psychiatr Scand 67 (6): 361-70, 1983. [PUBMED Abstract]
- Love AW, Kissane DW, Bloch S, et al.: Diagnostic efficiency of the Hospital Anxiety and Depression Scale in women with early stage breast cancer. Aust N Z J Psychiatry 36 (2): 246-50, 2002. [PUBMED Abstract]
- Jensen RE, Potosky AL, Moinpour CM, et al.: United States Population-Based Estimates of Patient-Reported Outcomes Measurement Information System Symptom and Functional Status Reference Values for Individuals With Cancer. J Clin Oncol 35 (17): 1913-1920, 2017. [PUBMED Abstract]
- McNair DM, Lorr M, Droppleman LF: Profile of Mood States Manual. Educational and Industrial Testing Service, 1992.
- Dugan W, McDonald MV, Passik SD, et al.: Use of the Zung Self-Rating Depression Scale in cancer patients: feasibility as a screening tool. Psychooncology 7 (6): 483-93, 1998 Nov-Dec. [PUBMED Abstract]
- Roth AJ, Kornblith AB, Batel-Copel L, et al.: Rapid screening for psychologic distress in men with prostate carcinoma: a pilot study. Cancer 82 (10): 1904-8, 1998. [PUBMED Abstract]
- Carroll BT, Kathol RG, Noyes R, et al.: Screening for depression and anxiety in cancer patients using the Hospital Anxiety and Depression Scale. Gen Hosp Psychiatry 15 (2): 69-74, 1993. [PUBMED Abstract]
- Ibbotson T, Maguire P, Selby P, et al.: Screening for anxiety and depression in cancer patients: the effects of disease and treatment. Eur J Cancer 30A (1): 37-40, 1994. [PUBMED Abstract]
- Razavi D, Delvaux N, Farvacques C, et al.: Screening for adjustment disorders and major depressive disorders in cancer in-patients. Br J Psychiatry 156: 79-83, 1990. [PUBMED Abstract]
- Kissane DW, McKenzie M, McKenzie DP, et al.: Psychosocial morbidity associated with patterns of family functioning in palliative care: baseline data from the Family Focused Grief Therapy controlled trial. Palliat Med 17 (6): 527-37, 2003. [PUBMED Abstract]
- Maunsell E, Brisson J, Deschênes L, et al.: Randomized trial of a psychologic distress screening program after breast cancer: effects on quality of life. J Clin Oncol 14 (10): 2747-55, 1996. [PUBMED Abstract]
- McLachlan SA, Allenby A, Matthews J, et al.: Randomized trial of coordinated psychosocial interventions based on patient self-assessments versus standard care to improve the psychosocial functioning of patients with cancer. J Clin Oncol 19 (21): 4117-25, 2001. [PUBMED Abstract]
- Carlson LE, Groff SL, Maciejewski O, et al.: Screening for distress in lung and breast cancer outpatients: a randomized controlled trial. J Clin Oncol 28 (33): 4884-91, 2010. [PUBMED Abstract]
- Carlson LE, Waller A, Groff SL, et al.: Online screening for distress, the 6th vital sign, in newly diagnosed oncology outpatients: randomised controlled trial of computerised vs personalised triage. Br J Cancer 107 (4): 617-25, 2012. [PUBMED Abstract]
- Zung WW: Depression in the normal aged. Psychosomatics 8 (5): 287-92, 1967 Sep-Oct. [PUBMED Abstract]
- Zung WW: Factors influencing the self-rating depression scale. Arch Gen Psychiatry 16 (5): 543-7, 1967. [PUBMED Abstract]
- Kirsh KL, Passik S, Holtsclaw E, et al.: I get tired for no reason: a single item screening for cancer-related fatigue. J Pain Symptom Manage 22 (5): 931-7, 2001. [PUBMED Abstract]
Adaptación normal
La adaptación, el bienestar o la adaptación psicosocial al cáncer se definió [1-3] como un proceso constante en el que cada paciente trata de hacer lo siguiente:
- Abordar el sufrimiento emocional.
- Solucionar problemas específicos relacionados con el cáncer.
- Lograr dominar o controlar los acontecimientos vitales relacionados con el cáncer.
La adaptación al cáncer no es una situación unitaria y simple sino, más bien, una serie de respuestas constantes para enfrentar las muchas tareas que impone el hecho de vivir con cáncer. Los pacientes se enfrentan con muchos retos que varían según la evolución clínica de la enfermedad. Los períodos comunes de crisis y reto significativo son los siguientes:
- Diagnóstico inicial.
- Tratamiento activo (por ejemplo, cirugía, radiación o quimioterapia).
- Postratamiento y remisión.
- Recidiva.
- Conclusión del tratamiento curativo.
- Supervivencia a largo plazo.
Cada una de estas situaciones en ocasiones supone retos como los siguientes:
- Ciertas tareas para enfrentar situaciones difíciles.
- Preguntas existenciales particulares.
- Respuestas emocionales comunes.
- Problemas específicos.
La adaptación normal o exitosa se produce en pacientes capaces de reducir a un mínimo las perturbaciones de las tareas vitales, regular el sufrimiento emocional y continuar participando de forma activa en los aspectos de la vida que tienen significado e importancia.
La adaptación a situaciones difíciles se refiere a los pensamientos y comportamientos específicos que un paciente utiliza para ajustarse al cáncer.[2] Una teoría cognitiva de la adaptación a situaciones difíciles [4] propone que, en respuesta a acontecimientos vitales significativos, la persona se formula dos preguntas importantes:
- ¿Esta situación es personalmente significativa para mí?
- ¿Qué recursos tengo para manejar o controlar esta situación?
Un grado bajo de sufrimiento es el resultado de percibir que las demandas de una situación son bajas o que los recursos individuales son considerables.[5] Por lo tanto, para disminuir los niveles de sufrimiento, las demandas percibidas de una situación se deben reducir o bien los recursos percibidos deben aumentar.
Las estrategias de adaptación a situaciones difíciles se refieren a actividades cognitivas y conductuales específicas para las que se utilizan esfuerzos de adaptación acordes con la situación; por ejemplo, reajustar la rutina diaria o el horario de trabajo para amoldarse a los efectos secundarios del tratamiento de cáncer. Entre muchas estrategias de excelentes resultados para enfrentar dificultades, se indicaron tres categorías amplias:[2,6,7]
- Estrategias enfocadas en los problemas. Ayudan a los pacientes a abordar problemas específicos, para lo cual tratan de modificar directamente situaciones problemáticas. Algunos de estos enfoques son adaptativos (por ejemplo, buscar información sobre las tasas de supervivencia de una opción de tratamiento), pero otros no (por ejemplo, pago de grandes sumas de dinero por opciones de tratamiento no aprobadas).[8]
- Estrategias enfocadas en las emociones. Permiten a los pacientes regular su grado de sufrimiento emocional con conductas que apelan a las emociones (por ejemplo, buscar apoyo social) o con conductas evasivas, cuando la persona procura huir de los recordatorios de la causa de sufrimiento (por ejemplo, no buscar tratamiento después de un diagnóstico, consumir bebidas alcohólicas u otras drogas).
- Estrategias enfocadas en el significado. Ayudan a los pacientes a entender por qué ha sucedido determinado evento, así como el efecto que el cáncer tendrá en su vida. En general, las personas que se adaptan bien suelen continuar comprometidas y participan activamente en el proceso de hacer frente al cáncer, y siguen encontrando sentido e importancia en sus vidas. Las personas que no se adaptan bien a menudo desisten, se desconectan y se sienten desesperanzadas. Por ende, evaluar el grado de compromiso versus renunciar a este quizás sea una manera de distinguir la adaptación exitosa de la adaptación insatisfactoria.
Los pacientes pueden alternar entre estas estrategias, incluso de adaptación a inadaptación, según sus niveles de funcionamiento actual.
El estilo de enfrentar situaciones difíciles se refiere al uso más común, más frecuente y más duradero de una serie de estrategias para enfrentarlas a las que tiende a recurrir una persona en diversas situaciones de vida (por ejemplo, consumo de bebidas alcohólicas, búsqueda de apoyo social, uso de recursos religiosos o de espiritualidad). Con frecuencia, el estilo de enfrentar situaciones difíciles se relaciona de modo estrecho con la disposición general y la personalidad (por ejemplo, optimismo, pesimismo, introversión, extraversión).[9]
Una de las críticas de la bibliografía se enfoca en la suposición de que hacer frente al cáncer es una situación unitaria y simple. En realidad, el hacer frente al cáncer impone estilos y estrategias que en ocasiones varían dependiendo de la naturaleza de los factores estresantes enfrentados. Por ejemplo, en un estudio de 52 adultos que recibían cuidados paliativos para el cáncer,[10] los pacientes participaron en una entrevista semiestructurada en la que se les preguntó cómo lidiaban con los factores estresantes más importantes. Los resultados indicaron que la mayoría de los participantes utilizaban una variedad de estrategias para hacer frente a la dificultad; sin embargo, había interacciones entre los dominios de los factores estresantes (existenciales, psicosociales, físicos) y las categorías de respuesta (enfocada en los problemas, enfocadas en las emociones, evitación de las emociones). Las estrategias enfocadas en los problemas se usaron con menos frecuencia para enfrentar los factores estresantes existenciales, mientras que las estrategias enfocadas en las emociones se utilizaron con menos frecuencia para los factores estresantes físicos.[10]
Factores generales que influyen en la adaptación
A pesar de que hay algunos factores comunes en la adaptación normal a los factores estresantes del cáncer, también son muchas las diferencias individuales. Es difícil predecir la manera en que una determinada persona enfrentará el cáncer, por lo que es importante reconocer los factores que influyen en la adaptación a esta enfermedad. En un estudio de mujeres con cáncer de mama en estadio II o III,[11] se notificó que los grados más altos de estrés (tanto los factores estresantes oncológicos como no oncológicos) medidos en el momento del diagnóstico y, de nuevo, después de la cirugía pronosticaron una calidad de vida psicológica y física más baja.
En otro estudio, se evaluó a mujeres con cáncer de mama en estadios 0 a III (N = 89) en 3 momentos específicos: durante el tratamiento, 3 semanas después de terminado el tratamiento y 3 meses después de terminado el tratamiento. La mayoría de las sobrevivientes exhibieron una buena adaptación en los índices de sufrimiento general. Los factores que pronosticaron sufrimiento continuo incluyeron una edad temprana, antecedentes de depresión o ansiedad, y tratamientos más exhaustivos.[12]
Se determinó que el ajuste o la adaptación psicosocial están influidos por las siguientes tres categorías amplias de factores: derivados del cáncer, derivados del paciente y derivados de la sociedad.[3]
Los rasgos de personalidad de optimismo y pesimismo podrían desempeñar una función crucial en el bienestar psicológico de los pacientes con cáncer. En un estudio alemán se investigó el efecto del optimismo y el pesimismo en el bienestar psicológico de 161 pacientes que recibieron diagnósticos de distintos cánceres.[13] Se evaluó a los pacientes con respecto al optimismo o el pesimismo, así como las emociones positivas o negativas antes de su primera sesión de quimioterapia y durante el seguimiento realizado a los 9 meses. Antes del comienzo de la quimioterapia, el bienestar psicológico se relacionó con mayor optimismo y menor pesimismo. En el seguimiento a los 9 meses, el pesimismo predijo cambios negativos en el bienestar psicológico, así como experiencias acentuadas de efectos secundarios relacionados con la quimioterapia.
Se encontró que la disponibilidad de apoyo social se relaciona con la mortalidad por cáncer de mama. En un estudio longitudinal de 2835 enfermeras con cáncer de mama, aquellas que informaron no haber tenido relaciones personales cercana antes del diagnóstico (por ejemplo, familiares, amigos o hijos vivos) tuvieron un riesgo de mortalidad por cáncer de mama 2 veces más alto que aquellas que tenían más contactos sociales (por ejemplo, 10 o más familiares cercanos).[14]
Influencias de una situación específica en la adaptación
Escuchar el diagnóstico
El proceso de adaptarse al cáncer puede comenzar incluso antes del diagnóstico. Los pacientes pueden responder con grados normales de miedo, inquietud y preocupación cuando tienen síntomas inexplicados o cuando se dan cuenta de que son sometidos a pruebas para determinar la presencia de cáncer. Cuando escuchan el diagnóstico, sus miedos se tornan realidad, con lo cual se genera una situación psicológica y existencial difícil (crisis).[15] Debido al efecto que la agudización del sufrimiento (producto de la adaptación al cáncer) puede tener en la atención y el procesamiento cognitivo, la comunicación con los pacientes sobre el diagnóstico de cáncer en ocasiones se ve afectada. [16] Durante este período, a veces resulta beneficioso un apoyo profesional adicional para considerar problemas como la fatiga, el insomnio y la depresión que se relacionan con la adaptación al cáncer y que también es posible que afecten las interacciones entre el paciente y el proveedor, además de la calidad de vida.[17] Para obtener más información, consultar Comunicación en la atención del cáncer.
Tratamiento activo
La adaptación a largo plazo se produce en el transcurso un período prolongado en el que aparece una adaptación más duradera y permanente al cáncer. Durante este período de semanas y meses el paciente usa una variedad de estrategias y estilos para enfrentar las dificultades. Esta combinación de estilos duraderos para enfrentar la adversidad y estrategias de adaptación a corto plazo suelen ser útiles para los pacientes que hacen esfuerzos por adaptarse al cáncer.[18] Las diferencias individuales dan lugar a toda una variedad de estilos y estrategias para enfrentar una situación difícil, tanto adaptativos como inadaptados.[19] En cuanto a las características clínicas, los pacientes con más comorbilidades, un estado funcional más bajo o un diagnóstico de depresión o dolor de espalda autonotificado quizás tengan más probabilidad de presentar ansiedad de importancia clínica durante el tratamiento de quimioterapia que los pacientes que no tienen dichas características clínicas.[20][Nivel de evidencia: II]
Remisión posterior al tratamiento
La finalización del tratamiento activo puede provocar ambivalencia para los pacientes de cáncer y sus familias. La finalización del tratamiento activo puede ser un momento de acentuación del sufrimiento [21] y un sentido renovado de vulnerabilidad que surge con la interrupción de las esfuerzos médicos activos para luchar contra la enfermedad, disminución de la frecuencia de los controles, y pérdida del contacto o el apoyo frecuentes del equipo médico.[22]
Otros aspectos de la adaptación incluyen vivir con incertidumbre, reasumir las funciones vitales previas y prestar extrema atención a las preocupaciones por la salud; en especial, si perduran los efectos cognitivos o físicos del cáncer o el tratamiento.[23]
La ansiedad y la preocupación normales a menudo se intensifican a medida que se acercan las visitas de seguimiento. Se genera una ansiedad normal en torno a la preocupación por una recidiva y las consecuencias emocionales relacionadas (por ejemplo, retomar el papel de paciente y sensaciones renovadas de pérdida de control). Muchos pacientes consideran que la espera de los resultados de los exámenes es una experiencia particularmente angustiante.
Para la mayoría de las personas, esta intensificación normal del sufrimiento después del tratamiento parece ser temporario y se resuelve en el lapso de unas cuantas semanas. En un estudio empírico sobre la adaptación posterior al tratamiento, se evaluó a 94 mujeres con cáncer de mama en estadios 0, l, ll o lll que estaban por terminar su tratamiento con radioterapia, según mediciones de depresión, ansiedad y calidad de vida en el último día de tratamiento, y luego, 2 semanas, 4 a 6 semanas, y a los 3 y 6 meses después del tratamiento. Los resultados indicaron síntomas de depresión elevados, ansiedad de intensidad baja y disminución de la calidad de vida el último día de tratamiento; sin embargo, 2 semanas después, los síntomas de depresión y la calidad de vida mejoraron mucho.[24]
Recidiva
La recidiva del cáncer después del tratamiento puede intensificar el estrés en los pacientes y quizás estimule a los proveedores a evaluar el sufrimiento psicosocial. En un estudio de mujeres con cáncer de mama recidivante, se identificaron alteraciones importantes en el bienestar físico, funcional y emocional en un lapso de un mes después de presentarse la recidiva; sin embargo, los siguientes factores tuvieron un efecto positivo en la calidad de vida:[25]
- Autosuficiencia de la paciente (confianza en su capacidad para manejar las demandas de la enfermedad).
- Apoyo social.
- Fortaleza familiar (fortaleza interior de la familia y capacidad de manejar el infortunio y el cambio).
Por el contrario, los siguientes factores se relacionaron con una calidad de vida más baja:[25]
- Más sufrimiento en relación con los síntomas físicos.
- Preocupaciones cotidianas adicionales.
- Sensación de desesperanza.
- Una percepción negativa de la enfermedad o de las personas que brindan atención.
El paciente que se adapta con éxito a la crisis de recidiva a menudo cambia expectativas y mantiene la esperanza con una cantidad de actividades vitales significativas. Por ejemplo, un paciente que cree que el dolor y el sufrimiento se pueden controlar tendrá esperanza en su futura calidad de vida. La religión y la espiritualidad también desempeñan una función importante para ayudar a muchos pacientes a mantener la calidad de vida mental y física. Los proveedores tal vez deseen evaluar la salud espiritual en este estadio del cáncer, a fin de realizar las derivaciones adecuadas.[26,27] Para obtener más información, consultar La espiritualidad en el tratamiento del cáncer.
Cáncer avanzado y tratamiento no curativo
Los pacientes con cáncer avanzado en ocasiones presentan sufrimiento psicológico, síntomas físicos y una crisis existencial ante la muerte; cuando todo esto se combina da como resultado el sufrimiento intenso.[28] En un metanálisis se analizaron las variables de salud mental en 24 estudios de trastornos del estado de ánimo en entornos de cuidados paliativos en 7 países con más de 4000 pacientes.[29] Los diagnósticos en todos los estudios se realizaron conforme a los criterios del Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM) o la Clasificación Estadística Internacional de Enfermedades y Problemas Relacionados con la Salud (CIE). En este metanálisis se estableció que si bien los trastornos del estado de ánimo y la ansiedad prevalecían en el entorno de cuidados paliativos —aunque deberían examinarse y tratarse en cualquier entorno— también es normal que los pacientes no presenten problemas de salud mental durante el tratamiento de cuidados paliativos. En el metanálisis se encontraron trastornos del estado de ánimo o depresión importantes en 24,6 % de la población tratada con cuidados paliativos y alguna forma de trastorno de ansiedad en 9,8 % de los pacientes. En 24,7 % de los pacientes se observaron formas más leves de preocupaciones en torno a la salud mental, como un trastorno de adaptación (con ansiedad o características depresivas).[29] Para obtener más información, consultar Depresión y Estrés postraumático relacionado con el cáncer.
Es posible que una de las razones de sufrimiento psicosocial tenga que ver con cómo el paciente con cáncer avanzado percibe su pronóstico. En un estudio transversal descriptivo de 559 pacientes con cáncer incurable, los pacientes completaron el Prognosis and Treatment Perception Questionnaire y la Hospital Anxiety and Depression Scale (HADS).[30][Nivel de evidencia: II] Los autores definieron los síntomas de depresión y ansiedad como clínicamente significativos cuando el puntaje en la subescala HADS de depresión y ansiedad era mayor de 7. Entre los hallazgos se incluyen los siguientes:
- Alrededor del 62 % de los participantes notificó que sus objetivos de tratamiento, al igual que los de su oncólogo, no eran curativos. De estos participantes, el 27 % notificó depresión y el 32 % ansiedad.
- El 19 % de los participantes notificó que sus objetivos de tratamiento, al igual que los de su oncólogo, eran curativos. En este grupo, el 19 % notificó depresión y el 23 % ansiedad.
- El 14 % de los participantes notificó que sus objetivos de tratamiento eran curativos mientras que los de su oncólogo no lo eran. En este grupo, el 27 % notificó depresión y el 37 % ansiedad.
- El 5 % de los participantes notificó que su objetivo no era curativo mientras que el del oncólogo sí lo era. En este grupo, el 21 % notificó depresión y el 39 % ansiedad.
Los hallazgos de este estudio indican que es posible que el paciente cuyo objetivo de tratamiento es diferente al de su oncólogo tenga más probabilidades de presentar ansiedad. Una limitación importante de este estudio es que los autores no evaluaron los objetivos de tratamiento de los oncólogos ni el estado del tratamiento del paciente. Además, el estudio se hizo en un solo centro oncológico y en la muestra predominó la población blanca, no hispana. Sin embargo, los hallazgos resaltan la importancia de la comunicación centrada en el paciente y el apoyo psicosocial, en particular cuando se conversa sobre los objetivos del tratamiento. Para obtener más información, consultar Comunicación en la atención del cáncer.
Supervivencia a largo plazo
La adaptación a la supervivencia a largo plazo después del tratamiento es gradual y se extiende durante muchos años. No obstante, la mayoría de los pacientes, a pesar de la variedad de diagnósticos y tratamientos del cáncer, se adaptan bien y algunos informan incluso sobre los beneficios de un diagnóstico de cáncer (por ejemplo, mayor aprecio por la vida, nueva priorización de los valores vitales, fortalecimiento de las creencias espirituales o religiosas).[31-34] Los pacientes que tienen una adaptación más precaria tienden a presentar las siguientes características:
- Mayores problemas médicos.
- Menos apoyo social.
- Adaptación psicológica premórbida más precaria.
- Menos recursos económicos.
En general, en los estudios sobre sobrevivientes de cáncer y grupos de comparación sanos no se encontraron diferencias significativas en las medidas de sufrimiento psicológico, adaptación marital y sexual, funcionamiento social y desempeño psicosocial general.
No obstante, muchos sobrevivientes de cáncer presentan algunas áreas comunes de sufrimiento que están por debajo del umbral o no son lo suficientemente graves como para satisfacer los criterios diagnósticos; por ejemplo:[35]
- Ansiedad sobre la recidiva.
- Aumento de la sensación de vulnerabilidad.
- Disminución de la sensación de control.
- Recuerdos condicionados de la quimioterapia (olores, imágenes visuales) que producen ansiedad y náuseas.
- Síntomas parecidos a los del estrés postraumático (como pensamientos persistentes molestos o imágenes recurrentes relacionadas con el cáncer).
- Cansancio.
- Preocupaciones sobre la imagen corporal y la sexualidad.
En una evaluación de más de 6000 sobrevivientes de cáncer, se estableció que más del 50 % notificaron temer una recidiva, en su mayoría de baja intensidad. Los sobrevivientes en riesgo de padecer niveles altos de miedo a una recidiva eran sobrevivientes mujeres, personas menores de 59 años, los que habían pasado entre 5 a 7 años después del diagnóstico, los aislados socialmente, los que tenían niveles educativos más bajos y las personas con antecedentes de metástasis o recidiva.[36]
En uno de los pocos estudios longitudinales prospectivos de sobrevivientes de cáncer, se preguntó a 752 pacientes de 3 estados de los Estados Unidos sobre una variedad de problemas psicosociales. Casi un año después del diagnóstico, el 68 % temía que su enfermedad regresara, aproximadamente el 60 % estaban preocupados por las recidivas y el 58 % tenían miedo al futuro. Además, aproximadamente dos de cada tres sobrevivientes estaban preocupados por un problema físico de salud, como la fatiga y la pérdida de fuerza. Aproximadamente el 48 % informaron problemas para dormir y el 41 % informaron tener preocupaciones sobre la disfunción sexual. Los sobrevivientes que eran más jóvenes (de 18 a 54 años), las mujeres, las personas que no son blancos, las personas solteras y aquellas con ingresos más bajos notificaron más problemas. En comparaciones de cuatro de los cánceres comunes, la mayoría de las preocupaciones relacionadas con problemas vitales fueron mencionadas por aquellos con cáncer de pulmón, seguidos de los sobrevivientes de cánceres de mama, colorrectal y de próstata.[37]
Durante la supervivencia, la derivación a los servicios de psicooncología a veces es beneficioso para los pacientes. En un estudio prospectivo observacional de 243 adultos sobrevivientes de cáncer que se derivaron a los servicios de psicooncología se evaluó el efecto de 1 o 2 citas con farmacoterapia o psicoterapia sobre la depresión y el sufrimiento.[38][Nivel de evidencia: II] Las citas de los pacientes se hicieron en un promedio de 2,5 años desde el diagnóstico. La depresión se midió mediante el Patient Health Questionnaire (PHQ-9) y el sufrimiento, mediante el Distress Thermometer. Los puntajes de depresión y sufrimiento de los pacientes fueron significativamente más bajos en la segunda cita que en la cita de referencia. Las diferencias en los puntajes fueron de importancia clínica y no variaron según el tipo de profesional clínico (prescriptor o no prescriptor).
Las intervenciones multifocales quizás ayuden a los sobrevivientes de cáncer a abordar diferentes problemas de salud física y mental de manera simultánea. En un ensayo multicéntrico con 222 sobrevivientes de cáncer de mama que habían recibido tratamiento, los investigadores pusieron en práctica la intervención utilizada en el Better Exercise Adherence after Treatment for Cancer (BEAT Cancer). En este estudio, durante 3 meses, los pacientes se comprometieron a realizar 12 sesiones de ejercicio supervisado que se redujeron a un programa de ejercicio en el hogar sin supervisión (aunque se registraron con un monitor de frecuencia cardíaca), sesiones de asesoramiento individual y asesoramiento grupal. Estas sesiones fomentaron el ejercicio regular, promovieron el autocontrol e incorporaron el replantamiento cognitivo de las limitaciones físicas actuales de los pacientes , lo que tuvo un impacto positivo importante sobre la imagen corporal, estado de ánimo, entrenamiento cardiovascular y calidad de vida en general.[39]
En un estudio longitudinal grande (N = 660) de mujeres mayores de 65 años sobrevivientes de cáncer de mama, se investigaron los factores relacionados con cambios en el bienestar emocional. Los hallazgos generales indicaron que la experiencia de sobrevivir a 5 años para la mayoría de las mujeres fue relativamente estable, con pocos cambios en el bienestar emocional. Sin embargo, las mujeres que tenían menos de 12 años de educación formal y las mujeres que percibían que no se habían curado tenían más probabilidades de presentar declives en el bienestar emocional. Por contra, aquellas que tenían mejor funcionamiento físico, buen apoyo emocional y percepción positiva de la comunicación médico-paciente tenían menos probabilidades de presentar salud emocional precaria.[40]
Bibliografía
- Brennan J: Adjustment to cancer - coping or personal transition? Psychooncology 10 (1): 1-18, 2001 Jan-Feb. [PUBMED Abstract]
- Folkman S, Greer S: Promoting psychological well-being in the face of serious illness: when theory, research and practice inform each other. Psychooncology 9 (1): 11-9, 2000 Jan-Feb. [PUBMED Abstract]
- Nicholas DR, Veach TA: The psychosocial assessment of the adult cancer patient. Prof Psychol 31 (2): 206-15, 2000.
- Lazarus RS, Folkman S: Stress, Appraisal, and Coping. Springer Publishing Co, 1984.
- American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders: DSM-5. 5th ed. American Psychiatric Association, 2013.
- Pearlin LI, Schooler C: The structure of coping. J Health Soc Behav 19 (1): 2-21, 1978. [PUBMED Abstract]
- Ahmad MM, Musil CM, Zauszniewski JA, et al.: Prostate cancer: appraisal, coping, and health status. J Gerontol Nurs 31 (10): 34-43, 2005. [PUBMED Abstract]
- Ransom S, Jacobsen PB, Schmidt JE, et al.: Relationship of problem-focused coping strategies to changes in quality of life following treatment for early stage breast cancer. J Pain Symptom Manage 30 (3): 243-53, 2005. [PUBMED Abstract]
- Schou I, Ekeberg Ø, Ruland CM, et al.: Pessimism as a predictor of emotional morbidity one year following breast cancer surgery. Psychooncology 13 (5): 309-20, 2004. [PUBMED Abstract]
- De Faye BJ, Wilson KG, Chater S, et al.: Stress and coping with advanced cancer. Palliat Support Care 4 (3): 239-49, 2006. [PUBMED Abstract]
- Golden-Kreutz DM, Thornton LM, Wells-Di Gregorio S, et al.: Traumatic stress, perceived global stress, and life events: prospectively predicting quality of life in breast cancer patients. Health Psychol 24 (3): 288-96, 2005. [PUBMED Abstract]
- Costanzo ES, Lutgendorf SK, Mattes ML, et al.: Adjusting to life after treatment: distress and quality of life following treatment for breast cancer. Br J Cancer 97 (12): 1625-31, 2007. [PUBMED Abstract]
- Pinquart M, Fröhlich C, Silbereisen RK: Optimism, pessimism, and change of psychological well-being in cancer patients. Psychol Health Med 12 (4): 421-32, 2007. [PUBMED Abstract]
- Kroenke CH, Kubzansky LD, Schernhammer ES, et al.: Social networks, social support, and survival after breast cancer diagnosis. J Clin Oncol 24 (7): 1105-11, 2006. [PUBMED Abstract]
- Weisman AD, Worden JW: The existential plight in cancer: significance of the first 100 days. Int J Psychiatry Med 7 (1): 1-15, 1976-77. [PUBMED Abstract]
- Bishop SJ: Trait anxiety and impoverished prefrontal control of attention. Nat Neurosci 12 (1): 92-8, 2009. [PUBMED Abstract]
- Visser MR, van Lanschot JJ, van der Velden J, et al.: Quality of life in newly diagnosed cancer patients waiting for surgery is seriously impaired. J Surg Oncol 93 (7): 571-7, 2006. [PUBMED Abstract]
- Paek MS, Ip EH, Levine B, et al.: Longitudinal Reciprocal Relationships Between Quality of Life and Coping Strategies Among Women with Breast Cancer. Ann Behav Med 50 (5): 775-783, 2016. [PUBMED Abstract]
- Bryant AL, Smith SK, Zimmer C, et al.: An exploratory path model of the relationships between positive and negative adaptation to cancer on quality of life among non-Hodgkin lymphoma survivors. J Psychosoc Oncol 33 (3): 310-31, 2015. [PUBMED Abstract]
- Oppegaard K, Harris CS, Shin J, et al.: Anxiety profiles are associated with stress, resilience and symptom severity in outpatients receiving chemotherapy. Support Care Cancer 29 (12): 7825-7836, 2021. [PUBMED Abstract]
- Henselmans I, Helgeson VS, Seltman H, et al.: Identification and prediction of distress trajectories in the first year after a breast cancer diagnosis. Health Psychol 29 (2): 160-8, 2010. [PUBMED Abstract]
- Sherman AC, Simonton S: Family therapy for cancer patients: clinical issues and interventions. The Family Journal: Counseling and Therapy for Couples and Families 7 (1): 39-50, 1999.
- Helgeson VS, Snyder P, Seltman H: Psychological and physical adjustment to breast cancer over 4 years: identifying distinct trajectories of change. Health Psychol 23 (1): 3-15, 2004. [PUBMED Abstract]
- Deshields T, Tibbs T, Fan MY, et al.: Ending treatment: the course of emotional adjustment and quality of life among breast cancer survivors immediately following radiation therapy. Support Care Cancer 13 (12): 1018-26, 2005. [PUBMED Abstract]
- Northouse LL, Mood D, Kershaw T, et al.: Quality of life of women with recurrent breast cancer and their family members. J Clin Oncol 20 (19): 4050-64, 2002. [PUBMED Abstract]
- Kristeller JL, Rhodes M, Cripe LD, et al.: Oncologist Assisted Spiritual Intervention Study (OASIS): patient acceptability and initial evidence of effects. Int J Psychiatry Med 35 (4): 329-47, 2005. [PUBMED Abstract]
- Ray A, Block SD, Friedlander RJ, et al.: Peaceful awareness in patients with advanced cancer. J Palliat Med 9 (6): 1359-68, 2006. [PUBMED Abstract]
- Cherny NI, Coyle N, Foley KM: Suffering in the advanced cancer patient: a definition and taxonomy. J Palliat Care 10 (2): 57-70, 1994 Summer. [PUBMED Abstract]
- Mitchell AJ, Chan M, Bhatti H, et al.: Prevalence of depression, anxiety, and adjustment disorder in oncological, haematological, and palliative-care settings: a meta-analysis of 94 interview-based studies. Lancet Oncol 12 (2): 160-74, 2011. [PUBMED Abstract]
- El-Jawahri A, Forst D, Fenech A, et al.: Relationship Between Perceptions of Treatment Goals and Psychological Distress in Patients With Advanced Cancer. J Natl Compr Canc Netw 18 (7): 849-855, 2020. [PUBMED Abstract]
- Polinsky ML: Functional status of long-term breast cancer survivors: demonstrating chronicity. Health Soc Work 19 (3): 165-73, 1994. [PUBMED Abstract]
- Curbow B, Somerfield MR, Baker F, et al.: Personal changes, dispositional optimism, and psychological adjustment to bone marrow transplantation. J Behav Med 16 (5): 423-43, 1993. [PUBMED Abstract]
- Belec RH: Quality of life: perceptions of long-term survivors of bone marrow transplantation. Oncol Nurs Forum 19 (1): 31-7, 1992 Jan-Feb. [PUBMED Abstract]
- Tartaro J, Roberts J, Nosarti C, et al.: Who benefits?: distress, adjustment and benefit-finding among breast cancer survivors. J Psychosoc Oncol 23 (2-3): 45-64, 2005. [PUBMED Abstract]
- Smith MY, Redd WH, Peyser C, et al.: Post-traumatic stress disorder in cancer: a review. Psychooncology 8 (6): 521-37, 1999 Nov-Dec. [PUBMED Abstract]
- Koch-Gallenkamp L, Bertram H, Eberle A, et al.: Fear of recurrence in long-term cancer survivors-Do cancer type, sex, time since diagnosis, and social support matter? Health Psychol 35 (12): 1329-1333, 2016. [PUBMED Abstract]
- Baker F, Denniston M, Smith T, et al.: Adult cancer survivors: how are they faring? Cancer 104 (11 Suppl): 2565-76, 2005. [PUBMED Abstract]
- Molinaro J, Banerjee A, Lyndon S, et al.: Reducing distress and depression in cancer patients during survivorship. Psychooncology 30 (6): 962-969, 2021. [PUBMED Abstract]
- Rogers LQ, Courneya KS, Anton PM, et al.: Effects of a multicomponent physical activity behavior change intervention on fatigue, anxiety, and depressive symptomatology in breast cancer survivors: randomized trial. Psychooncology 26 (11): 1901-1906, 2017. [PUBMED Abstract]
- Clough-Gorr KM, Ganz PA, Silliman RA: Older breast cancer survivors: factors associated with change in emotional well-being. J Clin Oncol 25 (11): 1334-40, 2007. [PUBMED Abstract]
Sufrimiento psicosocial
El sufrimiento de los pacientes con cáncer se definió como “una experiencia multifactorial desagradable de naturaleza psicológica (es decir, cognitiva, conductual, emocional), social, espiritual o física que a veces interfiere con la capacidad para enfrentar eficientemente el cáncer, sus síntomas físicos y su tratamiento. El sufrimiento se extiende a lo largo de un continuo que va desde los sentimientos normales comunes de vulnerabilidad, tristeza y temor hasta problemas que se pueden tornar incapacitantes, como la depresión, la ansiedad, el pánico, el aislamiento social, y la crisis existencial y espiritual”.[1] Para la atención del sufrimiento psicosocial se determinaron normas asistenciales.[2]
La National Comprehensive Cancer Network (NCCN) tiene la meta amplia de establecer normas de atención de manera que todos los pacientes que presentan sufrimiento psicosocial se identifiquen, reconozcan y traten de forma precisa y rutinaria en todos los estadios de la enfermedad.[1] Las pautas de la NCCN incluyen recomendaciones sobre los siguientes aspectos:
- Exámenes de detección.
- Priorización.
- Evaluación inicial.
También se incluyen recomendaciones para la derivación y el tratamiento para cada profesión participante:
- Salud mental (psicología y psiquiatría).
- Trabajo social.
- Cuidados paliativos.
- Atención pastoral.
El sufrimiento y la necesidad de su detección es más probable que se presente en los siguientes períodos:
- Enseguida después del diagnóstico.
- Al comienzo del tratamiento (cirugía, radiación, quimioterapia).
- Al final de un ciclo largo de tratamiento.
- Periódicamente, durante el postratamiento y la remisión.
- En el momento de la recidiva.
- En la transición a los cuidados paliativos.
Para obtener más información, consultar la sección Aspectos generales.
Intervenciones psicosociales para el sufrimiento
Gran cantidad de bibliografía médica respalda la eficacia de las intervenciones psicosociales para pacientes adultos con cáncer.[3][Nivel de evidencia: IV];[4-6][Nivel de evidencia: I] En general, en las revisiones se concluyó que las intervenciones psicosociales para los pacientes de cáncer mostraron beneficios.
Las intervenciones psicosociales generalmente se definieron como intervenciones no farmacológicas con una variedad de componentes psicológicos y educativos, como los siguientes:
- Entrenamiento para la relajación.
- Estrategias cognitivas y conductuales para enfrentar situaciones difíciles.
- Sesiones de educación o información sobre el cáncer.
- Terapia existencial.
- Apoyo social grupal.
Las intervenciones han incluido varias combinaciones de estos componentes, con duración diferente (desde una sola sesión a múltiples sesiones semanales) y se han administrado tanto en formato individual como grupal. La población más común de pacientes ha sido la de mujeres blancas estadounidenses de condición socioeconómica media o alta con cáncer de mama; no obstante, en varios estudios, algunos de países europeos, se incorporan diagnósticos desiguales de cáncer.[3] Las mediciones de los resultados variaron entre los estudios e incluyeron los siguientes aspectos:[3,4]
- Adaptación emocional (por ejemplo, depresión, ansiedad).
- Compromiso funcional (por ejemplo, retorno al trabajo, funciones sociales).
- Síntomas relacionados con la enfermedad (por ejemplo, náuseas y vómitos, fatiga, dolor).
- Conductas de salud (por ejemplo, régimen alimentario, consumo de tabaco, ejercicio).
- Funcionamiento del sistema inmunitario.
Gran parte de esta investigación ha estado orientada por un modelo bioconductual [3] que se basa en la hipótesis de vías psicológicas, conductuales y biológicas a partir de los factores estresantes del cáncer hasta el desenlace de la enfermedad; sin embargo, el resultado medido con mayor frecuencia ha sido la adaptación emocional.
Si bien se encontraron beneficios de las intervenciones psicosociales, se cuestionó su importancia clínica. Los revisores ofrecieron conclusiones variadas sobre la dimensión de los beneficios positivos,[4][Nivel de evidencia: I] que van desde insignificantes para la depresión, hasta pequeños en cuanto a los resultados emocionales generales y moderados en relación con la ansiedad.[5][Nivel de evidencia: I]
Las dimensiones de los efectos se pueden relacionar con el momento apropiado en que se realiza la intervención y los procedimientos para la selección de pacientes. En el caso de muchos pacientes, los grados de sufrimiento psicosocial son más altos durante los primeros días de su experiencia con el cáncer y se disipan rápidamente. Si las intervenciones se ofrecen semanas o meses después del diagnóstico y el tratamiento, es posible que los pacientes tengan menos sufrimiento que si las intervenciones se hubiesen ofrecido más temprano, con lo cual es más difícil detectar los efectos más importantes.[7][Nivel de evidencia: II]
En un estudio,[8] se asignó al azar a 249 díadas de pacientes de cáncer de mama y sus parejas a uno de los cuatro grupos siguientes:
- Un grupo de control que recibió un tratamiento estándar para la enfermedad.
- Un grupo de psicoeducación estandarizada.
- Un grupo que recibió orientación por teléfono.
- Un grupo que recibió psicoeducación y orientación por teléfono.
Los pacientes y las parejas que recibieron las intervenciones del estudio presentaron menos sufrimiento y gravedad como efecto secundario, así como grados más altos de bienestar psicológico que aquellos que recibieron atención estándar. Además, para lograr estos beneficios físicos y psicológicos, los resultados del estudio apoyaron la eficacia de las intervenciones de bajo costo que se pueden reproducir mediante video y por teléfono.[8]
En dos metanálisis, [4,5][Nivel de evidencia: I] se notificaron las siguientes dimensiones de efectos:
Estas dimensiones de los beneficios indican que el paciente promedio que recibe la intervención está mejor que el 57 % al 65 % de los que no reciben la intervención.
En resumen, parece que cuando se ofrecen intervenciones psicosociales a los pacientes que presentan sufrimiento (por ejemplo, ansiedad, depresión), la eficacia de la intervención es muy sólida. Así, el beneficio general de las intervenciones psicosociales aparenta ser mayor para quienes parecen necesitarlo más.[4,5]
Ensayo aleatorizado de intervenciones grupales para cáncer de mama
En ensayos clínicos aleatorizados se evaluó la eficacia de las intervenciones psicosociales en grupos pequeños para mujeres estadounidenses con cáncer de mama en estadio temprano. Estos estudios variaban en relación con el período total de tratamiento, de 8 [9][Nivel de evidencia: I] a 20 horas,[7,10][Nivel de evidencia: II] hasta 27 horas,[11][Nivel de evidencia: I] e incluyen una variedad de componentes en las intervenciones. Para obtener más información, consultar la sección Orientación grupal.
En un estudio, los investigadores evaluaron una intervención educativa que consistió en sesiones grupales mensuales de 2 horas en un lapso de 4 meses consecutivos.[9][Nivel de evidencia: I] Las participantes fueron 252 mujeres menores de 50 años con cáncer de mama en estadio temprano. Todas habían finalizado el tratamiento adyuvante sin hormonas recientemente y enfrentaban la transición del tratamiento activo a la supervivencia posterior al tratamiento. Se asignaron al azar a uno de los tres grupos siguientes:
- Grupo de atención médica estándar.
- Grupo de educación nutricional.
- Grupo de educación psicosocial.
En los grupos de educación psicosocial y nutricional se incluyeron diseminación de información, discusiones, y algunas actividades o ejercicios. Los temas rotaron mensualmente y las participantes podían integrarse en un grupo en cualquier momento (es decir, los grupos eran abiertos). En general, la interacción entre las pacientes fue mínima porque las sesiones fueron más bien presentaciones didácticas. El grupo de educación psicosocial presentó temas pertinentes a las mujeres más jóvenes con cáncer de mama, tales como los siguientes:
- Hablar con los hijos sobre el cáncer.
- La continuidad de la vida después del diagnóstico.
- Relaciones e intimidad con la pareja.
- Las hormonas y el cáncer.
- Bases genéticas del cáncer de mama.
El grupo de educación nutricional recibió información sobre la selección de frutas, verduras y alimentos con bajo contenido graso, así como la manera de incorporar sistemáticamente estos alimentos en la vida cotidiana. Se presentaron temas sobre compras, cocinar con bajo contenido graso, comer afuera y otros temas relacionados. Los resultados revelaron que las pacientes en ambos grupos de intervención notificaron menos síntomas depresivos y mejor funcionamiento físico que el grupo de atención estándar durante el seguimiento realizado 13 meses después. Este estudio es un ejemplo de una intervención más dirigida diseñada para una población específica de pacientes (mujeres más jóvenes con cáncer de mama) en un momento determinado del ciclo de tratamiento (inmediatamente después de finalizar el tratamiento activo).
Capacitación autoadministrada para abordar el estrés relacionado con la quimioterapia
En un ensayo aleatorizado con 411 pacientes diagnosticados con diferentes tipos de cáncer,[12][Nivel de evidencia: I] se comparó la atención psicosocial tradicional con el tratamiento del estrés causado por la quimioterapia, administrado por un profesional y autoadministrado. El control profesional del estrés incluyó una sesión educativa individual de 60 minutos en la que se revisaron las fuentes comunes de estrés causado por la quimioterapia y tres técnicas específicas para el control del estrés:
- Respiración abdominal controlada.
- Relajación muscular progresiva con imágenes.
- Uso de autoafirmaciones para enfrentar situaciones difíciles.
El profesional entregó al paciente una cinta de audio de la sesión individual, indicó la práctica diaria de las tres técnicas y se reunió brevemente con el paciente antes de su primera sesión de quimioterapia.
En el grupo autoadministrado, un profesional se reunió con cada paciente durante aproximadamente 10 minutos, le entregó un paquete de material didáctico sobre la adaptación a la quimioterapia y lo instruyó brevemente sobre su uso. Estos materiales incluyeron la misma información proporcionada al grupo administrado por un profesional más los siguientes materiales:
- Una cinta de video de 15 minutos de duración.
- Un folleto de 12 páginas.
- Una cinta de audio sobre relajación de 35 minutos de duración.
Se explicó a los pacientes de este grupo que debían mirar primero la cinta de video y luego revisar el folleto, seguir las instrucciones adicionales para capacitarse más y el uso de varias técnicas.
Los resultados de este enfoque novedoso mostraron que los pacientes en la intervención autoadministrada notificaron que el funcionamiento físico, la vitalidad y la salud mental fueron mejores, y que hubo menos limitaciones funcionales que las de cualquiera de los otros dos grupos. Los pacientes en el grupo manejado por un profesional no manifestaron mejores resultados que los pacientes en el grupo de atención tradicional. Se determinó que los costos del grupo autoadministrado fueron significativamente inferiores a los de los otros dos grupos.
Orientación breve y visita a un centro de atención oncológica
Un tipo de intervención muy novedosa probó los efectos de visita breve a un consultorio clínico (15 a 20 minutos) para pacientes nuevos de un centro de atención oncológica.[13][Nivel de evidencia: I] El recorrido incluyó los siguientes aspectos:
- Una oportunidad de visitar las áreas de flebotomía, enfermería y quimioterapia.
- La distribución de bibliografía médica sobre los horarios del centro y los procedimientos.
- Un período de preguntas y respuestas.
Los 150 pacientes derivados de manera consecutiva y que presentaban una variedad de cánceres se asignaron al azar para recibir una intervención de orientación en un entorno clínico o la atención estándar. Los pacientes sometidos a la intervención mostraron menos ansiedad, menos trastornos del estado de ánimo y menos síntomas depresivos luego de una semana de seguimiento. Además, estos pacientes informaron tener mayor conocimiento sobre los procedimientos clínicos, mayor confianza en sus médicos, y grados más altos de satisfacción y esperanza. Esto es un ejemplo de cómo incluso una intervención mínima simple puede tener beneficios.
Uso de la información en línea
El Comprehensive Health Enhancement Support System (CHESS) [14] es un recurso en línea para pacientes de cáncer. Consta de dos componentes:
- Material didáctico.
- Información narrada de temas médicos, prácticos y psicosociales.
En este estudio, se abordó la atracción relativa y el valor de estos dos componentes por separado para las mujeres blancas y afroamericanas con diagnóstico de cáncer de mama (tres cuartas partes de las participantes tenían enfermedad en estadio temprano). El tiempo promedio que tomó consultar en línea cualquiera de los recursos fue un poco más largo para las mujeres afroamericanas (didáctica: 19,7 minutos, desviación estándar [DE] = 31,10; narrativa: 17,16 minutos, DE = 38,19) que para las mujeres blancas (didáctica: 18,30 minutos, DE = 28,62; narrativa: 15,78 minutos, DE = 36,60) pero el efecto fue sustancialmente mayor.
Antes de usar el recurso, las mujeres afroamericanas participaban mucho menos en la atención de la salud. Después del uso, aumentaron marcadamente su participación en la atención de la salud, sin importar el tipo de recurso utilizado, sobrepasando el grado de participación de las mujeres blancas; en particular en relación con el efecto de los servicios didácticos. Este resultado indica que, si bien el uso de los recursos CHESS —tanto didácticos como narrativos— es valioso para ambas poblaciones, es particularmente útil para las mujeres afroamericanas. La versión narrativa parece tener un mayor efecto diferencial en las mujeres blancas.
Bibliografía
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Distress Management. Version 1.2025. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2024. Available online with free registration. Last accessed Feb. 26, 2025.
- Fashoyin-Aje LA, Martinez KA, Dy SM: New patient-centered care standards from the commission on cancer: opportunities and challenges. J Support Oncol 10 (3): 107-11, 2012 May-Jun. [PUBMED Abstract]
- Andersen BL: Biobehavioral outcomes following psychological interventions for cancer patients. J Consult Clin Psychol 70 (3): 590-610, 2002. [PUBMED Abstract]
- Meyer TJ, Mark MM: Effects of psychosocial interventions with adult cancer patients: a meta-analysis of randomized experiments. Health Psychol 14 (2): 101-8, 1995. [PUBMED Abstract]
- Sheard T, Maguire P: The effect of psychological interventions on anxiety and depression in cancer patients: results of two meta-analyses. Br J Cancer 80 (11): 1770-80, 1999. [PUBMED Abstract]
- Barsevick AM, Sweeney C, Haney E, et al.: A systematic qualitative analysis of psychoeducational interventions for depression in patients with cancer. Oncol Nurs Forum 29 (1): 73-84; quiz 85-7, 2002 Jan-Feb. [PUBMED Abstract]
- Antoni MH, Lehman JM, Kilbourn KM, et al.: Cognitive-behavioral stress management intervention decreases the prevalence of depression and enhances benefit finding among women under treatment for early-stage breast cancer. Health Psychol 20 (1): 20-32, 2001. [PUBMED Abstract]
- Budin WC, Hoskins CN, Haber J, et al.: Breast cancer: education, counseling, and adjustment among patients and partners: a randomized clinical trial. Nurs Res 57 (3): 199-213, 2008 May-Jun. [PUBMED Abstract]
- Scheier MF, Helgeson VS, Schulz R, et al.: Interventions to enhance physical and psychological functioning among younger women who are ending nonhormonal adjuvant treatment for early-stage breast cancer. J Clin Oncol 23 (19): 4298-311, 2005. [PUBMED Abstract]
- Antoni MH, Wimberly SR, Lechner SC, et al.: Reduction of cancer-specific thought intrusions and anxiety symptoms with a stress management intervention among women undergoing treatment for breast cancer. Am J Psychiatry 163 (10): 1791-7, 2006. [PUBMED Abstract]
- Andersen BL, Farrar WB, Golden-Kreutz DM, et al.: Psychological, behavioral, and immune changes after a psychological intervention: a clinical trial. J Clin Oncol 22 (17): 3570-80, 2004. [PUBMED Abstract]
- Jacobsen PB, Meade CD, Stein KD, et al.: Efficacy and costs of two forms of stress management training for cancer patients undergoing chemotherapy. J Clin Oncol 20 (12): 2851-62, 2002. [PUBMED Abstract]
- McQuellon RP, Wells M, Hoffman S, et al.: Reducing distress in cancer patients with an orientation program. Psychooncology 7 (3): 207-17, 1998 May-Jun. [PUBMED Abstract]
- Wise M, Han JY, Shaw B, et al.: Effects of using online narrative and didactic information on healthcare participation for breast cancer patients. Patient Educ Couns 70 (3): 348-56, 2008. [PUBMED Abstract]
Trastornos de adaptación
Los trastornos de adaptación son una categoría diagnóstica de la quinta edición del Manual Diagnóstico y Estadístico de los Trastornos Mentales de la American Psychiatric Association (DSM-5),[1] definidos como reacciones ante un factor psicosocial de estrés que se puede identificar (por ejemplo, un diagnóstico de cáncer o una transición en la atención). Las reacciones se presentan dentro de los 3 meses del comienzo del factor de estrés con un grado de psicopatología menos grave que los trastornos mentales diagnosticables como trastorno depresivo mayor o trastorno de ansiedad generalizado, sin embargo, "superan en exceso las expectativas” o resultan en “discapacidad importante del funcionamiento social u ocupacional”.
Cuatro de los subtipos más comunes son los siguientes:
- Con estado de ánimo deprimido.
- Con ansiedad.
- Con ansiedad y estado de ánimo deprimido.
- Con perturbación mixta de emociones y conducta (para pacientes que presentan indicios conductuales de un trastorno de adaptación, como faltar a citas médicas o nuevo consumo indebido de sustancias).
Prevalencia
Aproximadamente todos los pacientes de cáncer presentan lo que se puede considerar un factor de estrés identificable, como el diagnóstico, el tratamiento, la recidiva o los efectos secundarios. La respuesta del paciente al factor de estrés identificable determina la presencia de un trastorno de adaptación.
Los trastornos de adaptación son los problemas de salud mental diagnosticados con mayor frecuencia en el entorno oncológico. En un metanálisis que examinó 70 estudios en 14 países con más de 10 000 participantes en entornos oncológicos, incluso hematooncológicos. En el estudio se encontró una tasa de prevalencia de trastorno de ajuste cercana al 20 % entre pacientes oncológicos ambulatorios en tratamiento activo.[2]
En otras revisiones más enfocadas en las poblaciones norteamericanas,[3] se estableció que los trastornos de adaptación son el problema de salud mental más común entre los pacientes de cáncer. En los pacientes de cáncer en estadio avanzado, la prevalencia oscila entre el 14 % y el 34,7 %; en los pacientes con cáncer terminal, las tasas oscilan entre el 10,6 % y el 16,3 %. El estadio de la enfermedad, el tipo de cáncer, los procedimientos diagnósticos utilizados y otras variables de los pacientes influyen en esta variabilidad en las tasas de prevalencia. En un estudio de mujeres con cáncer de mama sometidas a quimioterapia adyuvante, se encontró una tasa de prevalencia del 36,1 %.[4]
Tratamiento
A pesar de que pocos estudios se dirigen específicamente a pacientes de cáncer con diagnóstico de trastorno de adaptación, en diferentes estudios se revelaron los beneficios de las intervenciones psicosociales para pacientes adultos con cáncer.[5][Nivel de evidencia: I] Estas intervenciones incluyeron tanto orientación individual [6][Nivel de evidencia: I] como grupal [7][Nivel de evidencia: IV];[8,9][Nivel de evidencia: I] y se usó una variedad de enfoques teóricos.
Orientación grupal
Los investigadores evaluaron la eficacia de una intervención grupal para el control del estrés cognitivo-conductual.[10] Se asignó al azar a 100 mujeres con cáncer de mama recién tratadas para participar en la intervención o en condición de control. La intervención psicosocial comprendió 10 sesiones semanales grupales de 2 horas de duración durante las cuales se presentó material didáctico, con una variedad de ejercicios experimentales y tareas para el hogar. La intervención general se enfocó en aprender a enfrentar mejor los factores cotidianos de estrés relacionados con el cáncer. Los temas incluyeron los siguientes aspectos:
- Relajación muscular progresiva.
- Reestructuración cognitiva.
- Resolución de conflictos de factores interpersonales de estrés.
- Apoyo social.
La condición de control comprendió un seminario de un día de duración en el cual las participantes recibieron una versión psicoeducativa resumida de la intervención, con mucha menos interacción entre los miembros del grupo. Entre las participantes en la intervención, los resultados mostraron una disminución de la depresión y un aumento de la identificación de beneficios (es decir, notificar que el cáncer de mama tuvo una contribución positiva para sus vidas) y optimismo.
En un estudio aleatorizado más grande (N = 199) llevado a cabo por el mismo grupo de investigación [11] en mujeres de cáncer de mama no metastásico en estadios 0 a III, una intervención similar produjo disminuciones continuas un tanto más pronunciadas en los pensamientos indeseados relacionados con el cáncer y mejoras sostenidas de la ansiedad.
En otro estudio, se examinó una intervención grupal de 1,5 horas semanales durante 18 semanas que incluyó estrategias psicológicas diseñadas para lo siguiente:[12]
- Reducir el estrés.
- Fortalecer el estado de ánimo.
- Modificar los comportamientos de salud (régimen alimentario, ejercicio, consumo de tabaco).
- Mejorar el cumplimiento de los tratamientos del cáncer.
Las medidas de los desenlaces incluyeron:
- Sufrimiento emocional.
- Comportamientos de salud.
- Respuestas inmunitarias.
Se asignó al azar a 227 mujeres, quienes se habían sometido a cirugía a raíz de cáncer de mama regional, a un grupo de intervención o a un grupo de control con fines de evaluación solamente. En comparación con el grupo de control, el grupo de intervención reveló mucha menos ansiedad, una mejora de la capacidad para acceder al apoyo social, conductas de estilo de vida más saludables (con la observación de mejoras específicas en las conductas de alimentación y de consumo de tabaco) y una mejora en los niveles de síntomas y estado funcional.[12] Por otra parte, se identificaron mejoras bioconductuales en las respuestas inmunitarias en el grupo de intervención. La mejora en las respuestas fue congruente con los cambios psicológicos y conductuales. Este estudio es un ejemplo sólido de la forma en que las intervenciones psicosociales pueden mejorar en diversas variables bioconductuales (psicológicas, conductuales, inmunitarias).
Tratamiento con base en la consciencia plena
Se llevó a cabo un ensayo aleatorizado controlado durante 6 semanas con 84 mujeres sobrevivientes de cáncer de mama consistente en una intervención para reducir el estrés fundamentada en la consciencia plena, en comparación con la atención habitual.[13] Todas las participantes estaban dentro de un período de 18 meses de haber completado una cirugía, radioterapia o quimioterapia y se encontraban en un período de transición entre la finalización del tratamiento activo y la supervivencia posterior al tratamiento. La intervención consistió en una sesión grupal semanal de 2 horas de duración conducida por un psicólogo que siguió un protocolo estándar para enseñar a las participantes meditación sentada, exploración corporal, caminatas de meditación y yoga suave. Todas las participantes recibieron un manual de capacitación y cuatro cintas de audio para uso en el hogar y se las animó a que practicaran a diario. Las participantes que practicaron con mayor frecuencia tuvieron mejoras en los siguientes parámetros:
- Mediciones psicológicas (miedo a la recidiva, preocupaciones sobre la recidiva, estado de ansiedad grave y depresión).
- Calidad de vida (funcionamiento físico, limitación de sus funciones y energía).
En un estudio en el que se examinó la eficacia de la reducción del estrés en función de la conciencia plena en sobrevivientes de cáncer de mama,[14] se asignó al azar a 322 participantes para participar en un programa de 6 semanas de duración o la atención habitual. El grupo de intervención recibió sesiones semanales de 2 horas que incluyeron técnicas de meditación, procesos grupales e integración de la conciencia plena en las actividades cotidianas. Quienes practicaron la reducción del estrés mediante la conciencia plena mostraron una mejora en los siguientes parámetros:
- Síntomas psicológicos (ansiedad, miedo a la recidiva en general y miedo a los síntomas de recidiva).
- Síntomas físicos (gravedad de la fatiga e interferencia de la fatiga).
Las sobrevivientes con el grado de estrés inicial más alto tuvieron el mayor beneficio.
En un estudio de 8 semanas de terapia cognitiva basada en la conciencia plena para hombres con cáncer de próstata en estadio avanzado,[15] se asignó al azar a pacientes para recibir una intervención grupal semanal por teléfono (n = 94) o la atención habitual con educación para el paciente mejorada al mínimo (n = 95). Las sesiones telefónicas de 1 hora 15 minutos de duración se plasmaron en manuales e incluyeron meditaciones breves. Se alentó a realizar en el hogar meditación basada en la conciencia plena a diario. No se observaron diferencias entre los grupos en los desenlaces psicológicos o de calidad de vida, y ninguna influencia en el uso de las aptitudes de conciencia plena más allá de la observación. Los autores indicaron que las poblaciones masculinas de mayor edad quizás sean menos receptivas y sensibles a la conciencia plena.
Hipnosis y relajación
En un estudio, se asignó al azar a un grupo de 90 mujeres, que tenían programada una biopsia de mama por escisión a una sesión breve (15 minutos) de hipnosis y relajación guiada dirigida por psicólogos clínicos capacitados o a una sesión de igual duración en la que la paciente escuchaba de forma empática con atención controlada; ambas intervenciones se realizaron el día de la cirugía. Se midió el sufrimiento antes de la cirugía con escalas analógicas visuales (VAS) y la versión corta del Profile of Mood States. La sesión de hipnosis redujo de modo notable la ansiedad anticipatoria y aumentó la relajación, que se midió inmediatamente antes de la biopsia; ello indica que los pacientes que nunca fueron sometidos a hipnosis y relajación se pueden beneficiar con el tratamiento breve antes de situaciones que producen estrés.[16][Nivel de evidencia: II]
Terapia cognitiva conductual
La terapia cognitiva conductual (TCC) es un abordaje que se ha estudiado ampliamente y que se basa en la idea que los síntomas mentales, emocionales, e incluso físicos, surgen en parte como resultado de pensamientos, sensaciones y comportamientos, que resultan en una adaptación deficiente.[17] Las intervenciones se enfocan directamente en los pensamientos, los sentimientos y los comportamientos de un paciente con la meta de modificar estrategias específicas para enfrentar situaciones difíciles y aliviar el sufrimiento emocional.
La TCC incluye una variedad de técnicas, como las siguientes:
- Entrenamiento de relajación.
- Solución de problemas.[18][Nivel de evidencia: I]
- Reestructuración cognitiva.
- Autoafirmaciones para enfrentar situaciones difíciles.
En la mayoría de los estudios se combinaron estos abordajes en una estrategia de tratamiento con componentes múltiples diseñados para aliviar síntomas específicos. Los abordajes de TCC tienden a ser intervenciones a corto plazo, relativamente breves, bien adaptadas al entorno oncológico.[17,18] En un estudio se asignó al azar a 382 pacientes, con diferentes tipos de cáncer, a uno de tres grupos siguientes:[19][Nivel de evidencia: I
- Atención habitual.
- Manejo del estrés guiado por un profesional.
- Manejo del estrés autoadministrado.
Los dos grupos de intervención recibieron capacitación para el manejo del estrés que incluyó el uso de las siguientes técnicas antes del comienzo de la quimioterapia:
- Respiración abdominal.
- Entrenamiento de relajación muscular progresiva con imágenes guiadas.
- Autoafirmaciones para enfrentar situaciones difíciles.
El grupo de intervención guiado por un profesional se reunió con un experto en salud mental que les enseñó técnicas para manejar el estrés durante una sesión de 60 minutos. El grupo autoguiado recibió un paquete de materiales para la capacitación que incluyó lo siguiente:
- Un video de 15 minutos con instrucciones.
- Un folleto de 12 páginas sobre cómo hacer frente a la quimioterapia.
- Una cinta de audio de 35 minutos con instrucciones sobre el entrenamiento para la relajación.
Los resultados mostraron una mejora en la calidad de vida en comparación con la atención habitual solamente en el grupo autoguiado. El grupo guiado por un profesional no mostró ninguna mejora en la calidad de vida cuando se lo comparó con el grupo de atención habitual.
En un ensayo clínico aleatorizado para el tratamiento de los trastornos de adaptación, se asignó al azar a 57 pacientes con una variedad de tipos de cáncer para someterse a una intervención de TCC individual enfocada en sus problemas durante 8 semanas o a una intervención individual con orientación de apoyo durante 8 semanas.[20][Nivel de evidencia: I] Los resultados mostraron que quienes recibieron la TCC enfocada en sus problemas exhibieron un cambio substancial en su espíritu de lucha, en cómo hacer frente al cáncer, la ansiedad y sus problemas autodefinidos, tanto al concluir la intervención como durante el seguimiento realizado a los 4 meses.
La terapia individual en la que se utilizan técnicas de TCC para ayudar a los pacientes en la formación de aptitudes para la solución de problemas aplicables a varios factores vitales de estrés, demostró ser útil para los pacientes con cáncer.[21][Nivel de evidencia: II] En este estudio, la intervención psicosocial incluyó 10 sesiones semanales de 1,5 horas de psicoterapia (con la presencia o no de un ser querido), que se enfocaron en la capacitación para convertirse en una persona eficaz para resolver problemas. Se hizo hincapié en las siguientes cuatro tareas racionales para resolver problemas:
- Formulación de la naturaleza de los problemas.
- Intercambio de ideas sobre soluciones alternativas.
- Evaluación sistemática de las posibles consecuencias de una solución mientras se decide cuáles son óptimas.
- Evaluación del desenlace posible tras la aplicación de la solución.
Los participantes en el grupo de intervención demostraron mayor capacidad para resolver problemas, menos sufrimiento multidimensional y mayor calidad de vida que los participantes en el grupo de control.
En un metanálisis de 45 estudios en el que se investigaron 62 comparaciones de tratamiento y control, se hallaron efectos beneficiosos importantes en la adaptación emocional de los pacientes adultos de cáncer que participaron en intervenciones psicosociales.[5][Nivel de evidencia: I] Las dimensiones del efecto beneficioso para la adaptación emocional oscilaron entre 0,19 y 0,28; lo que indicó que el paciente promedio de cáncer que recibe tratamiento estaba en mejor situación que 56,5 a 59,5 % de los pacientes que no reciben tratamiento. Se observaron beneficios del ajuste emocional para las intervenciones que se administraron tanto en formato individual [6][Nivel de evidencia: I] como grupal,[22][Nivel de evidencia: II] al concluir la intervención y en evaluaciones de seguimiento a los 6 y 12 meses. Un enfoque novedoso adaptó un formato de grupo de 6 semanas al que se le brindó una llamada conferencia telefónica estructurada para sobrevivientes de cáncer de mama; hubo una alta aceptación y se vieron efectos modestos del tratamiento inmediatamente después de la intervención, pero no durante el seguimiento a los 3 meses.[23][Nivel de evidencia: I]
En otro estudio se encontró que una intervención cognitivo conductual para enseñar a resolver problemas fue eficaz al promover un mejor automanejo de los síntomas relacionados con el cáncer, especialmente en pacientes de 60 años o menos.[24][Nivel de evidencia: I]
Cada vez más, los estudios de TCC para el cáncer incluyen desenlaces bioconductuales. En un ensayo aleatorizado y controlado se asignó a 159 hombres con cáncer de próstata a uno de los 3 grupos: un grupo de gestión del estrés basado en la TCC, un grupo de atención de apoyo o un grupo de atención estándar. Los resultados demostraron que 2 sesiones individuales (60–90 minutos por sesión) de intervención mediante TCC, administrada durante 1 a 2 semanas antes de una prostatectomía radical, tenía un efecto positivo en varios parámetros del sistema inmunitario (mayores efectos tóxicos de células citolíticas naturales y citocinas proinflamatorias circulantes).[25][Nivel de evidencia: I] Solo en el grupo de intervención se encontraron diferencias estadísticamente significativas en los resultados inmunitarios, pero no en los otros dos grupos.
¿Las intervenciones psicosociales pueden aumentar la supervivencia?
La pregunta intrigante de que la participación en una intervención grupal psicosocial pueda producir un aumento de la supervivencia se investiga desde 1989. En el estudio original,[26] se analizó un formato de terapia grupal expresiva para mujeres con cáncer de mama metastásico; en otro estudio [27] se puso a prueba un grupo de intervención psicoeducativo para pacientes de melanoma maligno. En ambos estudios se estableció una ventaja para la supervivencia en el grupo de intervención. Sin embargo, como en un análisis crítico del primer estudio,[28] se determinó que los miembros del grupo de control tuvieron una supervivencia significativamente más corta de lo esperado en comparación con datos del Surveillance, Epidemiology, and End Results (SEER) Program del Instituto Nacional del Cáncer. Este hallazgo indica que las ventajas en supervivencia quizás resultaron de errores inadvertidos en la muestra.
En Canadá,[29] los Estados Unidos [30] y Australia, se procuró repetir los resultados de la terapia grupal expresiva.[31] Aunque en los tres grupos se identificaron beneficios psicológicos importantes, en ningún estudio se logró repetir el beneficio para la supervivencia.
En las revisiones de la bibliografía médica, que incluyeron tres metanálisis [32-34] y una revisión sistemática,[35] se concluyó que las investigaciones previas no lograron encontrar que la psicoterapia afecta la supervivencia. En un resumen,[36] se informó sobre diez ensayos aleatorizados controlados adicionales de varias intervenciones psicosociales para pacientes con diferentes tipos de cánceres (aunque la mayoría eran mujeres con cáncer de mama). En los diez estudios se notó una mejora de los beneficios psicosociales. Sin embargo, en 9 de los estudios, no se observaron diferencias significativas en la supervivencia, mientras que en un estudio [37] se estableció una ventaja de supervivencia de alrededor de 1 año. En este ensayo con resultados positivos, se logró estratificar a los grupos según un número de variables importantes (por ejemplo, estado ganglionar, estado de los receptores de estrógeno y progesterona, y estado menopáusico) y se proporcionaron datos que sustentan posibles mecanismos, tales como una intensificación del funcionamiento inmunitario y el cumplimiento de los pacientes con los procedimientos de reducción del estrés. En un análisis de los resultados, en este estudio se identificó la complejidad de factores que participan en cualquier beneficio de supervivencia y la posibilidad de que los beneficios mediados por el sistema inmunitario contribuyan al aumento de la supervivencia, cuando se consideran cuidadosamente.
En resumen, la preponderancia de las pruebas indica que, a pesar de la evidencia de mejor calidad de vida, es poco probable que la intervención psicosocial contribuya con independencia a la duración de la supervivencia en pacientes con cáncer. Algunos expertos indican que no se justifica continuar investigando este asunto.[38]
Farmacoterapia
No se realizaron estudios dirigidos específicamente a pacientes con cáncer diagnosticados exclusivamente con un trastorno de adaptación y cuya intervención primaria fue alguna forma de terapia farmacológica. Teniendo en cuenta la naturaleza de los trastornos de adaptación, la experiencia clínica indica que, de estar disponible, se debería llevar a cabo un ensayo inicial a corto plazo de orientación o psicoterapia diseñado para modificar o eliminar el factor de estrés identificado (y así aliviar los síntomas) antes administrar terapia farmacológica.[39]
Sin embargo, algunas veces el trastorno de adaptación progresa a un trastorno mental más grave (por ejemplo, trastorno depresivo mayor) y justifica que se considere el uso de la terapia farmacológica. Por otra parte, cuando el paciente no se beneficia de la psicoterapia a corto plazo, la adición de medicación psicotrópica adecuada durante un período breve (por ejemplo, 2 a 3 semanas en el caso de los ansiolíticos, 12 meses en el caso de los antidepresivos) a veces facilita la psicoterapia y permite que el paciente use mejor las estrategias disponibles para enfrentar situaciones difíciles. La configuración específica de síntomas emocionales o conductuales determinará el tipo de medicación psicotrópica que se considere. Para obtener más información, consultar Depresión.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders: DSM-5. 5th ed. American Psychiatric Association, 2013.
- Mitchell AJ, Chan M, Bhatti H, et al.: Prevalence of depression, anxiety, and adjustment disorder in oncological, haematological, and palliative-care settings: a meta-analysis of 94 interview-based studies. Lancet Oncol 12 (2): 160-74, 2011. [PUBMED Abstract]
- Miovic M, Block S: Psychiatric disorders in advanced cancer. Cancer 110 (8): 1665-76, 2007. [PUBMED Abstract]
- Morasso G: Screening adjustment disorders related to mastectomy and its treatment. New Trends in Experimental and Clinical Psychiatry 13 (1): 90-3, 1997.
- Meyer TJ, Mark MM: Effects of psychosocial interventions with adult cancer patients: a meta-analysis of randomized experiments. Health Psychol 14 (2): 101-8, 1995. [PUBMED Abstract]
- Greer S, Moorey S, Baruch JD, et al.: Adjuvant psychological therapy for patients with cancer: a prospective randomised trial. BMJ 304 (6828): 675-80, 1992. [PUBMED Abstract]
- Telch CF, Telch MJ: Group coping skills instruction and supportive group therapy for cancer patients: a comparison of strategies. J Consult Clin Psychol 54 (6): 802-8, 1986. [PUBMED Abstract]
- Penedo FJ, Dahn JR, Molton I, et al.: Cognitive-behavioral stress management improves stress-management skills and quality of life in men recovering from treatment of prostate carcinoma. Cancer 100 (1): 192-200, 2004. [PUBMED Abstract]
- Goodwin PJ, Leszcz M, Ennis M, et al.: The effect of group psychosocial support on survival in metastatic breast cancer. N Engl J Med 345 (24): 1719-26, 2001. [PUBMED Abstract]
- Antoni MH, Lehman JM, Kilbourn KM, et al.: Cognitive-behavioral stress management intervention decreases the prevalence of depression and enhances benefit finding among women under treatment for early-stage breast cancer. Health Psychol 20 (1): 20-32, 2001. [PUBMED Abstract]
- Antoni MH, Wimberly SR, Lechner SC, et al.: Reduction of cancer-specific thought intrusions and anxiety symptoms with a stress management intervention among women undergoing treatment for breast cancer. Am J Psychiatry 163 (10): 1791-7, 2006. [PUBMED Abstract]
- Andersen BL, Farrar WB, Golden-Kreutz DM, et al.: Psychological, behavioral, and immune changes after a psychological intervention: a clinical trial. J Clin Oncol 22 (17): 3570-80, 2004. [PUBMED Abstract]
- Lengacher CA, Johnson-Mallard V, Post-White J, et al.: Randomized controlled trial of mindfulness-based stress reduction (MBSR) for survivors of breast cancer. Psychooncology 18 (12): 1261-72, 2009. [PUBMED Abstract]
- Lengacher CA, Reich RR, Paterson CL, et al.: Examination of Broad Symptom Improvement Resulting From Mindfulness-Based Stress Reduction in Breast Cancer Survivors: A Randomized Controlled Trial. J Clin Oncol 34 (24): 2827-34, 2016. [PUBMED Abstract]
- Chambers SK, Occhipinti S, Foley E, et al.: Mindfulness-Based Cognitive Therapy in Advanced Prostate Cancer: A Randomized Controlled Trial. J Clin Oncol 35 (3): 291-297, 2017. [PUBMED Abstract]
- Schnur JB, Bovbjerg DH, David D, et al.: Hypnosis decreases presurgical distress in excisional breast biopsy patients. Anesth Analg 106 (2): 440-4, table of contents, 2008. [PUBMED Abstract]
- Jacobsen PB, Hann DM: Cognitive-behavioral interventions. In: Holland JC, Breitbart W, Jacobsen PB, et al., eds.: Psycho-oncology. Oxford University Press, 1998, pp 717-29.
- Allen SM, Shah AC, Nezu AM, et al.: A problem-solving approach to stress reduction among younger women with breast carcinoma: a randomized controlled trial. Cancer 94 (12): 3089-100, 2002. [PUBMED Abstract]
- Jacobsen PB, Meade CD, Stein KD, et al.: Efficacy and costs of two forms of stress management training for cancer patients undergoing chemotherapy. J Clin Oncol 20 (12): 2851-62, 2002. [PUBMED Abstract]
- Moorey S, Greer S, Bliss J, et al.: A comparison of adjuvant psychological therapy and supportive counselling in patients with cancer. Psychooncology 7 (3): 218-28, 1998 May-Jun. [PUBMED Abstract]
- Nezu AM, Nezu CM, Felgoise SH, et al.: Project Genesis: assessing the efficacy of problem-solving therapy for distressed adult cancer patients. J Consult Clin Psychol 71 (6): 1036-48, 2003. [PUBMED Abstract]
- Fawzy FI, Cousins N, Fawzy NW, et al.: A structured psychiatric intervention for cancer patients. I. Changes over time in methods of coping and affective disturbance. Arch Gen Psychiatry 47 (8): 720-5, 1990. [PUBMED Abstract]
- Heiney SP, McWayne J, Hurley TG, et al.: Efficacy of therapeutic group by telephone for women with breast cancer. Cancer Nurs 26 (6): 439-47, 2003. [PUBMED Abstract]
- Sherwood P, Given BA, Given CW, et al.: A cognitive behavioral intervention for symptom management in patients with advanced cancer. Oncol Nurs Forum 32 (6): 1190-8, 2005. [PUBMED Abstract]
- Cohen L, Parker PA, Vence L, et al.: Presurgical stress management improves postoperative immune function in men with prostate cancer undergoing radical prostatectomy. Psychosom Med 73 (3): 218-25, 2011. [PUBMED Abstract]
- Spiegel D, Bloom JR, Kraemer HC, et al.: Effect of psychosocial treatment on survival of patients with metastatic breast cancer. Lancet 2 (8668): 888-91, 1989. [PUBMED Abstract]
- Fawzy FI, Fawzy NW, Hyun CS, et al.: Malignant melanoma. Effects of an early structured psychiatric intervention, coping, and affective state on recurrence and survival 6 years later. Arch Gen Psychiatry 50 (9): 681-9, 1993. [PUBMED Abstract]
- Fox BH: A hypothesis about Spiegel et al.'s 1989 paper on Psychosocial intervention and breast cancer survival. Psychooncology 7 (5): 361-70, 1998 Sep-Oct. [PUBMED Abstract]
- Goodwin PJ, Leszcz M, Quirt G, et al.: Lessons learned from enrollment in the BEST study--a multicenter, randomized trial of group psychosocial support in metastatic breast cancer. J Clin Epidemiol 53 (1): 47-55, 2000. [PUBMED Abstract]
- Classen C, Butler LD, Koopman C, et al.: Supportive-expressive group therapy and distress in patients with metastatic breast cancer: a randomized clinical intervention trial. Arch Gen Psychiatry 58 (5): 494-501, 2001. [PUBMED Abstract]
- Kissane DW, Love A, Hatton A, et al.: Effect of cognitive-existential group therapy on survival in early-stage breast cancer. J Clin Oncol 22 (21): 4255-60, 2004. [PUBMED Abstract]
- Newell SA, Sanson-Fisher RW, Savolainen NJ: Systematic review of psychological therapies for cancer patients: overview and recommendations for future research. J Natl Cancer Inst 94 (8): 558-84, 2002. [PUBMED Abstract]
- Chow E, Tsao MN, Harth T: Does psychosocial intervention improve survival in cancer? A meta-analysis. Palliat Med 18 (1): 25-31, 2004. [PUBMED Abstract]
- Smedslund G, Ringdal GI: Meta-analysis of the effects of psychosocial interventions on survival time in cancer patients. J Psychosom Res 57 (2): 123-31; discussion 133-5, 2004. [PUBMED Abstract]
- Edwards AG, Hailey S, Maxwell M: Psychological interventions for women with metastatic breast cancer. Cochrane Database Syst Rev (2): CD004253, 2004. [PUBMED Abstract]
- Kissane DW: Survival following psychotherapy interventions. In: Holland JC, Breitbart WS, Jacobsen PB, et al., eds.: Psycho-oncology. 2nd ed. Oxford University Press, Inc., 2010, pp 479-82.
- Andersen BL, Yang HC, Farrar WB, et al.: Psychologic intervention improves survival for breast cancer patients: a randomized clinical trial. Cancer 113 (12): 3450-8, 2008. [PUBMED Abstract]
- Coyne JC, Stefanek M, Palmer SC: Psychotherapy and survival in cancer: the conflict between hope and evidence. Psychol Bull 133 (3): 367-94, 2007. [PUBMED Abstract]
- Strain JJ: Adjustment disorders. In: Holland JC, Breitbart W, Jacobsen PB, et al., eds.: Psycho-oncology. Oxford University Press, 1998, pp 509-17.
Trastornos de ansiedad: descripción y etiología
La ansiedad se presenta en grados variables en los pacientes de cáncer y es posible que aumente a medida que la enfermedad progresa o el tratamiento se vuelve más intensivo.[1] Los investigadores hallaron que el 44 % de los pacientes de cáncer notifican algo de ansiedad y que el 23 % notifican una ansiedad importante.[2,3] En un metanálisis que examinó 70 estudios en 14 países con más de 10 000 participantes, se estableció la tasa de prevalencia de los trastornos de ansiedad parece aproximarse al 10 % entre pacientes ambulatorios en tratamiento activo del cáncer.[4]
Las reacciones de ansiedad que son más prolongadas o intensas ya no se pueden clasificar como trastornos de adaptación. Estos trastornos pueden afectar negativamente la calidad de vida, interferir en la capacidad del paciente de funcionar social o emocionalmente, y exigen una intervención.[5] En ocasiones, los trastornos de ansiedad son secundarios a otros aspectos de la afección, como el dolor incontrolable, ciertos estados metabólicos o efectos secundarios de la medicación.
Otros trastornos de ansiedad específicos, como la ansiedad generalizada, las fobias o el trastorno de angustia, no son tan comunes entre los pacientes con cáncer y suelen preceder al diagnóstico de cáncer. Estos trastornos merecen más atención para facilitar la atención del cáncer. El estrés causado por un diagnóstico de cáncer y su tratamiento a veces desencadena una recaída de trastornos de ansiedad preexistentes. Estos trastornos pueden ser incapacitantes e interferir en el tratamiento. Exigen un diagnóstico inmediato y un tratamiento eficaz.[6]
Los factores que quizás aumenten la probabilidad de que se presenten trastornos de ansiedad durante el tratamiento son los siguientes:
- Antecedentes de trastornos de ansiedad.
- Dolor agudo u otros síntomas físicos (los trastornos de ansiedad no tratados también pueden intensificar la experiencia de dolor).[7,8]
- Ansiedad en el momento del diagnóstico.[9]
- Limitaciones funcionales.
- Falta de apoyo social.[2]
- Enfermedad en estadio avanzado.
- Antecedentes de trauma.[1,10]
Algunas afecciones e intervenciones se relacionan con síntomas que se presentan como trastornos de ansiedad, incluso los siguientes:
- Metástasis en el sistema nervioso central.
- Disnea relacionada con el cáncer de pulmón.
- Tratamiento con corticoesteroides y otros medicamentos.
Es posible que la experiencia de un paciente con un cáncer u otras enfermedades reactive asociaciones y recuerdos de enfermedades previas, y contribuya a un estado de ansiedad aguda. Ciertos factores demográficos, como ser mujer y presentar cáncer a una edad temprana, se relacionan con un aumento de la ansiedad en situaciones médicas.[2,11] Los pacientes que tienen problemas de comunicación con sus familias, amigos y médicos también tienen mayor riesgo de presentar ansiedad.[11]
Por otra parte, la ansiedad puede conducir a sobrestimar un pronóstico negativo. En un estudio longitudinal de mujeres con carcinoma ductal in situ (N = 487), se estableció que la ansiedad medida de acuerdo con la Hospital Anxiety and Depression Scale fue el factor que se relacionó más sistemática y firmemente con una percepción inexacta y una sobrestimación de futuros riesgos relacionados con un cáncer de mama.[12]
En los pacientes con enfermedad en estadio avanzado, a menudo la causa de la ansiedad no es el miedo a la muerte sino a los aspectos de dolor incontrolable, aislamiento, abandono y dependencia.[13] Muchos de estos factores se pueden manejar cuando se los evalúa y trata de forma adecuada.
Trastorno de ansiedad causado por otras afecciones generales
En el cuadro siguiente se subrayan las causas posibles de ansiedad en los pacientes de cáncer.
| Problema médico | Ejemplos |
|---|---|
| aAdaptado de Massie.[14] | |
| Dolor controlado precariamente | Medicación insuficiente o administrada cuando se necesita. |
| Estados metabólicos anormales | Hipoxia, émbolo pulmonar, sepsis, delirium, hipoglucemia, hemorragia, oclusión coronaria o insuficiencia cardíaca. |
| Tumores secretores de hormonas | Feocromocitoma, adenoma o carcinoma tiroideo, adenoma paratiroideo, tumores que producen corticotropina e insulinoma. |
| Medicamentos que producen ansiedad | Corticoesteroides, neurolépticos usados como antieméticos, tiroxina, broncodilatadores, estimulantes adrenérgicos beta, antihistamínicos y benzodiacepinas (a menudo se observan reacciones paradójicas en personas de edad avanzada). |
| Afecciones que producen ansiedad | Abstinencia de sustancias (por ejemplo, bebidas alcohólicas, opioides o sedantes hipnóticos). |
Los pacientes con dolor grave están ansiosos y agitados, y la ansiedad puede estimular o empeorar el dolor. Para controlar adecuadamente el dolor, se debe tratar la ansiedad del paciente.[15,16]
La aparición de ansiedad aguda puede que sea un precursor de un cambio en el estado metabólico o de otro episodio clínico inminente, como un infarto de miocardio, una infección o una neumonía. La sepsis y las anomalías de los electrolitos también pueden causar síntomas de ansiedad. La ansiedad súbita con dolor de pecho o disnea a veces indican una embolia pulmonar. Los pacientes hipóxicos pueden experimentar ansiedad, quizás tengan miedo de asfixiarse.
Muchos medicamentos pueden precipitar la ansiedad en las personas enfermas. Por ejemplo, los corticoesteroides pueden producir agitación motriz, agitación y manía, así como depresión e ideas suicidas. Los broncodilatadores y los estimulantes de los receptores adrenérgicos beta empleados para tratar afecciones respiratorias crónicas pueden causar ansiedad, irritabilidad y temblores. La acatisia o agitación motriz, acompañada de sentimientos subjetivos de sufrimiento, es un efecto secundario de los medicamentos neurolépticos que se emplean generalmente para controlar la emesis. Además, la abstinencia de opioides, benzodiacepinas, barbitúricos, nicotina y bebidas alcohólicas puede producir ansiedad, agitación y comportamientos que tal vez sean problemáticos para los pacientes en tratamiento activo.
Ciertos sitios tumorales pueden producir síntomas que se asemejan a los trastornos de ansiedad. Los feocromocitomas y los microadenomas hipofisarios se pueden manifestar como episodios de pánico y ansiedad.[17] Los cánceres pancreáticos que no secretan hormonas pueden causar síntomas de ansiedad. Los tumores primarios de pulmón y las metástasis en el pulmón a menudo pueden causar disnea, que puede provocar ansiedad.
Trastornos de ansiedad primarios
Los pacientes que tienen los siguientes síntomas a veces presentaban un trastorno de ansiedad preexistente debido al estrés causado por el diagnóstico y el tratamiento del cáncer:
- Miedo intenso.
- Incapacidad de absorber información.
- Incapacidad de cooperar con los procedimientos médicos.
Los síntomas somáticos son los siguientes:
- Disnea.
- Transpiración.
- Sensación de mareo.
- Palpitaciones.
Los pacientes de cáncer pueden presentar cualquiera de los múltiples trastornos de ansiedad diagnosticados según los criterios de la quinta edición del Manual Diagnóstico y Estadístico de los Trastornos Mentales, como los siguientes:
- Fobias.
- Trastorno de angustia.
- Trastorno de ansiedad generalizada.
- Trastorno obsesivo compulsivo (posiblemente en forma de obsesión por la recidiva del cáncer).
- Trastorno de ansiedad por la salud.
- Trastorno de estrés postraumático (si se relaciona con el diagnóstico de cáncer, para obtener más información consultar Estrés postraumático relacionado con el cáncer).
- Trastorno de ansiedad causado por otra afección.
Los pacientes con estos trastornos de ansiedad generalmente sufren por sus síntomas y aceptan la intervención conductual y psicofarmacológica.[5]
Fobias
Las fobias son temores persistentes o evitación de un objeto o situación circunscritos. Las personas con fobias suelen experimentar una ansiedad intensa y evitan situaciones que potencialmente les puedan provocar miedo. Los pacientes con cáncer presentan las fobias de varias maneras, como temor a ver sangre o lesiones en los tejidos (también conocido como fobia a las agujas) o claustrofobia (por ejemplo, durante un procedimiento de imágenes por resonancia magnética). Las fobias pueden complicar los procedimientos médicos y resultar en el rechazo de una intervención o pruebas necesarias.[5] Por lo general, las fobias responden bien a la terapia y a la terapia cognitiva conductual (TCC).
Trastorno de angustia
En el caso del trastorno de angustia, el síntoma predominante es la ansiedad de inicio rápido e intensa, que casi siempre se acompaña de síntomas somáticos graves como los siguientes:
- Disnea.
- Mareos.
- Palpitaciones.
- Náuseas.
- Miedo a estar enloqueciendo o estar sufriendo un infarto de miocardio.
El trastorno de angustia se caracteriza por ataques de pánico aislados repentinos, a menudo sin un factor desencadenante específico, y se intensifican rápidamente. Los ataques son autolimitados y, por lo general, duran entre 10 y 20 minutos, si bien el malestar psicológico y el temor a su repetición duren más tiempo. Los pacientes con ataques de pánico a menudo presentan con síntomas que pueden ser difíciles de diferenciar de otros trastornos, aunque los antecedentes conocidos de un trastorno de angustia pueden ayudar a aclarar el diagnóstico. Un trastorno de angustia en pacientes de cáncer a menudo se trata con benzodiacepinas y antidepresivos,[5] pero también responden bien a la TCC.
Trastorno de ansiedad generalizada
Los trastornos de ansiedad generalizada se caracterizan por una ansiedad continua, poco realista y excesiva, y preocupación acerca de dos o más circunstancias vitales de un grado tal que se torna generalizada y no responde a palabras tranquilizadoras ni pruebas en contrario. Es probable que se notifiquen los siguientes síntomas físicos, pero no son tan repentinos ni intensos como los ataques de angustia:
- Tensión motriz (agitación, tensión muscular y fatiga con facilidad).
- Hiperactividad autonómica (disnea, palpitaciones, transpiración y mareos).
- Vigilancia en la exploración (sensación de excitación e impaciencia, irritabilidad y respuestas sorpresivas exageradas).
Trastorno obsesivo compulsivo
Los trastornos obsesivos compulsivos (TOC) se caracterizan por pensamientos, ideas o imágenes (obsesiones) persistentes y por comportamientos repetitivos (compulsiones), que tienen un propósito e intención que realiza una persona para controlar la intensidad de su sufrimiento. Para satisfacer los requisitos de diagnóstico de un TOC, los pensamientos obsesivos y los comportamientos compulsivos deben ocupar mucho tiempo en la mente del paciente y crear tal distracción que interfieren con la capacidad de la persona para desempeñarse en situaciones laborales, académicas o sociales.
Puede que los pacientes de cáncer con antecedentes de TOC exhiban comportamientos compulsivos, como lavarse las manos, revisar o contar a tal extremo que no pueden cumplir con el tratamiento. En tales pacientes, la preocupación normal acerca del diagnóstico de cáncer y su pronóstico se puede convertir en síntomas totalmente obsesivo compulsivos y provocar una incapacidad grave. Los TOC a menudo se controlan con medicamentos antidepresivos serotoninérgicos (inhibidores selectivos de la recaptación de serotonina [ISRS] y clomipramina) y TCC. Los pensamientos obsesivos leves o el uso de rituales que no interfieren con el tratamiento se podrían abordar con TCC, pero los medicamentos no son indicados. Este trastorno es poco frecuente en pacientes de cáncer que no tienen antecedentes premórbidos de algún tipo de trastorno de ansiedad.
Trastorno de ansiedad generalizada
Se ha observado que los sobrevivientes de cáncer padecen trastorno de ansiedad generalizada en relación con sus temores de recidiva, como los siguientes:[18]
- Hipervigilancia de posibles síntomas físicos.
- Somatización.
- Concentración extrema en el estado del cáncer.
- Identificación con la función de paciente en los entornos de atención.
- Solicitud frecuente de atención, incluso después de que las necesidades de cuidado de alto mantenimiento están satisfechas (incluso, pero no limitadas, a las solicitudes de visitas adicionales al consultorio médico y exploraciones prematuras de mantenimiento).
Si bien la investigación está en curso, las pautas clínicas iniciales sugieren que la TCC y el tratamiento con ISRS pueden ser beneficiosos.
En un estudio realizado en sobrevivientes sin cáncer después del tratamiento (N = 133) se investigó el conjunto completo de trastornos de ansiedad usando diagnósticos estandarizados y evaluaciones dimensionales.[19] Solo se incluyeron los sobrevivientes de riesgo alto (pacientes que tuvieron un resultado positivo en la detección de síntomas de ansiedad en la vida cotidiana y que habían confirmado al menos ansiedad moderada por el cáncer). Se evaluó un vínculo con el cáncer analizando el momento de aparición de los trastornos de ansiedad relacionados con un diagnóstico del cáncer. En el estudio se encontró que el 58 % de los trastornos de ansiedad comenzaron después de un diagnóstico de cáncer y que el 68 % de los sobrevivientes notificaron haber tenido su primer episodio de trastorno de ansiedad. Los trastornos de ansiedad comunes en este grupo de riesgo alto de sobrevivientes de cáncer fueron los siguientes:[19]
- Trastorno de ansiedad generalizada (41 %).
- Determinadas fobias (14 %).
- Trastorno de ansiedad social (13 %).
Muchos sobrevivientes que notificaron ansiedad generalizada (74 %) y ansiedad social (62 %) presentaron los síntomas después del diagnóstico de cáncer y relacionaron sus síntomas con el cáncer. La ansiedad generalizada muchas veces se desencadenó por cambios en la percepción de la salud y la vulnerabilidad relacionados con el cáncer, y la ansiedad social se asoció a cambios en la apariencia, la autopercepción y la falta de vínculos sociales relacionados con el cáncer. En los supervivientes sin antecedentes de trastornos de ansiedad, los efectos secundarios persistentes relacionados con el tratamiento predijeron la aparición del primer episodio de trastorno de ansiedad. En los sobrevivientes con antecedentes de trastorno de ansiedad, un estadio más avanzado del cáncer predijo la aparición de síntomas de trastorno de ansiedad.[19]
Detección y evaluación
El manejo eficaz de los trastornos de ansiedad empieza con una evaluación minuciosa y un diagnóstico preciso. Los miedos e incertidumbres normales relacionados con el cáncer suelen ser intensos. Con frecuencia, no hay una distinción clara entre miedos normales y miedos que son más graves y alcanzan los criterios para ser considerados trastornos de ansiedad. Para obtener más información, consultar el Cuadro 3.[14]
Para evaluar la gravedad de la ansiedad, es importante entender el grado en que los síntomas de ansiedad interfieren en las actividades de la vida diaria. Los exámenes de detección de la ansiedad podrían incluir un breve cuestionario de autonotificación que, si excede un límite previamente definido de puntuación, se le podría dar seguimiento con una entrevista clínica en más profundidad. Se ha utilizado una gran variedad de cuestionarios generales de detección para identificar el sufrimiento. También se han utilizado otros cuestionarios de autonotificación específicos para la ansiedad (por ejemplo, el State-Trait Anxiety Inventory) y se ha formulado y validado un cuestionario para evaluar la ansiedad relacionada con el cáncer de próstata.[2,20,21] Para obtener más información, consultar la sección Instrumentos de autonotificación para la detección.
La siguiente es una lista de síntomas diseñada para distinguir la preocupación común o normal de los síntomas más graves de ansiedad. Cuando los pacientes notifican los síntomas más graves, se justifica una derivación a un profesional de la salud mental calificado.
| Síntomas de preocupación normal o común | Síntomas de trastornos de ansiedad más graves |
|---|---|
| aAdaptado de Nicholas.[22] | |
| La preocupación aparece y desaparece. | La preocupación es constante. |
| Tiene cierta dificultad para concentrarse. | No se puede concentrar. |
| La mayor parte del tiempo puede "desconectarse de los pensamientos". | La mayor parte del tiempo no puede "desconectarse de los pensamientos". |
| Ocasionalmente tiene problemas para dormirse. | Tiene problemas para dormirse o se despierta temprano la mayoría de las noches. |
| Ocasionalmente tiene crisis de llanto que parecen proporcionarle cierto alivio. | Con frecuencia, tiene crisis de llanto que interfieren con sus actividades diarias. |
| El miedo y la aprensión se conectan claramente con una situación cercana (por ejemplo, comenzar el tratamiento, acudir a una cita médica o recibir los resultados de una prueba). | El miedo y la aprensión se consideran "libres" y parecen estar presentes la mayor parte del tiempo. |
| Tiene pocos síntomas físicos o ninguno (por ejemplo, corazón galopante, xerostomía, manos temblorosas o agitación). | Tiene muchos síntomas físicos (por ejemplo, corazón galopante, xerostomía, manos temblorosas o agitación). |
| Tiene recursos para disminuir la ansiedad (por ejemplo, distraerse manteniéndose ocupado). | Tiene pocas formas o ninguna para disminuir la ansiedad. |
Intervenciones
Las opciones de tratamiento deben tener en cuenta la calidad de vida del paciente y no basarse solo en el trastorno. Cuando la ansiedad es situacional (es decir, producida por dolor, otra afección subyacente, un tumor que secreta hormonas o un efecto secundario de la medicación), el tratamiento inmediato de la causa conduce generalmente a un inmediato control de los síntomas de ansiedad.[1]
El manejo inicial de la ansiedad supone proporcionar al paciente información y apoyo adecuados. Los síntomas iniciales, que justifican una consulta psicológica o psiquiátrica, a menudo se comunican primero al oncólogo a cargo del paciente o al cirujano.[23][Nivel de evidencia: IV]
Intervenciones psicosociales
Los abordajes psicosociales del manejo de la ansiedad son los siguientes:[24]
- Combinaciones de técnicas de terapia cognitiva conductual (TCC).
- Psicoterapia introspectiva.
- Intervención en crisis.
- Terapia de pareja y familia.
- Terapia de grupo.
- Grupos de autoayuda.
- Intervenciones para la relajación.
La hipnosis, la meditación, la relajación progresiva, las imágenes guiadas y la biorretroalimentación se pueden emplear para tratar los síntomas de ansiedad relacionados con las siguientes situaciones:
- Procedimientos dolorosos.
- Síndromes de dolor.
- Situaciones de crisis.
- Miedos anticipatorios.
- Síndromes depresivos.
La combinación de diferentes abordajes puede resultar beneficiosa para algunos pacientes. La derivación de pacientes que quizás estén lidiando con trastornos de ansiedad para una evaluación completa y tratamiento psicológico afianzará la participación en la atención, mejorará la calidad de vida y reducirá la experiencia de dolor.[25,26] Para obtener más información, consultar la sección Intervenciones psicosociales para el sufrimiento.
En un estudio de 509 sobrevivientes de cáncer de mama sin recidiva entre 5 y 9 años después del tratamiento, se examinó la utilidad de una intervención integral que combinaba estrategias positivas para hacer frente a situaciones difíciles basada en TCC (por ejemplo, aplacar los pensamientos mediante charlas con uno mismo o relajación) con la educación sobre la enfermedad, el tratamiento y los efectos secundarios posibles.[27] Los hallazgos de este estudio indicaron que las mujeres en el grupo de intervención (N = 244) usaron de manera sistemática los componentes de la intervención para lidiar con los factores desencadenantes de temores a la recidiva del cáncer de mama y los efectos secundarios a largo plazo del tratamiento. Para la mayoría de las mujeres en el grupo de intervención, las estrategias fueron útiles.[27][Nivel de evidencia: I]
Las pruebas preliminares indican que hay diferencias raciales en el uso y beneficio de estrategias específicas para hacer frente a una situación difícil (por ejemplo, las mujeres afroamericanas utilizan más las estrategias religiosas como la oración y la fe, y obtienen un mayor beneficio de ellas).[27][Nivel de evidencia: I];[28][Nivel de evidencia: II]
Intervenciones farmacológicas
A menudo, los pacientes de cáncer tienen síntomas de ansiedad y depresión ocasionados por las tensiones relacionadas con el tratamiento del cáncer. Tales síntomas de sufrimiento se resuelven con frecuencia mediante apoyo psicológico solo; sin embargo, en algunos casos, se necesitan intervenciones farmacológicas. Para obtener una lista de los síntomas de trastornos de ansiedad que posiblemente exijan tratamiento farmacológico, consultar el Cuadro 4 .
Las opciones de tratamientos farmacológicos para los trastornos de ansiedad se fundamentan en evidencia de estudios realizados con pacientes sin cáncer debido a la carencia de dichos estudios en pacientes de cáncer. Sin embargo, se han usado algunos de estos medicamentos durante varias décadas para tratar los síntomas de ansiedad en los pacientes de cáncer. Las opciones de tratamiento y su uso en las situaciones descritas a continuación también se fundamentan en la experiencia clínica con estos fármacos en los pacientes de cáncer.
Se considera el uso de medicamentos para el tratamiento de los trastornos de ansiedad cuando los pacientes presentan síntomas más graves o cuando sus respuestas a las intervenciones psicosociales son inadecuadas. Cuando no se dispone de recursos para la orientación o cuando el paciente se niega a recibir dichos recursos, puede que se considere la administración de medicamentos mejor pronto que tarde. En ciertos casos, los medicamentos se inician de forma simultánea con la intervención psicosocial cuando existe la probabilidad de que el apoyo psicosocial solo sea inadecuado para proveer alivio o para proporcionarlo lo suficientemente rápido.
Las intervenciones farmacológicas se pueden usar a largo o corto plazo, dependiendo de factores propios del paciente y de su enfermedad, como los siguientes:
- Gravedad de los síntomas de ansiedad.
- Grado de disfunción social o funcional.
- Anamnesis psiquiátrica.
- Presencia continuada del cáncer.
- Factores relacionados con el tratamiento del cáncer que contribuyen de manera directa o indirecta a la ansiedad (por ejemplo, tratamientos contra el cáncer de intensidad alta o prolongada, o tratamientos con fármacos de los que se sabe que ocasionan síntomas psiquiátricos [por ejemplo, citocinas]).
Los medicamentos específicos para la ansiedad, como las benzodiacepinas que se detallan en el Cuadro 4, se usan con frecuencia solos o combinados con abordajes psicológicos a fin de aliviar los síntomas de ansiedad. Por su efecto rápido, estos medicamentos son eficaces para el tratamiento urgente de los trastornos de ansiedad. Por lo general, se usan como monoterapia o como adyuvantes durante el manejo de corto plazo (<4 meses) de los trastornos de ansiedad. Su uso a largo plazo (>4 meses) es limitado por la posibilidad de abuso y dependencia, y por su falta de efectos antidepresivos, ya que la depresión se presenta con frecuencia como comorbilidad de los trastornos de ansiedad. A continuación, se presentan algunas de las indicaciones y consideraciones sobre la inocuidad de la administración de benzodiacepinas a pacientes de cáncer:[29,30]
- Las benzodiacepinas de acción corta, como el alprazolam y el lorazepam, se pueden administrar de forma eficaz para suministrar alivio a corto plazo en diferentes momentos específicos en el continuo del diagnóstico, el tratamiento y la recidiva del cáncer. Entre los ejemplos de uso a corto plazo se incluye el tratamiento de la ansiedad durante los procedimientos diagnósticos (por ejemplo, ciertos procedimientos de radioimágenes) y de la ansiedad en torno al resultado de las pruebas pendientes (por ejemplo, durante las mamografías anuales en pacientes con antecedente de cáncer de mama).
- Los tratamientos del cáncer como los regímenes quimioterapéuticos intensivos pueden causar un sufrimiento físico y emocional importante y, exacerbar la ansiedad. Los fármacos de acción corta o intermedia (por ejemplo, el clonazepam) pueden aliviar mucho la ansiedad y otros síntomas, como el insomnio ocasionado por la ansiedad, durante los tratamientos activos del cáncer.
- Los medicamentos de acción más prolongada (como el diazepam y el clorazepato) se deben evitar debido a su semivida prolongada. Estos medicamentos pueden ocasionar o exacerbar la disfunción cognitiva, la desorientación y la somnolencia debido a su potencial de acumulación.
- Los pacientes con trastornos médicos como el delirium pueden presentar ansiedad y agitación. Se contraindica la administración de benzodiacepinas a los pacientes con estos trastornos porque estos fármacos pueden ocasionar o exacerbar la confusión y desorientación.
- Todos los pacientes, en particular los adultos de más edad, que reciben benzodiacepinas se deben controlar de cerca para detectar el deterioro cognitivo, la sedación diurna y el riesgo de caídas. La administración de estos fármacos se debe optimizar en los pacientes mayores, con múltiples comorbilidades, con hepatopatía o que reciben múltiples medicamentos.
- Se debe realizar un seguimiento cuidadoso de estos fármacos y mejorar al máximo su uso en pacientes que reciben otros sedantes depresivos del sistema nervioso central o fármacos que puedan producir depresión respiratoria (como los opioides).
- Es importante el seguimiento continuo y la reevaluación de los síntomas de ansiedad en todos los pacientes que reciben benzodiacepinas. El uso de estos medicamentos se puede disminuir si los síntomas de ansiedad se resuelven después de que termina el tratamiento del cáncer.
- En algunos pacientes, el uso de las benzodiacepinas se continúa (como monoterapia o tratamiento adyuvante) durante un período más largo (>4 meses) debido a síntomas de ansiedad persistentes y debilitantes. Es importante dar seguimiento a la presentación de tolerancia, abuso, y dependencia, al igual que a síntomas comórbidos depresivos en tales pacientes. El uso prolongado y a veces crónico de estos fármacos se podría indicar para una subpoblación de pacientes con un seguimiento cercano y una evaluación frecuente del beneficio y los riesgos. Los síntomas de ansiedad persistentes (al cabo de 3 o 4 meses) con frecuencia conducen a depresión. Los pacientes con síntomas persistentes de ansiedad, con depresión o sin esta, se podrían beneficiar de otros tratamientos (por ejemplo, paroxetina y sertralina).
| CYP = isoenzimas del citocromo P450. | |||
| aAdaptado de Lorenz et al.,[31] Traeger et al.,[32] y Lexicomp.[33] | |||
| bPara obtener información sobre la dosificación de los antidepresivos empleados en el tratamiento de la ansiedad, consultar Depresión. | |||
| Benzodiacepinas | • Administrar en forma aguda, luego disminuir según se tolere. | ||
| Fármacob | Dosis inicial (intervalo) | Comentarios | Referencias |
| Alprazolam | 0,25–0,5 mg 3 veces por día (≤4 mg/d) | Disponible en forma de liberación prolongada. | [33][Nivel de evidencia: I] |
| Clordiazepóxido | 5–10 mg 3 a 4 veces por día | No se indica dosis máxima. | [33][Nivel de evidencia: I] |
| Ajustar la dosis cuidadosamente hasta >40 mg/d. | |||
| Clonazepam | 0,125–0,25 mg 2 o 3 veces por día (≤4 mg/d) | Administrado con más frecuencia. | [33][Nivel de evidencia: II] |
| Clorazepato | 30 mg/d en 2 a 3 dosis (≤60 mg/d) | [33][Nivel de evidencia: I] | |
| Diazepam | 2–10 mg 2 a 4 veces por día | No se indica dosis máxima. | [33][Nivel de evidencia: I] |
| Ajustar la dosis cuidadosamente hasta >40 mg/d. | |||
| Lorazepam | 0,5–1 mg 2 o 3 veces por día (≤10 mg/d) | Preferido para hepatopatías. | [33][Nivel de evidencia: I] |
| Administrado con más frecuencia. | |||
| Oxazepam | 10–15 mg 3 a 4 veces por día | No se indica dosis máxima. | [33][Nivel de evidencia: I] |
| Ajustar la dosis cuidadosamente hasta >120 mg/d. | |||
| Preferido para hepatopatías. | |||
| Antidepresivos. | • Administrar en caso de que se necesite tratamiento a largo plazo. | ||
| • Administrar con cautela con tamoxifeno debido a las interacciones con CYP2D6. | |||
| Fármacob | Dosis inicial (intervalo) | Comentarios | Referencia |
| Citalopram | 10–40 mg/d | Prolongación del intervalo QT corregido. | [33][Nivel de evidencia: II] |
| Preferido con tamoxifeno. | |||
| Desipramina | 25–200 mg/d | Administrar con cautela en pacientes mayores. | [33][Nivel de evidencia: III] |
| Duloxetina | 20–60 mg/d | [33][Nivel de evidencia: I] | |
| Escitalopram | 5–20 mg/d | Prolongación del intervalo QT corregido. | [33][Nivel de evidencia: II] |
| Preferido con tamoxifeno. | |||
| Fluoxetina | 10–60 mg/d | No administrar con tamoxifeno. | [33][Nivel de evidencia: II] |
| Imipramina | 10–200 mg/d | Administrar con cautela en pacientes mayores. | [33][Nivel de evidencia: III] |
| Mirtazapina | 7,5–45 mg/d | [33][Nivel de evidencia: III] | |
| Paroxetina | 10–40 mg/d | No administrar con tamoxifeno. | [33][Nivel de evidencia: I] |
| Sertralina | 25–200 mg/d | [33][Nivel de evidencia: I] | |
| Venlafaxina | 37,5–225 mg/d | [33][Nivel de evidencia: I] | |
| Otros fármacos | |||
| Fármacob | Dosis inicial (intervalo) | Comentarios | Referencia |
| Buspirona | 7,5 mg 2 veces por día | ≤30 mg/d para la ansiedad. | [33][Nivel de evidencia: I] |
| Hidroxizina | 50–100 mg 4 veces por día | [33][Nivel de evidencia: I] | |
| Neurolépticos | • Tener en cuenta para tratamiento de la ansiedad resistente al tratamiento. | ||
| • Más relacionados con aumento importante de peso. | |||
| • Evaluar también para efectos secundarios de síndrome metabólico, cardiovasculares y cerebrovasculares. | |||
| • Riesgo de prolongación del intervalo QT corregido y efectos secundarios extrapiramidales. | |||
| Fármacob | Dosis inicial (intervalo) | Comentarios | Referencia |
| Aripiprazol | 2–10 mg/d | Ajustar la dosis cuidadosamente hasta >15 mg/d. | [33][Nivel de evidencia: II] |
| Haloperidol | 0,5–2 mg 2 a 3 veces por día | [33][Nivel de evidencia: II] | |
| Olanzapina | 2,5–10 mg/d | [33][Nivel de evidencia: II] | |
| Quetiapina | 12,5–25 mg/d | Se puede ajustar la dosis hasta >300 mg/d. | [33][Nivel de evidencia: I] |
| Observación de beneficio en algunos ensayos. | |||
| Risperidona | 0,5–1 mg 1 o 2 veces por día | Ajustar la dosis cuidadosamente hasta >2 mg/d. | [33][Nivel de evidencia: I] |
La elección de una benzodiacepina depende de los siguientes aspectos:
- Duración del efecto que conviene más al paciente.
- Rapidez deseada para el inicio del efecto.
- Vía de administración disponible.
- Presencia o ausencia de metabolitos activos.
- Problemas metabólicos.
El cronograma de dosificación depende de la tolerancia del paciente y exige un ajuste individual de la dosis. Las benzodiacepinas de acción más corta (alprazolam y lorazepam) se administran de 3 a 4 veces por día. Las benzodiacepinas de acción corta, en particular aquellas que se pueden administrar por vías múltiples (lorazepam y diazepam) son eficaces para grados altos de sufrimiento. Las benzodiacepinas disminuyen la ansiedad diurna y reducen el insomnio. Los efectos secundarios más comunes de las benzodiacepinas dependen de la dosis y se controlan mediante su ajuste para evitar somnolencia, confusión, falta de coordinación motriz y sedación. Para obtener más información, consultar Trastornos del sueño.
Todas las benzodiacepinas pueden causar cierto grado de depresión respiratoria, que en general es mínima en pacientes no tratados con benzodiacepinas en el pasado. Las benzodiacepinas se deben emplear con cautela (o evitarse) en caso de insuficiencia respiratoria.
Siempre que se administren sedantes a pacientes que tienen un funcionamiento respiratorio en el límite de la normalidad, se deben tomar las precauciones estándar. Es importante evaluar constantemente a esta población. Las dosis bajas del antihistamínico hidroxizina (25 mg, 2 o 3 veces por día) se pueden usar con inocuidad en tales situaciones. Para pacientes con disfunción hepática, es mejor emplear benzodiacepinas de acción corta, que se metabolizan principalmente mediante conjugación y se excretan por los riñones (por ejemplo, oxazepam, temazepam o lorazepam). Otra ventaja del uso de lorazepam es su falta de metabolitos activos. Por el contrario, se deben seleccionar otras benzodiacepinas en casos de insuficiencia renal.
Los IRSS (por ejemplo, fluoxetina y sertralina) y los inhibidores de la recaptación de serotonina y norepinefrina (IRSN) (por ejemplo, venlafaxina) se consideran fármacos de primera línea para el tratamiento a largo plazo de los trastornos de ansiedad. Los IRSS e IRSN también son eficaces para tratar síntomas depresivos, con frecuencia comórbidos con los trastornos de ansiedad persistentes. Los IRSS e IRSN pueden tomar alrededor de 4 a 6 semanas para tener efecto debido a su inicio lento de acción. Las benzodiacepinas se usan con frecuencia como fármacos adyuvantes para estabilizar los síntomas en el período inicial de tratamiento con IRSS y IRSN.
Los antidepresivos atípicos (por ejemplo, mirtazapina) se usan algunas veces para el tratamiento de los trastornos de ansiedad debido a sus efectos adicionales en los síntomas comórbidos, como el insomnio. Los medicamentos más antiguos como los antidepresivos tricíclicos (por ejemplo, imipramina y clomipramina) y los inhibidores de la monoamina oxidasa (por ejemplo, fenelzina) también son eficaces para tratar los trastornos de ansiedad. El uso de antidepresivos en la práctica clínica está limitado por sus efectos secundarios desfavorables, tolerabilidad precaria y riesgo más altos de efectos tóxicos.[34]
Para obtener más información, consultar la sección Riesgo de suicidio en pacientes con cáncer en Depresión.
La buspirona, que no es una benzodiacepina, es útil para los pacientes sin tratamiento previo con una benzodiacepina y para aquellos que pueden abusar de las benzodiacepinas (por ejemplo, quienes tienen antecedentes de abuso de sustancias ilícitas o alcoholismo). La buspirona también es útil para la población geriátrica al aumentar la concentración de la fluoxetina para el tratamiento de la ansiedad y la depresión. La dosis inicial es de 5 mg 3 veces por día y se puede aumentar a 15 mg 3 veces por día. La buspirona también se puede administrar 2 veces por día.
Para el tratamiento de los síntomas de ansiedad resistentes al tratamiento o en ciertas situaciones clínicas, se considera el uso de clases específicas de medicamentos. Las dosis bajas de neurolépticos (por ejemplo, 10 mg de tioridazina 3 veces por día, y risperidona, 1 mg 2 veces por día) se emplean para tratar la ansiedad grave cuando una dosis adecuada de una benzodiacepina es ineficaz o si se espera que el paciente responda mal a las benzodiacepinas (por ejemplo, pacientes con metástasis encefálicas). También se pueden emplear dosis bajas de neurolépticos cuando las benzodiacepinas no son útiles o cuando existe la posibilidad de delirium, demencia u otras complicaciones. Los anticonvulsivos en dosis bajas (por ejemplo, pregabalina, 200 mg por día) se usan algunas veces para tratar la ansiedad grave resistente al tratamiento cuando otros medicamentos son ineficaces o están contraindicados debido a ciertos riesgos relacionados con el uso de los mismos.[34] Por lo general, el uso de ciertos neurolépticos o anticonvulsivos se toma en cuenta solo luego de ciertos ensayos adecuados de fármacos de primera línea (IRSS, IRSN y benzodiacepinas) debido a los efectos secundarios importantes y el potencial de interacción farmacológica con estas sustancias. Se recomienda enfáticamente consultar con un médico psiquiatra antes de administrar estos medicamentos, con participación directa de un psiquiatra o el tratamiento de pacientes que toman estos medicamentos.
La presencia o ausencia de comorbilidades psiquiátricas o médicas específicas, es con frecuencia un factor de suma importancia en la selección de los tratamientos farmacológicos. Las interacciones farmacocinéticas y farmacodinámicas con otros medicamentos también son factores importantes para tomar en cuenta. A continuación, se dan algunos ejemplos de dichos factores y situaciones clínicas que impulsan a la selección de tratamientos farmacológicos:
- Cuando los síntomas depresivos son comórbidos con la ansiedad, se recomiendan enfáticamente los tratamientos con IRSS, IRSN u otros antidepresivos.
- Cuando el dolor neuropático es comórbido con los síntomas de ansiedad, se deben considerar antidepresivos específicos con reconocida eficacia en el tratamiento del dolor neuropático (por ejemplo, duloxetina y venlafaxina).
- Cuando los sofocos son comórbidos con los síntomas de ansiedad, se deben tomar en cuenta fármacos específicos con reconocida eficacia en el tratamiento de los sofocos (por ejemplo, venlafaxina).
- Se evitan los medicamentos específicos con efectos secundarios conocidos (por ejemplo, náuseas con duloxetina o riesgo de sedación con mirtazapina) cuando los pacientes ya están presentando estos efectos secundarios a causa del tratamiento del cáncer y debido a la posible exacerbación de estos efectos secundarios.
- Los pacientes tratados con inhibidores de CYP2D6 (por ejemplo, paroxetina) y tamoxifeno pueden ser vulnerables a interacciones farmacológicas importantes. Para obtener más información, consultar Sofocos y sudores nocturnos.
No se han llevado a cabo estudios de tratamiento farmacológico en niños y adolescentes con cáncer. Aún más, la evidencia para el tratamiento farmacológico de los trastornos de ansiedad en niños sin cáncer también es limitada. En un metanálisis de ensayos clínicos con antidepresivos pediátricos,[35][Nivel de evidencia: I] se concluyó que los antidepresivos, en comparación con un placebo, son eficaces para el tratamiento de los trastornos de ansiedad y que los efectos más fuertes son en trastornos de ansiedad que no son TOC y los efectos intermedios en TOC. Para obtener información sobre el riesgo de la ideación suicida y los intentos de suicidio relacionados con el uso de antidepresivos, consultar Riesgo de suicidio en pacientes con cáncer en Depresión.
En general, se debe alentar a los pacientes de cáncer a tomar una cantidad suficiente de medicación para aliviar la ansiedad. Los medicamentos se disminuyen gradualmente y se descontinúan fácilmente cuando los síntomas ceden. Las inquietudes sobre la adicción en pacientes de cáncer tienden a ser exageradas y, a menudo, interfieren en el alivio adecuado de los síntomas.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Breitbart W: Identifying patients at risk for, and treatment of major psychiatric complications of cancer. Support Care Cancer 3 (1): 45-60, 1995. [PUBMED Abstract]
- Stark D, Kiely M, Smith A, et al.: Anxiety disorders in cancer patients: their nature, associations, and relation to quality of life. J Clin Oncol 20 (14): 3137-48, 2002. [PUBMED Abstract]
- Schag CA, Heinrich RL: Anxiety in medical situations: adult cancer patients. J Clin Psychol 45 (1): 20-7, 1989. [PUBMED Abstract]
- Mitchell AJ, Chan M, Bhatti H, et al.: Prevalence of depression, anxiety, and adjustment disorder in oncological, haematological, and palliative-care settings: a meta-analysis of 94 interview-based studies. Lancet Oncol 12 (2): 160-74, 2011. [PUBMED Abstract]
- Razavi D, Stiefel F: Common psychiatric disorders in cancer patients. I. Adjustment disorders and depressive disorders. Support Care Cancer 2 (4): 223-32, 1994. [PUBMED Abstract]
- Maguire P, Faulkner A, Regnard C: Managing the anxious patient with advancing disease--a flow diagram. Palliat Med 7 (3): 239-44, 1993. [PUBMED Abstract]
- Fischer DJ, Villines D, Kim YO, et al.: Anxiety, depression, and pain: differences by primary cancer. Support Care Cancer 18 (7): 801-10, 2010. [PUBMED Abstract]
- Suskin JA, Paul S, Stuckey AR, et al.: Risk factors for worse anxiety trajectories among patients undergoing cancer chemotherapy. Support Care Cancer 31 (1): 32, 2022. [PUBMED Abstract]
- Nordin K, Glimelius B: Predicting delayed anxiety and depression in patients with gastrointestinal cancer. Br J Cancer 79 (3-4): 525-9, 1999. [PUBMED Abstract]
- Green BL, Krupnick JL, Rowland JH, et al.: Trauma history as a predictor of psychologic symptoms in women with breast cancer. J Clin Oncol 18 (5): 1084-93, 2000. [PUBMED Abstract]
- Friedman LC, Lehane D, Webb JA, et al.: Anxiety in medical situations and chemotherapy-related problems among cancer patients. J Cancer Educ 9 (1): 37-41, 1994. [PUBMED Abstract]
- Partridge A, Adloff K, Blood E, et al.: Risk perceptions and psychosocial outcomes of women with ductal carcinoma in situ: longitudinal results from a cohort study. J Natl Cancer Inst 100 (4): 243-51, 2008. [PUBMED Abstract]
- Hackett TP, Cassem NH: Massachusetts General Hospital Handbook of General Hospital Psychiatry. 2nd ed. PSG, 1987.
- Massie MJ: Anxiety, panic, and phobias. In: Holland JC, Rowland JH, eds.: Handbook of Psychooncology: Psychological Care of the Patient With Cancer. Oxford University Press, 1989, pp 300-9.
- Velikova G, Selby PJ, Snaith PR, et al.: The relationship of cancer pain to anxiety. Psychother Psychosom 63 (3-4): 181-4, 1995. [PUBMED Abstract]
- Glover J, Dibble SL, Dodd MJ, et al.: Mood states of oncology outpatients: does pain make a difference? J Pain Symptom Manage 10 (2): 120-8, 1995. [PUBMED Abstract]
- Wilcox JA: Pituitary microadenoma presenting as panic attacks. Br J Psychiatry 158: 426-7, 1991. [PUBMED Abstract]
- Stark DP, House A: Anxiety in cancer patients. Br J Cancer 83 (10): 1261-7, 2000. [PUBMED Abstract]
- Arch JJ, Genung SR, Ferris MC, et al.: Presence and predictors of anxiety disorder onset following cancer diagnosis among anxious cancer survivors. Support Care Cancer 28 (9): 4425-4433, 2020. [PUBMED Abstract]
- Roth AJ, Rosenfeld B, Kornblith AB, et al.: The memorial anxiety scale for prostate cancer: validation of a new scale to measure anxiety in men with prostate cancer. Cancer 97 (11): 2910-8, 2003. [PUBMED Abstract]
- Roth A, Nelson CJ, Rosenfeld B, et al.: Assessing anxiety in men with prostate cancer: further data on the reliability and validity of the Memorial Anxiety Scale for Prostate Cancer (MAX-PC). Psychosomatics 47 (4): 340-7, 2006 Jul-Aug. [PUBMED Abstract]
- Nicholas DR: Emotional Side Effects of Cancer: Distinguishing Normal Distress from Mental Disorders [brochure]. Ball Memorial Hospital and Ball State University, 2008.
- Hinshaw DB, Carnahan JM, Johnson DL: Depression, anxiety, and asthenia in advanced illness. J Am Coll Surg 195 (2): 271-7; discussion 277-8, 2002. [PUBMED Abstract]
- Montazeri A, Jarvandi S, Haghighat S, et al.: Anxiety and depression in breast cancer patients before and after participation in a cancer support group. Patient Educ Couns 45 (3): 195-8, 2001. [PUBMED Abstract]
- Brown LF, Kroenke K, Theobald DE, et al.: The association of depression and anxiety with health-related quality of life in cancer patients with depression and/or pain. Psychooncology 19 (7): 734-41, 2010. [PUBMED Abstract]
- Osborn RL, Demoncada AC, Feuerstein M: Psychosocial interventions for depression, anxiety, and quality of life in cancer survivors: meta-analyses. Int J Psychiatry Med 36 (1): 13-34, 2006. [PUBMED Abstract]
- Gil KM, Mishel MH, Germino B, et al.: Uncertainty management intervention for older African American and Caucasian long-term breast cancer survivors. J Psychosoc Oncol 23 (2-3): 3-21, 2005. [PUBMED Abstract]
- Reddick BK, Nanda JP, Campbell L, et al.: Examining the influence of coping with pain on depression, anxiety, and fatigue among women with breast cancer. J Psychosoc Oncol 23 (2-3): 137-57, 2005. [PUBMED Abstract]
- Stiefel F, Berney A, Mazzocato C: Psychopharmacology in supportive care in cancer: a review for the clinician. I. Benzodiazepines. Support Care Cancer 7 (6): 379-85, 1999. [PUBMED Abstract]
- Michael Kaplan E, DuPont RL: Benzodiazepines and anxiety disorders: a review for the practicing physician. Curr Med Res Opin 21 (6): 941-50, 2005. [PUBMED Abstract]
- Lorenz RA, Jackson CW, Saitz M: Adjunctive use of atypical antipsychotics for treatment-resistant generalized anxiety disorder. Pharmacotherapy 30 (9): 942-51, 2010. [PUBMED Abstract]
- Traeger L, Greer JA, Fernandez-Robles C, et al.: Evidence-based treatment of anxiety in patients with cancer. J Clin Oncol 30 (11): 1197-205, 2012. [PUBMED Abstract]
- Lexicomp Online. Hudson, Ohio: Lexi-Comp, Inc., 2025. Available online with subscription. Last accessed Jan. 15, 2025.
- Hoffman EJ, Mathew SJ: Anxiety disorders: a comprehensive review of pharmacotherapies. Mt Sinai J Med 75 (3): 248-62, 2008 May-Jun. [PUBMED Abstract]
- Bridge JA, Iyengar S, Salary CB, et al.: Clinical response and risk for reported suicidal ideation and suicide attempts in pediatric antidepressant treatment: a meta-analysis of randomized controlled trials. JAMA 297 (15): 1683-96, 2007. [PUBMED Abstract]
Consideraciones para los pacientes pediátricos y sus familias
Adaptación psicológica
El tratamiento del cáncer infantil es una situación muy estresante, compleja y perturbadora para los niños y sus familiares. A menudo se considera que los niños que reciben tratamiento contra el cáncer tienen un riesgo significativamente mayor de depresión, ansiedad y otros indicadores de sufrimiento psicológico. Sin embargo, la evidencia empírica que apoya esta suposición es débil. En general, los estudios indican que los niños que reciben tratamiento para el cáncer y los niños sobrevivientes de cáncer a largo plazo presentan pocos problemas significativos de adaptación psicológica.[1-3]
Hay evidencia de que los niños presentan sufrimiento durante el tratamiento del cáncer. El sufrimiento es más importante al principio del tratamiento, por lo general cuando se requieren hospitalizaciones frecuentes, y con el paso del tiempo hay un menor sufrimiento.[4,5] Se comparó un grupo de 39 familias de niños con un diagnóstico reciente de leucemia, con un grupo de 49 familias de niños sanos. Si bien los padres y los niños que recibieron tratamiento para el cáncer informaron niveles más altos de sufrimiento justo después del diagnóstico, estos niveles disminuyeron durante los 4 años de seguimiento y no hubo diferencias significativas en el sufrimiento psicológico en comparación con la cohorte sana.[4] Hallazgos similares se notificaron en otros grupos culturales.[6]
Se ha cuestionado la validez de obtener informes precisos acerca del sufrimiento psicológico en esta población. En una investigación se analizó si una actitud defensiva psicológica podría estar ocultando la notificación de depresión y otros síntomas de sufrimiento psicológico. Los investigadores evaluaron a 107 niños tratados por cáncer y 422 controles sanos, que completaron una serie de mediciones de depresión y ansiedad.[7][Nivel de evidencia: II] Los niños que recibieron tratamiento para el cáncer notificaron significativamente menos síntomas de depresión que los niños sanos, y el estilo defensivo no se relacionó con las notificaciones de depresión. En otro estudio con 205 niños y 321 progenitores de niños con cáncer, asma, u otros problemas significativos de salud tampoco se encontraron niveles significativos de depresión en los niños tratados por cáncer. Sin embargo, los progenitores de niños con cáncer les atribuyeron a sus hijos más características alegres que los progenitores de niños en otros grupos.[8][Nivel de evidencia: II]
En los estudios no se notificaron diferencias con los controles en las siguientes mediciones:
Un grupo de investigadores [10] observó que los maestros notaban que los niños con cáncer eran más sociables y menos agresivos, y sus compañeros los consideraban menos agresivos y con mayor aceptación social que otros compañeros. A veces esto difiere según quién sea el que notifica: los progenitores reportan más limitaciones que los propios niños,[11] sin embargo los niños comunican menor satisfacción en cuanto a sus habilidades deportivas que lo que notifican sus compañeros.[10]
Diferencias en la adaptación
El diagnóstico y el tipo de tratamiento influyen en la adaptación de determinados subgrupos de niños con cáncer.[12]
Tumores sólidos
Los niños que reciben tratamiento para tumores sólidos que no afectan el sistema nervioso central (SNC) presentan un sufrimiento psicológico mínimo que se mantiene después del tratamiento.[13]
Leucemia o linfoma linfoblástico agudo
Los niños que reciben tratamiento para la leucemia o linfoma linfoblástico agudo notifican peor funcionamiento emocional, capacidades cognitivas, autonomía e interacción familiar que los niños que reciben tratamiento para tumores sólidos que no afectan el SNC.[13]
Tumores del sistema nervioso central
En los niños con enfermedad que afecta en forma directa el sistema nervioso central (SNC), el riesgo de presentar problemas sociales y emocionales es mucho mayor. A los niños con tumores encefálicos sus compañeros los perciben como niños enfermos, cansados, que faltan a la escuela, aislados socialmente y es menos probable que sus compañeros los consideren sus amigos.[14]
Trasplante de células madre
Es probable que los niños que reciben un trasplante de células madre hematopoyéticas (TCMH) presenten con el tiempo una disminución en las habilidades sociales y en el concepto de sí mismos.[15]
Etnia
La etnia también cumple es un factor importante en la calidad de vida.[16]
Factores familiares
Los factores familiares son importantes en la adaptación de los niños con cáncer; la cohesión familiar y la expresividad se relacionan con mejores resultados y el conflicto familiar se relaciona con resultados más precarios, sobre todo en los niños que reciben un tratamiento más intensivo.[15] Los niños en edad preescolar son más susceptibles que los adolescentes a presentar una mayor externalización de los problemas de comportamiento (por ejemplo, agresión, impulsividad o comportamiento disruptivo) durante el tratamiento, pero en general la calidad de vida relacionada con la salud (CVRS) notificada por los padres es mejor en los niños más pequeños que en los adolescentes.[17] En ocasiones, la edad también sirve como mediador en el abordaje del afrontamiento y en el nivel de control percibido que experimentan los niños que reciben tratamiento para el cáncer. Un grupo de investigadores encontró que los niños con cáncer notificaron significativamente más estrategias de afrontamiento de evitación que los niños sanos, con independencia de la edad.[18] Sin embargo, otro grupo de investigación observó que la relación entre el control percibido y el afrontamiento centrado en el problema o en las emociones (el afrontamiento centrado en el problema se relacionaba con la apreciación de un mayor control) estaba mediado por la edad.[19] Se han realizado pocos estudios en esta área y es probable que haya otros intermediarios adicionales de las relaciones de regulación del afrontamiento, que todavía no se han analizado.
Hermanos y hermanas
Los desafíos de enfrentar el diagnóstico y el tratamiento del cáncer infantil también tienen repercusiones en el afrontamiento y la adaptación de los hermanos y hermanas del niño con cáncer. Durante el tratamiento, a veces estos notifican los siguientes efectos:
- Niveles superiores de ansiedad y soledad que los hermanos y hermanas de niños sanos.[20][Nivel de evidencia: II]
- Síntomas de sufrimiento postraumático (notificado por alrededor del 50 % de los hermanos y hermanas).[21][Nivel de evidencia: II]
- Sufrimiento por rupturas familiares y separaciones.[21]
- Falta de atención debido a que la prioridad para otros miembros de la familia es el niño enfermo.[21]
- Interacciones negativas con miembros de la familia.[21]
- Miedo a la muerte del niño enfermo.[21]
Los hermanos y hermanas de niños con cáncer también notifican que se vuelven más compasivos y perciben un acercamiento en sus familias a través de la experiencia.[22]
Los riesgos de las familias aumentan en las siguientes situaciones:
Para los hermanos de niños que se someten a TCMH alogénico, el riesgo de ansiedad y baja autoestima es mayor en los hermanos que son donantes de células madre hematopoyéticas, mientras que los no donantes tienen un mayor riesgo de desarrollar problemas escolares.[24] Programas de apoyo social, como grupos de hermanos y hermanas [25] o campamentos de verano [26] reducen la ansiedad y mejoran la autoestima de los hermanos y hermanas de niños que reciben tratamiento para el cáncer.
Estudio de sobrevivientes de cáncer infantil
El Childhood Cancer Survivor Study (CCSS) es un estudio en curso de gran tamaño, multicéntrico de un grupo de más de 10 000 sobrevivientes de cáncer infantil a largo plazo que se comparó con un grupo de control integrado por hermanos y hermanas de los pacientes. En el CCSS se analizó de forma selectiva la adaptación a largo plazo en muestras grandes de adultos jóvenes que recibieron tratamiento por cánceres infantiles similares mediante una metodología de encuesta exhaustiva que relaciona los informes de la actividad funcional actual con el diagnóstico, los tipos de tratamiento y otros factores de salud vinculados al cáncer y su tratamiento. En un informe de este estudio, se encuestó a 2778 sobrevivientes de tumores sólidos diagnosticados durante la infancia y 2925 hermanos y hermanas mediante un cuestionario de seguimiento a largo plazo estandarizado. Se informaron síntomas relacionados con depresión, somatización y ansiedad, además de información demográfica, médica y de salud. Los sobrevivientes de cáncer notificaron pocos o ningún síntoma de sufrimiento psicológico, aunque aquellos que sobrevivieron a tumores sólidos comunicaron niveles más altos de sufrimiento general que sus hermanos y hermanas. Estas medidas no fueron diferentes a las normas de la población. En los sobrevivientes de cáncer al igual que en sus hermanos y hermanas, el sexo femenino, la menor educación, los ingresos más bajos, un estado de salud percibido como deficiente y los problemas de salud actuales se asociaron con niveles más altos de síntomas de sufrimiento psicológico.[27][Nivel de evidencia: II]
En el CCSS también se notificaron hallazgos positivos en adultos jóvenes sobrevivientes de leucemias y linfomas. Se administraron cuestionarios de seguimiento sobre adaptación psicológica a 5736 adultos jóvenes sobrevivientes de leucemia, linfoma no Hodgkin y linfoma de Hodgkin, así como a 2565 hermanos adultos de ambos sexos. Los sobrevivientes comunicaron niveles más altos de síntomas de depresión y sufrimiento psicosomático que los hermanos o hermanas, pero los puntajes de ninguno de los grupos estuvieron dentro del intervalo clínicamente significativo para la población general. Los factores sociodemográficos como el género y la posición socioeconómica se relacionaron con informes de síntomas de depresión, con independencia del estado del tratamiento. El único factor relacionado con la enfermedad que se relacionó con el sufrimiento psicológico fue la quimioterapia intensiva, que se vinculó con un aumento de los síntomas psicosomáticos.[2][Nivel de evidencia: II] Se informaron resultados similares en los sobrevivientes de cánceres encefálicos. Los sobrevivientes de tumores encefálicos notificaron niveles más altos de síntomas de depresión que sus hermanos y hermanas, pero las tasas de ambos grupos fueron semejantes a las tasas de la población general.[3][Nivel de evidencia: II] Se dispone de un resumen de los desenlaces psicosociales principales notificados en el CCSS.[28][Nivel de evidencia: II] En otros informes del CCSS se hace referencia al consumo de bebidas alcohólicas,[29] el efecto de las limitaciones físicas en la CVRS,[30][Nivel de evidencia: II] el cansancio, y el sueño.[31]
Bibliografía
- Eiser C, Hill JJ, Vance YH: Examining the psychological consequences of surviving childhood cancer: systematic review as a research method in pediatric psychology. J Pediatr Psychol 25 (6): 449-60, 2000. [PUBMED Abstract]
- Zebrack BJ, Zeltzer LK, Whitton J, et al.: Psychological outcomes in long-term survivors of childhood leukemia, Hodgkin's disease, and non-Hodgkin's lymphoma: a report from the Childhood Cancer Survivor Study. Pediatrics 110 (1 Pt 1): 42-52, 2002. [PUBMED Abstract]
- Zebrack BJ, Gurney JG, Oeffinger K, et al.: Psychological outcomes in long-term survivors of childhood brain cancer: a report from the childhood cancer survivor study. J Clin Oncol 22 (6): 999-1006, 2004. [PUBMED Abstract]
- Sawyer M, Antoniou G, Toogood I, et al.: Childhood cancer: a 4-year prospective study of the psychological adjustment of children and parents. J Pediatr Hematol Oncol 22 (3): 214-20, 2000 May-Jun. [PUBMED Abstract]
- Varni JW, Katz E: Stress, social support and negative affectivity in children with newly diagnosed cancer: a prospective transactional analysis. Psychooncology 6 (4): 267-78, 1997. [PUBMED Abstract]
- Chao CC, Chen SH, Wang CY, et al.: Psychosocial adjustment among pediatric cancer patients and their parents. Psychiatry Clin Neurosci 57 (1): 75-81, 2003. [PUBMED Abstract]
- Phipps S, Srivastava DK: Approaches to the measurement of depressive symptomatology in children with cancer: attempting to circumvent the effects of defensiveness. J Dev Behav Pediatr 20 (3): 150-6, 1999. [PUBMED Abstract]
- Grootenhuis MA, Last BF, van der Wel M, et al.: Parents' attribution of positive characteristics to their children with cancer. Psychol Health 13: 67-81, 1998.
- Ritchie MA: Self-esteem and hopefulness in adolescents with cancer. J Pediatr Nurs 16 (1): 35-42, 2001. [PUBMED Abstract]
- Noll RB, Gartstein MA, Vannatta K, et al.: Social, emotional, and behavioral functioning of children with cancer. Pediatrics 103 (1): 71-8, 1999. [PUBMED Abstract]
- Levi RB, Drotar D: Health-related quality of life in childhood cancer: discrepancy in parent-child reports. Int J Cancer Suppl 12: 58-64, 1999. [PUBMED Abstract]
- Armstrong FD, Toledano SR, Miloslavich K, et al.: The Miami pediatric quality of life questionnaire: parent scale. Int J Cancer Suppl 12: 11-7, 1999. [PUBMED Abstract]
- Calaminus G, Weinspach S, Teske C, et al.: Quality of life in children and adolescents with cancer. First results of an evaluation of 49 patients with the PEDQOL questionnaire. Klin Padiatr 212 (4): 211-5, 2000 Jul-Aug. [PUBMED Abstract]
- Vannatta K, Gartstein MA, Short A, et al.: A controlled study of peer relationships of children surviving brain tumors: teacher, peer, and self ratings. J Pediatr Psychol 23 (5): 279-87, 1998. [PUBMED Abstract]
- Phipps S, Mulhern RK: Family cohesion and expressiveness promote resilience to the stress of pediatric bone marrow transplant: a preliminary report. J Dev Behav Pediatr 16 (4): 257-63, 1995. [PUBMED Abstract]
- Casillas JN, Zebrack BJ, Zeltzer LK: Health-related quality of life for Latino survivors of childhood cancer. J Psychosoc Oncol 24 (3): 125-45, 2006. [PUBMED Abstract]
- Barrera M, Wayland LA, D’Agostino NM, et al.: Developmental differences in psychological adjustment and health-related quality of life in pediatric cancer patients. Child Health Care 32 (3): 215-32, 2003.
- Phipps S, Fairclough D, Mulhern RK: Avoidant coping in children with cancer. J Pediatr Psychol 20 (2): 217-32, 1995. [PUBMED Abstract]
- Sorgen KE, Manne SL: Coping in children with cancer: examining the goodness-of-fit hypothesis. Child Health Care 31 (3): 191-207, 2002.
- Hamama R, Ronen T, Feigin R: Self-control, anxiety, and loneliness in siblings of children with cancer. Soc Work Health Care 31 (1): 63-83, 2000. [PUBMED Abstract]
- Alderfer MA, Labay LE, Kazak AE: Brief report: does posttraumatic stress apply to siblings of childhood cancer survivors? J Pediatr Psychol 28 (4): 281-6, 2003. [PUBMED Abstract]
- Sargent JR, Sahler OJ, Roghmann KJ, et al.: Sibling adaptation to childhood cancer collaborative study: siblings' perceptions of the cancer experience. J Pediatr Psychol 20 (2): 151-64, 1995. [PUBMED Abstract]
- MacLeod KD, Whitsett SF, Mash EJ, et al.: Pediatric sibling donors of successful and unsuccessful hematopoietic stem cell transplants (HSCT): a qualitative study of their psychosocial experience. J Pediatr Psychol 28 (4): 223-30, 2003. [PUBMED Abstract]
- Packman W: Psychosocial impact of pediatric BMT on siblings. Bone Marrow Transplant 24 (7): 701-6, 1999. [PUBMED Abstract]
- Houtzager BA, Grootenhuis MA, Last BF: Supportive groups for siblings of pediatric oncology patients: impact on anxiety. Psychooncology 10 (4): 315-24, 2001 Jul-Aug. [PUBMED Abstract]
- Murray JS: Self-concept of siblings of children with cancer. Issues Compr Pediatr Nurs 24 (2): 85-94, 2001 Apr-Jun. [PUBMED Abstract]
- Zebrack BJ, Zevon MA, Turk N, et al.: Psychological distress in long-term survivors of solid tumors diagnosed in childhood: a report from the childhood cancer survivor study. Pediatr Blood Cancer 49 (1): 47-51, 2007. [PUBMED Abstract]
- Zeltzer LK, Lu Q, Leisenring W, et al.: Psychosocial outcomes and health-related quality of life in adult childhood cancer survivors: a report from the childhood cancer survivor study. Cancer Epidemiol Biomarkers Prev 17 (2): 435-46, 2008. [PUBMED Abstract]
- Lown EA, Goldsby R, Mertens AC, et al.: Alcohol consumption patterns and risk factors among childhood cancer survivors compared to siblings and general population peers. Addiction 103 (7): 1139-48, 2008. [PUBMED Abstract]
- Ness KK, Gurney JG, Zeltzer LK, et al.: The impact of limitations in physical, executive, and emotional function on health-related quality of life among adult survivors of childhood cancer: a report from the Childhood Cancer Survivor Study. Arch Phys Med Rehabil 89 (1): 128-36, 2008. [PUBMED Abstract]
- Mulrooney DA, Ness KK, Neglia JP, et al.: Fatigue and sleep disturbance in adult survivors of childhood cancer: a report from the childhood cancer survivor study (CCSS). Sleep 31 (2): 271-81, 2008. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (05/12/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre los cuidados médicos de apoyo y los cuidados paliativos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre los aspectos de la adaptación normal, y la fisiopatología y tratamiento del sufrimiento y los trastornos de adaptación. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre los cuidados médicos de apoyo y los cuidados paliativos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Adaptación al cáncer son:
- Natalie Jacobowski, MD (Nationwide Children's Hospital)
- Jayesh Kamath, MD, PhD (University of Connecticut Health Center)
- Tammy I. Kang, MD, MSCE, FAAHPM (Texas Children's Pavilion for Women)
- Edward B. Perry, MD (VA Connecticut Healthcare System)
- Rachel A. Pozzar, PhD, RN (Dana-Farber Cancer Institute)
- Amy Wachholtz, PhD, MDiv, MS, ABPP (University of Colorado)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre los cuidados médicos de apoyo y los cuidados paliativos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre los cuidados médicos de apoyo y los cuidados paliativos. PDQ Adaptación al cáncer. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/cancer/sobrellevar/sentimientos/ansiedad-sufrimiento-pro-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.