Tratamiento del ependimoma infantil (PDQ®)–Versión para profesionales de salud
Información general sobre el ependimoma infantil
Los tumores de encéfalo primarios, incluso los ependimomas, son un grupo diverso de enfermedades que, juntas, constituyen el tumor sólido más común en la niñez. Para el diagnóstico y la clasificación de los tumores, se usan cada vez más los análisis inmunohistoquímicos, los hallazgos citogenéticos y genético moleculares, y las mediciones de la actividad mitótica. Los tumores de encéfalo se clasifican según las características histológicas, pero la ubicación del tumor, el grado de diseminación, las características moleculares y la edad son factores importantes que afectan el tratamiento y el pronóstico.
De acuerdo con la revisión de 2021 de la clasificación de tumores del sistema nervioso central (SNC) de la Organización Mundial de la Salud (OMS), los tumores ependimarios se clasifican en los siguientes diez subtipos principales en función de su localización anatómica y de sus características histopatológicas y moleculares:[1-3]
- Ependimoma supratentorial.
- Ependimoma supratentorial positivo para fusiones de ZFTA (antes llamado positivo para fusiones de RELA).
- Ependimoma supratentorial positivo para fusiones de YAP1.
- Ependimoma de fosa posterior.
- Ependimoma de fosa posterior, grupo PFA.
- Ependimoma de fosa posterior, grupo PFB.
- Ependimoma medular (también conocido como ependimoma de médula espinal).
- Ependimoma medular con amplificación de MYCN.
- Ependimoma mixopapilar.
- Subependimoma (localización supratentorial, de fosa posterior y de médula espinal).
Los resúmenes de tratamiento del PDQ sobre los tumores de encéfalo infantiles se organizan sobre todo de acuerdo con la clasificación de los tumores del SNC establecida por la OMS.[1,3] Para obtener una descripción de la clasificación de los tumores del sistema nervioso y un enlace al resumen de tratamiento correspondiente a cada tipo de tumor encefálico, consultar Resumen de la clasificación de los tumores de encéfalo y médula espinal infantiles.
Incidencia
El ependimoma infantil abarca alrededor del 9 % de todos los tumores de encéfalo y de médula espinal en los niños, lo que representa cerca de 200 casos por año en los Estados Unidos.[4,5]
Características anatómicas
Los ependimomas surgen de los ependimocitos que revisten los ventrículos y los espacios en el encéfalo y el centro de la médula espinal (consultar la Figura 1). Los ependimocitos producen el líquido cefalorraquídeo (LCR). Los tumores ependimarios se clasifican como supratentoriales, de fosa posterior (infratentoriales) o de médula espinal. En los niños, del 65 % al 75 % de los ependimomas surgen en la fosa posterior, alrededor del cuarto ventrículo.[6] Con menor frecuencia, los ependimomas se presentan en el compartimento supratentorial. Los ependimomas de médula espinal son infrecuentes en la infancia.
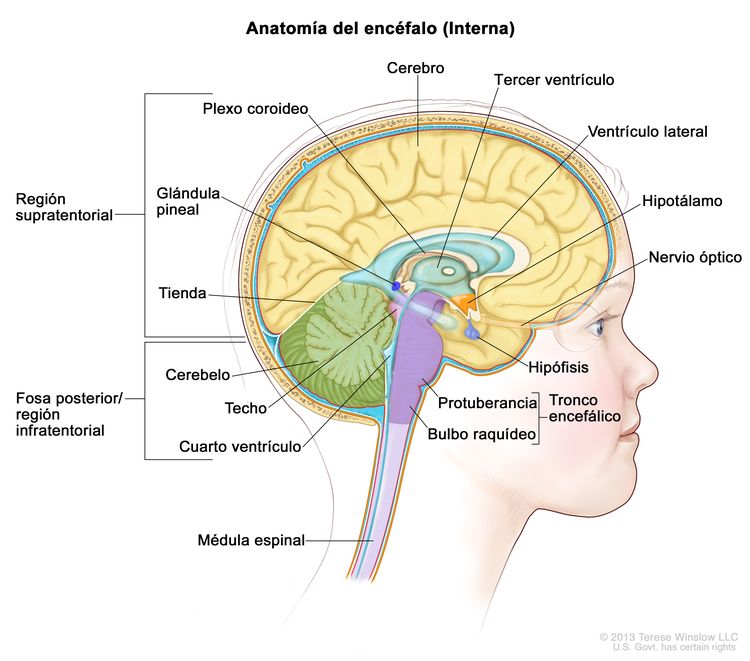
Características clínicas
El cuadro clínico inicial del ependimoma depende de la ubicación del tumor.
- Ependimomas de fosa posterior (infratentoriales): los niños con ependimoma de fosa posterior quizás presenten signos y síntomas de hidrocefalia obstructiva debido a una obstrucción a la altura del cuarto ventrículo. A veces, también tienen ataxia, dolor cervical o parálisis de pares craneales.
- Ependimomas supratentoriales: este tipo de ependimomas producen cefaleas, convulsiones o déficits neurológicos focales que dependen de la ubicación.
- Ependimomas de médula espinal: este tipo de ependimomas a menudo son de la variante mixopapilar, tienden a producir dolor de espalda, debilidad en las extremidades inferiores o disfunción intestinal y vesical.
Evaluación diagnóstica
Todo paciente con diagnóstico de sospecha de ependimoma se evalúa con imágenes diagnósticas de todo el encéfalo y la médula espinal. El método más sensible para evaluar las metástasis subaracnoideas en la médula espinal consiste en las imágenes por resonancia magnética (IRM) de la médula espinal con gadolinio. En condiciones ideales, se obtienen las IRM antes de la cirugía para evitar confusión con la sangre posoperatoria. Si se utilizan IRM, por lo general se obtienen imágenes de toda la columna en al menos dos planos con cortes contiguos de la IRM después del realce con gadolinio.
Si es viable, se hace una evaluación citológica del LCR.[7] A pesar de que es frecuente encontrar enfermedad diseminada en el momento de la recidiva, la enfermedad metastásica en el momento de la presentación inicial no es habitual.[8][Nivel de evidencia C2]
Factores pronósticos
A continuación, se enumeran los factores desfavorables que afectan el desenlace (excepto cuando se indica):
-
Características moleculares.
Los ependimomas de fosa posterior se subdividen en los siguientes dos grupos moleculares primarios a partir de perfiles característicos de expresión génica.[9-12]
- Ependimoma de fosa posterior A (PF-EPN-A).
- Este tipo de ependimoma se presenta sobre todo en niños pequeños y se caracteriza por un perfil genómico que, en su mayor parte, está equilibrado, con un aumento en la frecuencia de ganancia del cromosoma 1q [13-16] y expresión de genes y proteínas que ya demostraron relación con un pronóstico adverso, como la tenascina C y el receptor del factor de crecimiento epidérmico.[13,17,18]
- La ganancia de 1q confiere un pronóstico muy precario a pesar de la resección completa y la radioterapia posoperatoria (tasa de supervivencia sin complicaciones a 5 años, 81,5 % para equilibrio de 1q vs. 35,7 % para ganancia de 1q).[19][Nivel de evidencia B4]
- En un análisis retrospectivo combinado de 663 pacientes de 5 cohortes no solapadas se identificó la pérdida de 6q como factor pronóstico precario para pacientes con PF-EPN-A.[20] La pérdida de 6q se observó en el 8,6 % de los casos de PF-EPN-A, y es más frecuente en tumores con ganancia de 1q. El subconjunto de pacientes (n = 22) con ganancia de 1q y pérdida de 6q presentó un pronóstico muy adverso.
- En un estudio multicéntrico retrospectivo se compararon las muestras emparejadas de tumores primarios de cada paciente con las de tumores recidivantes. En el estudio se notificó que las características de riesgo alto de ganancia de 1q y pérdida de 6q fueron más frecuentes en los tumores recidivantes que en los tumores primarios, y estas características se siguen relacionando con un pronóstico precario.[21]
- Ependimoma de fosa posterior B (PF-EPN-B).
- Este tipo de ependimoma se presenta de manera principal en niños mayores y en adultos, y se caracteriza por un pronóstico más favorable y por numerosas anomalías citogenéticas que afectan cromosomas enteros o brazos cromosómicos.[9,12,22]
- Los pacientes con PF-EPN-B tienen un desenlace favorable, en comparación con los pacientes con PF-EPN-A. La tasa de supervivencia sin progresión (SSP) a 5 años de los pacientes con PF-EPN-B es del 73 % y la tasa de supervivencia general (SG) supera el 90 %.[11,12]
- La ganancia de 1q no es una característica pronóstica en los pacientes con PF-EPN-B, mientras que es posible que la pérdida del cromosoma 13q confiera un pronóstico adverso.[22]
Los ependimomas supratentoriales se dividen en los siguientes dos grupos moleculares principales a partir del estado de las fusiones génicas:
- Ependimoma supratentorial positivo para fusiones de ZFTA (ST-EPN-ZFTA) (antes llamado positivo para fusiones de RELA).
- Si bien en un análisis retrospectivo se indicó que la fusión de RELA producía un pronóstico precario,[11] en informes posteriores se indicó que los pacientes con fusiones de RELA que se someten a resección completa y radioterapia posoperatoria tienen tasas de supervivencia relativamente favorables de cerca del 80 % a los 5 años.[11,19,23,24] En estudios retrospectivos se indican desenlaces precarios en los pacientes que se someten a resecciones quirúrgicas completas, pero no reciben radioterapia posoperatoria.[11]
- La deleción homocigota de CDKN2A se ha relacionado con un pronóstico adverso en pacientes con ST-EPN-ZFTA.[25][Nivel de evidencia B4] La deleción de CDKN2A también se ha descrito como un acontecimiento secundario en el ependimoma recidivante.[26]
- Ependimoma supratentorial con fusiones de YAP1 (ST-EPN-YAP1).
Los ependimomas de médula espinal se distinguen mediante estudios del metiloma, pero la clasificación molecular no proporciona ninguna ventaja clinicopatológica sobre la clasificación histopatológica para el ependimoma mixopapilar y el subependimoma. Sin embargo, la clasificación molecular es útil para identificar el ependimoma medular con amplificación de MYCN, que se ha relacionado con un pronóstico adverso. Los datos sobre la estratificación óptima del riesgo del ependimoma medular en niños son escasos, aunque se infiere, a partir de datos de adultos, que una resección completa acarrea un pronóstico favorable.
- Ependimoma medular con amplificación de MYCN (SP-EPN-MYCN).
- Ependimoma de fosa posterior A (PF-EPN-A).
- Edad más joven en el momento del diagnóstico. Tradicionalmente, una edad más joven en el momento del diagnóstico se consideró un factor de pronóstico precario, aunque es posible que esto se deba en parte a la práctica común de evitar la radiación o diferir este tratamiento en niños menores de 3 años. En un ensayo prospectivo del Children's Oncology Group (COG) (ACNS0121 [NCT00027846]), se administró radioterapia posoperatoria inmediata a todos los niños mayores de 1 año después de una resección macroscópica total o de una resección casi total. En el estudio se demostró ausencia de diferencia significativa en la SSP o la SG a 5 años entre los pacientes de 1 a 3 años de edad y los pacientes de 3 a 21 años.[19]
- Tipo histológico anaplásico. El tipo histológico anaplásico se relacionó con un pronóstico adverso.[32][Nivel de evidencia B4]; [33-36]; [37][Nivel de evidencia C1]; [38][Nivel de evidencia C2] La diferenciación entre la enfermedad de grado 2 y de grado 3 tiene una variabilidad interobservador importante, por lo que se vuelve confuso el uso de la anaplasia como factor pronóstico. [39] La clasificación de 2021 de los tumores del SNC establecida por la OMS ya no usa el término ependimoma anaplásico y solo permite un diagnóstico, definido desde el punto de vista histológico, del ependimoma en el diagnóstico integrado. Dentro del informe estratificado, el especialista en anatomía patológica aún puede optar por asignar a un tumor el grado 2 o 3 del SNC de la OMS en función de las características histológicas.[2,3]
- Resección subtotal. La resección subtotal acarrea un pronóstico muy precario.[19,35,36]; [32][Nivel de evidencia B4]
- Dosis bajas de radiación. Las dosis bajas de radiación y los protocolos de quimioterapia sola confieren un pronóstico precario.[12,23,40,41]
Seguimiento después del tratamiento
Por lo general, después del tratamiento del ependimoma se recomienda la vigilancia con neuroimágenes y evaluaciones clínicas. En un informe de 198 pacientes con ependimoma, 90 de ellos experimentaron una recaída. Los pacientes cuyo tumor recidivante se detectó por medio de imágenes de vigilancia sistemática tuvieron una segunda SSP superior a la de los pacientes cuyo tumor recidivante se detectó mediante sintomatología clínica. Estos últimos tenían más probabilidad de presentar enfermedad metastásica en el momento de la recaída. Se desconoce si estos pacientes también presentaban enfermedad más agresiva en cuanto a las características biológicas, aunque la mediana del tiempo transcurrido hasta la recaída y la mediana del tiempo desde la última imagen de vigilancia fueron las mismas para ambos grupos.[42]
La mayoría de los médicos obtienen IRM del encéfalo o la médula espinal durante los siguientes intervalos:[43][Nivel de evidencia B4]
- Primeros 2 a 3 años después del tratamiento: cada 3 a 4 meses.
- De 4 a 5 años después del tratamiento: cada 6 meses.
- Más de 5 años después del tratamiento: cada año debido a una incidencia alta de recidivas tardías.
Bibliografía
- Louis DN, Ohgaki H, Wiestler OD: WHO Classification of Tumours of the Central Nervous System. 4th rev.ed. IARC Press, 2016.
- Louis DN, Perry A, Wesseling P, et al.: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 23 (8): 1231-1251, 2021. [PUBMED Abstract]
- WHO Classification of Tumours Editorial Board, ed.: WHO Classification of Tumours: Central Nervous System Tumours. Vol. 6. 5th ed. IARC Press; 2021.
- Gurney JG, Smith MA, Bunin GR: CNS and miscellaneous intracranial and intraspinal neoplasms. In: Ries LA, Smith MA, Gurney JG, et al., eds.: Cancer incidence and survival among children and adolescents: United States SEER Program 1975-1995. National Cancer Institute, SEER Program, 1999. NIH Pub.No. 99-4649, Chapter 3, pp 51-63. Also available online. Last accessed February 9, 2024.
- Ostrom QT, Gittleman H, Truitt G, et al.: CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2011-2015. Neuro Oncol 20 (suppl_4): iv1-iv86, 2018. [PUBMED Abstract]
- Andreiuolo F, Puget S, Peyre M, et al.: Neuronal differentiation distinguishes supratentorial and infratentorial childhood ependymomas. Neuro Oncol 12 (11): 1126-34, 2010. [PUBMED Abstract]
- Moreno L, Pollack IF, Duffner PK, et al.: Utility of cerebrospinal fluid cytology in newly diagnosed childhood ependymoma. J Pediatr Hematol Oncol 32 (6): 515-8, 2010. [PUBMED Abstract]
- Benesch M, Mynarek M, Witt H, et al.: Newly Diagnosed Metastatic Intracranial Ependymoma in Children: Frequency, Molecular Characteristics, Treatment, and Outcome in the Prospective HIT Series. Oncologist 24 (9): e921-e929, 2019. [PUBMED Abstract]
- Wani K, Armstrong TS, Vera-Bolanos E, et al.: A prognostic gene expression signature in infratentorial ependymoma. Acta Neuropathol 123 (5): 727-38, 2012. [PUBMED Abstract]
- Witt H, Mack SC, Ryzhova M, et al.: Delineation of two clinically and molecularly distinct subgroups of posterior fossa ependymoma. Cancer Cell 20 (2): 143-57, 2011. [PUBMED Abstract]
- Pajtler KW, Witt H, Sill M, et al.: Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups. Cancer Cell 27 (5): 728-43, 2015. [PUBMED Abstract]
- Ramaswamy V, Hielscher T, Mack SC, et al.: Therapeutic Impact of Cytoreductive Surgery and Irradiation of Posterior Fossa Ependymoma in the Molecular Era: A Retrospective Multicohort Analysis. J Clin Oncol 34 (21): 2468-77, 2016. [PUBMED Abstract]
- Mendrzyk F, Korshunov A, Benner A, et al.: Identification of gains on 1q and epidermal growth factor receptor overexpression as independent prognostic markers in intracranial ependymoma. Clin Cancer Res 12 (7 Pt 1): 2070-9, 2006. [PUBMED Abstract]
- Korshunov A, Witt H, Hielscher T, et al.: Molecular staging of intracranial ependymoma in children and adults. J Clin Oncol 28 (19): 3182-90, 2010. [PUBMED Abstract]
- Kilday JP, Mitra B, Domerg C, et al.: Copy number gain of 1q25 predicts poor progression-free survival for pediatric intracranial ependymomas and enables patient risk stratification: a prospective European clinical trial cohort analysis on behalf of the Children's Cancer Leukaemia Group (CCLG), Societe Francaise d'Oncologie Pediatrique (SFOP), and International Society for Pediatric Oncology (SIOP). Clin Cancer Res 18 (7): 2001-11, 2012. [PUBMED Abstract]
- Godfraind C, Kaczmarska JM, Kocak M, et al.: Distinct disease-risk groups in pediatric supratentorial and posterior fossa ependymomas. Acta Neuropathol 124 (2): 247-57, 2012. [PUBMED Abstract]
- Korshunov A, Golanov A, Timirgaz V: Immunohistochemical markers for intracranial ependymoma recurrence. An analysis of 88 cases. J Neurol Sci 177 (1): 72-82, 2000. [PUBMED Abstract]
- Andreiuolo F, Le Teuff G, Bayar MA, et al.: Integrating Tenascin-C protein expression and 1q25 copy number status in pediatric intracranial ependymoma prognostication: A new model for risk stratification. PLoS One 12 (6): e0178351, 2017. [PUBMED Abstract]
- Merchant TE, Bendel AE, Sabin ND, et al.: Conformal Radiation Therapy for Pediatric Ependymoma, Chemotherapy for Incompletely Resected Ependymoma, and Observation for Completely Resected, Supratentorial Ependymoma. J Clin Oncol 37 (12): 974-983, 2019. [PUBMED Abstract]
- Baroni LV, Sundaresan L, Heled A, et al.: Ultra high-risk PFA ependymoma is characterized by loss of chromosome 6q. Neuro Oncol 23 (8): 1360-1370, 2021. [PUBMED Abstract]
- Donson AM, Bertrand KC, Riemondy KA, et al.: Significant increase of high-risk chromosome 1q gain and 6q loss at recurrence in posterior fossa group A ependymoma: A multicenter study. Neuro Oncol 25 (10): 1854-1867, 2023. [PUBMED Abstract]
- Cavalli FMG, Hübner JM, Sharma T, et al.: Heterogeneity within the PF-EPN-B ependymoma subgroup. Acta Neuropathol 136 (2): 227-237, 2018. [PUBMED Abstract]
- Upadhyaya SA, Robinson GW, Onar-Thomas A, et al.: Molecular grouping and outcomes of young children with newly diagnosed ependymoma treated on the multi-institutional SJYC07 trial. Neuro Oncol 21 (10): 1319-1330, 2019. [PUBMED Abstract]
- Fukuoka K, Kanemura Y, Shofuda T, et al.: Significance of molecular classification of ependymomas: C11orf95-RELA fusion-negative supratentorial ependymomas are a heterogeneous group of tumors. Acta Neuropathol Commun 6 (1): 134, 2018. [PUBMED Abstract]
- Jünger ST, Andreiuolo F, Mynarek M, et al.: CDKN2A deletion in supratentorial ependymoma with RELA alteration indicates a dismal prognosis: a retrospective analysis of the HIT ependymoma trial cohort. Acta Neuropathol 140 (3): 405-407, 2020. [PUBMED Abstract]
- Milde T, Pfister S, Korshunov A, et al.: Stepwise accumulation of distinct genomic aberrations in a patient with progressively metastasizing ependymoma. Genes Chromosomes Cancer 48 (3): 229-38, 2009. [PUBMED Abstract]
- Andreiuolo F, Varlet P, Tauziède-Espariat A, et al.: Childhood supratentorial ependymomas with YAP1-MAMLD1 fusion: an entity with characteristic clinical, radiological, cytogenetic and histopathological features. Brain Pathol 29 (2): 205-216, 2019. [PUBMED Abstract]
- Ghasemi DR, Sill M, Okonechnikov K, et al.: MYCN amplification drives an aggressive form of spinal ependymoma. Acta Neuropathol 138 (6): 1075-1089, 2019. [PUBMED Abstract]
- Swanson AA, Raghunathan A, Jenkins RB, et al.: Spinal Cord Ependymomas With MYCN Amplification Show Aggressive Clinical Behavior. J Neuropathol Exp Neurol 78 (9): 791-797, 2019. [PUBMED Abstract]
- Scheil S, Brüderlein S, Eicker M, et al.: Low frequency of chromosomal imbalances in anaplastic ependymomas as detected by comparative genomic hybridization. Brain Pathol 11 (2): 133-43, 2001. [PUBMED Abstract]
- Raffeld M, Abdullaev Z, Pack SD, et al.: High level MYCN amplification and distinct methylation signature define an aggressive subtype of spinal cord ependymoma. Acta Neuropathol Commun 8 (1): 101, 2020. [PUBMED Abstract]
- Massimino M, Miceli R, Giangaspero F, et al.: Final results of the second prospective AIEOP protocol for pediatric intracranial ependymoma. Neuro Oncol 18 (10): 1451-60, 2016. [PUBMED Abstract]
- Merchant TE, Jenkins JJ, Burger PC, et al.: Influence of tumor grade on time to progression after irradiation for localized ependymoma in children. Int J Radiat Oncol Biol Phys 53 (1): 52-7, 2002. [PUBMED Abstract]
- Korshunov A, Golanov A, Sycheva R, et al.: The histologic grade is a main prognostic factor for patients with intracranial ependymomas treated in the microneurosurgical era: an analysis of 258 patients. Cancer 100 (6): 1230-7, 2004. [PUBMED Abstract]
- Tamburrini G, D'Ercole M, Pettorini BL, et al.: Survival following treatment for intracranial ependymoma: a review. Childs Nerv Syst 25 (10): 1303-12, 2009. [PUBMED Abstract]
- Massimino M, Barretta F, Modena P, et al.: Second series by the Italian Association of Pediatric Hematology and Oncology of children and adolescents with intracranial ependymoma: an integrated molecular and clinical characterization with a long-term follow-up. Neuro Oncol 23 (5): 848-857, 2021. [PUBMED Abstract]
- Amirian ES, Armstrong TS, Aldape KD, et al.: Predictors of survival among pediatric and adult ependymoma cases: a study using Surveillance, Epidemiology, and End Results data from 1973 to 2007. Neuroepidemiology 39 (2): 116-24, 2012. [PUBMED Abstract]
- Tihan T, Zhou T, Holmes E, et al.: The prognostic value of histological grading of posterior fossa ependymomas in children: a Children's Oncology Group study and a review of prognostic factors. Mod Pathol 21 (2): 165-77, 2008. [PUBMED Abstract]
- Ellison DW, Kocak M, Figarella-Branger D, et al.: Histopathological grading of pediatric ependymoma: reproducibility and clinical relevance in European trial cohorts. J Negat Results Biomed 10: 7, 2011. [PUBMED Abstract]
- Vaidya K, Smee R, Williams JR: Prognostic factors and treatment options for paediatric ependymomas. J Clin Neurosci 19 (9): 1228-35, 2012. [PUBMED Abstract]
- Zapotocky M, Beera K, Adamski J, et al.: Survival and functional outcomes of molecularly defined childhood posterior fossa ependymoma: Cure at a cost. Cancer 125 (11): 1867-1876, 2019. [PUBMED Abstract]
- Klawinski D, Indelicato DJ, Hossain J, et al.: Surveillance imaging in pediatric ependymoma. Pediatr Blood Cancer 67 (11): e28622, 2020. [PUBMED Abstract]
- Massimino M, Barretta F, Modena P, et al.: Pediatric intracranial ependymoma: correlating signs and symptoms at recurrence with outcome in the second prospective AIEOP protocol follow-up. J Neurooncol 140 (2): 457-465, 2018. [PUBMED Abstract]
Características moleculares del ependimoma infantil
Subgrupos moleculares del ependimoma
En los estudios de caracterización molecular iniciales se identificaron 9 subgrupos moleculares de ependimoma, 6 de los cuales predominan en niños. Los subgrupos se identificaron a partir de los perfiles característicos de metilación del DNA y de expresión génica, y también por una variedad exclusiva de alteraciones genómicas (consultar la Figura 2).[1-4]
Se añadió un nuevo ependimoma definido a nivel molecular a la clasificación de tumores del sistema nervioso central de la Organización Mundial de la Salud (OMS) de 2021: ependimoma medular con amplificación de MYCN. En la clasificación de 2021 se describió con más detalle los tumores ependimarios definidos por la localización anatómica y las características histológicas, pero no por la alteración molecular. Estos tumores se denominan ependimoma de fosa posterior (PF-EPN), ependimoma supratentorial (ST-EPN) y ependimoma medular (SP-EPN). Estos tumores contienen una alteración molecular exclusiva (sin clasificar), o bien su análisis molecular falló o no se obtuvo (sin especificar).[5]
- Tumores infratentoriales.
- Ependimoma de fosa posterior (PF-EPN).
- Ependimoma de fosa posterior A (PF-EPN-A) con pérdida de la marca de trimetilación de H3 K27.
- Ependimoma de fosa posterior B (PF-EPN-B) con retención de la marca de trimetilación de H3 K27.
- Tumores supratentoriales.
- Ependimoma supratentorial (ST-EPN).
- Ependimoma supratentorial positivo para fusiones de ZFTA (ST-EPN-ZFTA). Antes se denominaba ependimoma supratentorial positivo para fusiones de RELA (ST-EPN-RELA), pero se ha cambiado el nombre porque ZFTA es la nueva denominación de C11orf95 y ZFTA puede fusionarse con otro gen diferente a RELA.[6]
- Ependimoma positivo para fusiones de YAP1 (ST-EPN-YAP1).
- Tumores de médula espinal.
- Ependimoma medular (SP-EPN).
- Ependimoma medular con amplificación de MYCN (SP-EPN-MYCN).
- Ependimoma mixopapilar (SP-EPN-MPE).
El subependimoma (supratentorial, infratentorial o medular) incluye las otras tres variantes moleculares que son bastante infrecuentes en niños.
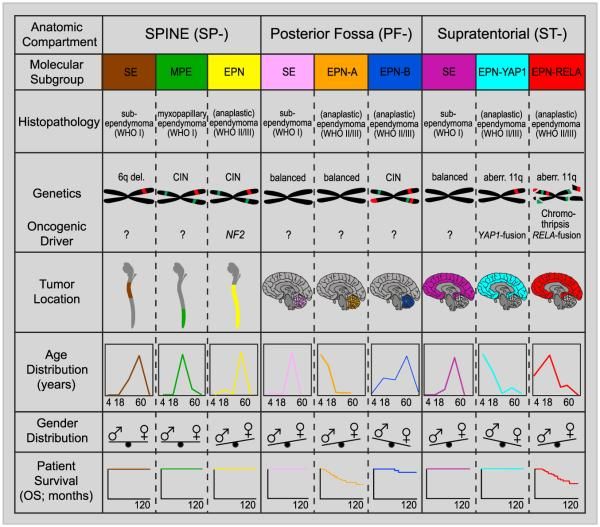
Tumores infratentoriales
Ependimoma de fosa posterior A
El ependimoma de fosa posterior A (PF-EPN-A) es el subgrupo más común que se caracteriza por los siguientes aspectos:
- Cuadro clínico inicial en niños pequeños (mediana de edad, 3 años).[1,7]
- Tasas bajas de variantes que afectan la estructura proteica, alrededor de 5 por genoma.[2]
- Ganancia del cromosoma 1q, un factor de pronóstico precario para pacientes con ependimoma,[8] en alrededor del 25 % de los casos.[1,3,9]
- Pérdida del cromosoma 6q, que se ha notificado como factor de pronóstico precario para los pacientes con PF-EPN-A, en el 8 % al 10 % de los casos.[10]
- Perfil cromosómico equilibrado con pocas ganancias o pérdidas cromosómicas.[1,2]
- Pérdida de la marca de trimetilación de H3 K27 y DNA con hipometilación general.[11] En un estudio multiinstitucional prospectivo se analizó un grupo de 147 pacientes con ependimoma. En el estudio se notificaron sensibilidad y especificidad altas para la detección por análisis inmunohistoquímico de la pérdida de la marca de trimetilación H3 K27 para identificar los casos de PF-EPN-A.[12] La pérdida de esta marca se presenta mediante múltiples mecanismos, como los siguientes:
- Variantes recurrentes de EZHIP en el 10 % de los casos, con expresión alta de mRNA de EZHIP en casi todos los PF-EPN-A.[13,14] La expresión de EZHIP (con alteración o sin esta) produce la inhibición de la metiltransferasa EZH2, que conduce a la pérdida de la marca de trimetilación de H3 K27.[14,15]
- Variantes recurrentes de K27M en genes de la histona H3 en una proporción baja de los casos.[16,17] A diferencia de los gliomas de línea media difusos, las variantes de H3.1 (H3C2 y H3C3) son más frecuentes que las variantes de H3.3 (H3-3A).[13] Las variantes de las histonas son mutuamente excluyentes de la expresión alta de EZHIP,[13] y también conducen a la pérdida de la marca de trimetilación de H3 K27 mediante la inhibición de EZH2.
En un estudio en el que se incluyeron más de 600 casos de PF-EPN-A, se usaron perfiles de matrices de metilación para dividir a la población en dos subgrupos característicos: PFA-1 y PFA-2.[13] El perfil de expresión génica indicó que estos dos subtipos quizás surjan en localizaciones anatómicas diferentes en el rombencéfalo. Dentro de los grupos PFA-1 y PFA-2, es posible que se identifiquen subtipos secundarios característicos, lo que indica heterogeneidad. Se necesitan más estudios para definir la importancia clínica de estos subtipos.
Ependimoma de fosa posterior B
En niños, el subgrupo de ependimoma de fosa posterior B (PF-EPN-B) es menos común que el subgrupo PF-EPN-A, representa entre 15 y 20 % de todos los ependimomas de fosa posterior, y se caracteriza por los siguientes aspectos:
- Cuadro clínico inicial predominante en adolescentes y adultos jóvenes (mediana de edad, 30 años).[1,7]
- Tasas bajas de variantes que afectan la estructura proteica (alrededor de 5 por genoma), sin variantes recurrentes.[3]
- Numerosas anomalías citogenéticas, sobre todo ganancias o pérdidas de cromosomas enteros.[1,3]
- Retención de la trimetilación de H3 K27.[11]
- La ganancia de 1q y la pérdida de 6q se producen en el PF-EPN-B, pero no se han notificado como factor pronóstico en este subgrupo (a diferencia del PF-EPN-A).[18]
Tumores supratentoriales
Ependimomas supratentoriales con fusiones de ZFTA
El subgrupo de ependimomas supratentoriales con fusiones de ZFTA (ST-EPN-ZFTA) es el tipo más numeroso de ependimoma supratentorial infantil que se caracteriza por fusiones génicas que afectan a RELA,[19,20] un factor de transcripción importante para la actividad de la vía NF-κB. El subgrupo ST-EPN-ZFTA se caracteriza por los siguientes aspectos:
- Representa alrededor de 70 % de los ependimomas supratentoriales en niños,[19,20] y se presenta a una mediana de edad de 8 años.[1]
- Presencia de fusiones de ZFTA que se producen por cromotripsis del cromosoma 11q13.1.[19]
- Tasas bajas de variantes que afectan la estructura proteica y casi ausencia de variantes recurrentes fuera de las fusiones ZFTA::RELA.[19]
- Indicios de activación de la vía NF-κB a nivel proteico o del RNA.[19]
- Ganancia del cromosoma 1q en cerca de un cuarto de los casos, y efecto indeterminado en la supervivencia.[1]
- El grado de concordancia fue elevado entre la prueba inmunohistoquímica del p65-RelA nuclear, la hibridación fluorescente in situ de ZFTA y RELA, y la clasificación según la metilación del DNA para definir el ST-EPN-ZFTA.[21]
- La deleción homocigota de CDKN2A se ha relacionado con un pronóstico precario en pacientes con ependimoma positivo para fusiones de ZFTA.[22][Nivel de evidencia B4] La deleción de CDKN2A también se ha notificado como un evento secundario en el ependimoma recidivante.[23]
Ependimomas supratentoriales con fusiones de YAP1
El subgrupo de ependimomas supratentoriales con fusiones de YAP1 (ST-EPN-YAP1) es el segundo tipo menos común de ependimomas supratentoriales y exhibe fusiones que afectan el gen YAP1 en el cromosoma 11; se caracteriza por los siguientes aspectos:
Tumores que se confunden con ependimomas supratentoriales
Los ependimomas supratentoriales sin fusiones de ZFTA o YAP1 (en el cromosoma 11) son una entidad que no se ha definido y no se conoce su importancia. Mediante análisis de metilación del DNA, estas muestras a menudo se agrupan con otras entidades como los gliomas de grado alto y los tumores embrionarios. Por ejemplo, en un análisis de metilación retrospectivo de tumores de encéfalo supratentoriales se identificó un grupo de tumores diferente al de los ependimomas supratentoriales que albergan fusiones de PLAGL1 recurrentes.[24] El linaje histológico de estos tumores con alteración de PLAGL1 no está claro aún. De los 32 tumores, 19 (59 %) se habían notificado antes como ependimomas. Se debe tener cuidado al diagnosticar un ependimoma supratentorial que no presenta una fusión que afecte el cromosoma 11.[6,25,26]
Ependimoma medular con amplificación de MYCN
El ependimoma medular con amplificación de MYCN (SP-EPN-MYCN) es poco frecuente; solo se han notificado 27 casos.[27-30]
- La mediana de edad en el momento de la presentación fue de 31 años (intervalo, 12–56 años).
- Se presentó un alto nivel de amplificación de MYCN en el momento del diagnóstico y en la recaída.
- SP-EPN-MYCN tiene un perfil de metilación único en comparación con otros ependimomas de la médula espinal, con amplificación de MYCN parecida a la del glioblastoma de tipo pediátrico y el neuroblastoma.
Bibliografía
- Pajtler KW, Witt H, Sill M, et al.: Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups. Cancer Cell 27 (5): 728-43, 2015. [PUBMED Abstract]
- Witt H, Mack SC, Ryzhova M, et al.: Delineation of two clinically and molecularly distinct subgroups of posterior fossa ependymoma. Cancer Cell 20 (2): 143-57, 2011. [PUBMED Abstract]
- Mack SC, Witt H, Piro RM, et al.: Epigenomic alterations define lethal CIMP-positive ependymomas of infancy. Nature 506 (7489): 445-50, 2014. [PUBMED Abstract]
- Pajtler KW, Mack SC, Ramaswamy V, et al.: The current consensus on the clinical management of intracranial ependymoma and its distinct molecular variants. Acta Neuropathol 133 (1): 5-12, 2017. [PUBMED Abstract]
- WHO Classification of Tumours Editorial Board, ed.: WHO Classification of Tumours: Central Nervous System Tumours. Vol. 6. 5th ed. IARC Press; 2021.
- Zschernack V, Jünger ST, Mynarek M, et al.: Supratentorial ependymoma in childhood: more than just RELA or YAP. Acta Neuropathol 141 (3): 455-466, 2021. [PUBMED Abstract]
- Ramaswamy V, Hielscher T, Mack SC, et al.: Therapeutic Impact of Cytoreductive Surgery and Irradiation of Posterior Fossa Ependymoma in the Molecular Era: A Retrospective Multicohort Analysis. J Clin Oncol 34 (21): 2468-77, 2016. [PUBMED Abstract]
- Korshunov A, Witt H, Hielscher T, et al.: Molecular staging of intracranial ependymoma in children and adults. J Clin Oncol 28 (19): 3182-90, 2010. [PUBMED Abstract]
- Merchant TE, Bendel AE, Sabin ND, et al.: Conformal Radiation Therapy for Pediatric Ependymoma, Chemotherapy for Incompletely Resected Ependymoma, and Observation for Completely Resected, Supratentorial Ependymoma. J Clin Oncol 37 (12): 974-983, 2019. [PUBMED Abstract]
- Baroni LV, Sundaresan L, Heled A, et al.: Ultra high-risk PFA ependymoma is characterized by loss of chromosome 6q. Neuro Oncol 23 (8): 1360-1370, 2021. [PUBMED Abstract]
- Panwalkar P, Clark J, Ramaswamy V, et al.: Immunohistochemical analysis of H3K27me3 demonstrates global reduction in group-A childhood posterior fossa ependymoma and is a powerful predictor of outcome. Acta Neuropathol 134 (5): 705-714, 2017. [PUBMED Abstract]
- Chapman RJ, Ghasemi DR, Andreiuolo F, et al.: Optimizing biomarkers for accurate ependymoma diagnosis, prognostication, and stratification within International Clinical Trials: A BIOMECA study. Neuro Oncol 25 (10): 1871-1882, 2023. [PUBMED Abstract]
- Pajtler KW, Wen J, Sill M, et al.: Molecular heterogeneity and CXorf67 alterations in posterior fossa group A (PFA) ependymomas. Acta Neuropathol 136 (2): 211-226, 2018. [PUBMED Abstract]
- Hübner JM, Müller T, Papageorgiou DN, et al.: EZHIP/CXorf67 mimics K27M mutated oncohistones and functions as an intrinsic inhibitor of PRC2 function in aggressive posterior fossa ependymoma. Neuro Oncol 21 (7): 878-889, 2019. [PUBMED Abstract]
- Jain SU, Do TJ, Lund PJ, et al.: PFA ependymoma-associated protein EZHIP inhibits PRC2 activity through a H3 K27M-like mechanism. Nat Commun 10 (1): 2146, 2019. [PUBMED Abstract]
- Gessi M, Capper D, Sahm F, et al.: Evidence of H3 K27M mutations in posterior fossa ependymomas. Acta Neuropathol 132 (4): 635-7, 2016. [PUBMED Abstract]
- Ryall S, Guzman M, Elbabaa SK, et al.: H3 K27M mutations are extremely rare in posterior fossa group A ependymoma. Childs Nerv Syst 33 (7): 1047-1051, 2017. [PUBMED Abstract]
- Cavalli FMG, Hübner JM, Sharma T, et al.: Heterogeneity within the PF-EPN-B ependymoma subgroup. Acta Neuropathol 136 (2): 227-237, 2018. [PUBMED Abstract]
- Parker M, Mohankumar KM, Punchihewa C, et al.: C11orf95-RELA fusions drive oncogenic NF-κB signalling in ependymoma. Nature 506 (7489): 451-5, 2014. [PUBMED Abstract]
- Pietsch T, Wohlers I, Goschzik T, et al.: Supratentorial ependymomas of childhood carry C11orf95-RELA fusions leading to pathological activation of the NF-κB signaling pathway. Acta Neuropathol 127 (4): 609-11, 2014. [PUBMED Abstract]
- Pagès M, Pajtler KW, Puget S, et al.: Diagnostics of pediatric supratentorial RELA ependymomas: integration of information from histopathology, genetics, DNA methylation and imaging. Brain Pathol 29 (3): 325-335, 2019. [PUBMED Abstract]
- Jünger ST, Andreiuolo F, Mynarek M, et al.: CDKN2A deletion in supratentorial ependymoma with RELA alteration indicates a dismal prognosis: a retrospective analysis of the HIT ependymoma trial cohort. Acta Neuropathol 140 (3): 405-407, 2020. [PUBMED Abstract]
- Milde T, Pfister S, Korshunov A, et al.: Stepwise accumulation of distinct genomic aberrations in a patient with progressively metastasizing ependymoma. Genes Chromosomes Cancer 48 (3): 229-38, 2009. [PUBMED Abstract]
- Sievers P, Henneken SC, Blume C, et al.: Recurrent fusions in PLAGL1 define a distinct subset of pediatric-type supratentorial neuroepithelial tumors. Acta Neuropathol 142 (5): 827-839, 2021. [PUBMED Abstract]
- Sturm D, Orr BA, Toprak UH, et al.: New Brain Tumor Entities Emerge from Molecular Classification of CNS-PNETs. Cell 164 (5): 1060-72, 2016. [PUBMED Abstract]
- Fukuoka K, Kanemura Y, Shofuda T, et al.: Significance of molecular classification of ependymomas: C11orf95-RELA fusion-negative supratentorial ependymomas are a heterogeneous group of tumors. Acta Neuropathol Commun 6 (1): 134, 2018. [PUBMED Abstract]
- Ghasemi DR, Sill M, Okonechnikov K, et al.: MYCN amplification drives an aggressive form of spinal ependymoma. Acta Neuropathol 138 (6): 1075-1089, 2019. [PUBMED Abstract]
- Swanson AA, Raghunathan A, Jenkins RB, et al.: Spinal Cord Ependymomas With MYCN Amplification Show Aggressive Clinical Behavior. J Neuropathol Exp Neurol 78 (9): 791-797, 2019. [PUBMED Abstract]
- Scheil S, Brüderlein S, Eicker M, et al.: Low frequency of chromosomal imbalances in anaplastic ependymomas as detected by comparative genomic hybridization. Brain Pathol 11 (2): 133-43, 2001. [PUBMED Abstract]
- Raffeld M, Abdullaev Z, Pack SD, et al.: High level MYCN amplification and distinct methylation signature define an aggressive subtype of spinal cord ependymoma. Acta Neuropathol Commun 8 (1): 101, 2020. [PUBMED Abstract]
Clasificación histopatológica de los tumores ependimarios infantiles
La clasificación de tumores del sistema nervioso central (SNC) de la Organización Mundial de la Salud (OMS) de 2016 incorporó por primera vez los hallazgos genotípicos en la clasificación de determinados tumores del SNC. Con esta clasificación integrada se intenta definir entidades clínicas más homogéneas a fin de mejorar la exactitud del diagnóstico, perfeccionar el pronóstico y llegar a conclusiones más fidedignas sobre las estrategias de tratamiento.
En la clasificación de la OMS de 2021 se sigue categorizando a los tumores ependimarios en función de su localización anatómica (es decir, supratentorial, de fosa posterior o de médula espinal), las características histopatológicas (es decir, subependimoma, ependimoma mixopapilar o ependimoma) y características moleculares (es decir, ependimoma supratentorial con fusiones ZFTA [antes llamado C11orf95] o YAP1, de fosa posterior A o B, y ependimoma medular con amplificación de MYCN). La clasificación actualizada también incluye los tumores ependimarios definidos por su localización anatómica y sus características histológicas, pero no por su alteración molecular. Algunos ejemplos son los casos en los que el tumor contiene una alteración molecular única (en estos casos, se usa el término "sin clasificar" [SC]) o cuando el análisis molecular falla o no es factible (en estos casos, se usa el término "sin otra indicación" [SAI]).[1]
En la actualidad, los tumores ependimarios se clasifican en los siguientes tres subtipos histológicos principales:[1,2]
- Subependimoma (grado 1 de la OMS): un subependimoma es una neoplasia de crecimiento lento que, por lo general, está unida a la pared ventricular y se compone de conglomerados de células neurogliales tumorales dentro de una matriz fibrilar.
Es difícil determinar la incidencia real de los subependimomas (grado 1 de la OMS). Con frecuencia, estos tumores son asintomáticos y a veces se encuentran de manera fortuita durante las autopsias. Es probable que los subependimomas abarquen menos del 5 % de los tumores ependimarios.
El diagnóstico de subependimoma en los niños es cuestionable y se debe considerar una evaluación adicional o análisis molecular.[3]
- Ependimoma mixopapilar (grado 2 de la OMS): los ependimomas mixopapilares surgen casi siempre en la ubicación del cono medular, la cola de caballo y el filum terminale de la médula espinal. Desde el punto de vista histológico, se caracterizan por células tumorales dispuestas de forma papilar alrededor de núcleos estromales mixoides vascularizados. El ependimoma mixopapilar se considera en la actualidad como de grado 2 de la OMS, en lugar de grado 1, porque su tasa de recidiva es similar a la del ependimoma medular convencional.[4]
- Ependimoma: los ependimomas surgen en las paredes de los ventrículos o en el canal medular, y están compuestos por células ependimarias neoplásicas.
En la revisión de la OMS de 2016, el ependimoma anaplásico se eliminó como subtipo. En la revisión de la OMS de 2021, el ependimoma papilar, el de células claras y el tanicítico se eliminaron como subtipos porque carecían de utilidad desde el punto de vista clinicopatológico. En la actualidad se incluyen como patrones al describir las características histopatológicas de un ependimoma.
La clasificación del ependimoma ha tenido muchos problemas de reproducibilidad y utilidad clínica, en especial cuando el ependimoma se define de manera molecular. Por lo tanto, la clasificación de la OMS de 2021 solo permite un diagnóstico, definido desde el punto de vista histológico, de ependimoma en el diagnóstico integrado (es decir, ya no se permite el ependimoma anaplásico), pero el patólogo puede optar por asignar el grado 2 o 3 de la OMS en función de las características histopatológicas. El ependimoma de grado 3, en comparación con el ependimoma de grado 2, muestra mayor celularidad y actividad mitótica, a menudo relacionadas con la proliferación microvascular y necrosis. La diferenciación entre la enfermedad de grado 2 y la enfermedad de grado 3 tiene una variabilidad interobservador importante y carece de uniformidad en los estudios de los grupos cooperativos.[5]
El ependimoma definido desde el punto de vista histológico puede a su vez clasificarse por sus características moleculares, de la siguiente manera:
- El ependimoma supratentorial incluye los subtipos moleculares ST-EPN (SC o SAI), ST-EPN-ZFTA y ST-EPN-YAP1.
- El ependimoma de fosa posterior incluye el PF-EPN (SC o SAI), el PF-EPN-A y el PF-EPN-B.
- El ependimoma medular incluye el SP-EPN (SC o SAI) y el SP-EPN-MYCN.
Desde el punto de vista clínico y patológico, los subependimomas y los ependimomas mixopapilares suelen considerarse tumores diferentes a los ependimomas de médula espinal.
Aunque se cree que los ependimomas supratentoriales e infratentoriales surgen de las células neurogliales radiales, estos tipos de ependimomas exhiben diferencias en las características genómicas, los panoramas genómicos, la expresión génica y las firmas inmunohistoquímicas de cada uno.[6-9] Los tumores supratentoriales se caracterizan con más frecuencia por diferenciación neuronal.[7] Está claro que los ependimomas supratentoriales e infratentoriales se deben considerar entidades biológicas separadas.[6,9-12]
El ependimoblastoma ya no se incluye en la clasificación de la OMS y en la actualidad se clasifica como un tumor embrionario con rosetas de capas múltiples. Para obtener más información, consultar Tratamiento del meduloblastoma y otros tumores embrionarios del sistema nervioso central infantil.
Bibliografía
- WHO Classification of Tumours Editorial Board, ed.: WHO Classification of Tumours: Central Nervous System Tumours. Vol. 6. 5th ed. IARC Press; 2021.
- Louis DN, Ohgaki H, Wiestler OD: WHO Classification of Tumours of the Central Nervous System. 4th rev.ed. IARC Press, 2016.
- Pajtler KW, Mack SC, Ramaswamy V, et al.: The current consensus on the clinical management of intracranial ependymoma and its distinct molecular variants. Acta Neuropathol 133 (1): 5-12, 2017. [PUBMED Abstract]
- Louis DN, Perry A, Wesseling P, et al.: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 23 (8): 1231-1251, 2021. [PUBMED Abstract]
- Ellison DW, Kocak M, Figarella-Branger D, et al.: Histopathological grading of pediatric ependymoma: reproducibility and clinical relevance in European trial cohorts. J Negat Results Biomed 10: 7, 2011. [PUBMED Abstract]
- Taylor MD, Poppleton H, Fuller C, et al.: Radial glia cells are candidate stem cells of ependymoma. Cancer Cell 8 (4): 323-35, 2005. [PUBMED Abstract]
- Andreiuolo F, Puget S, Peyre M, et al.: Neuronal differentiation distinguishes supratentorial and infratentorial childhood ependymomas. Neuro Oncol 12 (11): 1126-34, 2010. [PUBMED Abstract]
- Grill J, Bergthold G, Ferreira C: Pediatric ependymomas: will molecular biology change patient management? Curr Opin Oncol 23 (6): 638-42, 2011. [PUBMED Abstract]
- Mack SC, Pajtler KW, Chavez L, et al.: Therapeutic targeting of ependymoma as informed by oncogenic enhancer profiling. Nature 553 (7686): 101-105, 2018. [PUBMED Abstract]
- Mack SC, Witt H, Piro RM, et al.: Epigenomic alterations define lethal CIMP-positive ependymomas of infancy. Nature 506 (7489): 445-50, 2014. [PUBMED Abstract]
- Pajtler KW, Witt H, Sill M, et al.: Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups. Cancer Cell 27 (5): 728-43, 2015. [PUBMED Abstract]
- Johnson RA, Wright KD, Poppleton H, et al.: Cross-species genomics matches driver mutations and cell compartments to model ependymoma. Nature 466 (7306): 632-6, 2010. [PUBMED Abstract]
Información sobre los estadios del ependimoma infantil
Aunque no hay un sistema de estadificación formal, los ependimomas se dividen en tumores supratentoriales, de fosa posterior (infratentoriales) y de médula espinal. Alrededor del 20 % de los ependimomas infantiles surgen en la columna vertebral y 80 % surgen en el encéfalo (un 30 % en la región supratentorial y un 70 % en la región de la fosa posterior).[1]
Por lo general, los ependimomas se originan en el revestimiento ependimario de los ventrículos, en el canal central o en el ventrículo terminal de la médula espinal, y entran al líquido cefalorraquídeo. Por lo tanto, es posible que estos tumores se diseminen por todo el sistema nervioso central, aunque la diseminación leptomeníngea se observa en menos del 10 % de los pacientes con ependimomas intracraneales en el momento del diagnóstico inicial.
Es posible que el ependimoma mixopapilar se disemine,[2,3] y el ependimoma medular con amplificación de MYCN tiene una alta tasa de metástasis; la diseminación leptomeníngea en el momento de la presentación se observa en hasta un 50 % de los pacientes pediátricos.[4]
En el momento del diagnóstico se realiza una resonancia magnética del encéfalo y de toda la columna vertebral, junto con una punción lumbar para análisis citológico, a fin de evaluar la presencia de enfermedad metastásica.
Bibliografía
- Villano JL, Parker CK, Dolecek TA: Descriptive epidemiology of ependymal tumours in the United States. Br J Cancer 108 (11): 2367-71, 2013. [PUBMED Abstract]
- Fassett DR, Pingree J, Kestle JR: The high incidence of tumor dissemination in myxopapillary ependymoma in pediatric patients. Report of five cases and review of the literature. J Neurosurg 102 (1 Suppl): 59-64, 2005. [PUBMED Abstract]
- Bandopadhayay P, Silvera VM, Ciarlini PDSC, et al.: Myxopapillary ependymomas in children: imaging, treatment and outcomes. J Neurooncol 126 (1): 165-174, 2016. [PUBMED Abstract]
- Raffeld M, Abdullaev Z, Pack SD, et al.: High level MYCN amplification and distinct methylation signature define an aggressive subtype of spinal cord ependymoma. Acta Neuropathol Commun 8 (1): 101, 2020. [PUBMED Abstract]
Aspectos generales de las opciones de tratamiento del ependimoma infantil
Muchos de los avances en la supervivencia de los pacientes con cáncer infantil se han logrado como resultado de ensayos clínicos en los que se ha intentado superar el mejor tratamiento aceptado disponible. Los ensayos clínicos en el ámbito pediátrico se diseñan para comparar un tratamiento nuevo con el tratamiento actual aceptado como estándar. Es posible realizar esta comparación en un ensayo aleatorizado con dos grupos de tratamiento, o mediante la evaluación de un solo tratamiento nuevo, al confrontar los resultados con los obtenidos antes por medio del tratamiento vigente.
Debido a que el cáncer infantil es relativamente poco frecuente, todos los pacientes con tumores de encéfalo de gran malignidad se deben considerar aptos para ingresar en un ensayo clínico. Con el fin de determinar y poner en práctica un tratamiento óptimo, la revisión de cada caso debe estar a cargo de un equipo multidisciplinario de especialistas en cáncer con experiencia en el tratamiento de tumores de encéfalo infantiles. La radioterapia para los tumores de encéfalo infantiles es muy difícil desde el punto de vista técnico y se debe administrar en centros con experiencia pediátrica a fin de garantizar resultados óptimos.
El tratamiento del ependimoma infantil comienza con cirugía. El tipo de terapia adyuvante que se administra, como una segunda cirugía, quimioterapia o radioterapia, depende de los siguientes aspectos:
- Subtipo de ependimoma.
- Ubicación del tumor primario.
- Si el tumor se extirpó de forma completa durante la cirugía inicial.
- Si el tumor se diseminó por todo el sistema nervioso central.
- Edad del niño.
En el Cuadro 1 se describen las opciones de tratamiento estándar del ependimoma infantil recién diagnosticado y del ependimoma infantil recidivante.
| Grupo de tratamiento | Opciones de tratamiento estándar | |
|---|---|---|
| OMS = Organización Mundial de la Salud. | ||
| Ependimoma mixopapilar infantil recién diagnosticado (grado 2 de la OMS) | Cirugía con radioterapia adyuvante o sin esta | |
| Ependimoma medular no mixopapilar infantil recién diagnosticado | Cirugía | |
| Radioterapia | ||
| Ependimoma intracraneal (supratentorial o de fosa posterior) infantil recién diagnosticado: | Cirugía | |
| Terapia adyuvante: | ||
| Sin enfermedad residual, sin enfermedad diseminada | —Radioterapia | |
| Enfermedad residual, sin enfermedad diseminada | —Cirugía de revisión | |
| —Radioterapia | ||
| —Quimioterapia antes de la irradiación | ||
| Enfermedad diseminada por el sistema nervioso central | —Radioterapia (no se considera un tratamiento estándar) | |
| —Quimioterapia (no se considera un tratamiento estándar) | ||
| Niños menores de 1 año | —Quimioterapia | |
| —Radioterapia diferida | ||
| Ependimoma infantil recidivante | Cirugía | |
| Radioterapia o quimioterapia | ||
Se han logrado mejoras notables en la supervivencia de niños y adolescentes con cáncer. Entre 1975 y 2020, la mortalidad por cáncer infantil disminuyó en más de un 50 %.[1-3] Los niños y adolescentes sobrevivientes de cáncer necesitan un seguimiento minucioso, ya que es posible que los efectos secundarios del tratamiento del cáncer persistan o se presenten meses o años después de este. Para obtener información específica sobre la incidencia, el tipo y la vigilancia de los efectos tardíos en los niños y adolescentes sobrevivientes de cáncer, consultar Efectos tardíos del tratamiento anticanceroso en la niñez.
Bibliografía
- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014. [PUBMED Abstract]
- National Cancer Institute: NCCR*Explorer: An interactive website for NCCR cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed February 25, 2025.
- Surveillance Research Program, National Cancer Institute: SEER*Explorer: An interactive website for SEER cancer statistics. Bethesda, MD: National Cancer Institute. Available online. Last accessed December 30, 2024.
Tratamiento del ependimoma mixopapilar infantil
El ependimoma mixopapilar, que se considera un subtipo histológico de ependimoma, tiene una incidencia relativamente alta de diseminación tumoral por el sistema nervioso central (SNC) en el momento del diagnóstico y durante el seguimiento. Se indican las imágenes de todo el eje encefalomedular en el momento del diagnóstico y durante el seguimiento.[1,2] Según la clasificación de tumores del SNC de la Organización Mundial de la Salud (OMS) de 2021, el ependimoma mixopapilar se considera en la actualidad como de grado 2 de la OMS, en lugar de grado 1, porque su tasa de recidiva es similar a la del ependimoma medular convencional y supera la tasa característica de los tumores de grado 1.[3]
La opción de tratamiento estándar del ependimoma mixopapilar infantil recién diagnosticado es la siguiente:
- Cirugía con radioterapia adyuvante o sin esta.
Tradicionalmente, el tratamiento del ependimoma mixopapilar consistió en un intento de resección tumoral en bloque sin necesidad de otro tratamiento si se lograba una resección macroscópica total.[4]; [5][Nivel de evidencia C2] No obstante, en la actualidad algunos médicos prefieren administrar radioterapia después de la resección quirúrgica de la masa primaria. Esta práctica se fundamenta en que haya diseminación tumoral a otras partes del sistema nervioso central, en particular cuando no se logra una resección completa, y hay evidencia de que la radioterapia focal a veces mejora la supervivencia sin progresión (SSP).[1,4]; [6-8][Nivel de evidencia C2]
Con la excepción de una resección macroscópica total en bloque, en la que se ha debatido la utilidad de la radioterapia adyuvante, la radioterapia se suele considerar para pacientes con una resección macroscópica que no sea total, una resección incompleta o enfermedad local recidivante después de la cirugía sola. En una revisión retrospectiva de una sola institución participaron 18 pacientes pediátricos con ependimoma mixopapilar.[9]
- El estudio registró unas tasas precarias de supervivencia sin complicaciones (SSC) a 5 y 10 años del 52 % y el 26 %, respectivamente.
- Sin embargo, estos pacientes tuvieron una excelente tasa de supervivencia general (SG) a 10 años del 100 %.
- De los pacientes, un 50 % tenían enfermedad metastásica en el momento del diagnóstico y un 50 % se sometieron a resecciones subtotales, pero solo 3 pacientes recibieron radioterapia (2 recibieron focal y 1 craneoespinal).
- La extensión de la resección no afectó la tasa de SSC.
- La enfermedad metastásica se relacionó con una peor SSC (tasa de SSC a 10 años, 13 %), en comparación con la enfermedad localizada (57 %; P = 0,07).
- En este estudio se concluyó que, a pesar del riesgo alto de recidiva, los pacientes con ependimoma mixopapilar tienen una excelente supervivencia a largo plazo. Por lo tanto, la radioterapia debe reservarse para los pacientes con recidivas sintomáticas con el fin de evitar complicaciones a largo plazo derivadas de la exposición a la radiación.
Sin embargo, en dos informes se apoyo el uso de radioterapia para pacientes con ependimoma mixopapilar espinal multifocal. En el primer estudio participaron 12 niños (<21 años de edad) que recibieron tratamiento con un volumen limitado de radioterapia de protones sin compromiso del encéfalo. La mediana de edad de los pacientes fue de 13,5 años. La radioterapia se administró como terapia adyuvante tras la cirugía primaria en 5 pacientes y para la recidiva en 7 pacientes. No se había administrado radioterapia a ningún paciente antes. De los 12 pacientes, 11 (92 %) presentaban evidencia de enfermedad macroscópica en el momento de la radioterapia, y todos menos 1 recibieron radioterapia a una dosis de eficacia biológica relativa (EBR) de 54 Gy.[10]
- Al cabo de una mediana de seguimiento de 3,6 años (intervalo, 1,8–10,6 años), la tasa de control local a 5 años fue del 100 %, la tasa de SSP fue del 92 % y la tasa de SG fue del 100 %.
- Un paciente presentó cifosis de columna vertebral de grado 3 tras la combinación de cirugía y radioterapia, y otro presentó neuropatía unilateral de grado 2 en L5.
En un estudio retrospectivo multiinstitucional secundario de 60 pacientes que tuvieron cáncer durante la niñez, adolescencia o juventud también se indicó beneficio de la radioterapia (2000–2020). La mediana de edad en el momento de recibir la radioterapia fue de 14,8 años (intervalo, 7,1–26,5 años). La población se consideró de riesgo alto porque las indicaciones para la radioterapia incluyeron enfermedad macroscópica residual, enfermedad microscópica residual, o enfermedad multifocal o recidivante.[11]
- En el momento de administración de la radioterapia, 45 pacientes (75,0 %) tenían enfermedad macroscópica residual y 35 (58,3 %), tenían enfermedad multifocal.
- De todos los pacientes, 48 (80,0 %) recibió radioterapia dirigida al campo comprometido (RTCC), 7 (11,7 %), recibió radioterapia craneoespinal y 5 (8,3 %), recibió radioterapia dirigida a toda la médula espinal.
- Al cabo de una mediana de seguimiento de 6,2 años (intervalo, 0,6–21,0 años), la tasa de SG a 5 años fue del 100 %, la tasa de SSP fue del 60,8 % y la incidencia acumulada de tasa de progresión en el campo fue del 4,1 %.
- Las 2 recidivas locales se presentaron en sitios de enfermedad macroscópica residual. De los 18 casos de recidivas fuera del campo de radioterapia, todos los casos se presentaron en un nivel superior al campo de tratamiento inicial. De estos pacientes, 9 presentaron recaídas intracraneales (5 de ellas fueron recaídas intracraneales aisladas).
- Entre los pacientes con ependimoma mixopapilar metastásico, no hubo diferencias estadísticamente significativas en la SSP en los pacientes tratados con RTCC (dirigida a todos los sitios) y aquellos tratados con irradiación dirigida a todo el encéfalo o craneoespinal (P = 0,283).
- En un análisis univariante, la presencia de recidiva a distancia aislada antes de la radioterapia se asoció de manera significativa con un periodo más corto hasta la progresión (CRI, 4,00; IC 95 %, 1,54–10,43; P = 0,005).
- Las conclusiones de este informe fueron las siguientes: 1) el riesgo de recidiva en el campo de radiación es bajo, y 2) los pacientes que presentaron cáncer durante la infancia, adolescencia y juventud con alto riesgo de ependimoma mixopapilar continúan presentando un riesgo alto de recidiva en la médula espinal, por encima de los campos de radiación y de recidiva intracraneal después de la radioterapia.
Bibliografía
- Fassett DR, Pingree J, Kestle JR: The high incidence of tumor dissemination in myxopapillary ependymoma in pediatric patients. Report of five cases and review of the literature. J Neurosurg 102 (1 Suppl): 59-64, 2005. [PUBMED Abstract]
- Bagley CA, Kothbauer KF, Wilson S, et al.: Resection of myxopapillary ependymomas in children. J Neurosurg 106 (4 Suppl): 261-7, 2007. [PUBMED Abstract]
- Louis DN, Perry A, Wesseling P, et al.: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 23 (8): 1231-1251, 2021. [PUBMED Abstract]
- Akyurek S, Chang EL, Yu TK, et al.: Spinal myxopapillary ependymoma outcomes in patients treated with surgery and radiotherapy at M.D. Anderson Cancer Center. J Neurooncol 80 (2): 177-83, 2006. [PUBMED Abstract]
- Bagley CA, Wilson S, Kothbauer KF, et al.: Long term outcomes following surgical resection of myxopapillary ependymomas. Neurosurg Rev 32 (3): 321-34; discussion 334, 2009. [PUBMED Abstract]
- Pica A, Miller R, Villà S, et al.: The results of surgery, with or without radiotherapy, for primary spinal myxopapillary ependymoma: a retrospective study from the rare cancer network. Int J Radiat Oncol Biol Phys 74 (4): 1114-20, 2009. [PUBMED Abstract]
- Agbahiwe HC, Wharam M, Batra S, et al.: Management of pediatric myxopapillary ependymoma: the role of adjuvant radiation. Int J Radiat Oncol Biol Phys 85 (2): 421-7, 2013. [PUBMED Abstract]
- Jeibmann A, Egensperger R, Kuchelmeister K, et al.: Extent of surgical resection but not myxopapillary versus classical histopathological subtype affects prognosis in lumbo-sacral ependymomas. Histopathology 54 (2): 260-2, 2009. [PUBMED Abstract]
- Bandopadhayay P, Silvera VM, Ciarlini PDSC, et al.: Myxopapillary ependymomas in children: imaging, treatment and outcomes. J Neurooncol 126 (1): 165-174, 2016. [PUBMED Abstract]
- Looi WS, Indelicato DJ, Mailhot Vega RB, et al.: Outcomes following limited-volume proton therapy for multifocal spinal myxopapillary ependymoma. Pediatr Blood Cancer 68 (3): e28820, 2021. [PUBMED Abstract]
- Liu KX, Indelicato DJ, Paulino AC, et al.: Multi-institutional Characterization of Outcomes for Pediatric and Young Adult Patients With High-Risk Myxopapillary Ependymoma After Radiation Therapy. Int J Radiat Oncol Biol Phys 117 (5): 1174-1180, 2023. [PUBMED Abstract]
Tratamiento del ependimoma medular no mixopapilar infantil
Las opciones de tratamiento estándar del ependimoma medular no mixopapilar infantil recién diagnosticado son las siguientes:
- Cirugía.
- Radioterapia.
Aunque en los estudios se indica que la cirugía sola puede ser adecuada para muchos tumores de grado 1, la radioterapia adyuvante tal vez mejore la supervivencia en pacientes con tumores no mixopapilares de grado alto (2/3); un informe bicéntrico de la University of Florida y el Massachusetts General Hospital respalda el uso de la radioterapia para el control tumoral.[1-3]
Entre 2008 y 2019, 14 pacientes pediátricos con ependimomas medulares no metastásicos y no mixopapilares de grado 2 (n = 6) y grado 3 (n = 8) recibieron tratamiento con dosis de radioterapia entre 50,4 Gy (eficacia biológica relativa [RBE]) y 54 Gy (RBE) (protones). La mediana de edad de los pacientes en el momento de la radioterapia era de 14 años (intervalo, 1,5–18 años). Antes de la radioterapia, 3 pacientes se sometieron a resección subtotal y 11 a resección macroscópica total o casi total.[4]
- Al cabo de una mediana de seguimiento de 6,3 años (intervalo, 1,5–14,8 años), ningún tumor progresó.
- Aunque la mayoría de los pacientes experimentaron secuelas neurológicas tras la cirugía, solo 1 presentó déficits neurológicos adicionales tras la radioterapia.
Bibliografía
- Oh MC, Ivan ME, Sun MZ, et al.: Adjuvant radiotherapy delays recurrence following subtotal resection of spinal cord ependymomas. Neuro Oncol 15 (2): 208-15, 2013. [PUBMED Abstract]
- Volpp PB, Han K, Kagan AR, et al.: Outcomes in treatment for intradural spinal cord ependymomas. Int J Radiat Oncol Biol Phys 69 (4): 1199-204, 2007. [PUBMED Abstract]
- Merchant TE, Kiehna EN, Thompson SJ, et al.: Pediatric low-grade and ependymal spinal cord tumors. Pediatr Neurosurg 32 (1): 30-6, 2000. [PUBMED Abstract]
- Indelicato DJ, Ioakeim-Ioannidou M, Grippin AJ, et al.: Bicentric Treatment Outcomes After Proton Therapy for Nonmyxopapillary High-Grade Spinal Cord Ependymoma in Children. Int J Radiat Oncol Biol Phys 112 (2): 335-341, 2022. [PUBMED Abstract]
Tratamiento del ependimoma intracraneal infantil
Las opciones de tratamiento estándar del ependimoma intracraneal infantil recién diagnosticado son las siguientes:
Por lo general, todos los pacientes se someten a cirugía para extirpar el tumor. La administración de tratamiento adicional depende del subtipo de ependimoma, la edad del niño, el grado de resección del tumor y la presencia de enfermedad diseminada.
Cirugía
Con la cirugía se pretende conseguir la máxima reducción del tumor. La evidencia indica que la resección quirúrgica más extensa se relaciona con una mejor tasa de supervivencia.[1-5]; [6,7][Nivel de evidencia C2] Se obtienen imágenes por resonancia magnética (IRM) posoperatorias a fin de corroborar el alcance de la resección. Si no se realiza antes de la operación, se toma una IRM de todo el sistema nervioso central y un análisis citopatológico del líquido cefalorraquídeo con el fin de evaluar la diseminación de la enfermedad.
Los pacientes de todos los subtipos moleculares que tienen tumor residual o enfermedad diseminada se consideran pacientes en riesgo alto de recaída, y tal vez se deban tratar con protocolos diseñados de manera específica para ellos. Los pacientes sin indicios de tumor residual tienen un riesgo de recaída alrededor del 20 % al 40 %, a pesar de recibir radioterapia posoperatoria.[8][Nivel de evidencia B4]
La experiencia anecdótica indica que, en determinados casos, la cirugía sola es el abordaje terapéutico apropiado para el tratamiento de los tumores supratentoriales de grado 2 de la Organización Mundial de la Salud (OMS) completamente resecados y de los ependimomas medulares.[9-13][Nivel de evidencia C2]
Evidencia (cirugía):
- En un ensayo prospectivo multicéntrico de un grupo cooperativo (Children's Oncology Group [COG] ACNS0121 [NCT00027846]) se incluyó a pacientes con ependimomas intracraneales recién diagnosticados (N = 356). Se usó cirugía sola para el tratamiento de los ependimomas supratentoriales de grado 2 de la OMS con resección macroscópica completa (n = 11).[8][Nivel de evidencia B4]
- La tasa de supervivencia sin complicaciones (SSC) a 5 años fue del 61,4 % y la tasa de supervivencia general (SG) fue del 100 %.
- Se presentó fracaso local en 4 pacientes (36 %), y fracaso local y a distancia en 1 paciente (9 %).
- En este estudio, el número de pacientes apto para un abordaje quirúrgico solo fue muy pequeño. Únicamente un subgrupo de estos pacientes evitó con éxito un tratamiento adicional.
El análisis retrospectivo de los desenlaces de pacientes con ependimoma de fosa posterior B indica que la resección macroscópica completa podría ser un tratamiento suficiente por sí solo,[7] pero este abordaje no se ha sometido a prueba en un ensayo clínico aleatorizado prospectivo.
Terapia adyuvante
Tratamiento de pacientes sin enfermedad residual ni diseminada
Radioterapia
El tratamiento posquirúrgico estándar para estos pacientes ha sido la radioterapia con de 54 Gy a 59,4 Gy dirigidos al lecho tumoral en niños de 3 años y más.[5,14] En el estudio ACNS0121 (NCT00027846) se amplió el uso de radioterapia (54 Gy) a los pacientes de hasta 1 año de edad, lo que produjo tasas de SSC y SG similares, en comparación con los niños mayores de 3 años.[8][Nivel de evidencia B4]
No es necesario tratar todo el SNC (encéfalo y médula espinal) porque es habitual que la primera recidiva de estos tumores sea local, aunque a veces los ependimomas de fosa posterior están diseminados en el momento de la recidiva, en especial, los tumores con ganancia de 1q.[15]; [16][Nivel de evidencia C1]
Evidencia (radioterapia):
- En un estudio de una sola institución, se trató a 74 pacientes de 1 a 21 años con radioterapia conformada inmediatamente después de la cirugía.[17]
- La tasa de supervivencia sin progresión (SSP) a 3 años fue del 77,6 % (± 5,8 %).
- En una extensión de la serie descrita antes, 107 de 153 pacientes se sometieron a radioterapia conformada inmediatamente después de la resección inicial.[5][Nivel de evidencia C1]
- La tasa de SSC a 7 años fue del 76,9 % (± 13,5 %).
- En un estudio prospectivo del COG (ACNS0121 [NCT00027846]) se inscribieron 356 pacientes con ependimoma recién diagnosticado, de edades entre 1 y 21 años, divididos en los siguientes 4 estratos.[8][Nivel de evidencia B4]
- Estrato 1: pacientes con ependimomas supratentoriales de tipo histológico diferenciado completamente resecados que recibieron tratamiento sin radioterapia.
- La tasa de SSP a 5 años fue del 61,4 % (intervalo de confianza 95 %, 34,5–89,6 %), sin muertes a los 7 años, aunque solo 11 pacientes se incluyeron en este estrato.
- Estrato 2: pacientes con ependimomas que se sometieron a resección subtotal (supratentorial e infratentorial) con enfermedad residual que mide más de 5 mm. El tratamiento consistió en 2 ciclos de quimioterapia seguidos de cirugía de revisión y radioterapia conformada dirigida al lecho tumoral (se añadió 1 cm de volumen clínico diana). La dosis de radiación fue de 54 Gy para los pacientes de 12 a 18 meses, y de 59,4 Gy para los pacientes mayores de 18 meses.
- La tasa de SSP a 5 años fue del 25 % en los pacientes en quienes no era viable hacer una segunda cirugía, y del 50 % en los pacientes en quienes se logró una resección macroscópica completa con la segunda cirugía.
- Estratos 3 y 4: pacientes con resección casi total (estrato 3) y resección macroscópica total (estrato 4). Los pacientes de 12 a 18 meses recibieron radioterapia posoperatoria en dosis de 54 Gy, y los pacientes mayores de 18 meses recibieron dosis de 59,4 Gy (se adicionó 1 cm de volumen clínico diana).
- La tasa de SSP a 5 años fue del 68,5 % (intervalo, 62,8–74,2 %).
- Ependimoma de fosa posterior A (PF-EPN-A), equilibrio de 1q (sin ganancia de 1q): la tasa de SSP a 5 años fue del 81,5 % (intervalo, 71,5–91,5 %).
- PF-EPN-A, ganancia de 1q: la tasa de SSP a 5 años fue del 35,7 % (intervalo, 12,8–58,6 %).
- Para los pacientes con PF-EPN-A, la recidiva a distancia fue más frecuente en los pacientes con ganancia de 1q que en los pacientes con 1q equilibrado (sin ganancia de 1q).
- Ependimomas supratentoriales: de los 39 pacientes con tumores supratentoriales sometidos a pruebas, 30 albergaban fusiones de ZFTA, 23 de ellos estaban en los estratos 3 y 4. No hubo diferencia significativa en la supervivencia. Las tasas de SG a 5 años superaron el 80 %.
- Estrato 1: pacientes con ependimomas supratentoriales de tipo histológico diferenciado completamente resecados que recibieron tratamiento sin radioterapia.
- La radioterapia con haz de protones (tipo de radioterapia con partículas cargadas) ofrece una posible ventaja porque se dirige al tumor (supratentorial o infratentorial) sin afectar el encéfalo sano ni los tejidos neuroendocrinos vitales.
- Según un informe del Massachusetts General Hospital, 150 pacientes (<22 años de edad) con ependimomas de grado 2 y grado 3 de la OMS recibieron tratamiento con radioterapia de protones entre 2001 y 2019. La mediana de seguimiento fue de 6,5 años.[18]
- Para la cohorte intracraneal (n = 145), la tasa de SSC a 7 años fue del 63,4 %, la tasa de SG fue del 82,6 % y la tasa de control local fue del 76,1 %.
- De estos pacientes, 51 experimentaron recidiva del tumor: 26 pacientes (51 %) presentaron recidivas locales, 19 pacientes (37,3 %) tuvieron recidivas a distancia y 6 pacientes (11,8 %) presentaron recidivas sincrónicas.
- De los 150 pacientes, 116 (77,3 %) se sometieron a resección macroscópica total, 5 (3,3 %) a resección casi total y 29 (19,3 %) a resección subtotal.
- En la cohorte intracraneal, la tasa de SSC a 7 años fue del 70,3 % en los pacientes que se sometieron a resección macroscópica total o casi total, y del 35,2 % en los que se sometieron a resección subtotal.
- Con el análisis multivariante, el efecto de la escisión del tumor persistió tras controlar la ubicación del tumor.
- En un estudio combinado del Massachusetts General Hospital y la University of Florida, 386 niños con ependimomas intracraneales no metastásicos de grado 2 y 3 recibieron tratamiento con radioterapia de protones.[19]
- Al cabo de una mediana de seguimiento de 5 años, la tasa de control local a 7 años fue del 77 %, la tasa de SSP del 63,8 % y la tasa de SG del 82 %.
- Al igual que en el informe anterior, la resección subtotal se relacionó con un peores resultados de control local, SSP y SG.
- Las dosis de radioterapia superiores a 54 Gy no se relacionaron con control de la enfermedad o supervivencia superiores.
- La tasa de toxicidad del tronco encefálico superior al grado 2 fue del 4 %, y 2 niños murieron debido a toxicidad en el tronco encefálico.
- En el estudio KiProReg, 105 niños con ependimomas intracraneales recibieron tratamiento con radioterapia de protones a una mediana de dosis total de 59,4 Gy. Los niños menores de 4 años recibieron 54 Gy. La mediana de seguimiento fue de 1,9 años.[20]
- La tasa estimada de SG a 3 años fue del 93,7 %, la tasa de control local, del 74,1 % y la tasa de SSP, del 55,6 %.
- Las cirugías múltiples se identificaron como un factor de riesgo de SSP inferior.
- La tasa de toxicidad de grado 3 fue baja y no se produjeron episodios de necrosis sintomática en el tronco encefálico.
En algunos centros, la preocupación por la toxicidad en el tronco encefálico en niños muy pequeños (edad <3 años) después de la terapia de protones dirigida a la fosa posterior ha motivado el uso de dosis más moderadas para estos niños.[21-23]
- Según un informe del Massachusetts General Hospital, 150 pacientes (<22 años de edad) con ependimomas de grado 2 y grado 3 de la OMS recibieron tratamiento con radioterapia de protones entre 2001 y 2019. La mediana de seguimiento fue de 6,5 años.[18]
- En el estudio International Society of Paediatric Oncology (SIOP) Ependymoma I participaron 74 pacientes pediátricos aptos con ependimomas localizados. De los pacientes, 33 se sometieron a una resección macroscópica total antes de recibir irradiación focal.[24][Nivel de evidencia B4]
- La tasa de SSC a 5 años fue del 69 % y la tasa de SSC a 10 años, del 63 %.
- La tasa de SG a 5 años fue del 81 % y la tasa de SG a 10 años, del 68 %.
- El análisis post hoc de los factores de riesgo conocidos confirmó el impacto de la ganancia de 1q, la pérdida de H3K27me3 y la expresión de hTERT.
Cuando sea posible, los pacientes pediátricos deben recibir tratamiento en un centro con experiencia en la administración de radioterapia conformada tridimensional (incluso radioterapia de intensidad modulada o radioterapia con partículas cargadas [por ejemplo, radioterapia de protones]) para minimizar efectos secundarios a largo plazo.
Quimioterapia
Los abordajes actuales de tratamiento no incluyen la quimioterapia como un componente estándar para el tratamiento primario de niños con un ependimoma recién diagnosticado totalmente resecado. La utilidad de la quimioterapia adyuvante se estudió en el finalizado ensayo del COG ACNS0831 (NCT01096368) . Está pendiente la publicación de los resultados de este ensayo. No hay evidencia de que la quimioterapia mieloablativa [25] mejore los desenlaces de los pacientes con ependimomas totalmente resecados que no se han diseminado.
Tratamiento de la enfermedad residual no diseminada
Cirugía de revisión
Se deberá considerar la cirugía de revisión porque los pacientes sometidos a una resección completa seguida de irradiación obtienen mejor control de la enfermedad.[26] En algunos casos, se hace otra cirugía después del intento de resección inicial si el neurocirujano pediatra cree que se podría obtener una resección macroscópica total mediante un abordaje quirúrgico alternativo del tumor. En otros casos, no se prevé que otra cirugía permita obtener una resección macroscópica total; por lo tanto, la terapia adyuvante se inicia teniendo en cuenta una posible cirugía de revisión posterior.[8]
Radioterapia
La base teórica para la radioterapia, como se describió antes en la sección Tratamiento de pacientes sin enfermedad residual ni diseminada, también corresponde al tratamiento de los niños con ependimoma residual no diseminado. En los pacientes con resección subtotal, el tratamiento con radioterapia produce una tasa de SSP a 5 años del 25 % y el desenlace es particularmente precario en los pacientes con PF-EPN-A,[8] aunque quizás sea mejor en los pacientes con tumor residual dentro del canal medular.[27]
Quimioterapia antes de la irradiación
La justificación para usar quimioterapia en los pacientes con tumor residual es intentar lograr un estado de ausencia de indicios de enfermedad antes de recibir la radioterapia, ya sea al obtener una respuesta completa (RC) a la quimioterapia sola o aumentando la probabilidad de una resección macroscópica total en el momento de la cirugía de revisión después de la quimioterapia. Está en investigación el beneficio de la quimioterapia para un tumor residual después de la cirugía inicial.
Evidencia (quimioterapia antes de la irradiación con cirugía o sin esta):
- En un estudio se demostró beneficio de la administración de quimioterapia antes de la irradiación para los niños con una resección casi total (resección >90 %), y se obtuvieron resultados similares a los de niños sometidos a una resección macroscópica total seguida de radioterapia.[28]
- En el ensayo del COG ACNS0121 (NCT00027846) se administraron 2 ciclos de quimioterapia antes de la irradiación a los niños con enfermedad residual después de la cirugía inicial (n = 64).[8][Nivel de evidencia B4]
- Se hizo una cirugía de revisión en el 39 % de los pacientes (n = 25) (resección macroscópica total, 56 %; resección casi total, 20 %; resección subtotal, 24 %).
- En los pacientes sometidos a cirugía de revisión, la tasa de SSC a 5 años fue del 50,5 %, en comparación con el 28,5 % en los pacientes que no se sometieron a una cirugía de revisión (P = 0,12).
- En un ensayo multicéntrico de niños menores de 3 años se usó quimioterapia antes de la irradiación, seguida de radiación conformada después de los 12 meses de edad y luego, quimioterapia de mantenimiento.[29][Nivel de evidencia B4]
- Se inscribieron 54 pacientes, y el 54 % de los pacientes (n = 29) se sometieron a resección macroscópica total en el momento del diagnóstico.
- De los 25 pacientes restantes, el 60 % (n = 15) se sometieron a una cirugía de revisión después de la quimioterapia; en el 80 % de los pacientes se logró una resección macroscópica total.
- En el momento de la radioterapia, un 76 % de los pacientes se había sometido a una resección macroscópica total, un 13 %, a una resección casi total y un 11 %, a una resección subtotal.
- La SSP mejoró (pero no la SG) en los pacientes sometidos a una resección macroscópica total o casi total antes de la radioterapia, en comparación con los pacientes sometidos a resección subtotal (tasa de SSP a 4 años, 79 % para la resección macroscópica total o casi total vs. 41,7 % para la resección subtotal) (P = 0,024).
- En el estudio SIOP Ependymoma I participaron 74 pacientes, 41 de los cuales se sometieron a una resección subtotal tras el tratamiento quirúrgico inicial. El protocolo especificaba que estos pacientes debían recibir hasta 4 ciclos de vincristina, etopósido y ciclofosfamida (VEC) antes de la irradiación. De los 41 pacientes, 10 no recibieron la terapia VEC especificada en el protocolo y 3 pacientes optaron por no recibir más terapia y no recibieron radioterapia.[24][Nivel de evidencia B4]
- De los 29 pacientes que recibieron VEC, la tasa combinada de respuesta completa y respuesta parcial fue del 65 %, lo que superó el umbral de tasa de respuesta preespecificado del 45 %.
- De los pacientes, 8 presentaron enfermedad progresiva al finalizar la quimioterapia VEC. Las tasas de SSC a 5 y 10 años fueron del 34 %. La tasa de SG a 5 años fue del 60 % y la tasa de SG a 10 años, del 54 %.
- En el estudio se demostró respuesta a los fármacos quimioterapéuticos en la mayoría de los pacientes. Sin embargo, debido al reducido número de pacientes, no fue posible determinar el beneficio añadido de la VEC previa a la irradiación para facilitar una resección macroscópica total posterior o para mejorar la supervivencia, en comparación con los pacientes con una resección subtotal que optaron por no recibir la VEC antes de la radioterapia.
No hay evidencia de que la quimioterapia de dosis altas con rescate de células madre produzca ningún beneficio.[30]; [31][Nivel de evidencia B4]
Tratamiento de la enfermedad diseminada por el sistema nervioso central
Radioterapia
Con independencia del grado de resección quirúrgica, los pacientes con enfermedad diseminada al SNC por lo general reciben radioterapia dirigida a todo el encéfalo y la médula espinal, junto con refuerzos dirigidos a la enfermedad local y a las áreas macroscópicas de enfermedad diseminada. Las dosis tradicionales de radiación local posoperatoria para estos pacientes son de 54 Gy a 55,8 Gy. También se administran dosis de alrededor de 36 Gy dirigidas a todo el sistema nervioso central (es decir, todo el encéfalo y la médula espinal), aunque es posible modularlas de acuerdo con la edad del paciente.[32] Se deberán administrar refuerzos de 41,4 Gy y 50,4 Gy dirigidos a las áreas de enfermedad macroscópica en la médula espinal, con dosis ajustadas a la edad del paciente y la localización del tumor. Sin embargo, no hay estudios contemporáneos publicados que respalden este abordaje.
Quimioterapia
Aunque la quimioterapia se utiliza a menudo debido a cierto grado de respuesta, se necesita evidencia que demuestre una mejora en la SSC y la SG.[33]
Tratamiento de los niños menores de 1 año
Quimioterapia
Algunos regímenes quimioterapéuticos producen respuestas objetivas en niños menores de 3 años con ependimomas recién diagnosticados.[34-37] El objetivo de la quimioterapia es evitar la radiación, diferirla hasta que el niño sea mayor o alcanzar un estado de ausencia de indicios de enfermedad antes de someterse a radioterapia (RC a la quimioterapia o resección macroscópica total en el momento de la cirugía de revisión después de la quimioterapia). Hasta un 25 % de los lactantes y niños pequeños con enfermedad totalmente resecada logran una supervivencia a largo plazo. En estos estudios no se hizo ninguna caracterización molecular y no está claro qué pacientes obtienen beneficio de los regímenes de quimioterapia sola. Es posible que los sobrevivientes que recibieron protocolos de quimioterapia sola con el tiempo reciban radioterapia de rescate.[38]; [39][Nivel de evidencia B4]
Radioterapia diferida
Tradicionalmente, la radioterapia posoperatoria se omitió en los niños menores de 3 años con ependimomas. En dos estudios del COG (POG-9233 y ACNS0121 [NCT00027846]) y en muchos estudios posteriores, se redujo el límite de edad para la radioterapia posoperatoria hasta 1 año en un intento por mejorar los desenlaces de estos niños pequeños. En el ensayo ACNS0121 se observó que la radiación conformada en niños con tumores completamente resecados produjo mejoras significativas en los desenlaces, en comparación con los pacientes que recibieron quimioterapia sola.[8][Nivel de evidencia B4]
No queda claro qué pacientes se benefician de los abordajes de reducción de la radiación. Sin embargo, en la comparación de los resultados del ensayo POG-9233 con los resultados del ensayo ACNS0121 (NCT00027846) se indicó una mejora del 50 % al 60 % en la supervivencia de los pacientes tratados con radioterapia.[8,38] Una evaluación prospectiva de los marcadores moleculares quizás permita identificar a los lactantes que se pueden tratar de manera inocua con abordajes de reducción de la radiación, y a los pacientes que quizás se beneficien de la quimioterapia.
Evidencia (radioterapia):
- Las revisiones retrospectivas a partir de datos del Surveillance, Epidemiology, and End Results Program de niños menores de 3 años en el momento del diagnóstico se acumularon durante un período de 50 años.[40]
- En los resultados se observó que los pacientes que recibieron radioterapia local obtuvieron mejores tasas de supervivencia a 10 años, incluso después de los ajustes relacionados con el alcance de la resección y el grado del tumor (grado 2 vs. grado 3 de la OMS).
- En un amplio estudio retrospectivo, de 820 ependimomas de fosa posterior caracterizados desde el punto de vista molecular, se demostró lo siguiente:[7]
- La radioterapia adyuvante de primera línea, junto con la resección completa y el subgrupo PF-EPN-B, se relacionaron con un mejor pronóstico.
- Los abordajes de reducción de la radiación se relacionaron con desenlaces desalentadores en niños con tumores PF-EPN-A.
- La radioterapia conformada o de partículas cargadas (por ejemplo, protones) es un abordaje alternativo para minimizar el daño neurológico causado por la radiación en los niños pequeños con ependimomas. Todavía está por determinarse la necesidad de la radioterapia y el momento oportuno para administrarla a niños que completaron con éxito la quimioterapia y no tienen enfermedad residual.
- La experiencia inicial con este abordaje indicó que los niños menores de 3 años con ependimomas presentan déficits neurológicos en el momento del diagnóstico que mejoran con el tiempo después de recibir radioterapia conformada.[17]
- En otro estudio se indicó que hubo una tendencia al deterioro intelectual a lo largo del tiempo, incluso en niños mayores tratados con radioterapia localizada.[41]; [42][Nivel de evidencia C1]
- En el estudio del COG ACNS0121 (NCT00027846) se observó que los niños de entre 1 y 3 años que se sometieron a resección macroscópica total o casi total seguida inmediatamente después por radioterapia posoperatoria presentaron los siguientes resultados:[8][Nivel de evidencia B4]
- La tasa de SSC a 5 años fue del 62,9 %, y la tasa de SG fue del 87,4 %.
- Estos resultados no son estadísticamente diferentes a los resultados observados en pacientes de 3 a 21 años, con una tasa de SSC a 5 años del 70,5 % y una tasa de SG del 85,8 %.
- En un ensayo multicéntrico de niños menores de 3 años con ependimomas recién diagnosticados (n = 54) que recibieron 4 a 6 ciclos de quimioterapia, seguidos de radioterapia (después de los 12 meses de edad) se observaron los siguientes resultados:[29][Nivel de evidencia B4]
- La tasa de SSP a 4 años fue del 75,1 % y la tasa de SG fue del 92,6 %.
- Estos resultados fueron comparables con los resultados observados en estudios de tratamiento de niños mayores de 3 años.
- Es interesante notar que no se observaron diferencias en los resultados entre lactantes menores de 1 año y niños de 1 a 3 años de edad en el momento del diagnóstico.
Los abordajes de radioterapia conformada, como la radioterapia conformada tridimensional, que reducen al mínimo el daño al tejido encefálico normal, y la radioterapia con partículas cargadas, como la terapia con haz de protones, se encuentran en evaluación para los lactantes y niños con ependimomas.[17,43] Cuando se analizan los desenlaces neurológicos después del tratamiento de los niños pequeños con ependimomas, es importante tener en cuenta que no todos los déficits a largo plazo se pueden atribuir a la radioterapia, porque estos a veces se presentan en niños pequeños antes de que comience el tratamiento.[17] Por ejemplo, la presencia de hidrocefalia en el momento del diagnóstico se relaciona con un coeficiente intelectual más bajo medido después de la resección quirúrgica y antes de la administración de radioterapia.[44]
Opciones de tratamiento en evaluación clínica para el ependimoma infantil
Tal vez haya ensayos clínicos terapéuticos de fase inicial para pacientes seleccionados. Es posible que estos ensayos estén disponibles a través del COG, el Pediatric Brain Tumor Consortium u otras entidades. La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- van Veelen-Vincent ML, Pierre-Kahn A, Kalifa C, et al.: Ependymoma in childhood: prognostic factors, extent of surgery, and adjuvant therapy. J Neurosurg 97 (4): 827-35, 2002. [PUBMED Abstract]
- Abdel-Wahab M, Etuk B, Palermo J, et al.: Spinal cord gliomas: A multi-institutional retrospective analysis. Int J Radiat Oncol Biol Phys 64 (4): 1060-71, 2006. [PUBMED Abstract]
- Kothbauer KF: Neurosurgical management of intramedullary spinal cord tumors in children. Pediatr Neurosurg 43 (3): 222-35, 2007. [PUBMED Abstract]
- Zacharoulis S, Ji L, Pollack IF, et al.: Metastatic ependymoma: a multi-institutional retrospective analysis of prognostic factors. Pediatr Blood Cancer 50 (2): 231-5, 2008. [PUBMED Abstract]
- Merchant TE, Li C, Xiong X, et al.: Conformal radiotherapy after surgery for paediatric ependymoma: a prospective study. Lancet Oncol 10 (3): 258-66, 2009. [PUBMED Abstract]
- Cage TA, Clark AJ, Aranda D, et al.: A systematic review of treatment outcomes in pediatric patients with intracranial ependymomas. J Neurosurg Pediatr 11 (6): 673-81, 2013. [PUBMED Abstract]
- Ramaswamy V, Hielscher T, Mack SC, et al.: Therapeutic Impact of Cytoreductive Surgery and Irradiation of Posterior Fossa Ependymoma in the Molecular Era: A Retrospective Multicohort Analysis. J Clin Oncol 34 (21): 2468-77, 2016. [PUBMED Abstract]
- Merchant TE, Bendel AE, Sabin ND, et al.: Conformal Radiation Therapy for Pediatric Ependymoma, Chemotherapy for Incompletely Resected Ependymoma, and Observation for Completely Resected, Supratentorial Ependymoma. J Clin Oncol 37 (12): 974-983, 2019. [PUBMED Abstract]
- Volpp PB, Han K, Kagan AR, et al.: Outcomes in treatment for intradural spinal cord ependymomas. Int J Radiat Oncol Biol Phys 69 (4): 1199-204, 2007. [PUBMED Abstract]
- Hukin J, Epstein F, Lefton D, et al.: Treatment of intracranial ependymoma by surgery alone. Pediatr Neurosurg 29 (1): 40-5, 1998. [PUBMED Abstract]
- Little AS, Sheean T, Manoharan R, et al.: The management of completely resected childhood intracranial ependymoma: the argument for observation only. Childs Nerv Syst 25 (3): 281-4, 2009. [PUBMED Abstract]
- Venkatramani R, Dhall G, Patel M, et al.: Supratentorial ependymoma in children: to observe or to treat following gross total resection? Pediatr Blood Cancer 58 (3): 380-3, 2012. [PUBMED Abstract]
- Ghia AJ, Mahajan A, Allen PK, et al.: Supratentorial gross-totally resected non-anaplastic ependymoma: population based patterns of care and outcomes analysis. J Neurooncol 115 (3): 513-20, 2013. [PUBMED Abstract]
- Koshy M, Rich S, Merchant TE, et al.: Post-operative radiation improves survival in children younger than 3 years with intracranial ependymoma. J Neurooncol 105 (3): 583-90, 2011. [PUBMED Abstract]
- Combs SE, Kelter V, Welzel T, et al.: Influence of radiotherapy treatment concept on the outcome of patients with localized ependymomas. Int J Radiat Oncol Biol Phys 71 (4): 972-8, 2008. [PUBMED Abstract]
- Schroeder TM, Chintagumpala M, Okcu MF, et al.: Intensity-modulated radiation therapy in childhood ependymoma. Int J Radiat Oncol Biol Phys 71 (4): 987-93, 2008. [PUBMED Abstract]
- Merchant TE, Mulhern RK, Krasin MJ, et al.: Preliminary results from a phase II trial of conformal radiation therapy and evaluation of radiation-related CNS effects for pediatric patients with localized ependymoma. J Clin Oncol 22 (15): 3156-62, 2004. [PUBMED Abstract]
- Patteson BE, Baliga S, Bajaj BVM, et al.: Clinical outcomes in a large pediatric cohort of patients with ependymoma treated with proton radiotherapy. Neuro Oncol 23 (1): 156-166, 2021. [PUBMED Abstract]
- Indelicato DJ, Ioakeim-Ioannidou M, Bradley JA, et al.: Proton Therapy for Pediatric Ependymoma: Mature Results From a Bicentric Study. Int J Radiat Oncol Biol Phys 110 (3): 815-820, 2021. [PUBMED Abstract]
- Peters S, Merta J, Schmidt L, et al.: Evaluation of dose, volume, and outcome in children with localized, intracranial ependymoma treated with proton therapy within the prospective KiProReg Study. Neuro Oncol 24 (7): 1193-1202, 2022. [PUBMED Abstract]
- Indelicato DJ, Flampouri S, Rotondo RL, et al.: Incidence and dosimetric parameters of pediatric brainstem toxicity following proton therapy. Acta Oncol 53 (10): 1298-304, 2014. [PUBMED Abstract]
- Sato M, Gunther JR, Mahajan A, et al.: Progression-free survival of children with localized ependymoma treated with intensity-modulated radiation therapy or proton-beam radiation therapy. Cancer 123 (13): 2570-2578, 2017. [PUBMED Abstract]
- Indelicato DJ, Bradley JA, Rotondo RL, et al.: Outcomes following proton therapy for pediatric ependymoma. Acta Oncol 57 (5): 644-648, 2018. [PUBMED Abstract]
- Ritzmann TA, Chapman RJ, Kilday JP, et al.: SIOP Ependymoma I: Final results, long-term follow-up, and molecular analysis of the trial cohort-A BIOMECA Consortium Study. Neuro Oncol 24 (6): 936-948, 2022. [PUBMED Abstract]
- Zacharoulis S, Levy A, Chi SN, et al.: Outcome for young children newly diagnosed with ependymoma, treated with intensive induction chemotherapy followed by myeloablative chemotherapy and autologous stem cell rescue. Pediatr Blood Cancer 49 (1): 34-40, 2007. [PUBMED Abstract]
- Massimino M, Solero CL, Garrè ML, et al.: Second-look surgery for ependymoma: the Italian experience. J Neurosurg Pediatr 8 (3): 246-50, 2011. [PUBMED Abstract]
- Wahab SH, Simpson JR, Michalski JM, et al.: Long term outcome with post-operative radiation therapy for spinal canal ependymoma. J Neurooncol 83 (1): 85-9, 2007. [PUBMED Abstract]
- Garvin JH, Selch MT, Holmes E, et al.: Phase II study of pre-irradiation chemotherapy for childhood intracranial ependymoma. Children's Cancer Group protocol 9942: a report from the Children's Oncology Group. Pediatr Blood Cancer 59 (7): 1183-9, 2012. [PUBMED Abstract]
- Upadhyaya SA, Robinson GW, Onar-Thomas A, et al.: Molecular grouping and outcomes of young children with newly diagnosed ependymoma treated on the multi-institutional SJYC07 trial. Neuro Oncol 21 (10): 1319-1330, 2019. [PUBMED Abstract]
- Grill J, Kalifa C, Doz F, et al.: A high-dose busulfan-thiotepa combination followed by autologous bone marrow transplantation in childhood recurrent ependymoma. A phase-II study. Pediatr Neurosurg 25 (1): 7-12, 1996. [PUBMED Abstract]
- Venkatramani R, Ji L, Lasky J, et al.: Outcome of infants and young children with newly diagnosed ependymoma treated on the "Head Start" III prospective clinical trial. J Neurooncol 113 (2): 285-91, 2013. [PUBMED Abstract]
- Merchant TE, Boop FA, Kun LE, et al.: A retrospective study of surgery and reirradiation for recurrent ependymoma. Int J Radiat Oncol Biol Phys 71 (1): 87-97, 2008. [PUBMED Abstract]
- Bouffet E, Capra M, Bartels U: Salvage chemotherapy for metastatic and recurrent ependymoma of childhood. Childs Nerv Syst 25 (10): 1293-301, 2009. [PUBMED Abstract]
- Duffner PK, Horowitz ME, Krischer JP, et al.: The treatment of malignant brain tumors in infants and very young children: an update of the Pediatric Oncology Group experience. Neuro-oncol 1 (2): 152-61, 1999. [PUBMED Abstract]
- Duffner PK, Horowitz ME, Krischer JP, et al.: Postoperative chemotherapy and delayed radiation in children less than three years of age with malignant brain tumors. N Engl J Med 328 (24): 1725-31, 1993. [PUBMED Abstract]
- Geyer JR, Sposto R, Jennings M, et al.: Multiagent chemotherapy and deferred radiotherapy in infants with malignant brain tumors: a report from the Children's Cancer Group. J Clin Oncol 23 (30): 7621-31, 2005. [PUBMED Abstract]
- Grill J, Le Deley MC, Gambarelli D, et al.: Postoperative chemotherapy without irradiation for ependymoma in children under 5 years of age: a multicenter trial of the French Society of Pediatric Oncology. J Clin Oncol 19 (5): 1288-96, 2001. [PUBMED Abstract]
- Strother DR, Lafay-Cousin L, Boyett JM, et al.: Benefit from prolonged dose-intensive chemotherapy for infants with malignant brain tumors is restricted to patients with ependymoma: a report of the Pediatric Oncology Group randomized controlled trial 9233/34. Neuro Oncol 16 (3): 457-65, 2014. [PUBMED Abstract]
- Grundy RG, Wilne SA, Weston CL, et al.: Primary postoperative chemotherapy without radiotherapy for intracranial ependymoma in children: the UKCCSG/SIOP prospective study. Lancet Oncol 8 (8): 696-705, 2007. [PUBMED Abstract]
- Snider CA, Yang K, Mack SC, et al.: Impact of radiation therapy and extent of resection for ependymoma in young children: A population-based study. Pediatr Blood Cancer 65 (3): , 2018. [PUBMED Abstract]
- Zapotocky M, Beera K, Adamski J, et al.: Survival and functional outcomes of molecularly defined childhood posterior fossa ependymoma: Cure at a cost. Cancer 125 (11): 1867-1876, 2019. [PUBMED Abstract]
- von Hoff K, Kieffer V, Habrand JL, et al.: Impairment of intellectual functions after surgery and posterior fossa irradiation in children with ependymoma is related to age and neurologic complications. BMC Cancer 8: 15, 2008. [PUBMED Abstract]
- MacDonald SM, Safai S, Trofimov A, et al.: Proton radiotherapy for childhood ependymoma: initial clinical outcomes and dose comparisons. Int J Radiat Oncol Biol Phys 71 (4): 979-86, 2008. [PUBMED Abstract]
- Merchant TE, Lee H, Zhu J, et al.: The effects of hydrocephalus on intelligence quotient in children with localized infratentorial ependymoma before and after focal radiation therapy. J Neurosurg 101 (2 Suppl): 159-68, 2004. [PUBMED Abstract]
Tratamiento del ependimoma infantil recidivante
La recidiva de ependimomas de todos los grados es frecuente y es posible que se presente muchos años después del tratamiento inicial.[1,2] Se notificaron recidivas tardías después de 10 a 15 años.[3] Por lo general, la enfermedad recidiva en el sitio del tumor primario, aunque a veces también se observa diseminación simultánea en el sistema nervioso central. La recaída sistémica es muy infrecuente.
En el momento de la recaída, se indica una evaluación completa de la extensión de la recidiva para todos los pacientes.
Las opciones de tratamiento del ependimoma infantil recidivante son las siguientes:
Cirugía
La utilidad de una intervención quirúrgica adicional se individualiza a partir de la extensión y ubicación del tumor. En un estudio de 53 pacientes con ependimoma recidivante se demostró una mejora de la tasa de supervivencia general (SG) a 5 años del 48,7 % en pacientes con resecciones macroscópicas totales o casi totales en el momento de la cirugía, en comparación con el 5,3 % en pacientes con resecciones no macroscópicas totales o casi totales.[4][Nivel de evidencia B4]
En algunos casos, las lesiones de acceso quirúrgico fácil se tratan de manera alternativa con radioterapia.
Radioterapia o quimioterapia
En los pacientes con ependimomas recidivantes se deben considerar las siguientes modalidades de tratamiento:[5][Nivel de evidencia C1]
- Nuevo tratamiento focal con varias modalidades de radiación, incluso radiocirugía estereotáctica,[6-8][Nivel de evidencia C1]; [9-11][Nivel de evidencia C2]; [12] terapia con fotones de intensidad modulada y terapia con protones.[13]; [14][Nivel de evidencia C1]
- Es posible considerar la irradiación craneoespinal tanto para la recidiva local como para la recidiva a distancia (de médula espinal).[15] En un estudio de 101 pacientes reirradiados que se llevó a cabo en el St. Jude Children's Research Hospital se observaron los siguientes resultados:[13][Nivel de evidencia C2]
- La mediana de duración de SG fue de 75,1 meses y la mediana de supervivencia sin progresión fue de 27,3 meses.
- Las tasas de SG estimadas a 1, 2 y 5 años fueron del 95,5 %, 74,9 % y 57,3 %, respectivamente.
- Entre los 46 pacientes que recibieron reirradiación focal por fracaso local, 13 tuvieron fracasos locales y 11 fracasos solo a distancia.
- Entre los 10 pacientes que recibieron irradiación craneoespinal por fracaso local, 6 tuvieron fracasos locales y ninguno tuvo fracaso solo a distancia.
- Los pacientes con fracaso solo a distancia que recibieron tratamiento con irradiación craneoespinal tuvieron una mejor SG, en comparación con las personas con fracaso local tratadas con radioterapia focal (cociente de riesgos instantáneos [CRI], 0,37; intervalo de confianza [IC] 95 %, 0,16–0,87).
- La incidencia acumulada a 10 años de necrosis por radiación superior al grado 3 tras la repetición de la radioterapia fue del 7,9 %.
- La ganancia del cromosoma 1q se relacionó con una SG más precaria (CRI, 3,5; IC 95 %, 1,1–10,6) en pacientes con recidiva a distancia (pero no local) tras la radioterapia inicial. Otras variables relacionadas con una menor SG y ausencia de progresión fueron el sexo masculino, el tipo histológico anaplásico en el momento de la recidiva y un intervalo corto entre la radioterapia inicial y la recidiva.
- En un estudio de 31 niños con recidiva local de los ependimomas, los pacientes recibieron radiación local (conformada) en el momento de la recidiva. Se administraron varios esquemas de fraccionamiento mediante dosis de radiación similares a las usadas en el diagnóstico inicial.[16]
- La mediana de supervivencia sin recidiva local fue de 31 meses (intervalo, 2–63 meses), y la mediana de SG fue de 34 meses (intervalo, 3–63 meses).
- Los pacientes que se sometieron primero a cirugía tuvieron tasas de supervivencia significativamente más altas que los pacientes que solo recibieron reirradiación.
- Por el contrario, en un estudio de 53 pacientes con ependimomas recidivantes tratados con radioterapia después de la cirugía no se observó ninguna ventaja con la adición de radioterapia después de una resección macroscópica total o casi total.[4][Nivel de evidencia B4]
- Hubo una mejora en la tasa de SG a 5 años (22 vs. 7 %) en los pacientes que recibieron tratamiento con radioterapia que tuvieron resecciones que no llegaron a ser macroscópicas totales o casi totales.
- La administración de 3, e incluso 4, ciclos de radioterapia para pacientes con recidivas puede prolongar la supervivencia con una toxicidad mínima aceptable.[13][Nivel de evidencia C2]
- En el contexto de la recidiva se han usado fármacos anticancerosos activos, como ciclofosfamida, cisplatino, carboplatino, lomustina o etopósido. Aunque en estudios anteriores de monoterapia se ha demostrado la respuesta a estos fármacos, esta rara vez es duradera.[17,18]
El pronóstico de los pacientes con recidiva es precario, con independencia de la estrategia terapéutica.[1] Se debe considerar la participación en estudios de abordajes terapéuticos nuevos.
Opciones de tratamiento en evaluación clínica para el ependimoma infantil recidivante
Tal vez haya ensayos clínicos terapéuticos de fase inicial para pacientes seleccionados. Es posible que estos ensayos estén disponibles a través del Children’s Oncology Group (COG), el Pediatric Brain Tumor Consortium u otras entidades. La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el portal de Internet del NCI. Para obtener información en inglés sobre ensayos clínicos patrocinados por otras organizaciones, consultar el portal de Internet ClinicalTrials.gov.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Zacharoulis S, Ashley S, Moreno L, et al.: Treatment and outcome of children with relapsed ependymoma: a multi-institutional retrospective analysis. Childs Nerv Syst 26 (7): 905-11, 2010. [PUBMED Abstract]
- Ritzmann TA, Rogers HA, Paine SML, et al.: A retrospective analysis of recurrent pediatric ependymoma reveals extremely poor survival and ineffectiveness of current treatments across central nervous system locations and molecular subgroups. Pediatr Blood Cancer 67 (9): e28426, 2020. [PUBMED Abstract]
- Wu J, Armstrong TS, Gilbert MR: Biology and management of ependymomas. Neuro Oncol 18 (7): 902-13, 2016. [PUBMED Abstract]
- Adolph JE, Fleischhack G, Mikasch R, et al.: Local and systemic therapy of recurrent ependymoma in children and adolescents: short- and long-term results of the E-HIT-REZ 2005 study. Neuro Oncol 23 (6): 1012-1023, 2021. [PUBMED Abstract]
- Messahel B, Ashley S, Saran F, et al.: Relapsed intracranial ependymoma in children in the UK: patterns of relapse, survival and therapeutic outcome. Eur J Cancer 45 (10): 1815-23, 2009. [PUBMED Abstract]
- Kano H, Yang HC, Kondziolka D, et al.: Stereotactic radiosurgery for pediatric recurrent intracranial ependymomas. J Neurosurg Pediatr 6 (5): 417-23, 2010. [PUBMED Abstract]
- Bouffet E, Hawkins CE, Ballourah W, et al.: Survival benefit for pediatric patients with recurrent ependymoma treated with reirradiation. Int J Radiat Oncol Biol Phys 83 (5): 1541-8, 2012. [PUBMED Abstract]
- Desrousseaux J, Claude L, Chaltiel L, et al.: Respective Roles of Surgery, Chemotherapy, and Radiation Therapy for Recurrent Pediatric and Adolescent Ependymoma: A National Multicentric Study. Int J Radiat Oncol Biol Phys 117 (2): 404-415, 2023. [PUBMED Abstract]
- Merchant TE, Boop FA, Kun LE, et al.: A retrospective study of surgery and reirradiation for recurrent ependymoma. Int J Radiat Oncol Biol Phys 71 (1): 87-97, 2008. [PUBMED Abstract]
- Kano H, Niranjan A, Kondziolka D, et al.: Outcome predictors for intracranial ependymoma radiosurgery. Neurosurgery 64 (2): 279-87; discussion 287-8, 2009. [PUBMED Abstract]
- Lin YY, Wu HM, Yang HC, et al.: Repeated gamma knife radiosurgery enables longer tumor control in cases of highly-recurrent intracranial ependymoma. J Neurooncol 148 (2): 363-372, 2020. [PUBMED Abstract]
- Kano H, Su YH, Wu HM, et al.: Stereotactic Radiosurgery for Intracranial Ependymomas: An International Multicenter Study. Neurosurgery 84 (1): 227-234, 2019. [PUBMED Abstract]
- Tsang DS, Burghen E, Klimo P, et al.: Outcomes After Reirradiation for Recurrent Pediatric Intracranial Ependymoma. Int J Radiat Oncol Biol Phys 100 (2): 507-515, 2018. [PUBMED Abstract]
- Eaton BR, Chowdhry V, Weaver K, et al.: Use of proton therapy for re-irradiation in pediatric intracranial ependymoma. Radiother Oncol 116 (2): 301-8, 2015. [PUBMED Abstract]
- Tsang DS, Murray L, Ramaswamy V, et al.: Craniospinal irradiation as part of re-irradiation for children with recurrent intracranial ependymoma. Neuro Oncol 21 (4): 547-557, 2019. [PUBMED Abstract]
- Régnier E, Laprie A, Ducassou A, et al.: Re-irradiation of locally recurrent pediatric intracranial ependymoma: Experience of the French society of children's cancer. Radiother Oncol 132: 1-7, 2019. [PUBMED Abstract]
- Bouffet E, Capra M, Bartels U: Salvage chemotherapy for metastatic and recurrent ependymoma of childhood. Childs Nerv Syst 25 (10): 1293-301, 2009. [PUBMED Abstract]
- Jakacki RI, Foley MA, Horan J, et al.: Single-agent erlotinib versus oral etoposide in patients with recurrent or refractory pediatric ependymoma: a randomized open-label study. J Neurooncol 129 (1): 131-8, 2016. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (05/15/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El Consejo editorial del PDQ sobre el tratamiento pediátrico es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del ependimoma infantil. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento pediátrico, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del ependimoma infantil son:
- Kenneth J. Cohen, MD, MBA (Sidney Kimmel Comprehensive Cancer Center at Johns Hopkins Hospital)
- Louis S. Constine, MD (James P. Wilmot Cancer Center at University of Rochester Medical Center)
- Roger J. Packer, MD (Children's National Hospital)
- D. Williams Parsons, MD, PhD (Texas Children's Hospital)
- Malcolm A. Smith, MD, PhD (National Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento pediátrico emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento pediátrico. PDQ Tratamiento del ependimoma infantil. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/cerebro/pro/tratamiento-ependimoma-infantil-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.