Tratamiento del cáncer de cuello uterino (PDQ®)–Versión para profesionales de salud
Información general sobre el cáncer de cuello uterino
El cáncer de cuello uterino es el cuarto tipo de cáncer más frecuente en las mujeres de todo el mundo en términos de incidencia y mortalidad, con 661 021 casos nuevos y 348 189 defunciones en 2022.[1] La mayoría de los casos de cáncer de cuello uterino se pueden prevenir mediante el uso de exámenes de detección de rutina y el tratamiento de las lesiones precancerosas. Como consecuencia, la mayoría de los casos de cáncer de cuello uterino se diagnostican en mujeres que viven en regiones desprovistas de protocolos de detección adecuados.
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por cáncer de cuello uterino en los Estados Unidos para 2025:[2]
- Casos nuevos: 13 360.
- Defunciones: 4320.
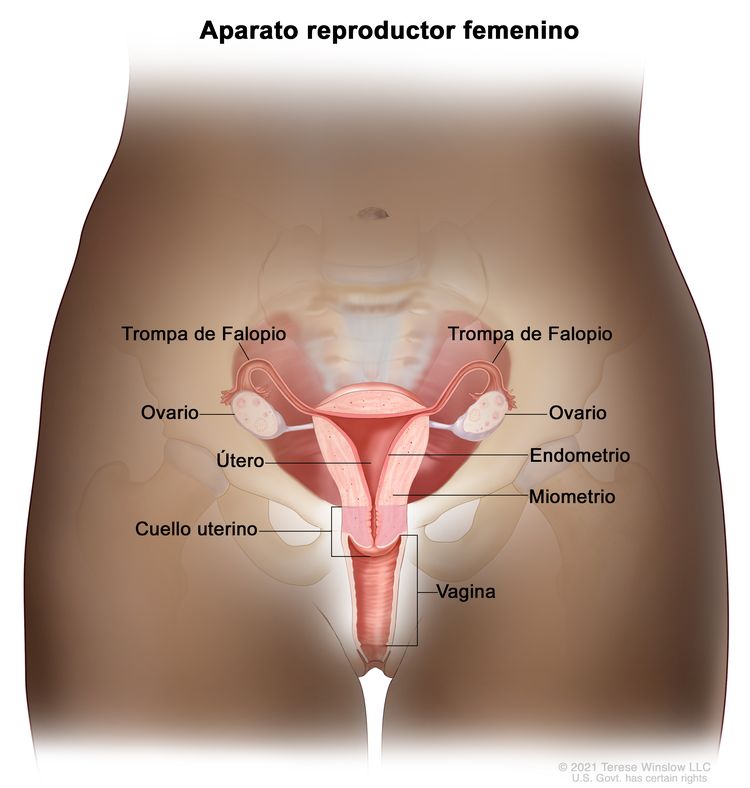
Características anatómicas
El cuello uterino es contiguo al cuerpo del útero y funciona como su apertura. Es un órgano cilíndrico y fibroso con una longitud promedio de 3 cm a 4 cm. La porción vaginal del cuello uterino (portio vaginalis cervicis) es visible en una inspección de la vagina. La abertura del cuello uterino se llama orificio externo. Este orificio externo se comunica con el conducto endocervical, que forma la parte interna del cuello uterino. La parte superior estrecha del conducto endocervical se llama orificio interno. Este estrechamiento señala la transición del cuello uterino al cuerpo del útero. El tramo del conducto endocervical que continúa después del orificio interno se llama conducto endometrial.
Hay 2 tipos de células epiteliales que revisten el cuello uterino: células escamosas en la parte más externa, y células cilíndricas glandulares en el conducto interno. La zona de transición entre las células escamosas y las células cilíndricas se llama unión escamocilíndrica. La mayoría de los cambios precancerosos y cancerosos surgen en esta zona.
Etiopatogenia
El carcinoma de cuello uterino comienza en la unión escamocolumnar (escamocilíndrica) y es posible que afecte las células escamosas externas, las células glandulares internas o ambas. La lesión precursora se llama displasia y se presentan 2 tipos: neoplasia intraepitelial cervical (NIC) o adenocarcinoma in situ, que posteriormente se puede convertir en un cáncer invasivo. Este proceso casi siempre es bastante lento. En algunos estudios longitudinales se observó que, en pacientes con cáncer de cuello uterino in situ no tratadas, entre el 30 % y el 70 % presentarán un carcinoma invasivo en un período de 10 a 12 años. Sin embargo, alrededor del 10 % de las pacientes presentarán progresión de las lesiones in situ a lesiones invasivas en menos de 1 año. Al volverse invasivo, el tumor atraviesa la membrana basal e invade el estroma del cuello uterino. La diseminación del tumor por el cuello uterino se manifiesta a la larga como una ulceración, un tumor exofítico o la infiltración extensa del tejido subyacente, incluso la vejiga o el recto.
Factores de riesgo
El envejecimiento es el factor de riesgo más importante para la mayoría de cánceres. El principal factor de riesgo del cáncer de cuello uterino es la infección por el virus del papiloma humano (VPH).[3-6]
Los siguientes son otros factores de riesgo del cáncer de cuello uterino:
- Número elevado de partos e infección por el VPH.[7]
- Consumo de tabaco e infección por el VPH.[8]
- Consumo prolongado de anticonceptivos orales e infección por el VPH.[9,10]
- Inmunodepresión.[11,12]
- Edad temprana en el momento de la primera relación sexual.[13]
- Número elevado de parejas sexuales.[13]
- Exposición al dietilestilbestrol (DES) en el útero.[14]
Infección por el virus del papiloma humano
La infección por el virus del papiloma humano (VPH) es un paso necesario para la formación de casi todas las lesiones precancerosas y cancerosas. En algunos estudios epidemiológicos se demuestra de modo convincente que el principal factor de riesgo del carcinoma de cuello uterino preinvasivo o invasivo es la infección por el VPH, que sobrepasa por mucho otros factores de riesgo conocidos.
Se calcula que más de 6 millones de mujeres en los Estados Unidos tienen la infección por el VPH. La infección transitoria por el VPH es frecuente, en especial, en las mujeres jóvenes,[15] aunque el cáncer de cuello uterino es infrecuente. La persistencia de una infección por el VPH acarrea un riesgo más alto de lesiones precancerosas y cancerosas.[16,17]
La cepa del VPH que causa la infección también afecta el riesgo. Múltiples subtipos del VPH infectan a los seres humanos; los subtipos 16 y 18 son los que exhiben una relación más estrecha con la formación de una displasia de grado alto y cáncer. En los estudios se indica que una infección aguda por los tipos 16 y 18 del VPH hace que el riesgo de presentación rápida de una NIC de grado alto sea de 11 a 16,9 veces más alto.[18-20] En estudios posteriores, se observó que la infección por el VPH 16 o 18 predice mejor una NIC de grado alto o una enfermedad más grave que los exámenes citológicos, y que la capacidad predictiva se observa hasta 18 años después de la prueba inicial.[21-23]
Hay 2 vacunas disponibles en el mercado que se dirigen a cepas del VPH relacionadas con infecciones anogenitales. Las vacunas se destinan a adolescentes y adultos jóvenes que nunca tuvieron una infección por el VPH. Aunque la introducción de la vacuna en el mercado es moderada, se documentó una disminución significativa de las enfermedades relacionadas con el VPH.[24] Para obtener más información, consultar Prevención del cáncer de cuello uterino.
Características clínicas
Es posible que el cáncer de cuello uterino en estadio temprano no cause signos ni síntomas perceptibles.
Los posibles signos y síntomas de cáncer de cuello uterino son los siguientes:
- Hemorragia vaginal.
- Flujo vaginal inusual.
- Dolor pélvico.
- Dispareunia.
- Hemorragia poscoital.
Diagnóstico
Los siguientes procedimientos se utilizan para el diagnóstico del cáncer de cuello uterino:
- Antecedentes y examen físico.
- Examen pélvico.
- Estudio citológico del cuello uterino (frotis de Pap).
- Prueba del VPH.
- Legrado endocervical.
- Colposcopia.
- Biopsia.
Prueba del virus del papiloma humano
Desde su introducción, el estudio citológico del cuello uterino (frotis de Pap) ha sido el pilar para la detección del cáncer de cuello uterino. Sin embargo, las técnicas moleculares para la identificación del ADN del VPH son muy sensibles y específicas. Las opciones vigentes para los exámenes de detección son las siguientes:
- Estudio citológico solo.
- Estudio citológico y prueba del VPH.
La prueba del VPH se indica cuando es probable que el resultado permita clasificar a las pacientes en grupos de riesgo bajo y riesgo alto cuando se encuentra una displasia de grado alto o una lesión más grave.
Es poco probable que las pruebas del ADN del VPH permitan diferenciar a las pacientes con lesiones escamosas intraepiteliales de grado bajo que necesitan evaluación adicional de las que no la necesitan. En un estudio de 642 mujeres, se encontró que el 83 % tenía 1 o más tipos oncógenos del VPH cuando se analizaron las muestras citológicas del cuello uterino mediante una técnica sensible (captura híbrida).[25] Los autores del estudio y de un artículo editorial que lo acompaña concluyeron que el uso de la prueba del ADN del VPH en este entorno no añade suficiente información que justifique su costo.[25]
La prueba del ADN del VPH ha resultado útil para la selección de las pacientes con células escamosas atípicas de significado indeterminado que se deben someter a colposcopia, y se integró en las recomendaciones vigentes para los exámenes de detección.[25-27]
En otros ensayos se observó que las pacientes con un resultado citológico de riesgo bajo e infección por el VPH de riesgo alto (tipos 16, 18 y 31) son más propensas a presentar NIC o características histopatológicas de microinvasión en una biopsia.[18,28-30] Otro método demostró que la integración de los tipos 16 y 18 del VPH en el genoma, que conduce a la transcripción de mensajes víricos y celulares, quizás permita predecir cuáles pacientes tienen un riesgo más alto de displasia de grado alto y cáncer invasivo.[31]
En las mujeres mayores de 30 años que son más propensas a presentar una infección por el VPH crónica, la tipificación del VPH permite clasificar con éxito a las mujeres en grupos de riesgo alto o riesgo bajo para NIC 3 o una enfermedad más grave. En este grupo etario, las pruebas del ADN del VPH son más eficaces que el estudio citológico solo para predecir el riesgo de una NIC 3 o una enfermedad más grave.[32] En otros estudios se observó la eficacia de una estrategia con exámenes de detección del ADN del VPH y la clasificación mediante estudio citológico en comparación con los algoritmos de exámenes de detección citológica utilizados antes.[33,34]
Factores pronósticos
El pronóstico de las pacientes con cáncer de cuello uterino depende en gran medida del grado de diseminación de la enfermedad en el momento del diagnóstico. Más del 90 % de los casos de cáncer de cuello uterino se pueden detectar rápido mediante la prueba de Papanicolaou y la prueba del VPH.[35] Las pruebas de Pap y del VPH no se hacen en cerca del 33 % de las mujeres que cumplen con los requisitos para hacerlas, lo que conlleva una tasa de mortalidad más alta de la esperada.
Estadio clínico
El estadio clínico como factor pronóstico se complementa con varios hallazgos macroscópicos y microscópicos en las pacientes tratadas con cirugía.
Evidencia (estadio clínico y otros hallazgos):
En un estudio grande sobre estadificación quirúrgico-patológica de pacientes con enfermedad de estadio clínico IB dirigido por el Gynecologic Oncology Group (GOG) GOG-49, los factores que permitieron predecir mejor la formación de metástasis ganglionares y disminución de la supervivencia sin enfermedad fueron el compromiso tumoral del espacio linfocapilar, el aumento del tamaño tumoral y el aumento de la profundidad de invasión estromal (que fue el más importante y reproducible).[36,37]
En un estudio con 1028 pacientes sometidas a cirugía radical, las tasas de supervivencia se correlacionaron más con el volumen tumoral (determinado mediante una volumetría tumoral precisa) que con el estadio clínico o histológico.[38]
En un análisis multivariante del COG sobre variables pronósticas en 626 pacientes con enfermedad localmente avanzada (ante todo estadios II, III, y IV), se identificaron las siguientes variables de importancia para determinar el intervalo y la supervivencia sin progresión:[39]
- Estado de los ganglios linfáticos periaórticos y pélvicos.
- Tamaño del tumor.
- Edad de la paciente.
- Estado funcional.
- Enfermedad bilateral.
- Estadio clínico.
En el estudio se confirmó la máxima importancia de los ganglios periaórticos positivos y se indicó evaluar más a fondo estos ganglios en los casos de cáncer de cuello uterino localmente avanzado. El estado de los ganglios pélvicos fue importante solo cuando los ganglios periaórticos eran negativos. Esto también fue cierto en relación con el tamaño del tumor.
Se debate si el adenocarcinoma de cuello uterino conlleva un pronóstico significativamente más adverso que el carcinoma de células escamosas de cuello uterino.[40] En varios estudios retrospectivos poblacionales se observó un desenlace más precario en las pacientes de adenocarcinoma, en quienes se encontró un aumento de las metástasis a distancia en comparación con las pacientes con el tipo histológico de células escamosas.[41-44] Los informes son contradictorios en relación con el efecto que tiene el tipo de célula adenoescamosa en el desenlace.[45,46] En un informe se indicó que en cerca del 25 % de los tumores aparentemente escamosos se demuestra la producción de mucina, estos tumores exhiben un comportamiento más maligno que su contraparte escamosa, lo que indica que cualquier diferenciación adenomatosa tal vez confiere un pronóstico adverso.[47]
En una serie numerosa de pacientes con cáncer de cuello uterino tratadas con radioterapia, se observó que la incidencia de metástasis a distancia (con más frecuencia a los pulmones, la cavidad abdominal, el hígado y el tubo gastrointestinal) aumentó de manera paralela al estadio de la enfermedad, desde el 3 % en el estadio IA hasta el 75 % en el estadio IVA.[48] En un análisis multivariante sobre los factores que influyen en la incidencia de metástasis a distancia, se observó que el estadio, la diseminación endometrial del tumor y el control del tumor pélvico son indicadores significativos de diseminación a distancia.[48]
En los estudios del GOG se indicó que los factores pronósticos varían según se use la estadificación quirúrgica o clínica y de acuerdo con los distintos tratamientos. El retraso para finalizar la administración de la radiación se relaciona con una supervivencia sin progresión más precaria cuando se usa la estadificación clínica. El estadio, el grado tumoral, la raza y la edad son factores pronósticos inciertos en los estudios con quimiorradiación.[49]
Otros factores pronósticos
Otros factores pronósticos que quizás afecten el resultado son los siguientes:
- Estado de la infección por el virus de la inmunodeficiencia humana (VIH): las mujeres con infección por el VIH presentan una enfermedad más maligna y avanzada, así como un pronóstico más adverso.[50]
- Sobreexpresión de MYC: en un estudio con pacientes de carcinoma escamoso de cuello uterino invasivo, se encontró que la sobreexpresión del oncogén MYC se relacionó con un pronóstico más adverso.[51]
- Número de células en fase S: el número de células en fase S quizás también sea pronóstico para el carcinoma de cuello uterino en estadio temprano.[52]
- ADN del VPH 18: el ADN del VPH 18 es un factor molecular independiente que acarrea un pronóstico adverso. En 2 estudios se observaron peores resultados cuando se identificó el VPH 18 en pacientes con cáncer de cuello uterino sometidas a histerectomía radical y linfadenectomía pélvica.[53,54]
- Se observó que un polimorfismo en la enzima gamma glutamil hidrolasa, que se relaciona con el metabolismo del folato, disminuye la respuesta al cisplatino y, como resultado, empeora los resultados.[55]
Seguimiento después del tratamiento
No hay estudios de calidad alta y se desconoce el seguimiento óptimo después del tratamiento del cáncer de cuello uterino. En estudios retrospectivos, se observó que es más probable que las recidivas se presenten durante los primeros 2 años.[56] En consecuencia, la mayoría de las recomendaciones indican seguimiento de rutina cada 3 a 4 meses durante los primeros 2 años, seguido de evaluaciones cada 6 meses. La mayoría de las recidivas se diagnostican como consecuencia de la aparición de nuevos síntomas y signos en la paciente,[57,58] y no es clara la eficacia de las pruebas de rutina, como el frotis de Pap y la radiografía del tórax.
El seguimiento se debe concentrar en anamnesis y examen físico completos, con una revisión cuidadosa de los síntomas. La obtención de imágenes se debe reservar para la evaluación de un hallazgo positivo. Se debe interrogar a las pacientes sobre posibles signos de alarma, como los siguientes:
- Dolor abdominal.
- Dolor de espalda.
- Dolor o hinchazón en las piernas.
- Problemas durante la micción.
- Tos.
- Fatiga.
En el examen de seguimiento también se deben detectar las posibles complicaciones del tratamiento previo debido a las múltiples modalidades (cirugía, quimioterapia y radiación) que se utilizan en las pacientes.
Bibliografía
- Bray F, Laversanne M, Sung H, et al.: Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 74 (3): 229-263, 2024. [PUBMED Abstract]
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025. Available online. Last accessed January 16, 2025.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans: Human papillomaviruses. IARC Monogr Eval Carcinog Risks Hum 100 (Pt B), 255-296, 2012. Available online. Last accessed January 31, 2025.
- Schiffman M, Castle PE, Jeronimo J, et al.: Human papillomavirus and cervical cancer. Lancet 370 (9590): 890-907, 2007. [PUBMED Abstract]
- Trottier H, Franco EL: The epidemiology of genital human papillomavirus infection. Vaccine 24 (Suppl 1): S1-15, 2006. [PUBMED Abstract]
- Ault KA: Epidemiology and natural history of human papillomavirus infections in the female genital tract. Infect Dis Obstet Gynecol 2006 (Suppl): 40470, 2006. [PUBMED Abstract]
- Muñoz N, Franceschi S, Bosetti C, et al.: Role of parity and human papillomavirus in cervical cancer: the IARC multicentric case-control study. Lancet 359 (9312): 1093-101, 2002. [PUBMED Abstract]
- Plummer M, Herrero R, Franceschi S, et al.: Smoking and cervical cancer: pooled analysis of the IARC multi-centric case--control study. Cancer Causes Control 14 (9): 805-14, 2003. [PUBMED Abstract]
- Moreno V, Bosch FX, Muñoz N, et al.: Effect of oral contraceptives on risk of cervical cancer in women with human papillomavirus infection: the IARC multicentric case-control study. Lancet 359 (9312): 1085-92, 2002. [PUBMED Abstract]
- Appleby P, Beral V, Berrington de González A, et al.: Cervical cancer and hormonal contraceptives: collaborative reanalysis of individual data for 16,573 women with cervical cancer and 35,509 women without cervical cancer from 24 epidemiological studies. Lancet 370 (9599): 1609-21, 2007. [PUBMED Abstract]
- Abraham AG, D'Souza G, Jing Y, et al.: Invasive cervical cancer risk among HIV-infected women: a North American multicohort collaboration prospective study. J Acquir Immune Defic Syndr 62 (4): 405-13, 2013. [PUBMED Abstract]
- Grulich AE, van Leeuwen MT, Falster MO, et al.: Incidence of cancers in people with HIV/AIDS compared with immunosuppressed transplant recipients: a meta-analysis. Lancet 370 (9581): 59-67, 2007. [PUBMED Abstract]
- International Collaboration of Epidemiological Studies of Cervical Cancer: Cervical carcinoma and reproductive factors: collaborative reanalysis of individual data on 16,563 women with cervical carcinoma and 33,542 women without cervical carcinoma from 25 epidemiological studies. Int J Cancer 119 (5): 1108-24, 2006. [PUBMED Abstract]
- Hoover RN, Hyer M, Pfeiffer RM, et al.: Adverse health outcomes in women exposed in utero to diethylstilbestrol. N Engl J Med 365 (14): 1304-14, 2011. [PUBMED Abstract]
- Dunne EF, Unger ER, Sternberg M, et al.: Prevalence of HPV infection among females in the United States. JAMA 297 (8): 813-9, 2007. [PUBMED Abstract]
- Rodríguez AC, Schiffman M, Herrero R, et al.: Rapid clearance of human papillomavirus and implications for clinical focus on persistent infections. J Natl Cancer Inst 100 (7): 513-7, 2008. [PUBMED Abstract]
- Jaisamrarn U, Castellsagué X, Garland SM, et al.: Natural history of progression of HPV infection to cervical lesion or clearance: analysis of the control arm of the large, randomised PATRICIA study. PLoS One 8 (11): e79260, 2013. [PUBMED Abstract]
- Brisson J, Morin C, Fortier M, et al.: Risk factors for cervical intraepithelial neoplasia: differences between low- and high-grade lesions. Am J Epidemiol 140 (8): 700-10, 1994. [PUBMED Abstract]
- Koutsky LA, Holmes KK, Critchlow CW, et al.: A cohort study of the risk of cervical intraepithelial neoplasia grade 2 or 3 in relation to papillomavirus infection. N Engl J Med 327 (18): 1272-8, 1992. [PUBMED Abstract]
- Schiffman MH, Bauer HM, Hoover RN, et al.: Epidemiologic evidence showing that human papillomavirus infection causes most cervical intraepithelial neoplasia. J Natl Cancer Inst 85 (12): 958-64, 1993. [PUBMED Abstract]
- Castle PE, Glass AG, Rush BB, et al.: Clinical human papillomavirus detection forecasts cervical cancer risk in women over 18 years of follow-up. J Clin Oncol 30 (25): 3044-50, 2012. [PUBMED Abstract]
- Khan MJ, Castle PE, Lorincz AT, et al.: The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice. J Natl Cancer Inst 97 (14): 1072-9, 2005. [PUBMED Abstract]
- Schlecht NF, Kulaga S, Robitaille J, et al.: Persistent human papillomavirus infection as a predictor of cervical intraepithelial neoplasia. JAMA 286 (24): 3106-14, 2001. [PUBMED Abstract]
- Muñoz N, Kjaer SK, Sigurdsson K, et al.: Impact of human papillomavirus (HPV)-6/11/16/18 vaccine on all HPV-associated genital diseases in young women. J Natl Cancer Inst 102 (5): 325-39, 2010. [PUBMED Abstract]
- Human papillomavirus testing for triage of women with cytologic evidence of low-grade squamous intraepithelial lesions: baseline data from a randomized trial. The Atypical Squamous Cells of Undetermined Significance/Low-Grade Squamous Intraepithelial Lesions Triage Study (ALTS) Group. J Natl Cancer Inst 92 (5): 397-402, 2000. [PUBMED Abstract]
- Wright TC, Massad LS, Dunton CJ, et al.: 2006 consensus guidelines for the management of women with abnormal cervical cancer screening tests. Am J Obstet Gynecol 197 (4): 346-55, 2007. [PUBMED Abstract]
- Wright TC, Massad LS, Dunton CJ, et al.: 2006 consensus guidelines for the management of women with cervical intraepithelial neoplasia or adenocarcinoma in situ. Am J Obstet Gynecol 197 (4): 340-5, 2007. [PUBMED Abstract]
- Tabbara S, Saleh AD, Andersen WA, et al.: The Bethesda classification for squamous intraepithelial lesions: histologic, cytologic, and viral correlates. Obstet Gynecol 79 (3): 338-46, 1992. [PUBMED Abstract]
- Cuzick J, Terry G, Ho L, et al.: Human papillomavirus type 16 in cervical smears as predictor of high-grade cervical intraepithelial neoplasia [corrected] Lancet 339 (8799): 959-60, 1992. [PUBMED Abstract]
- Richart RM, Wright TC: Controversies in the management of low-grade cervical intraepithelial neoplasia. Cancer 71 (4 Suppl): 1413-21, 1993. [PUBMED Abstract]
- Klaes R, Woerner SM, Ridder R, et al.: Detection of high-risk cervical intraepithelial neoplasia and cervical cancer by amplification of transcripts derived from integrated papillomavirus oncogenes. Cancer Res 59 (24): 6132-6, 1999. [PUBMED Abstract]
- Katki HA, Kinney WK, Fetterman B, et al.: Cervical cancer risk for women undergoing concurrent testing for human papillomavirus and cervical cytology: a population-based study in routine clinical practice. Lancet Oncol 12 (7): 663-72, 2011. [PUBMED Abstract]
- Naucler P, Ryd W, Törnberg S, et al.: Efficacy of HPV DNA testing with cytology triage and/or repeat HPV DNA testing in primary cervical cancer screening. J Natl Cancer Inst 101 (2): 88-99, 2009. [PUBMED Abstract]
- Castle PE, Stoler MH, Wright TC, et al.: Performance of carcinogenic human papillomavirus (HPV) testing and HPV16 or HPV18 genotyping for cervical cancer screening of women aged 25 years and older: a subanalysis of the ATHENA study. Lancet Oncol 12 (9): 880-90, 2011. [PUBMED Abstract]
- The 1988 Bethesda System for reporting cervical/vaginal cytological diagnoses. National Cancer Institute Workshop. JAMA 262 (7): 931-4, 1989. [PUBMED Abstract]
- Delgado G, Bundy B, Zaino R, et al.: Prospective surgical-pathological study of disease-free interval in patients with stage IB squamous cell carcinoma of the cervix: a Gynecologic Oncology Group study. Gynecol Oncol 38 (3): 352-7, 1990. [PUBMED Abstract]
- Zaino RJ, Ward S, Delgado G, et al.: Histopathologic predictors of the behavior of surgically treated stage IB squamous cell carcinoma of the cervix. A Gynecologic Oncology Group study. Cancer 69 (7): 1750-8, 1992. [PUBMED Abstract]
- Burghardt E, Baltzer J, Tulusan AH, et al.: Results of surgical treatment of 1028 cervical cancers studied with volumetry. Cancer 70 (3): 648-55, 1992. [PUBMED Abstract]
- Stehman FB, Bundy BN, DiSaia PJ, et al.: Carcinoma of the cervix treated with radiation therapy. I. A multi-variate analysis of prognostic variables in the Gynecologic Oncology Group. Cancer 67 (11): 2776-85, 1991. [PUBMED Abstract]
- Steren A, Nguyen HN, Averette HE, et al.: Radical hysterectomy for stage IB adenocarcinoma of the cervix: the University of Miami experience. Gynecol Oncol 48 (3): 355-9, 1993. [PUBMED Abstract]
- Park JY, Kim DY, Kim JH, et al.: Outcomes after radical hysterectomy in patients with early-stage adenocarcinoma of uterine cervix. Br J Cancer 102 (12): 1692-8, 2010. [PUBMED Abstract]
- Eifel PJ, Burke TW, Morris M, et al.: Adenocarcinoma as an independent risk factor for disease recurrence in patients with stage IB cervical carcinoma. Gynecol Oncol 59 (1): 38-44, 1995. [PUBMED Abstract]
- Lee YY, Choi CH, Kim TJ, et al.: A comparison of pure adenocarcinoma and squamous cell carcinoma of the cervix after radical hysterectomy in stage IB-IIA. Gynecol Oncol 120 (3): 439-43, 2011. [PUBMED Abstract]
- Galic V, Herzog TJ, Lewin SN, et al.: Prognostic significance of adenocarcinoma histology in women with cervical cancer. Gynecol Oncol 125 (2): 287-91, 2012. [PUBMED Abstract]
- Gallup DG, Harper RH, Stock RJ: Poor prognosis in patients with adenosquamous cell carcinoma of the cervix. Obstet Gynecol 65 (3): 416-22, 1985. [PUBMED Abstract]
- Yazigi R, Sandstad J, Munoz AK, et al.: Adenosquamous carcinoma of the cervix: prognosis in stage IB. Obstet Gynecol 75 (6): 1012-5, 1990. [PUBMED Abstract]
- Bethwaite P, Yeong ML, Holloway L, et al.: The prognosis of adenosquamous carcinomas of the uterine cervix. Br J Obstet Gynaecol 99 (9): 745-50, 1992. [PUBMED Abstract]
- Fagundes H, Perez CA, Grigsby PW, et al.: Distant metastases after irradiation alone in carcinoma of the uterine cervix. Int J Radiat Oncol Biol Phys 24 (2): 197-204, 1992. [PUBMED Abstract]
- Monk BJ, Tian C, Rose PG, et al.: Which clinical/pathologic factors matter in the era of chemoradiation as treatment for locally advanced cervical carcinoma? Analysis of two Gynecologic Oncology Group (GOG) trials. Gynecol Oncol 105 (2): 427-33, 2007. [PUBMED Abstract]
- Maiman M, Fruchter RG, Guy L, et al.: Human immunodeficiency virus infection and invasive cervical carcinoma. Cancer 71 (2): 402-6, 1993. [PUBMED Abstract]
- Bourhis J, Le MG, Barrois M, et al.: Prognostic value of c-myc proto-oncogene overexpression in early invasive carcinoma of the cervix. J Clin Oncol 8 (11): 1789-96, 1990. [PUBMED Abstract]
- Strang P, Eklund G, Stendahl U, et al.: S-phase rate as a predictor of early recurrences in carcinoma of the uterine cervix. Anticancer Res 7 (4B): 807-10, 1987 Jul-Aug. [PUBMED Abstract]
- Burger RA, Monk BJ, Kurosaki T, et al.: Human papillomavirus type 18: association with poor prognosis in early stage cervical cancer. J Natl Cancer Inst 88 (19): 1361-8, 1996. [PUBMED Abstract]
- Lai CH, Chang CJ, Huang HJ, et al.: Role of human papillomavirus genotype in prognosis of early-stage cervical cancer undergoing primary surgery. J Clin Oncol 25 (24): 3628-34, 2007. [PUBMED Abstract]
- Silva IH, Nogueira-Silva C, Figueiredo T, et al.: The impact of GGH -401C>T polymorphism on cisplatin-based chemoradiotherapy response and survival in cervical cancer. Gene 512 (2): 247-50, 2013. [PUBMED Abstract]
- Ansink A, de Barros Lopes A, Naik R, et al.: Recurrent stage IB cervical carcinoma: evaluation of the effectiveness of routine follow up surveillance. Br J Obstet Gynaecol 103 (11): 1156-8, 1996. [PUBMED Abstract]
- Duyn A, Van Eijkeren M, Kenter G, et al.: Recurrent cervical cancer: detection and prognosis. Acta Obstet Gynecol Scand 81 (4): 351-5, 2002. [PUBMED Abstract]
- Morice P, Deyrolle C, Rey A, et al.: Value of routine follow-up procedures for patients with stage I/II cervical cancer treated with combined surgery-radiation therapy. Ann Oncol 15 (2): 218-23, 2004. [PUBMED Abstract]
Clasificación celular del cáncer de cuello uterino
El carcinoma de células escamosas (epidermoide) representa cerca del 90 % de los casos de cáncer de cuello uterino, y el adenocarcinoma representa el otro 10 %. Los carcinomas de células pequeñas y los carcinomas adenoescamosos son relativamente poco frecuentes. También se notificaron sarcomas primarios de cuello uterino y linfomas malignos de cuello uterino primarios y secundarios.
Información sobre los estadios del cáncer de cuello uterino
El carcinoma de cuello uterino se disemina por invasión local a los ganglios linfáticos regionales o por el torrente sanguíneo. La diseminación tumoral por lo general depende de la extensión y la invasión de la lesión local. Aunque el cáncer de cuello uterino suele progresar de manera ordenada, en ocasiones, se observa un tumor pequeño con metástasis a distancia. Por este motivo, las pacientes se deben evaluar minuciosamente para detectar enfermedad metastásica.
La estadificación quirúrgica es el método más exacto para determinar la extensión de la enfermedad,[1] pero hay poca evidencia científica que demuestre mejora de la supervivencia general con el uso de la estadificación quirúrgica de rutina; la estadificación se suele realizar solo como parte de un ensayo clínico. A veces está indicado el uso de una estadificación prequirúrgica para una enfermedad con gran masa tumoral, pero localmente curable, cuando no se encuentra enfermedad metastásica durante una búsqueda no quirúrgica. Si se detectan ganglios anormales en la tomografía computarizada (TC) o la linfangiografía, la aspiración con aguja fina debe ser negativa antes de que se lleve a cabo un procedimiento quirúrgico de estadificación.
Las pruebas y procedimientos para evaluar la extensión de la enfermedad son las siguientes:
Agrupamiento por estadios y definiciones de la Fédération Internationale de Gynécologie et d’Obstétrique
La Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) y el American Joint Committee on Cancer diseñaron un sistema de estadificación del cáncer de cuello uterino. El sistema FIGO es el que se usa con mayor frecuencia.[3,4]
| Estadio | Descripción | Imagen |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | ||
| aAdaptación de FIGO Committee for Gynecologic Oncology.[3] | ||
| bLas pruebas con imágenes y los estudios patológicos se pueden usar en todos los estadios cuando estén disponibles para complementar los hallazgos clínicos relacionados con el tamaño y extensión del tumor. Los hallazgos patológicos prevalecen sobre los hallazgos de las pruebas con imágenes y los estudios clínicos. | ||
| cEl compromiso de los espacios vasculares o linfáticos no deberá cambiar el estadio. La diseminación lateral de la lesión ya no se tiene en cuenta. | ||
| I | Carcinoma limitado solo al cuello uterino (la diseminación al cuerpo del útero no se deberá tener en cuenta). | |
| IA | Carcinoma invasivo que solo es posible diagnosticar mediante estudio microscópico, con una profundidad de invasión máxima ≤5 mm.b |
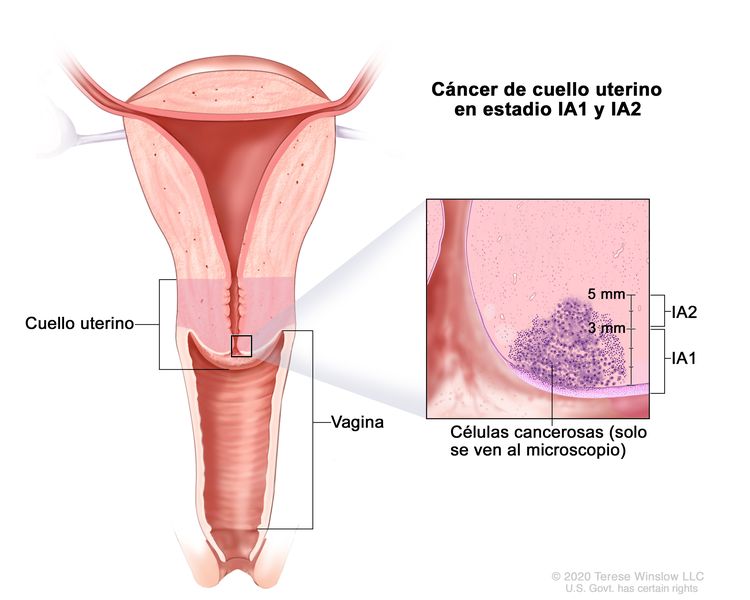 |
| –IA1 | –Profundidad de invasión estromal ≤3 mm. | |
| –IA2 | –Profundidad de invasión estromal >3 mm y ≤5 mm. | |
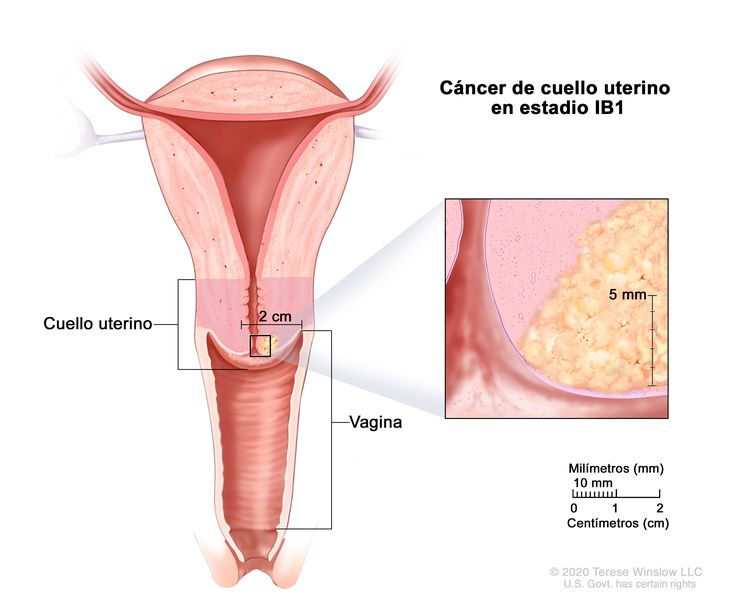
| IB | Carcinoma invasivo con profundidad de invasión máxima >5 mm (superior al estadio IA); lesión limitada al cuello uterino y el tamaño se mide según el diámetro tumoral máximo.c | |
| –IB1 | –Carcinoma invasivo con profundidad de invasión estromal >5 mm y ≤2 cm en su mayor dimensión. |
 |
| –IB2 | –Carcinoma invasivo >2 cm y ≤4 cm en su mayor dimensión. |
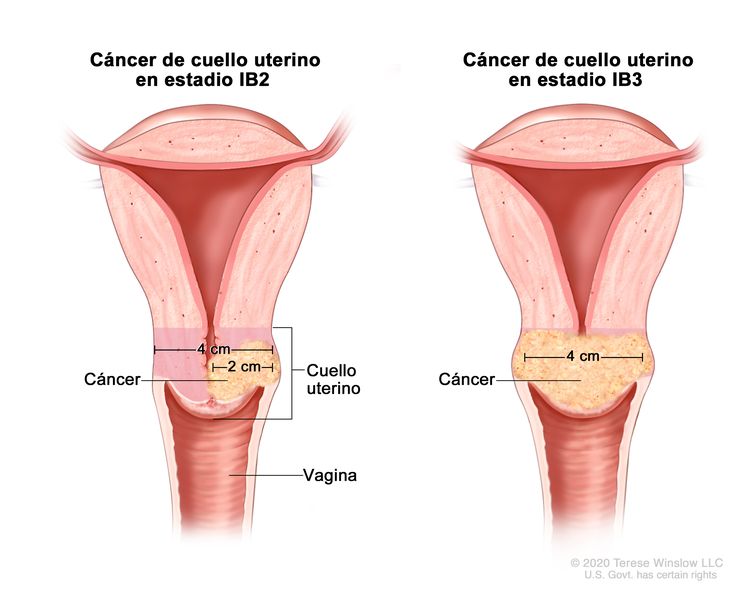 |
| –IB3 | –Carcinoma invasivo >4 cm en su mayor dimensión. | |
| Estadio | Descripción | Imagen |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | ||
| aAdaptación de FIGO Committee for Gynecologic Oncology.[3] | ||
| II | Carcinoma de cuello uterino con invasión fuera el útero, pero que no se extiende al tercio inferior de la vagina ni a la pared pélvica. |
 |
| IIA | Compromiso limitado a los dos tercios superiores de la vagina sin compromiso paramétrico. | |
| –IIA1 | –Carcinoma invasivo ≤4 cm en su mayor dimensión. | |
| –IIA2 | –Carcinoma invasivo >4 cm en su mayor dimensión. | |
| IIB | Con compromiso paramétrico pero que no se extiende a la pared pélvica. | |
| Estadio | Descripción | Imagen |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | ||
| aAdaptación de FIGO Committee for Gynecologic Oncology.[3] | ||
| bLa presencia de células tumorales aisladas no cambia el estadio pero se debe registrar su presencia. | ||
| cSe añade la notación de r (imágenes) y p (patológica) para describir los hallazgos que se usan para asignar el estadio IIIC. Por ejemplo, si la imagen indica metástasis ganglionar pélvica, se asigna el estadio IIIC1r; si se establece la confirmación por hallazgos patológicos, se asigna el estadio IIIC1p. Siempre se debe documentar el tipo de modalidad de imagen o de técnica patológica. Ante la duda, se debe asignar el estadio más bajo. | ||
| III | Carcinoma que infiltra el tercio inferior de la vagina, se diseminó a la pared pélvica, causa hidronefrosis, produce insuficiencia renal o infiltra los ganglios linfáticos pélvicos y paraórticos. | |
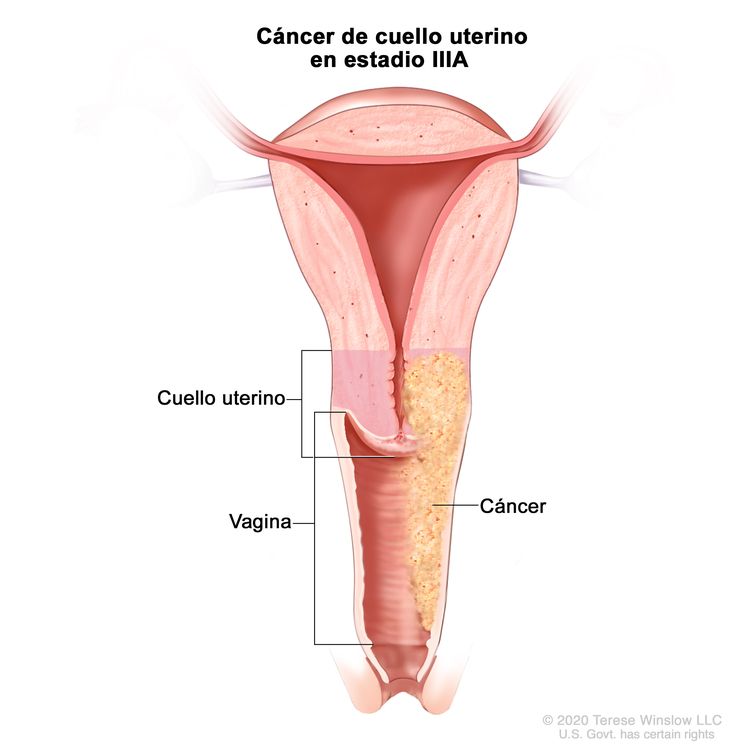
| IIIA | Carcinoma que infiltra el tercio inferior de la vagina sin diseminación a la pared pélvica. |
 |
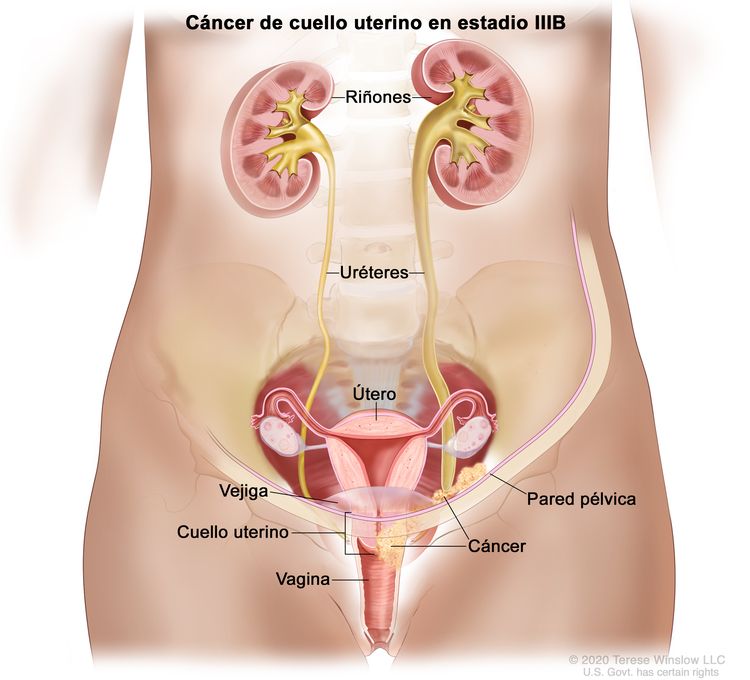
| IIIB | Diseminación a la pared pélvica, hidronefrosis o insuficiencia renal (salvo que se conozca otra causa). |
 |
| IIIC | Compromiso de los ganglios linfáticos pélvicos o paraórticos (incluso micrometástasis)b, independientemente del tamaño y la extensión del tumor (notaciones r y p).c |
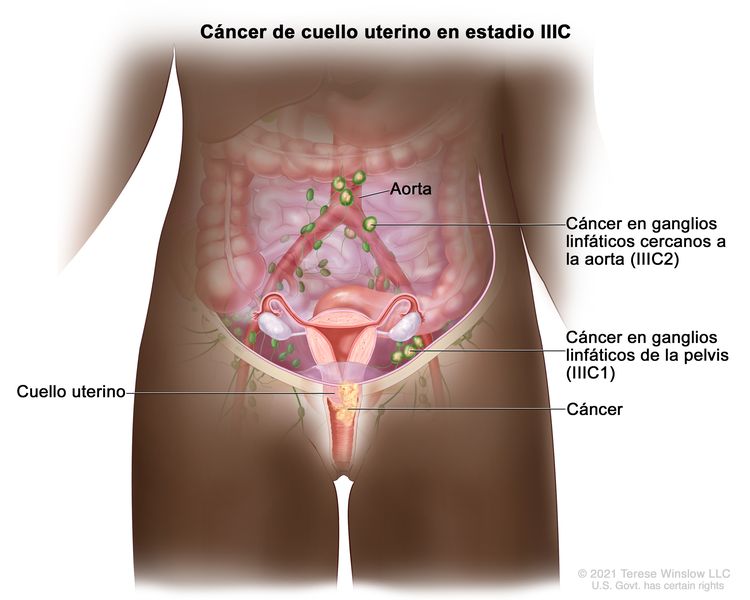 |
| –IIIC1 | –Metástasis solo en ganglio linfático pélvico. | |
| –IIIC2 | –Metástasis en ganglio linfático paraórtico. | |
| Estadio | Descripción | Imagen |
|---|---|---|
| FIGO = Fédération Internationale de Gynécologie et d’Obstétrique. | ||
| aAdaptación de FIGO Committee for Gynecologic Oncology.[3] | ||
| IV | El carcinoma se diseminó fuera de la pelvis menor o hay compromiso de la mucosa de la vejiga o el recto (verificado por biopsia). Un edema ampolloso por sí solo no es suficiente para asignar el estadio IV. | |
| IVA | Diseminación a órganos pélvicos adyacentes. |
 |
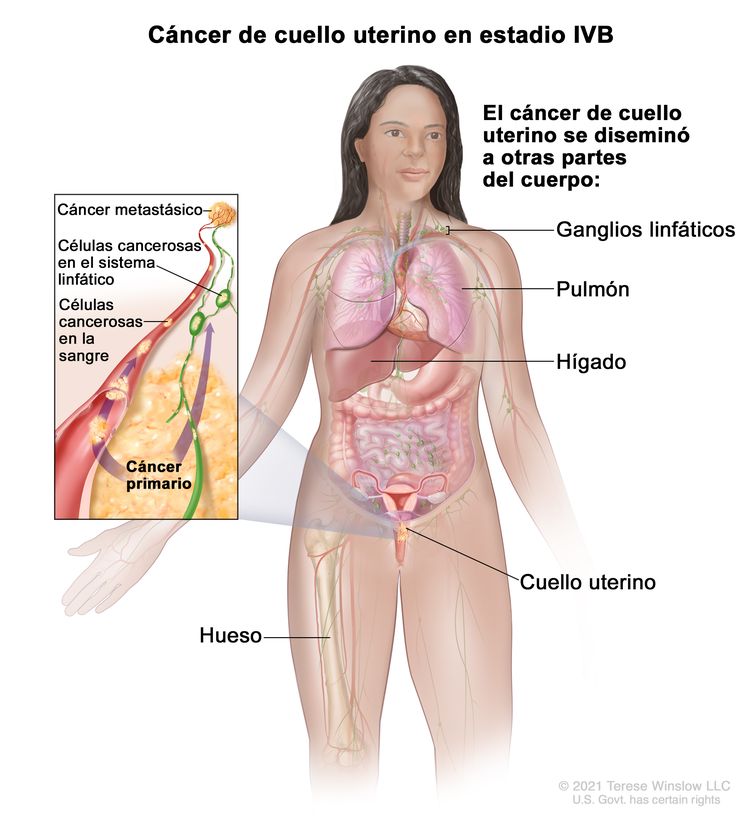
| IVB | Diseminación a órganos distantes |
 |
Bibliografía
- Gold MA, Tian C, Whitney CW, et al.: Surgical versus radiographic determination of para-aortic lymph node metastases before chemoradiation for locally advanced cervical carcinoma: a Gynecologic Oncology Group Study. Cancer 112 (9): 1954-63, 2008. [PUBMED Abstract]
- Epstein E, Testa A, Gaurilcikas A, et al.: Early-stage cervical cancer: tumor delineation by magnetic resonance imaging and ultrasound - a European multicenter trial. Gynecol Oncol 128 (3): 449-53, 2013. [PUBMED Abstract]
- Bhatla N, Aoki D, Sharma DN, et al.: Cancer of the cervix uteri: 2021 update. Int J Gynaecol Obstet 155 (Suppl 1): 28-44, 2021. [PUBMED Abstract]
- Olawaiye AB, Mutch DG, Bhosale P, et al.: Cervix uteri. In: Goodman KA, Gollub M, Eng C, et al.: AJCC Cancer Staging System. Version 9. American Joint Committee on Cancer; American College of Surgeons, 2020.
Aspectos generales de las opciones de tratamiento del cáncer de cuello uterino
En los estudios de modelos de atención, se demuestra claramente el efecto pronóstico adverso del aumento en el volumen tumoral y el modo de diseminación.[1] En consecuencia, el tratamiento varía dentro de cada estadio según las definiciones individuales vigentes de la Fédération Internationale de Gynécologie et d’Obstétrique (FIGO).
Quimiorradioterapia
En 5 ensayos aleatorizados de fase III se observó una ventaja general para la supervivencia del uso de terapia a base de cisplatino administrada de manera simultánea con radioterapia,[2-6] aunque en un ensayo en el que se evaluó este régimen no se demostró ningún beneficio.[7] La población de pacientes en estos estudios incluyó a mujeres con cáncer de cuello uterino en estadios FIGO IB2 a IVA, tratadas con radioterapia primaria y a mujeres con enfermedad en estadios FIGO I a IIA con factores de pronóstico adverso (enfermedad metastásica ganglionar pélvica, enfermedad paramétrica o compromiso de los márgenes quirúrgicos) en el momento de la cirugía primaria.
- A pesar de que los ensayos con resultados favorables varían en términos del estadio de la enfermedad, la dosis de radiación y los programas de cisplatino y radiación, en los ensayos se demostró una ventaja significativa para la supervivencia cuando se usó un abordaje de modalidad combinada. El riesgo de muerte por cáncer de cuello uterino disminuyó del 30 % al 50 % con el uso de quimiorradioterapia simultánea.
- A partir de estos resultados, se deberá considerar decididamente la incorporación de la administración simultánea de quimioterapia a base de cisplatino con radioterapia para las mujeres que necesitan radioterapia durante el tratamiento del cáncer de cuello uterino.[2-6]
Estos resultados se han validado en otros estudios.[8-10]
Administración de fluorouracilo
El gen DPYD codifica la enzima que cataboliza las pirimidinas y las fluoropirimidinas, como la capecitabina y el fluorouracilo. Se estima que entre el 1 % y el 2 % de la población tiene variantes defectuosas de DPYD que reducen la función de la proteína DPD y la acumulación de pirimidinas y fluoropirimidinas en el cuerpo.[11,12] Los pacientes con la variante DPYD*2A que reciben fluoropirimidinas quizás presenten efectos tóxicos graves que ponen en riesgo la salud, y a veces son mortales. Se han identificado muchas otras variantes de DPYD, con diferentes efectos clínicos.[11-13] Es posible que se recomiende evitar la fluoropirimidina o reducir la dosis al 50 % según el genotipo DPYD del paciente y el número de alelos funcionales de DPYD.[14-16] Las pruebas genéticas para DPYD cuestan menos de $200, pero la cobertura del seguro varía debido a la falta de directrices nacionales.[17] Además, es posible que las pruebas retrasen el tratamiento por 2 semanas, lo que no sería aconsejable en casos de urgencia. Este tema es objeto de controversia y requiere evaluación adicional.[18]
Cirugía y radioterapia
La cirugía y la radioterapia son igualmente eficaces para la enfermedad en estadio temprano de volumen pequeño.[19] Las pacientes más jóvenes a veces se benefician de la cirugía para conservar los ovarios y evitar la atrofia y estenosis vaginal.
El tratamiento de las pacientes con cáncer de muñón del cuello uterino es eficaz y produce resultados comparables con los observados en las pacientes con el útero intacto.[20]
Bibliografía
- Lanciano RM, Won M, Hanks GE: A reappraisal of the International Federation of Gynecology and Obstetrics staging system for cervical cancer. A study of patterns of care. Cancer 69 (2): 482-7, 1992. [PUBMED Abstract]
- Whitney CW, Sause W, Bundy BN, et al.: Randomized comparison of fluorouracil plus cisplatin versus hydroxyurea as an adjunct to radiation therapy in stage IIB-IVA carcinoma of the cervix with negative para-aortic lymph nodes: a Gynecologic Oncology Group and Southwest Oncology Group study. J Clin Oncol 17 (5): 1339-48, 1999. [PUBMED Abstract]
- Morris M, Eifel PJ, Lu J, et al.: Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high-risk cervical cancer. N Engl J Med 340 (15): 1137-43, 1999. [PUBMED Abstract]
- Rose PG, Bundy BN, Watkins EB, et al.: Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer. N Engl J Med 340 (15): 1144-53, 1999. [PUBMED Abstract]
- Keys HM, Bundy BN, Stehman FB, et al.: Cisplatin, radiation, and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma. N Engl J Med 340 (15): 1154-61, 1999. [PUBMED Abstract]
- Peters WA, Liu PY, Barrett RJ, et al.: Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix. J Clin Oncol 18 (8): 1606-13, 2000. [PUBMED Abstract]
- Pearcey R, Brundage M, Drouin P, et al.: Phase III trial comparing radical radiotherapy with and without cisplatin chemotherapy in patients with advanced squamous cell cancer of the cervix. J Clin Oncol 20 (4): 966-72, 2002. [PUBMED Abstract]
- Thomas GM: Improved treatment for cervical cancer--concurrent chemotherapy and radiotherapy. N Engl J Med 340 (15): 1198-200, 1999. [PUBMED Abstract]
- Rose PG, Bundy BN: Chemoradiation for locally advanced cervical cancer: does it help? J Clin Oncol 20 (4): 891-3, 2002. [PUBMED Abstract]
- Chemoradiotherapy for Cervical Cancer Meta-Analysis Collaboration: Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: a systematic review and meta-analysis of individual patient data from 18 randomized trials. J Clin Oncol 26 (35): 5802-12, 2008. [PUBMED Abstract]
- Sharma BB, Rai K, Blunt H, et al.: Pathogenic DPYD Variants and Treatment-Related Mortality in Patients Receiving Fluoropyrimidine Chemotherapy: A Systematic Review and Meta-Analysis. Oncologist 26 (12): 1008-1016, 2021. [PUBMED Abstract]
- Lam SW, Guchelaar HJ, Boven E: The role of pharmacogenetics in capecitabine efficacy and toxicity. Cancer Treat Rev 50: 9-22, 2016. [PUBMED Abstract]
- Shakeel F, Fang F, Kwon JW, et al.: Patients carrying DPYD variant alleles have increased risk of severe toxicity and related treatment modifications during fluoropyrimidine chemotherapy. Pharmacogenomics 22 (3): 145-155, 2021. [PUBMED Abstract]
- Amstutz U, Henricks LM, Offer SM, et al.: Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clin Pharmacol Ther 103 (2): 210-216, 2018. [PUBMED Abstract]
- Henricks LM, Lunenburg CATC, de Man FM, et al.: DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. Lancet Oncol 19 (11): 1459-1467, 2018. [PUBMED Abstract]
- Lau-Min KS, Varughese LA, Nelson MN, et al.: Preemptive pharmacogenetic testing to guide chemotherapy dosing in patients with gastrointestinal malignancies: a qualitative study of barriers to implementation. BMC Cancer 22 (1): 47, 2022. [PUBMED Abstract]
- Brooks GA, Tapp S, Daly AT, et al.: Cost-effectiveness of DPYD Genotyping Prior to Fluoropyrimidine-based Adjuvant Chemotherapy for Colon Cancer. Clin Colorectal Cancer 21 (3): e189-e195, 2022. [PUBMED Abstract]
- Baker SD, Bates SE, Brooks GA, et al.: DPYD Testing: Time to Put Patient Safety First. J Clin Oncol 41 (15): 2701-2705, 2023. [PUBMED Abstract]
- Eifel PJ, Burke TW, Delclos L, et al.: Early stage I adenocarcinoma of the uterine cervix: treatment results in patients with tumors less than or equal to 4 cm in diameter. Gynecol Oncol 41 (3): 199-205, 1991. [PUBMED Abstract]
- Kovalic JJ, Grigsby PW, Perez CA, et al.: Cervical stump carcinoma. Int J Radiat Oncol Biol Phys 20 (5): 933-8, 1991. [PUBMED Abstract]
Tratamiento del cáncer de cuello uterino in situ
Se han establecido recomendaciones por consenso para el tratamiento de las mujeres con neoplasia intraepitelial cervical o adenocarcinoma in situ.[1] Con el tratamiento adecuado, el control tumoral del carcinoma de cuello uterino in situ se debería acercar al 100 %. Se necesita una biopsia dirigida mediante colposcopia realizada por un experto o una biopsia en cono para excluir la enfermedad invasiva antes de iniciar el tratamiento. También es necesaria la correlación entre el estudio citológico y la biopsia dirigida mediante colposcopia antes de comenzar la terapia ablativa local. Es posible que una enfermedad invasiva no identificada tratada con terapia ablativa inadecuada sea la causa más frecuente de fracaso.[2]El fracaso en la identificación de la enfermedad, la falta de correlación entre el frotis de Pap y los hallazgos de la colposcopia, un adenocarcinoma in situ o la diseminación de la enfermedad al conducto endocervical hace que sea obligatoria la conización con láser, asa diatérmica o bisturí tradicional.
La elección del tratamiento depende de la extensión de la enfermedad y de varios factores relacionados con el paciente, como la edad, el tipo celular, el deseo de conservar la capacidad reproductiva y su estado de salud.
Opciones de tratamiento del cáncer de cuello uterino in situ
Las opciones de tratamiento del cáncer de cuello uterino in situ son las siguientes:
La histerectomía es el tratamiento estándar para pacientes con adenocarcinoma in situ. La enfermedad que se origina en el conducto endocervical a veces es más difícil de extirpar por completo mediante un procedimiento de conización. Se puede ofrecer la conización a pacientes con adenocarcinoma in situ seleccionadas que deseen conservar su capacidad reproductiva.
Conización
Cuando hay compromiso del conducto endocervical, es posible utilizar la conización con láser o bisturí tradicional en determinadas pacientes para conservar el útero y evitar la radioterapia o una cirugía más extensa.[6]
En casos seleccionados, el LEEP ambulatorio es una alternativa aceptable a la conización con bisturí tradicional. Este procedimiento solo exige anestesia local, lo que evita los riesgos relacionados con la anestesia general para la conización con bisturí tradicional.[7-9]Sin embargo, hay polémica sobre la conveniencia del LEEP como reemplazo de la conización, ya que es poco probable que el LEEP sea suficiente para pacientes de adenocarcinoma in situ.[10]
Evidencia (conización con LEEP):
- En un ensayo en el que se comparó el LEEP con la conización con bisturí tradicional, no se observó ninguna diferencia en la probabilidad de lograr una escisión completa de la displasia.[6]
- En 2 informes de casos, se indicó que el uso del LEEP en pacientes con cáncer invasivo oculto condujo a una incapacidad de determinar con exactitud la profundidad de invasión cuando se cortó transversalmente un foco de cáncer.[11]
Histerectomía para pacientes en edad posreproductiva
La histerectomía es el tratamiento estándar para las mujeres con adenocarcinoma de cuello uterino in situ porque la ubicación de la enfermedad en el conducto endocervical y la posibilidad de pasar por alto lesiones en esta región hacen que el estado del margen sea un factor pronóstico menos confiable. No obstante, no se estudió el efecto en la mortalidad de la histerectomía en comparación con abordajes quirúrgicos conservadores. Es posible que se haga una histerectomía para un carcinoma de células escamosas in situ si la conización no es posible debido a una cirugía anterior o si hay compromiso de los márgenes después de la conización. La histerectomía no es un tratamiento de primera línea admisible para un carcinoma de células escamosas in situ.[12]
Radioterapia interna para pacientes inoperables desde el punto de vista médico
En pacientes que tienen contraindicaciones médicas para la cirugía, a veces se utiliza una inserción intracavitaria simple con tándem y ovoides de 5000 mg horas (dosis de 80 Gy en la superficie vaginal).[13]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Wright TC, Massad LS, Dunton CJ, et al.: 2006 consensus guidelines for the management of women with cervical intraepithelial neoplasia or adenocarcinoma in situ. Am J Obstet Gynecol 197 (4): 340-5, 2007. [PUBMED Abstract]
- Shumsky AG, Stuart GC, Nation J: Carcinoma of the cervix following conservative management of cervical intraepithelial neoplasia. Gynecol Oncol 53 (1): 50-4, 1994. [PUBMED Abstract]
- Wright VC, Chapman W: Intraepithelial neoplasia of the lower female genital tract: etiology, investigation, and management. Semin Surg Oncol 8 (4): 180-90, 1992 Jul-Aug. [PUBMED Abstract]
- Bloss JD: The use of electrosurgical techniques in the management of premalignant diseases of the vulva, vagina, and cervix: an excisional rather than an ablative approach. Am J Obstet Gynecol 169 (5): 1081-5, 1993. [PUBMED Abstract]
- Tsukamoto N: Treatment of cervical intraepithelial neoplasia with the carbon dioxide laser. Gynecol Oncol 21 (3): 331-6, 1985. [PUBMED Abstract]
- Girardi F, Heydarfadai M, Koroschetz F, et al.: Cold-knife conization versus loop excision: histopathologic and clinical results of a randomized trial. Gynecol Oncol 55 (3 Pt 1): 368-70, 1994. [PUBMED Abstract]
- Wright TC, Gagnon S, Richart RM, et al.: Treatment of cervical intraepithelial neoplasia using the loop electrosurgical excision procedure. Obstet Gynecol 79 (2): 173-8, 1992. [PUBMED Abstract]
- Naumann RW, Bell MC, Alvarez RD, et al.: LLETZ is an acceptable alternative to diagnostic cold-knife conization. Gynecol Oncol 55 (2): 224-8, 1994. [PUBMED Abstract]
- Duesing N, Schwarz J, Choschzick M, et al.: Assessment of cervical intraepithelial neoplasia (CIN) with colposcopic biopsy and efficacy of loop electrosurgical excision procedure (LEEP). Arch Gynecol Obstet 286 (6): 1549-54, 2012. [PUBMED Abstract]
- Widrich T, Kennedy AW, Myers TM, et al.: Adenocarcinoma in situ of the uterine cervix: management and outcome. Gynecol Oncol 61 (3): 304-8, 1996. [PUBMED Abstract]
- Eddy GL, Spiegel GW, Creasman WT: Adverse effect of electrosurgical loop excision on assignment of FIGO stage in cervical cancer: report of two cases. Gynecol Oncol 55 (2): 313-7, 1994. [PUBMED Abstract]
- Massad LS: New guidelines on cervical cancer screening: more than just the end of annual Pap testing. J Low Genit Tract Dis 16 (3): 172-4, 2012. [PUBMED Abstract]
- Grigsby PW, Perez CA: Radiotherapy alone for medically inoperable carcinoma of the cervix: stage IA and carcinoma in situ. Int J Radiat Oncol Biol Phys 21 (2): 375-8, 1991. [PUBMED Abstract]
Tratamiento del cáncer de cuello uterino en estadio IA
Opciones de tratamiento del cáncer de cuello uterino en estadio IA1
Las opciones de tratamiento del cáncer de cuello uterino en estadio IA1 son las siguientes:
Conización
Si la profundidad de invasión es menor de 3 mm, no se observa invasión vascular o de conductos linfáticos y no hay compromiso de los márgenes del cono, es posible que la conización sola sea adecuada en las pacientes que desean conservar su capacidad reproductiva.[1]
Histerectomía total
Si la profundidad de invasión es menor de 3 mm (comprobada mediante márgenes limpios en la biopsia de cono),[2] no se observa invasión vascular o de conductos linfáticos y la frecuencia de compromiso ganglionar es suficientemente baja, no es necesaria la disección de ganglios linfáticos en el momento de la histerectomía. La ooforectomía es opcional y se debe posponer en las mujeres jóvenes.
Opciones de tratamiento del cáncer de cuello uterino en estadio IA2
Las opciones de tratamiento del cáncer de cuello uterino en estadio IA2 son las siguientes:
Histerectomía radical modificada con linfadenectomía
Para las pacientes con invasión tumoral de 3 a 5 mm, se recomienda la disección de ganglios pélvicos con histerectomía radical modificada porque se notificó un riesgo de metástasis de ganglios linfáticos de hasta un 10 %.[2] También se puede considerar la histerectomía radical con disección ganglionar para las pacientes con una profundidad de invasión tumoral incierta debido a tumor invasivo en los márgenes del cono.
Evidencia (cirugía abdominal abierta versus cirugía mínimamente invasiva [CMI]):
- En un ensayo aleatorizado multicéntrico internacional, el Laparoscopic Approach to Cervical Cancer (LACC [NCT00614211]) se exploró la eficacia de la histerectomía radical por cirugía abdominal abierta versus CMI para las pacientes con cáncer de cuello uterino en estadio temprano.[3] Las pacientes con enfermedad en estadios IA1 (con invasión del espacio linfovascular), IA2 y IB1, y con subtipos histológicos de carcinoma de células escamosas, adenocarcinoma o carcinoma adenoescamoso fueron aptas para la participación. El criterio principal de valoración fue la ausencia de inferioridad de la CMI en comparación con la cirugía abierta. El parámetro analizado fue el porcentaje de pacientes sin enfermedad 4,5 años después de la cirugía. Los criterios secundarios de valoración fueron comparaciones de las tasas de recidiva y supervivencia entre los 2 grupos.
Se planeó la inclusión de 740 pacientes, pero solo se inscribieron 632 hasta el momento de la interrupción prematura del estudio debido a un desequilibrio de las muertes entre los 2 grupos. De 631 pacientes aptas para participar, 319 se asignaron a CMI y 312 a cirugía abierta.
- La tasa de supervivencia sin enfermedad (SSE) a 4,5 años fue del 86 % en el grupo de CMI y del 96,5 % en el grupo de cirugía abierta (intervalo de confianza [IC], 95 %, -16,4 a -4,7). A los 3 años, el grupo de CMI tuvo una tasa de SSE del 91,2 % versus el 97,1 % para el grupo de cirugía abierta (cociente de riesgos instantáneos [CRI] de recidiva o muerte, 3,74; IC 95 %, 1,63–8,58).
- El grupo de CMI también tuvo una tasa de supervivencia general (SG) a 3 años más baja (93,8 vs. 99,0 % en el grupo de cirugía abierta; CRI de muerte por cualquier causa, 6,0; IC 95 %, 1,77–20,30).[3][Nivel de evidencia A1]
En el estudio se concluyó que la CMI fue inferior a la cirugía abdominal abierta, y que la CMI no debería reemplazar la cirugía abdominal abierta como el abordaje estándar para las pacientes con cáncer de cuello uterino.
- En un estudio epidemiológico se usaron 2 bases de datos numerosas de los Estados Unidos, la National Cancer Database (NCDB) y la Surveillance, Epidemiology, and End Results Database (SEER), y se confirmó una reducción de la SG en pacientes que de 2010 a 2013 se sometieron a una histerectomía radical mediante CMI para un cáncer de cuello uterino en estadio IA2 y estadio IB1. Además, entre las mujeres que se sometieron a histerectomía radical de 2000 a 2010, se presentó una disminución de la SG después de 2006, que coincide con la adopción generalizada de la CMI para el cáncer de cuello uterino.[4][Nivel de evidencia C1]
A pesar de que permanecen las dudas sobre el uso de la histerectomía radical mediante CMI para algunas subpoblaciones de pacientes con riesgo bajo, los datos de este ensayo indican que la cirugía abdominal abierta debería considerarse el tratamiento estándar para las pacientes con cáncer de cuello uterino en estadio temprano que son aptas para someterse a histerectomía radical.
Traquelectomía radical
Las pacientes con enfermedad en estadios IA2 a IB que quieran conservar la capacidad reproductiva quizás cumplan los requisitos para someterse a una traquelectomía radical. Durante este procedimiento, se extirpan el cuello uterino y los tejidos laterales del parametrio, y se conservan el cuerpo del útero y los ovarios. En la mayoría de los centros se usan los siguientes criterios de selección de las pacientes:
- Deseo de embarazo en el futuro.
- Edad menor de 40 años.
- Enfermedad en presunto estadio IA2 a IB1 y tamaño de la lesión inferior a 2 cm.
- Imágenes por resonancia magnética preoperatorias que muestran un margen desde el borde más distal del tumor hasta el segmento uterino inferior.
- Tipos de células escamosas, adenoescamosas o de adenocarcinoma.
En el entorno intraoperatorio, la evaluación de la paciente es similar a la que se hace para una histerectomía radical y se interrumpe el procedimiento si se encuentra una enfermedad más avanzada que lo previsto. En el momento de la cirugía también se evalúan los márgenes de la pieza quirúrgica y se lleva a cabo una histerectomía radical si no se obtienen márgenes adecuados.[5-9]
Radioterapia intracavitaria
La radioterapia intracavitaria es una opción cuando se considera un tratamiento paliativo en las mujeres que no son aptas para cirugía o que tienen otras contraindicaciones médicas.
Si la profundidad de invasión es menor de 3 mm, no se observa invasión del espacio capilar linfático, y la frecuencia de compromiso ganglionar es suficientemente baja, no se requiere radioterapia de haz externo. Se recomiendan 1 o 2 inserciones con tándem y ovoides de 6500 a 8000 mg horas (dosis de 100 a 125 Gy en la superficie vaginal).[10]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Sevin BU, Nadji M, Averette HE, et al.: Microinvasive carcinoma of the cervix. Cancer 70 (8): 2121-8, 1992. [PUBMED Abstract]
- Jones WB, Mercer GO, Lewis JL, et al.: Early invasive carcinoma of the cervix. Gynecol Oncol 51 (1): 26-32, 1993. [PUBMED Abstract]
- Ramirez PT, Frumovitz M, Pareja R, et al.: Minimally Invasive versus Abdominal Radical Hysterectomy for Cervical Cancer. N Engl J Med 379 (20): 1895-1904, 2018. [PUBMED Abstract]
- Melamed A, Margul DJ, Chen L, et al.: Survival after Minimally Invasive Radical Hysterectomy for Early-Stage Cervical Cancer. N Engl J Med 379 (20): 1905-1914, 2018. [PUBMED Abstract]
- Covens A, Shaw P, Murphy J, et al.: Is radical trachelectomy a safe alternative to radical hysterectomy for patients with stage IA-B carcinoma of the cervix? Cancer 86 (11): 2273-9, 1999. [PUBMED Abstract]
- Dargent D, Martin X, Sacchetoni A, et al.: Laparoscopic vaginal radical trachelectomy: a treatment to preserve the fertility of cervical carcinoma patients. Cancer 88 (8): 1877-82, 2000. [PUBMED Abstract]
- Plante M, Renaud MC, Hoskins IA, et al.: Vaginal radical trachelectomy: a valuable fertility-preserving option in the management of early-stage cervical cancer. A series of 50 pregnancies and review of the literature. Gynecol Oncol 98 (1): 3-10, 2005. [PUBMED Abstract]
- Shepherd JH, Spencer C, Herod J, et al.: Radical vaginal trachelectomy as a fertility-sparing procedure in women with early-stage cervical cancer-cumulative pregnancy rate in a series of 123 women. BJOG 113 (6): 719-24, 2006. [PUBMED Abstract]
- Wethington SL, Cibula D, Duska LR, et al.: An international series on abdominal radical trachelectomy: 101 patients and 28 pregnancies. Int J Gynecol Cancer 22 (7): 1251-7, 2012. [PUBMED Abstract]
- Grigsby PW, Perez CA: Radiotherapy alone for medically inoperable carcinoma of the cervix: stage IA and carcinoma in situ. Int J Radiat Oncol Biol Phys 21 (2): 375-8, 1991. [PUBMED Abstract]
Tratamiento del cáncer de cuello uterino en estadio IB y IIA
Opciones de tratamiento del cáncer de cuello uterino en estadios IB y IIA
Las opciones de tratamiento del cáncer de cuello uterino en estadio IB y estadio IIA son las siguientes:
- Radioterapia con quimioterapia simultánea.
- Histerectomía radical y linfadenectomía pélvica bilateral, con radioterapia pélvica total y quimioterapia o sin estas.
- Traquelectomía radical.
- Radioterapia sola.
- Inmunoterapia.
- Quimioterapia neoadyuvante (en evaluación clínica).
- Radioterapia de intensidad modulada (en evaluación clínica).
El tamaño del tumor es un factor pronóstico importante que se debe evaluar cuidadosamente al elegir el tratamiento óptimo.[1]
La radioterapia o la histerectomía radical con disección ganglionar bilateral producen tasas de curación del 85 % al 90 % en mujeres con enfermedad de volumen bajo en estadios IA2 y IB1 según la Fédération Internationale de Gynécologie et d’Obstétrique (FIGO). La elección del tratamiento depende de factores relacionados con la paciente y de la pericia local disponible. En un ensayo aleatorizado se notificaron tasas idénticas de supervivencia general a 5 años (SG) y supervivencia sin enfermedad (SSE) cuando se comparó la radioterapia con la histerectomía radical.[2]
En las pacientes con enfermedad en estadio IB2, con tumores que expanden el cuello uterino más de 4 cm, el tratamiento primario debe ser quimioterapia y radioterapia simultáneas.[3]
Radioterapia con quimioterapia simultánea
La quimioterapia a base de cisplatino con radioterapia simultánea es el estándar de atención para las mujeres que necesitan radioterapia para el cáncer de cuello uterino.[4-10] En los protocolos de radioterapia para pacientes con cáncer de cuello uterino, tradicionalmente se usa una dosificación en 2 puntos anatómicos (punto A y punto B) para estandarizar las dosis recibidas. El punto A se define como 2 cm desde el orificio externo del cuello uterino y 2 cm en dirección lateral al conducto endocervical. El punto B también se encuentra a 2 cm desde el orificio externo del cuello uterino y a 5 cm en dirección lateral desde la línea media en relación con la pelvis ósea. En general, para los tumores más pequeños, la dosis con intención curativa dirigida al punto A es de alrededor de 70 Gy, mientras que para los tumores más grandes, las dosis dirigida al punto A se acerca a 90 Gy.
Evidencia (radiación con quimioterapia simultánea):
- En 3 ensayos aleatorizados de fase III se observó una ventaja de SG para la terapia a base de cisplatino administrada de manera simultánea con radioterapia,[4-7] mientras que en otro ensayo en el que se examinó este régimen no se encontró beneficio.[8] Las poblaciones de pacientes en estos estudios incluyeron mujeres con cáncer de cuello uterino en estadios FIGO de IB2 a IVA tratadas con radioterapia primaria, y mujeres con enfermedad en estadios FIGO de I a IIA con factores pronósticos adversos, como enfermedad metastásica ganglionar pélvica, enfermedad paramétrica y compromiso de márgenes quirúrgicos, identificados en el momento de la cirugía primaria.
- Aunque los ensayos con resultados favorables varían en cierta medida según el estadio de la enfermedad, la dosis de radiación y el programa de cisplatino y radiación, en los ensayos se demuestra un beneficio de supervivencia significativo con el uso del abordaje combinado.
- El riesgo de muerte por cáncer de cuello uterino disminuyó del 30 % al 50 % con el uso de quimiorradioterapia simultánea.
- Estos resultados se confirmaron en otros ensayos.[9,10]
Braquiterapia
La radioterapia estándar para el cáncer de cuello uterino incluye braquiterapia después de la radioterapia de haz externo (RHE). Aunque la braquiterapia de dosis baja (LDR) por lo general con cesio Cs 137(137Cs) ha sido el abordaje tradicional, el uso de terapia de dosis altas (HDR), a menudo con iridio Ir 192, está en aumento rápido. La braquiterapia HDR tiene ventajas como la eliminación de la exposición del personal médico a la radiación, un tiempo de tratamiento más corto, conveniencia para la paciente y mejora de la atención ambulatoria. La American Brachytherapy Society publicó pautas para el uso de la braquiterapia LDR y HDR como componentes del tratamiento del cáncer de cuello uterino.[11,12]
Evidencia (braquiterapia):
- En 3 ensayos aleatorizados, la braquiterapia HDR fue comparable a la braquiterapia LDR en términos de control local regional y tasa de complicaciones.[13-15][Nivel de evidencia B1]
Es posible que se indique el uso de cirugía después de la radioterapia en algunas pacientes con tumores limitados al cuello uterino que tienen respuesta incompleta a la radioterapia o con características anatómicas vaginales que imposibilitan la administración óptima de la braquiterapia.[16]
Enfermedad ganglionar pélvica
Es posible que la resección de ganglios pélvicos con compromiso macroscópico mejore las tasas de control local cuando se usa radioterapia posoperatoria.[17] Las pacientes sometidas a muestreo ganglionar extraperitoneal presentaron menos complicaciones intestinales que las sometidas a muestreo ganglionar transperitoneal.[18-20] Las pacientes con márgenes vaginales estrechos (<0,5 cm) también se pueden beneficiar de la radioterapia pélvica.[21]
Histerectomía radical y linfadenectomía pélvica bilateral, con radioterapia pélvica total y quimioterapia o sin estas
Es posible considerar la histerectomía radical y la linfadenectomía pélvica bilateral en las mujeres con enfermedad en estadios IB a IIA.
Evidencia (histerectomía radical y linfadenectomía pélvica bilateral con radioterapia pélvica total y quimioterapia o sin estas):
- Un grupo italiano asignó al azar a 343 mujeres con cáncer de cuello uterino en estadios IB y IIA a someterse a cirugía o a recibir radioterapia. La radioterapia incluyó RHE y una inserción LDR de 137Cs, con una dosis total de 70 a 90 Gy dirigida al punto A (mediana 76 Gy). Las pacientes en el grupo de cirugía se sometieron a histerectomía radical de clase III, linfadenectomía pélvica y disección selectiva de los ganglios linfáticos paraórticos. Se administró radioterapia adyuvante a las pacientes que exhibieron características patológicas de riesgo alto en la pieza quirúrgica uterina o en los ganglios linfáticos comprometidos. La radioterapia adyuvante consistió en una dosis total de RHE de 50,4 Gy durante 5 a 6 semanas.[2][Nivel de evidencia A1]
- El criterio principal de valoración fue la SG a 5 años, con mediciones secundarias de la tasa de recidiva y complicaciones. Con una mediana de seguimiento de 87 meses, la tasa de SG fue del 83 % en ambos grupos (cociente de riesgos instantáneos [CRI], 1,2; intervalo de confianza [IC] 95 %, 0,7–2,3; P = 0,8).
- Las complicaciones fueron más altas en las pacientes que recibieron radioterapia adyuvante después de la cirugía.
- En general, se debe evitar la histerectomía radical en pacientes que probablemente necesiten terapia adyuvante.
Evidencia (cirugía abdominal abierta versus cirugía mínimamente invasiva [CMI]):
- En un ensayo aleatorizado multicéntrico internacional, el Laparoscopic Approach to Cervical Cancer (LACC [NCT00614211]), se exploró la eficacia de la histerectomía radical por cirugía abdominal abierta versus CMI para las pacientes con cáncer de cuello uterino en estadio temprano.[22] Las pacientes con enfermedad en estadios IA1 (con invasión del espacio linfovascular), IA2 y IB1, y con subtipos histológicos de carcinoma de células escamosas, adenocarcinoma o carcinoma adenoescamoso fueron aptas para la participación. El criterio principal de valoración fue la ausencia de inferioridad de la CMI en comparación con la cirugía abierta; el parámetro analizado fue el porcentaje de pacientes sin enfermedad 4,5 años después de la cirugía. Los criterios secundarios de valoración fueron comparaciones de las tasas de recidiva y supervivencia entre los 2 grupos.
Se planeó la inclusión de 740 pacientes, pero solo se inscribieron 632 hasta el momento de la interrupción prematura del estudio debido a un desequilibrio de las muertes entre los 2 grupos. De 631 pacientes aptas para participar, 319 se asignaron a CMI y 312 a cirugía abierta.
- La tasa de supervivencia sin enfermedad (SSE) a 4,5 años fue del 86 % en el grupo de CMI y del 96,5 % en el grupo de cirugía abierta (IC, 95 %, -16,4 a -4,7). A los 3 años, el grupo de CMI tuvo una tasa de SSE del 91,2 % versus el 97,1 % para el grupo de cirugía abierta (CRI de recidiva o muerte, 3,74; IC 95 %, 1,63–8,58).
- El grupo de CMI también tuvo una tasa de SG a 3 años más baja (93,8 vs. 99,0 % en el grupo de cirugía abierta; CRI de muerte por cualquier causa, 6,0; IC 95 %, 1,77–20,30).[22][Nivel de evidencia A1]
En el estudio, se concluyó que la CMI fue inferior a la cirugía abdominal abierta, y que la CMI no debería reemplazar la cirugía abdominal abierta como abordaje estándar para las pacientes con cáncer de cuello uterino.
- En un estudio epidemiológico, en el que se usaron 2 bases de datos numerosas de los Estados Unidos, la National Cancer Database (NCDB) y la Surveillance, Epidemiology, and End Results Database (SEER) Program, se confirmó una reducción de la SG en pacientes que de 2010 a 2013 se sometieron a una histerectomía radical mediante CMI para un cáncer de cuello uterino en estadio IA2 y estadio IB1. Además, entre las mujeres que se sometieron a histerectomía radical de 2000 a 2010, se presentó una disminución de la SG después de 2006, que coincide con la adopción generalizada de la CMI para el cáncer de cuello uterino.[23][Nivel de evidencia C1]
A pesar de que permanecen las dudas sobre el uso de la histerectomía radical mediante CMI para algunas subpoblaciones de pacientes con riesgo bajo, los datos de este ensayo indican que la cirugía abdominal abierta debería considerarse el tratamiento estándar para las pacientes con cáncer de cuello uterino en estadio temprano que son aptas para someterse a histerectomía radical.
Radioterapia adyuvante posquirúrgica
A partir de las tasas de recidiva en ensayos clínicos, se definieron 2 clases de riesgo de recidiva. Las pacientes con una combinación de tamaño tumoral grande, invasión del espacio linfático vascular e invasión estromal profunda en la pieza quirúrgica de la histerectomía tienen una enfermedad de riesgo intermedio. Estas pacientes son aptas para recibir RHE adyuvante.[24] Las pacientes que en el estudio patológico exhiben márgenes positivos, compromiso paramétrico o ganglionar tienen un riesgo alto de recidiva.
Evidencia (radioterapia adyuvante posquirúrgica):
- El Gynecologic Oncology Group (GOG) comparó la radioterapia adyuvante sola y la radioterapia con cisplatino y fluorouracilo (5-FU) después de una histerectomía radical en pacientes del grupo de riesgo alto. En el período posoperatorio, las pacientes eran aptas si en el estudio patológico exhibían una de las siguientes características: compromiso de parametrio, márgenes positivos o compromiso ganglionar. Las pacientes de ambos grupos recibieron 40 Gy dirigidos a la pelvis. Las pacientes en el grupo experimental también recibieron cisplatino (70 mg/m2) y una infusión de 5-FU durante 96 horas (1000 mg/m2/día cada 3 semanas durante 4 ciclos); los 2 primeros ciclos fueron simultáneos con la radioterapia.[6][Nivel de evidencia A1]
- Se evaluaron a 268 pacientes con un criterio principal de valoración de SG. Los resultados del estudio se notificaron temprano por los beneficios notificados en otros ensayos de cisplatino y radioterapia simultáneos.
- La tasa de supervivencia calculada a 4 años fue del 81 % para la quimioterapia con radioterapia y del 71 % para la radioterapia sola (CRI, 1,96; P = 0,007).
- Como era de esperar, los efectos tóxicos de grado 4 fueron más frecuentes en el grupo de quimioterapia y radioterapia, con predominio de toxicidad hematológica.
Se ha usado cirugía radical para lesiones pequeñas, pero la incidencia alta de factores patológicos que conducen a la radiación posoperatoria con quimioterapia o sin esta, hace que el abordaje más frecuente sea el uso de quimioterapia primaria y radiación simultánea en pacientes con tumores más grandes. Se debe considerar la radiación en dosis de 50 Gy durante 5 semanas acompañada de quimioterapia con cisplatino, y 5-FU o sin este en pacientes con riesgo alto de recidiva.
Enfermedad ganglionar paraórtica
Después de la estadificación quirúrgica, las pacientes que tienen enfermedad ganglionar paraórtica con un volumen pequeño y enfermedad pélvica controlable se pueden curar con radioterapia pélvica y paraórtica.[25] El tratamiento de las pacientes en las que no se extirparon los ganglios paraórticos mediante radioterapia de campo extendido y quimioterapia, conduce al control de la enfermedad a largo plazo cuando la enfermedad ganglionar por debajo de L3 es de volumen bajo (<2 cm).[18] En un estudio (RTOG-7920), se observó una ventaja de supervivencia en pacientes con tumores mayores de 4 cm que recibieron radioterapia dirigida a los ganglios paraórticos sin indicios histológicos de enfermedad.[26] Los efectos tóxicos de la radioterapia paraórtica fueron más altos que los de la radioterapia pélvica sola, pero se limitaron sobre todo a las pacientes sometidas antes a cirugía abdominopélvica.[26] La administración de radioterapia de intensidad modulada (RTIM) quizás reduzca al mínimo los efectos en el intestino delgado que suelen aparecer con este tratamiento.[27]
Traquelectomía radical
Las pacientes con presunta enfermedad en estadio temprano que deseen conservar la capacidad reproductiva quizás sean aptas para una traquelectomía radical. Durante este procedimiento, se extirpan el cuello uterino y los tejidos laterales del parametrio, y se conservan el cuerpo del útero y los ovarios. La selección de pacientes difiere un poco entre los grupos; sin embargo, los criterios generales son los siguientes:
- Deseo de embarazo en el futuro.
- Edad menor de 40 años.
- Enfermedad en presunto estadio IA2 a IB1 y tamaño de la lesión no mayor a 2 cm.
- Imágenes por resonancia magnética preoperatorias que muestran un margen desde el borde más distal del tumor hasta el segmento uterino inferior.
- Tipos de células escamosas, adenoescamosas o de adenocarcinoma.
En el entorno intraoperatorio, la evaluación de la paciente es similar a la que se hace para una histerectomía radical y se interrumpe el procedimiento si se encuentra una enfermedad más avanzada que lo previsto. En el momento de la cirugía también se evalúan los márgenes de la pieza quirúrgica y se lleva a cabo una histerectomía radical si no se obtienen márgenes adecuados.[28-32]
Radioterapia sola
La radioterapia de haz externo dirigida a la pelvis combinada con 2 o más aplicaciones de braquiterapia intracavitaria es un tratamiento adecuado en pacientes con lesiones en estadio IA2 y IB1. Para pacientes con lesiones en estadio IB2 y más grandes, se indica quimioterapia con radiosensibilizadores. No se ha probado la función de la quimioterapia con radiosensibilizadores en pacientes con lesiones en estadio IA2 y IB1. Sin embargo, es posible que sea beneficiosa en ciertos casos.
Inmunoterapia
Evidencia (inmunoterapia):
- El KEYNOTE-A18 (NCT04221945) fue un ensayo multicéntrico, de fase III, aleatorizado en el que se incluyeron 1060 mujeres con diagnóstico reciente de carcinoma de células escamosas, adenocarcinoma o carcinoma adenoescamoso de cuello uterino. Las pacientes tenían enfermedad en estadio IB2 o IIB con compromiso ganglionar o enfermedad en estadio III a IVA y no habían recibido tratamiento anterior. Las pacientes se asignaron al azar para recibir quimiorradioterapia (con cisplatino) y pembrolizumab (cada 3 semanas durante 5 ciclos) o quimiorradioterapia y placebo. Todas las pacientes recibieron terapia de mantenimiento con pembrolizumab o placebo cada 6 semanas durante 15 ciclos. Todas las pacientes recibieron braquiterapia, y el 94 % de las pacientes tenía enfermedad positiva para el ligando de muerte programada 1 (PD-L1). Los criterios de valoración primarios duales fueron la supervivencia sin progresión (SSP) y la SG. La mediana de seguimiento fue de 17,9 meses.[33]
- La tasa de SG a 24 meses fue del 87 % en el grupo de pembrolizumab y del 81% en el grupo de placebo (CRI, 0,73; IC 95 %, 0,49–1,07).[33][Nivel de evidencia B1]
- Hubo una mejora estadísticamente significativa en la SSP (CRI, 0,70; IC 95 %, 0,55–0,89). La tasa de SSP a 24 meses fue del 68 % en el grupo de pembrolizumab y del 57 % en el grupo de placebo.
- Las pacientes con enfermedad en estadio III o IV tuvieron una mejora superior de la SSP (CRI, 0,58; IC 95 %, 0,42–0,80).
Quimioterapia neoadyuvante
Varios grupos han investigado la función de la quimioterapia neoadyuvante para hacer que las pacientes que convencionalmente son aptas para quimiorradioterapia cumplan los requisitos para una cirugía radical.[34-38] Se han utilizado múltiples regímenes; sin embargo, en casi todos se usa el platino como fármaco principal. El ensayo aleatorizado más grande hasta ahora se notificó en 2001, el período de inclusión se completó antes de que el estándar de atención incluyera la adición de cisplatino a la radioterapia.[39] Como resultado, solo se administró radioterapia al grupo de control. Aunque hubo una mejora de la SG en el grupo experimental, los resultados no reflejan la práctica actual. En este estudio participaron pacientes con enfermedad en estadio IB a IVA, pero solo se observó mejoría en el grupo experimental de participantes con enfermedad en estadio temprano (estadios IB, IIA o IIB).
En el ensayo EORTC-55994 (NCT00039338), se asignó al azar a pacientes de cáncer de cuello uterino en estadios IB2, IIA2 y IIB a recibir quimiorradioterapia estándar o quimioterapia neoadyuvante (3 ciclos de cisplatino como fármaco principal), seguidas de evaluación para cirugía. Este ensayo tal vez defina si la quimioterapia neoadyuvante cumple una función para esta población de pacientes a partir de la SG como criterio principal de valoración.
Radioterapia de intensidad modulada
La radioterapia de intensidad modulada (RTIM) es una técnica radioterapéutica que permite una dosificación conformada al sitio anatómico objetivo sin afectar el tejido circundante. En teoría, esta técnica debe disminuir los efectos tóxicos relacionados con la radioterapia, pero esto podría ser a costa de disminuir la eficacia si se excluye tejido que debería incluirse en el campo de tratamiento. Varias instituciones informaron sobre su experiencia con la RTIM para el tratamiento adyuvante posoperatorio de pacientes con enfermedad de riesgo intermedio y alto después de la cirugía radical.[40-42] En el ensayo de fase II (RTOG-0418 [NCT00331760]) del Radiation Therapy Oncology Group (RTOG) se evaluó el uso de la RTIM en pacientes con cánceres de cuello uterino y de endometrio que necesitan radioterapia adyuvante.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Perez CA, Grigsby PW, Nene SM, et al.: Effect of tumor size on the prognosis of carcinoma of the uterine cervix treated with irradiation alone. Cancer 69 (11): 2796-806, 1992. [PUBMED Abstract]
- Landoni F, Maneo A, Colombo A, et al.: Randomised study of radical surgery versus radiotherapy for stage Ib-IIa cervical cancer. Lancet 350 (9077): 535-40, 1997. [PUBMED Abstract]
- Eifel PJ, Burke TW, Delclos L, et al.: Early stage I adenocarcinoma of the uterine cervix: treatment results in patients with tumors less than or equal to 4 cm in diameter. Gynecol Oncol 41 (3): 199-205, 1991. [PUBMED Abstract]
- Morris M, Eifel PJ, Lu J, et al.: Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high-risk cervical cancer. N Engl J Med 340 (15): 1137-43, 1999. [PUBMED Abstract]
- Keys HM, Bundy BN, Stehman FB, et al.: Cisplatin, radiation, and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma. N Engl J Med 340 (15): 1154-61, 1999. [PUBMED Abstract]
- Peters WA, Liu PY, Barrett RJ, et al.: Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix. J Clin Oncol 18 (8): 1606-13, 2000. [PUBMED Abstract]
- Thomas GM: Improved treatment for cervical cancer--concurrent chemotherapy and radiotherapy. N Engl J Med 340 (15): 1198-200, 1999. [PUBMED Abstract]
- Pearcey R, Brundage M, Drouin P, et al.: Phase III trial comparing radical radiotherapy with and without cisplatin chemotherapy in patients with advanced squamous cell cancer of the cervix. J Clin Oncol 20 (4): 966-72, 2002. [PUBMED Abstract]
- Rose PG, Bundy BN: Chemoradiation for locally advanced cervical cancer: does it help? J Clin Oncol 20 (4): 891-3, 2002. [PUBMED Abstract]
- Chemoradiotherapy for Cervical Cancer Meta-Analysis Collaboration: Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: a systematic review and meta-analysis of individual patient data from 18 randomized trials. J Clin Oncol 26 (35): 5802-12, 2008. [PUBMED Abstract]
- Nag S, Chao C, Erickson B, et al.: The American Brachytherapy Society recommendations for low-dose-rate brachytherapy for carcinoma of the cervix. Int J Radiat Oncol Biol Phys 52 (1): 33-48, 2002. [PUBMED Abstract]
- Nag S, Erickson B, Thomadsen B, et al.: The American Brachytherapy Society recommendations for high-dose-rate brachytherapy for carcinoma of the cervix. Int J Radiat Oncol Biol Phys 48 (1): 201-11, 2000. [PUBMED Abstract]
- Patel FD, Sharma SC, Negi PS, et al.: Low dose rate vs. high dose rate brachytherapy in the treatment of carcinoma of the uterine cervix: a clinical trial. Int J Radiat Oncol Biol Phys 28 (2): 335-41, 1994. [PUBMED Abstract]
- Hareyama M, Sakata K, Oouchi A, et al.: High-dose-rate versus low-dose-rate intracavitary therapy for carcinoma of the uterine cervix: a randomized trial. Cancer 94 (1): 117-24, 2002. [PUBMED Abstract]
- Lertsanguansinchai P, Lertbutsayanukul C, Shotelersuk K, et al.: Phase III randomized trial comparing LDR and HDR brachytherapy in treatment of cervical carcinoma. Int J Radiat Oncol Biol Phys 59 (5): 1424-31, 2004. [PUBMED Abstract]
- Thoms WW, Eifel PJ, Smith TL, et al.: Bulky endocervical carcinoma: a 23-year experience. Int J Radiat Oncol Biol Phys 23 (3): 491-9, 1992. [PUBMED Abstract]
- Downey GO, Potish RA, Adcock LL, et al.: Pretreatment surgical staging in cervical carcinoma: therapeutic efficacy of pelvic lymph node resection. Am J Obstet Gynecol 160 (5 Pt 1): 1055-61, 1989. [PUBMED Abstract]
- Vigliotti AP, Wen BC, Hussey DH, et al.: Extended field irradiation for carcinoma of the uterine cervix with positive periaortic nodes. Int J Radiat Oncol Biol Phys 23 (3): 501-9, 1992. [PUBMED Abstract]
- Weiser EB, Bundy BN, Hoskins WJ, et al.: Extraperitoneal versus transperitoneal selective paraaortic lymphadenectomy in the pretreatment surgical staging of advanced cervical carcinoma (a Gynecologic Oncology Group study). Gynecol Oncol 33 (3): 283-9, 1989. [PUBMED Abstract]
- Fine BA, Hempling RE, Piver MS, et al.: Severe radiation morbidity in carcinoma of the cervix: impact of pretherapy surgical staging and previous surgery. Int J Radiat Oncol Biol Phys 31 (4): 717-23, 1995. [PUBMED Abstract]
- Estape RE, Angioli R, Madrigal M, et al.: Close vaginal margins as a prognostic factor after radical hysterectomy. Gynecol Oncol 68 (3): 229-32, 1998. [PUBMED Abstract]
- Ramirez PT, Frumovitz M, Pareja R, et al.: Minimally Invasive versus Abdominal Radical Hysterectomy for Cervical Cancer. N Engl J Med 379 (20): 1895-1904, 2018. [PUBMED Abstract]
- Melamed A, Margul DJ, Chen L, et al.: Survival after Minimally Invasive Radical Hysterectomy for Early-Stage Cervical Cancer. N Engl J Med 379 (20): 1905-1914, 2018. [PUBMED Abstract]
- Sedlis A, Bundy BN, Rotman MZ, et al.: A randomized trial of pelvic radiation therapy versus no further therapy in selected patients with stage IB carcinoma of the cervix after radical hysterectomy and pelvic lymphadenectomy: A Gynecologic Oncology Group Study. Gynecol Oncol 73 (2): 177-83, 1999. [PUBMED Abstract]
- Cunningham MJ, Dunton CJ, Corn B, et al.: Extended-field radiation therapy in early-stage cervical carcinoma: survival and complications. Gynecol Oncol 43 (1): 51-4, 1991. [PUBMED Abstract]
- Rotman M, Pajak TF, Choi K, et al.: Prophylactic extended-field irradiation of para-aortic lymph nodes in stages IIB and bulky IB and IIA cervical carcinomas. Ten-year treatment results of RTOG 79-20. JAMA 274 (5): 387-93, 1995. [PUBMED Abstract]
- Poorvu PD, Sadow CA, Townamchai K, et al.: Duodenal and other gastrointestinal toxicity in cervical and endometrial cancer treated with extended-field intensity modulated radiation therapy to paraaortic lymph nodes. Int J Radiat Oncol Biol Phys 85 (5): 1262-8, 2013. [PUBMED Abstract]
- Covens A, Shaw P, Murphy J, et al.: Is radical trachelectomy a safe alternative to radical hysterectomy for patients with stage IA-B carcinoma of the cervix? Cancer 86 (11): 2273-9, 1999. [PUBMED Abstract]
- Dargent D, Martin X, Sacchetoni A, et al.: Laparoscopic vaginal radical trachelectomy: a treatment to preserve the fertility of cervical carcinoma patients. Cancer 88 (8): 1877-82, 2000. [PUBMED Abstract]
- Plante M, Renaud MC, Hoskins IA, et al.: Vaginal radical trachelectomy: a valuable fertility-preserving option in the management of early-stage cervical cancer. A series of 50 pregnancies and review of the literature. Gynecol Oncol 98 (1): 3-10, 2005. [PUBMED Abstract]
- Shepherd JH, Spencer C, Herod J, et al.: Radical vaginal trachelectomy as a fertility-sparing procedure in women with early-stage cervical cancer-cumulative pregnancy rate in a series of 123 women. BJOG 113 (6): 719-24, 2006. [PUBMED Abstract]
- Wethington SL, Cibula D, Duska LR, et al.: An international series on abdominal radical trachelectomy: 101 patients and 28 pregnancies. Int J Gynecol Cancer 22 (7): 1251-7, 2012. [PUBMED Abstract]
- Lorusso D, Xiang Y, Hasegawa K, et al.: Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): a randomised, double-blind, phase 3 clinical trial. Lancet 403 (10434): 1341-1350, 2024. [PUBMED Abstract]
- Ferrandina G, Margariti PA, Smaniotto D, et al.: Long-term analysis of clinical outcome and complications in locally advanced cervical cancer patients administered concomitant chemoradiation followed by radical surgery. Gynecol Oncol 119 (3): 404-10, 2010. [PUBMED Abstract]
- Ferrandina G, Distefano MG, De Vincenzo R, et al.: Paclitaxel, epirubicin, and cisplatin (TEP) regimen as neoadjuvant treatment in locally advanced cervical cancer: long-term results. Gynecol Oncol 128 (3): 518-23, 2013. [PUBMED Abstract]
- Zanaboni F, Grijuela B, Giudici S, et al.: Weekly topotecan and cisplatin (TOPOCIS) as neo-adjuvant chemotherapy for locally-advanced squamous cervical carcinoma: Results of a phase II multicentric study. Eur J Cancer 49 (5): 1065-72, 2013. [PUBMED Abstract]
- Manci N, Marchetti C, Di Tucci C, et al.: A prospective phase II study of topotecan (Hycamtin®) and cisplatin as neoadjuvant chemotherapy in locally advanced cervical cancer. Gynecol Oncol 122 (2): 285-90, 2011. [PUBMED Abstract]
- Gong L, Lou JY, Wang P, et al.: Clinical evaluation of neoadjuvant chemotherapy followed by radical surgery in the management of stage IB2-IIB cervical cancer. Int J Gynaecol Obstet 117 (1): 23-6, 2012. [PUBMED Abstract]
- Benedetti-Panici P, Greggi S, Colombo A, et al.: Neoadjuvant chemotherapy and radical surgery versus exclusive radiotherapy in locally advanced squamous cell cervical cancer: results from the Italian multicenter randomized study. J Clin Oncol 20 (1): 179-88, 2002. [PUBMED Abstract]
- Chen MF, Tseng CJ, Tseng CC, et al.: Adjuvant concurrent chemoradiotherapy with intensity-modulated pelvic radiotherapy after surgery for high-risk, early stage cervical cancer patients. Cancer J 14 (3): 200-6, 2008 May-Jun. [PUBMED Abstract]
- Hasselle MD, Rose BS, Kochanski JD, et al.: Clinical outcomes of intensity-modulated pelvic radiation therapy for carcinoma of the cervix. Int J Radiat Oncol Biol Phys 80 (5): 1436-45, 2011. [PUBMED Abstract]
- Folkert MR, Shih KK, Abu-Rustum NR, et al.: Postoperative pelvic intensity-modulated radiotherapy and concurrent chemotherapy in intermediate- and high-risk cervical cancer. Gynecol Oncol 128 (2): 288-93, 2013. [PUBMED Abstract]
Tratamiento del cáncer de cuello uterino en estadios IIB, III y IVA
Opciones de tratamiento del cáncer de cuello uterino en estadios IIB, III y IVA
El tamaño del tumor primario es un factor pronóstico importante que se debe evaluar minuciosamente al escoger el tratamiento óptimo.[1] La supervivencia y el control local son mejores si el compromiso paramétrico es unilateral en lugar de bilateral.[2] En los estudios de modelos de atención para pacientes con enfermedad en estadios IIIA y IIIB, se indica que la supervivencia depende de la extensión de la enfermedad; el compromiso unilateral de la pared pélvica pronostica un mejor desenlace que el compromiso bilateral que, a su vez, pronostica un mejor desenlace que el compromiso del tercio inferior de la pared vaginal.[2] En estos estudios también se reveló un aumento progresivo del control local y la supervivencia que fue paralelo a un aumento progresivo de la dosis paracentral (punto A) y el tratamiento intracavitario. La tasa más alta de control central se observó con una dosis paracentral (punto A) mayor de 85 Gy.[3]
Las opciones de tratamiento del cáncer de cuello uterino en estadio IIB, estadio III y estadio IVA es la siguiente:
Radioterapia con quimioterapia simultánea
Se debe considerar decididamente la administración de radioterapia intracavitaria y radioterapia de haz externo (RHE) dirigida a la pelvis en combinación con cisplatino o cisplatino y fluorouracilo (5-FU).[5-12]
Evidencia (radioterapia con quimioterapia simultánea):
- En 5 ensayos aleatorizados de fase III, se observó una ventaja de supervivencia general (SG) de la terapia a base de cisplatino con radioterapia simultánea,[5-10] pero no se observó beneficio en un ensayo en el que se examinó este régimen.[13] Las poblaciones de pacientes en estos estudios incluyeron mujeres con cáncer de cuello uterino en estadios IB2 a IVA según la Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) tratadas con radioterapia primaria, y mujeres con enfermedad en estadios de FIGO I a IIA con factores pronósticos adversos, como enfermedad metastásica ganglionar pélvica, enfermedad paramétrica y compromiso de márgenes quirúrgicos, identificados en el momento de la cirugía primaria.
- Aunque los ensayos con resultados favorables varían en cierta medida según el estadio de la enfermedad, la dosis de radiación y el programa de cisplatino y radiación, en los ensayos se demuestra un beneficio de supervivencia significativo con el uso del abordaje combinado.
- El riesgo de muerte por cáncer de cuello uterino disminuyó del 30 % al 50 % con el uso de quimiorradioterapia simultánea.
Evidencia (radioterapia intracavitaria de dosis bajas vs. dosis altas):
- Aunque la braquiterapia de dosis baja (LDR) por lo general con cesio Cs 137 ha sido el abordaje tradicional, el uso de terapia de dosis altas (HDR), a menudo con iridio Ir 192, está en aumento rápido. La braquiterapia HDR ofrece ventajas como la eliminación de la exposición del personal médico a la radiación, un tiempo de tratamiento más corto, conveniencia para la paciente y mejora de la atención ambulatoria. La American Brachytherapy Society publicó pautas para el uso de la braquiterapia LDR y HDR como componente del tratamiento del cáncer de cuello uterino.[14,15]
- En 3 ensayos aleatorizados, la braquiterapia HDR fue comparable a la braquiterapia LDR en términos de control local regional y tasa de complicaciones.[16-18][Nivel de evidencia B1]
- En un intento por mejorar la quimiorradioterapia estándar, en un ensayo aleatorizado de fase III el uso de gemcitabina, cisplatino y radioterapia simultánea seguida de gemcitabina y cisplatino adyuvantes (grupo experimental) se comparó con el uso de cisplatino y radioterapia simultánea (quimiorradiación estándar) en pacientes con cáncer de cuello uterino en estadios IIB a IVA.[19][Nivel de evidencia A1] Se inscribieron 515 pacientes de 9 países. El programa de tratamiento para el grupo experimental fue cisplatino (40 mg/m2) y gemcitabina (125 mg/m2) semanal durante 6 semanas con RHE simultánea (50,4 Gy en 28 fracciones), seguida de braquiterapia (30–35 Gy en 96 horas) y, luego, 2 ciclos de 21 días de cisplatino adyuvante (50 mg/m2) el día 1, y gemcitabina (1000 mg/m2) los días 1 y 8. El programa de tratamiento para el grupo estándar fue cisplatino (40 mg/m2) semanal durante 6 semanas con RHE simultánea y braquiterapia, como se describió para el grupo experimental.
- El criterio principal de valoración fue la supervivencia sin progresión (SSP) a los 3 años; sin embargo, en el estudio se encontró una mejora de la SSP a 3 años en el grupo experimental (74,4 %, intervalo de confianza [IC] 95 %, 68–79,8 vs. 65,0 %; IC 95 %, 58,5–70,7 %); SSP general (cociente de riesgos instantáneos [CRI], 0,68, IC 95 %, 0,49–0,95) y SG (CRI, 0,68, IC 95 %, 0,49–0,95). Las pacientes del grupo experimental tuvieron un mayor número de efectos tóxicos hematológicos y no hematológicos de grado 3 o 4, y es posible que 2 muertes en el grupo experimental estuvieran relacionadas con el tratamiento.
En un análisis de subgrupos se observó un aumento del beneficio en las pacientes con enfermedad en un estadio más alto (estadios III–IVA vs. estadio IIB), que justifica el aumento de la toxicidad del protocolo experimental en estas pacientes.[20] Se necesita más investigación para determinar qué aspecto del grupo experimental condujo a la mejora de la supervivencia (es decir, la adición de gemcitabina semanal, la quimioterapia adyuvante, o ambas) y para medir la calidad de vida durante el tratamiento y después de este, un aspecto que se omitió en el protocolo.
Braquiterapia intersticial
Para las pacientes que completan la RHE y tienen enfermedad de cuello uterino con gran masa tumoral que supone una restricción anatómica para la braquiterapia estándar, se ha utilizado la braquiterapia intersticial para administrar dosis tumoricidas suficientes con un perfil tóxico aceptable.[21]
Quimioterapia neoadyuvante
Varios grupos han investigado la función de la quimioterapia neoadyuvante para hacer que las pacientes que convencionalmente son aptas para quimiorradioterapia cumplan los requisitos para una cirugía radical.[22-26] Se han utilizado múltiples regímenes; sin embargo, en casi todos se usa el platino como fármaco principal. El ensayo aleatorizado más grande hasta ahora se notificó en 2001, el período de inclusión se completó antes de que el estándar de atención incluyera la adición de cisplatino a la radioterapia.[27] Como consecuencia, aunque hubo una mejora de la SG en el grupo experimental, los resultados no reflejan la práctica actual. En este estudio participaron pacientes con enfermedad en estadio IB a IVA, pero solo se observó mejoría en el grupo experimental de participantes con enfermedad en estadio temprano (estadios IB, IIA o IIB).
En el ensayo EORTC-55994 (NCT00039338), se asignó al azar a pacientes de cáncer de cuello uterino en estadios IB2, IIA2 y IIB a recibir quimiorradioterapia estándar o quimioterapia neoadyuvante (3 ciclos de cisplatino como fármaco principal), seguidas de evaluación para cirugía. Este ensayo tal vez defina si la quimioterapia neoadyuvante cumple una función para esta población de pacientes a partir de la SG como criterio principal de valoración.
Inmunoterapia
Evidencia (inmunoterapia):
- El KEYNOTE-A18 (NCT04221945) fue un ensayo multicéntrico, de fase III, aleatorizado en el que se incluyeron incluyó 1060 mujeres con diagnóstico reciente de carcinoma de células escamosas, adenocarcinoma o carcinoma adenoescamoso de cuello uterino. Las pacientes tenían enfermedad en estadio IB2 o IIB con compromiso ganglionar o enfermedad en estadio III a IVA y no habían recibido tratamiento anterior. Las pacientes se asignaron al azar para recibir quimiorradioterapia (con cisplatino) y pembrolizumab (cada 3 semanas durante 5 ciclos) o quimiorradioterapia y placebo. Todas las pacientes recibieron terapia de mantenimiento con pembrolizumab o placebo cada 6 semanas durante 15 ciclos. Todas las pacientes recibieron braquiterapia, y el 94 % de las pacientes tenía enfermedad positiva para el ligando de muerte programada 1 (PD-L1). Los criterios de valoración primarios duales fueron la supervivencia sin progresión (SSP) y la SG. La mediana de seguimiento fue de 17,9 meses.[28]
- La tasa de SG a 24 meses fue del 87 % en el grupo de pembrolizumab y del 81% en el grupo de placebo (CRI, 0,73; IC 95 %, 0,49–1,07).[28][Nivel de evidencia B1]
- Hubo una mejora estadísticamente significativa en la SSP (CRI, 0,70; IC 95 %, 0,55–0,89). La tasa de SSP a 24 meses fue del 68 % en el grupo de pembrolizumab y del 57 % en el grupo de placebo.
- Las pacientes con enfermedad en estadio III o IV tuvieron una mejora superior de la SSP (CRI, 0,58; IC 95 %, 0,42–0,80).
Tratamiento de los ganglios linfáticos
Las pacientes que se estadifican mediante cirugía como parte de un ensayo clínico y en quienes se encuentra una enfermedad ganglionar paraórtica de volumen pequeño con enfermedad pélvica controlable quizás se curen con radioterapia pélvica y paraórtica.[29] En las pacientes que no se sometieron a resección de ganglios paraórticos, el tratamiento con radioterapia de campo extendido y quimioterapia conduce al control de la enfermedad a largo plazo cuando la enfermedad ganglionar por debajo de L3 es de volumen bajo (<2 cm).[30] En un estudio (RTOG-7920), se observó una ventaja de supervivencia en pacientes que recibieron radioterapia dirigida a los ganglios paraórticos sin indicios histológicos de enfermedad.[31] Los efectos tóxicos son más frecuentes con la radioterapia paraórtica que con la radioterapia pélvica sola, pero se limitaron, en su mayoría, a las pacientes sometidas antes a cirugía abdominopélvica.[31]
Si se tiene previsto usar RHE después de la cirugía, el muestreo de los ganglios linfáticos extraperitoneales se relaciona con menos complicaciones de la radioterapia que si usa un abordaje transperitoneal.[32] Las pacientes sometidas a muestreo ganglionar extraperitoneal presentaron menos complicaciones intestinales que las sometidas a muestreo ganglionar transperitoneal.[30,32,33]
Es posible que la resección de ganglios pélvicos con compromiso macroscópico mejore las tasas de control local cuando se usa radioterapia posoperatoria.[34] Además, los datos prospectivos indicaron una mejora de los desenlaces de las pacientes que se someten a una resección de los ganglios linfáticos paraórticos comprometidos antes de recibir la quimiorradioterapia con intención curativa; sin embargo, solo se beneficiaron las pacientes con compromiso ganglionar mínimo (<5 mm).[35]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Perez CA, Grigsby PW, Nene SM, et al.: Effect of tumor size on the prognosis of carcinoma of the uterine cervix treated with irradiation alone. Cancer 69 (11): 2796-806, 1992. [PUBMED Abstract]
- Lanciano RM, Won M, Hanks GE: A reappraisal of the International Federation of Gynecology and Obstetrics staging system for cervical cancer. A study of patterns of care. Cancer 69 (2): 482-7, 1992. [PUBMED Abstract]
- Lanciano RM, Martz K, Coia LR, et al.: Tumor and treatment factors improving outcome in stage III-B cervix cancer. Int J Radiat Oncol Biol Phys 20 (1): 95-100, 1991. [PUBMED Abstract]
- Monk BJ, Tewari KS, Koh WJ: Multimodality therapy for locally advanced cervical carcinoma: state of the art and future directions. J Clin Oncol 25 (20): 2952-65, 2007. [PUBMED Abstract]
- Whitney CW, Sause W, Bundy BN, et al.: Randomized comparison of fluorouracil plus cisplatin versus hydroxyurea as an adjunct to radiation therapy in stage IIB-IVA carcinoma of the cervix with negative para-aortic lymph nodes: a Gynecologic Oncology Group and Southwest Oncology Group study. J Clin Oncol 17 (5): 1339-48, 1999. [PUBMED Abstract]
- Morris M, Eifel PJ, Lu J, et al.: Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high-risk cervical cancer. N Engl J Med 340 (15): 1137-43, 1999. [PUBMED Abstract]
- Rose PG, Bundy BN, Watkins EB, et al.: Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer. N Engl J Med 340 (15): 1144-53, 1999. [PUBMED Abstract]
- Keys HM, Bundy BN, Stehman FB, et al.: Cisplatin, radiation, and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma. N Engl J Med 340 (15): 1154-61, 1999. [PUBMED Abstract]
- Peters WA, Liu PY, Barrett RJ, et al.: Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix. J Clin Oncol 18 (8): 1606-13, 2000. [PUBMED Abstract]
- Thomas GM: Improved treatment for cervical cancer--concurrent chemotherapy and radiotherapy. N Engl J Med 340 (15): 1198-200, 1999. [PUBMED Abstract]
- Rose PG, Bundy BN: Chemoradiation for locally advanced cervical cancer: does it help? J Clin Oncol 20 (4): 891-3, 2002. [PUBMED Abstract]
- Chemoradiotherapy for Cervical Cancer Meta-Analysis Collaboration: Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: a systematic review and meta-analysis of individual patient data from 18 randomized trials. J Clin Oncol 26 (35): 5802-12, 2008. [PUBMED Abstract]
- Pearcey R, Brundage M, Drouin P, et al.: Phase III trial comparing radical radiotherapy with and without cisplatin chemotherapy in patients with advanced squamous cell cancer of the cervix. J Clin Oncol 20 (4): 966-72, 2002. [PUBMED Abstract]
- Nag S, Chao C, Erickson B, et al.: The American Brachytherapy Society recommendations for low-dose-rate brachytherapy for carcinoma of the cervix. Int J Radiat Oncol Biol Phys 52 (1): 33-48, 2002. [PUBMED Abstract]
- Nag S, Erickson B, Thomadsen B, et al.: The American Brachytherapy Society recommendations for high-dose-rate brachytherapy for carcinoma of the cervix. Int J Radiat Oncol Biol Phys 48 (1): 201-11, 2000. [PUBMED Abstract]
- Patel FD, Sharma SC, Negi PS, et al.: Low dose rate vs. high dose rate brachytherapy in the treatment of carcinoma of the uterine cervix: a clinical trial. Int J Radiat Oncol Biol Phys 28 (2): 335-41, 1994. [PUBMED Abstract]
- Hareyama M, Sakata K, Oouchi A, et al.: High-dose-rate versus low-dose-rate intracavitary therapy for carcinoma of the uterine cervix: a randomized trial. Cancer 94 (1): 117-24, 2002. [PUBMED Abstract]
- Lertsanguansinchai P, Lertbutsayanukul C, Shotelersuk K, et al.: Phase III randomized trial comparing LDR and HDR brachytherapy in treatment of cervical carcinoma. Int J Radiat Oncol Biol Phys 59 (5): 1424-31, 2004. [PUBMED Abstract]
- Dueñas-González A, Zarbá JJ, Patel F, et al.: Phase III, open-label, randomized study comparing concurrent gemcitabine plus cisplatin and radiation followed by adjuvant gemcitabine and cisplatin versus concurrent cisplatin and radiation in patients with stage IIB to IVA carcinoma of the cervix. J Clin Oncol 29 (13): 1678-85, 2011. [PUBMED Abstract]
- Dueňas-González A, Orlando M, Zhou Y, et al.: Efficacy in high burden locally advanced cervical cancer with concurrent gemcitabine and cisplatin chemoradiotherapy plus adjuvant gemcitabine and cisplatin: prognostic and predictive factors and the impact of disease stage on outcomes from a prospective randomized phase III trial. Gynecol Oncol 126 (3): 334-40, 2012. [PUBMED Abstract]
- Pinn-Bingham M, Puthawala AA, Syed AM, et al.: Outcomes of high-dose-rate interstitial brachytherapy in the treatment of locally advanced cervical cancer: long-term results. Int J Radiat Oncol Biol Phys 85 (3): 714-20, 2013. [PUBMED Abstract]
- Ferrandina G, Margariti PA, Smaniotto D, et al.: Long-term analysis of clinical outcome and complications in locally advanced cervical cancer patients administered concomitant chemoradiation followed by radical surgery. Gynecol Oncol 119 (3): 404-10, 2010. [PUBMED Abstract]
- Ferrandina G, Distefano MG, De Vincenzo R, et al.: Paclitaxel, epirubicin, and cisplatin (TEP) regimen as neoadjuvant treatment in locally advanced cervical cancer: long-term results. Gynecol Oncol 128 (3): 518-23, 2013. [PUBMED Abstract]
- Zanaboni F, Grijuela B, Giudici S, et al.: Weekly topotecan and cisplatin (TOPOCIS) as neo-adjuvant chemotherapy for locally-advanced squamous cervical carcinoma: Results of a phase II multicentric study. Eur J Cancer 49 (5): 1065-72, 2013. [PUBMED Abstract]
- Manci N, Marchetti C, Di Tucci C, et al.: A prospective phase II study of topotecan (Hycamtin®) and cisplatin as neoadjuvant chemotherapy in locally advanced cervical cancer. Gynecol Oncol 122 (2): 285-90, 2011. [PUBMED Abstract]
- Gong L, Lou JY, Wang P, et al.: Clinical evaluation of neoadjuvant chemotherapy followed by radical surgery in the management of stage IB2-IIB cervical cancer. Int J Gynaecol Obstet 117 (1): 23-6, 2012. [PUBMED Abstract]
- Benedetti-Panici P, Greggi S, Colombo A, et al.: Neoadjuvant chemotherapy and radical surgery versus exclusive radiotherapy in locally advanced squamous cell cervical cancer: results from the Italian multicenter randomized study. J Clin Oncol 20 (1): 179-88, 2002. [PUBMED Abstract]
- Lorusso D, Xiang Y, Hasegawa K, et al.: Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): a randomised, double-blind, phase 3 clinical trial. Lancet 403 (10434): 1341-1350, 2024. [PUBMED Abstract]
- Cunningham MJ, Dunton CJ, Corn B, et al.: Extended-field radiation therapy in early-stage cervical carcinoma: survival and complications. Gynecol Oncol 43 (1): 51-4, 1991. [PUBMED Abstract]
- Vigliotti AP, Wen BC, Hussey DH, et al.: Extended field irradiation for carcinoma of the uterine cervix with positive periaortic nodes. Int J Radiat Oncol Biol Phys 23 (3): 501-9, 1992. [PUBMED Abstract]
- Rotman M, Pajak TF, Choi K, et al.: Prophylactic extended-field irradiation of para-aortic lymph nodes in stages IIB and bulky IB and IIA cervical carcinomas. Ten-year treatment results of RTOG 79-20. JAMA 274 (5): 387-93, 1995. [PUBMED Abstract]
- Weiser EB, Bundy BN, Hoskins WJ, et al.: Extraperitoneal versus transperitoneal selective paraaortic lymphadenectomy in the pretreatment surgical staging of advanced cervical carcinoma (a Gynecologic Oncology Group study). Gynecol Oncol 33 (3): 283-9, 1989. [PUBMED Abstract]
- Fine BA, Hempling RE, Piver MS, et al.: Severe radiation morbidity in carcinoma of the cervix: impact of pretherapy surgical staging and previous surgery. Int J Radiat Oncol Biol Phys 31 (4): 717-23, 1995. [PUBMED Abstract]
- Downey GO, Potish RA, Adcock LL, et al.: Pretreatment surgical staging in cervical carcinoma: therapeutic efficacy of pelvic lymph node resection. Am J Obstet Gynecol 160 (5 Pt 1): 1055-61, 1989. [PUBMED Abstract]
- Gouy S, Morice P, Narducci F, et al.: Prospective multicenter study evaluating the survival of patients with locally advanced cervical cancer undergoing laparoscopic para-aortic lymphadenectomy before chemoradiotherapy in the era of positron emission tomography imaging. J Clin Oncol 31 (24): 3026-33, 2013. [PUBMED Abstract]
Tratamiento del cáncer de cuello uterino en estadio IVB y recidivante
Opciones de tratamiento del cáncer de cuello uterino en estadio IVB y recidivante
A excepción de la inmunoterapia, que ha proporcionado una supervivencia sin enfermedad prolongada, es poco probable que otras opciones de tratamiento produzcan resultados curativos y se aplican en su mayoría con fines paliativos.
Las opciones de tratamiento del cáncer de cuello uterino en estadio IVB y recidivante son las siguientes:
- Inmunoterapia.
- Radioterapia y quimioterapia.
- Quimioterapia paliativa y otra terapia sistémica.
- Exenteración pélvica.
- Participación en ensayos clínicos de fase I y II de fármacos antineoplásicos nuevos.
Inmunoterapia
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el inhibidor del punto de control dirigido a la proteína de muerte celular programada 1 (PD-1), pembrolizumab, a partir del ensayo de fase II KEYNOTE-158 (NCT02628067) de mujeres con cáncer de cuello uterino recidivante o metastásico que tenían tumores con expresión del ligando de muerte programada 1 (PD-L1) (puntuación positiva combinada [CPS], ≥1). En varios ensayos se obtuvieron datos adicionales acerca del beneficio de pembrolizumab.
Evidencia (inmunoterapia):
- En el ensayo multicéntrico internacional BEATcc (NCT03556839) se incluyeron 410 mujeres con carcinoma de células escamosas o adenocarcinoma de cuello uterino en estadio IVB persistente o recidivante no aptas para el tratamiento mediante cirugía curativa o radioterapia. Las pacientes no habían recibido terapia sistémica previa y se asignaron al azar para recibir bevacizumab con quimioterapia (carboplatino o cisplatino con paclitaxel) (grupo de control) o al grupo experimental, en el que se añadió atezolizumab al régimen de control. Los criterios principales de valoración duales fueron la supervivencia sin progresión (SSP) y la supervivencia general (SG); el ensayo no fue selectivo para la expresión de PD-L1.[1]
- Al cabo de una mediana de seguimiento de 32,9 meses, la mediana de SSP fue de 10,4 meses en las pacientes del grupo de control y de 13,7 meses en las pacientes del grupo experimental (cociente de riesgos instantáneos [CRI], 0,62; intervalo de confianza [IC] 95 %, 0,48–0,78; P < 0,0001). La mediana de SG fue de 22,8 meses en las pacientes del grupo de control y de 32,1 meses en las pacientes del grupo experimental (CRI, 0,68; IC 95 %, 0,52–0,88; P = 0,0046).[1][Nivel de evidencia A1]
- El KEYNOTE-826 (NCT03635567) fue un ensayo multicéntrico, de fase III y aleatorizado en el que participaron 617 mujeres con carcinoma de cuello uterino de células escamosas o adenoescamosas que no responde a un tratamiento curativo. Las pacientes presentaban enfermedad medible. Todas se trataron con cisplatino o carboplatino en combinación con paclitaxel, con la opción de añadir bevacizumab a discreción del médico tratante. Las pacientes recibieron 6 ciclos y se asignaron al azar en una proporción 1:1 a recibir pembrolizumab or placebo cada 3 semanas por un máximo de 35 ciclos. La mediana de seguimiento fue de 39,1 meses, y los criterios de valoración primarios duales fueron la SSP y la SG. Cerca del 89 % de las mujeres tenían una puntuación CPS de PD-L1 de 1 o superior.[2]
- La mediana de SG fue de 26,4 meses en las pacientes que recibieron pembrolizumab y de 16,8 meses en aquellas que recibieron placebo (CRI, 0,63; IC 95 %, 0,52–0,77). Este beneficio no se mantuvo en las mujeres con una puntuación CPS menor a 1. El beneficio se mantuvo en el grupo de mujeres que no recibieron bevacizumab.[2][Nivel de evidencia A1]
- La mediana de SSP fue de 10,4 meses en las pacientes queque recibieron pembrolizumab y de 8,2 meses en las pacientes que recibieron placebo (CRI, 0,61; IC 95 %, 0,50–0,74).
- El KEYNOTE-A18 (NCT04221945) fue un ensayo multicéntrico, de fase III, aleatorizado en el que se incluyeron 1060 mujeres con diagnóstico reciente de carcinoma de células escamosas, adenocarcinoma o carcinoma adenoescamoso de cuello uterino. Las pacientes tenían enfermedad en estadio IB2 o IIB con compromiso ganglionar o enfermedad en estadio III a IVA y no habían recibido tratamiento anterior. Las pacientes se asignaron al azar para recibir quimiorradioterapia (con cisplatino) y pembrolizumab (cada 3 semanas durante 5 ciclos) o quimiorradioterapia y placebo. Todas las pacientes recibieron terapia de mantenimiento con pembrolizumab o placebo cada 6 semanas durante 15 ciclos. Todas las pacientes recibieron braquiterapia, y el 94 % de las pacientes tenía enfermedad positiva para el ligando de muerte programada 1 (PD-L1). Los criterios de valoración primarios duales fueron la supervivencia sin progresión (SSP) y la SG. La mediana de seguimiento fue de 17,9 meses.[3]
- La tasa de SG a 24 meses fue del 87 % en el grupo de pembrolizumab y del 81% en el grupo de placebo (CRI, 0,73; IC 95 %, 0,49–1,07).[3][Nivel de evidencia B1]
- Hubo una mejora estadísticamente significativa en la SSP (CRI, 0,70; IC 95 %, 0,55–0,89). La tasa de SSP a 24 meses fue del 68 % en el grupo de pembrolizumab y del 57 % en el grupo de placebo.
- Las pacientes con enfermedad en estadio III o IV tuvieron una mejora superior de la SSP (CRI, 0,58; IC 95 %, 0,42–0,80).
- El ensayo KEYNOTE-158 (NCT02628067) fue multicéntrico no aleatorizado con 98 pacientes de cáncer de cuello uterino recidivante o metastásico que recibieron el fármaco en dosis de 200 mg intravenosos cada 3 semanas hasta que se presentó toxicidad inaceptable o progresión de la enfermedad.[4] Se realizó otro análisis de 77 pacientes cuyos tumores expresaban PD-L1 (CPS ≥1); el 92 % exhibían un tipo histológico de células escamosas.
- La tasa de respuesta general en las pacientes positivas para PD-L1 fue del 16 % (IC 95 %, 8,8–25,9 %) con 3 remisiones completas y 10 remisiones parciales; 17 pacientes se mantuvieron estables.
- La mediana de la supervivencia sin progresión (SSP) fue del 2,1 meses y la supervivencia general (SG) fue de 9,4 meses en estas pacientes que exhibieron el marcador.
- Se observaron efectos adversos relacionados con el tratamiento en el 65 % de las pacientes; los más frecuentes fueron el hipotiroidismo (10,2 %), la disminución del apetito (9,2 %), la fatiga (9,2 %) y la diarrea (8,2 %).[4][Nivel de evidencia B4]
- El GOG-0240 (NCT00803062), en el que se incluyeron pacientes con carcino de cuello uterino metastásico, persistente o recidivante, se diseñó para responder las siguientes 2 preguntas:[5]
- ¿Puede una combinación sin derivados del platino producir mejoría en comparación con el régimen estándar de cisplatino y paclitaxel en esta población tratada antes con cisplatino durante la radioterapia?
- ¿Puede la adición de bevacizumab mejorar la quimioterapia combinada en pacientes con cáncer de cuello uterino en estadio IVB persistente o recidivante?
Las pacientes se asignaron al azar a los siguientes 4 grupos de tratamiento:
- Cisplatino (50 mg/m2) y paclitaxel (135 mg/m2 o 175 mg/m2) el día 1 (PC).
- PC y bevacizumab (15mg/kg) el día 1.
- Topotecán (0,75 mg/m2) los días 1–3 y paclitaxel (175 mg/m2) el día 1 (PT).
- PT y bevacizumab (15mg/kg) el día 1.
Los métodos de estudio adicionales y los resultados fueron los siguientes:
- El criterio principal de valoración fue la SG y 452 pacientes fueron evaluables.
- La combinación PT no fue superior a la PC y se calculó un cociente de riesgos instantáneos (CRI) para la muerte de 1,2 (IC 99 %, 0,82–1,76). La exposición previa a derivados del platino no afectó este resultado.
- La adición de bevacizumab a la quimioterapia combinada produjo, por un lado, una SG superior: 17 meses para la quimioterapia con bevacizumab versus 13,3 meses para la quimioterapia sola (CRI, 0,71, IC 98 %, 0,54–0,95), y por otro lado, una SSP extendida: 8,2 meses para la quimioterapia con bevacizumab versus 5,9 meses para la quimioterapia sola (CRI, 0,67, IC 95 %, 0,54–0,82).
- La adición de bevacizumab se toleró bien y no se observaron diferencias en la calidad de vida entre los 2 grupos.
- Fue más probable que las pacientes que recibieron bevacizumab presentaran fistulas de grado 3 o más (6 vs. 0 %) y episodios tromboembólicos de grado 3 o más (8 vs. 1 %) en comparación con las pacientes tratadas con quimioterapia sola.
- Como consecuencia, se puede considerar la adición de bevacizumab para esta población de pacientes.
- En un ensayo internacional de fase III (NCT04697628) se asignó al azar a 502 mujeres para recibir tisotumab vedotina (2 mg/kg cada 3 semanas) o la elección de quimioterapia del investigador. Las pacientes tenían cáncer de cuello uterino metastásico o recidivante (características histológicas de células escamosas, adenocarcinoma o células adenoescamosas) con enfermedad medible después de un tratamiento sistémico previo (paclitaxel y derivado del platino o topotecán, con bevacizumab o sin este y con un fármaco anti–PD-1 o anti–PD-L1 o sin este). Se requirieron uno o dos tratamientos sistémicos previos (sin quimioterapia adyuvante, de mantenimiento o neoadyuvante ni quimiorradioterapia). Las pruebas con imágenes se realizaron cada 6 semanas durante 30 semanas y, posteriormente, cada 12 semanas. El criterio principal de valoración fue la SG.[6]
- Al cabo de una mediana de seguimiento de 10,8 meses, la mediana de SG fue de 11,5 meses en las pacientes que recibieron tisotumab vedotina y de 9,5 meses en el caso de las pacientes que recibieron quimioterapia.[6][Nivel de evidencia A1]
- Los efectos adversos comunes en el grupo de tisotumab vedotina incluyeron efectos oculares (52,8 %), neuropatías periféricas (38,4 %) y hemorragia (42 %).
Radioterapia y quimioterapia
La radioterapia y la quimioterapia (fluorouracilo con mitomicina o sin esta) curan del 40 % al 50 % de las pacientes que recidivan en la pelvis después de una cirugía radical inicial.[7]
Quimioterapia paliativa y otra terapia sistémica
Es posible usar quimioterapia con fines paliativos. Los fármacos que se utilizan para la quimioterapia paliativa se presentan en el Cuadro 6.
| Nombre del fármaco | Tasa de respuesta |
|---|---|
| Cisplatino [8] | 15–25 % |
| Ifosfamida [9,10] | 15–30 % |
| Paclitaxel [11] | 17 % |
| Irinotecán [12] | 21 % en pacientes tratadas antes con quimioterapia |
| Bevacizumab [13] | 11 %; 24 % sobrevivió sin progresión durante por lo menos 6 meses como se observó en el ensayo GOG-0227C (NCT00025233) |
| Ifosfamida o cisplatino [14,15] | 31 % |
| Paclitaxel o cisplatino [16] | 46 % |
| Cisplatino o gemcitabina [17] | 41 % |
| Cisplatino o topotecán [18] | 27 % |
| Cisplatino o vinorelbina [19] | 30 % |
Cisplatino combinado con otros fármacos
Dado que el medicamento se lanzó al mercado en la década de 1970, el régimen que más se ha usado para el tratamiento del cáncer de cuello uterino ha sido el cisplatino en monoterapia administrado por vía intravenosa en dosis de 50 mg/m² cada 3 semanas.[8] El Gynecologic Oncology Group (GOG) notificó sobre los ensayos aleatorizados secuenciales de quimioterapia combinada para el cáncer de cuello uterino en estadio IVB recidivante o persistente.[15,18,20-23]
Evidencia (cisplatino combinado con otros fármacos):
- GOG-110, GOG-0179, GOG-0169 (NCT00803062)
- GOG-110: la combinación de ifosfamida y cisplatino fue superior al cisplatino solo para el criterio de valoración secundario de tasa de respuesta, pero a costa de un aumento de la toxicidad.
- GOG-0179: la combinación doble de cisplatino y topotecán (CT) produjo una ventaja significativa de supervivencia general (SG) en comparación con el cisplatino solo; esto condujo a que la FDA aprobara esta indicación para el topotecán. Sin embargo, el cisplatino solo no tuvo buenos resultados en este ensayo porque hasta un 40 % de las pacientes había recibido cisplatino al inicio como radiosensibilizador.[18]
- GOG-0169: de manera similar, la combinación de paclitaxel y cisplatino (PC) fue superior en las tasas de respuesta y SSP, y su toxicidad fue similar a la de la monoterapia, excepto para las pacientes con estado funcional 2 del GOG (escala: 0, asintomático hasta 4, totalmente postrado en cama). En consecuencia, se eligió la combinación PC para el grupo de referencia en el ensayo GOG-0204 (NCT00064077).
- En el GOG-0204 se inscribieron 513 pacientes y se compararon 4 regímenes dobles a base de cisplatino. El ensayo se cerró de forma anticipada porque fue improbable que alguno de los grupos experimentales lograra una reducción significativa del CRIde muerte en relación con el régimen PC:[23]
- 1,15 (IC 95 %, 0,79–1,67) para la vinorelbina con cisplatino (VC).
- 1,32 (IC 95 %, 0,91–1,92) para la gemcitabina con cisplatino.
- 1,27 (IC 95%, 0,90–1,78) para CT. Las tendencias de la tasa de respuesta, la SSP y la SG favorecieron al régimen CT.
- Las pacientes de los cuatro grupos del estudio presentaron diferentes grados de neutropenia, infección y alopecia.[23] No hubo diferencias en la calidad de vida relacionada con la salud durante el tratamiento.[24] Sin embargo, las pacientes que recibieron el régimen PC tuvieron más efectos secundarios neurológicos.
Exenteración pélvica
No se dispone de un tratamiento estándar para pacientes con cáncer de cuello uterino recidivante que se diseminó más allá de los límites de un campo de radiación o cirugía. Para la enfermedad que recidiva localmente, la exenteración pélvica quizás conduzca a una tasa de supervivencia a 5 años del 32 % al 62 % en determinadas pacientes.[25,26] Estas pacientes cumplen los requisitos para participar en ensayos clínicos en los que se prueban combinaciones de fármacos o nuevos fármacos antineoplásicos.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
Bibliografía
- Oaknin A, Gladieff L, Martínez-García J, et al.: Atezolizumab plus bevacizumab and chemotherapy for metastatic, persistent, or recurrent cervical cancer (BEATcc): a randomised, open-label, phase 3 trial. Lancet 403 (10421): 31-43, 2024. [PUBMED Abstract]
- Monk BJ, Colombo N, Tewari KS, et al.: First-Line Pembrolizumab + Chemotherapy Versus Placebo + Chemotherapy for Persistent, Recurrent, or Metastatic Cervical Cancer: Final Overall Survival Results of KEYNOTE-826. J Clin Oncol 41 (36): 5505-5511, 2023. [PUBMED Abstract]
- Lorusso D, Xiang Y, Hasegawa K, et al.: Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): a randomised, double-blind, phase 3 clinical trial. Lancet 403 (10434): 1341-1350, 2024. [PUBMED Abstract]
- Chung HC, Schellens JHM, Delord JP, et al.: Pembrolizumab treatment of advanced cervical cancer: updated results from the phase 2 KEYNOTE-158 study. [Abstract] J Clin Oncol 36 (Suppl 18): A-5522, 2018.
- Tewari KS, Sill MW, Long HJ, et al.: Improved survival with bevacizumab in advanced cervical cancer. N Engl J Med 370 (8): 734-43, 2014. [PUBMED Abstract]
- Vergote I, González-Martín A, Fujiwara K, et al.: Tisotumab Vedotin as Second- or Third-Line Therapy for Recurrent Cervical Cancer. N Engl J Med 391 (1): 44-55, 2024. [PUBMED Abstract]
- Thomas GM, Dembo AJ, Black B, et al.: Concurrent radiation and chemotherapy for carcinoma of the cervix recurrent after radical surgery. Gynecol Oncol 27 (3): 254-63, 1987. [PUBMED Abstract]
- Thigpen JT, Blessing JA, DiSaia PJ, et al.: A randomized comparison of a rapid versus prolonged (24 hr) infusion of cisplatin in therapy of squamous cell carcinoma of the uterine cervix: a Gynecologic Oncology Group study. Gynecol Oncol 32 (2): 198-202, 1989. [PUBMED Abstract]
- Coleman RE, Harper PG, Gallagher C, et al.: A phase II study of ifosfamide in advanced and relapsed carcinoma of the cervix. Cancer Chemother Pharmacol 18 (3): 280-3, 1986. [PUBMED Abstract]
- Sutton GP, Blessing JA, McGuire WP, et al.: Phase II trial of ifosfamide and mesna in patients with advanced or recurrent squamous carcinoma of the cervix who had never received chemotherapy: a Gynecologic Oncology Group study. Am J Obstet Gynecol 168 (3 Pt 1): 805-7, 1993. [PUBMED Abstract]
- McGuire WP, Blessing JA, Moore D, et al.: Paclitaxel has moderate activity in squamous cervix cancer. A Gynecologic Oncology Group study. J Clin Oncol 14 (3): 792-5, 1996. [PUBMED Abstract]
- Verschraegen CF, Levy T, Kudelka AP, et al.: Phase II study of irinotecan in prior chemotherapy-treated squamous cell carcinoma of the cervix. J Clin Oncol 15 (2): 625-31, 1997. [PUBMED Abstract]
- Monk BJ, Sill MW, Burger RA, et al.: Phase II trial of bevacizumab in the treatment of persistent or recurrent squamous cell carcinoma of the cervix: a gynecologic oncology group study. J Clin Oncol 27 (7): 1069-74, 2009. [PUBMED Abstract]
- Buxton EJ, Meanwell CA, Hilton C, et al.: Combination bleomycin, ifosfamide, and cisplatin chemotherapy in cervical cancer. J Natl Cancer Inst 81 (5): 359-61, 1989. [PUBMED Abstract]
- Omura GA, Blessing JA, Vaccarello L, et al.: Randomized trial of cisplatin versus cisplatin plus mitolactol versus cisplatin plus ifosfamide in advanced squamous carcinoma of the cervix: a Gynecologic Oncology Group study. J Clin Oncol 15 (1): 165-71, 1997. [PUBMED Abstract]
- Rose PG, Blessing JA, Gershenson DM, et al.: Paclitaxel and cisplatin as first-line therapy in recurrent or advanced squamous cell carcinoma of the cervix: a gynecologic oncology group study. J Clin Oncol 17 (9): 2676-80, 1999. [PUBMED Abstract]
- Burnett AF, Roman LD, Garcia AA, et al.: A phase II study of gemcitabine and cisplatin in patients with advanced, persistent, or recurrent squamous cell carcinoma of the cervix. Gynecol Oncol 76 (1): 63-6, 2000. [PUBMED Abstract]
- Long HJ, Bundy BN, Grendys EC, et al.: Randomized phase III trial of cisplatin with or without topotecan in carcinoma of the uterine cervix: a Gynecologic Oncology Group Study. J Clin Oncol 23 (21): 4626-33, 2005. [PUBMED Abstract]
- Morris M, Blessing JA, Monk BJ, et al.: Phase II study of cisplatin and vinorelbine in squamous cell carcinoma of the cervix: a Gynecologic Oncology Group study. J Clin Oncol 22 (16): 3340-4, 2004. [PUBMED Abstract]
- Tewari KS, Monk BJ: Gynecologic oncology group trials of chemotherapy for metastatic and recurrent cervical cancer. Curr Oncol Rep 7 (6): 419-34, 2005. [PUBMED Abstract]
- Moore DH, Blessing JA, McQuellon RP, et al.: Phase III study of cisplatin with or without paclitaxel in stage IVB, recurrent, or persistent squamous cell carcinoma of the cervix: a Gynecologic Oncology Group study. J Clin Oncol 22 (15): 3113-9, 2004. [PUBMED Abstract]
- Tewari KS, Monk BJ: Recent achievements and future developments in advanced and recurrent cervical cancer: trials of the Gynecologic Oncology Group. Semin Oncol 36 (2): 170-80, 2009. [PUBMED Abstract]
- Monk BJ, Sill MW, McMeekin DS, et al.: Phase III trial of four cisplatin-containing doublet combinations in stage IVB, recurrent, or persistent cervical carcinoma: a Gynecologic Oncology Group study. J Clin Oncol 27 (28): 4649-55, 2009. [PUBMED Abstract]
- Cella D, Huang HQ, Monk BJ, et al.: Health-related quality of life outcomes associated with four cisplatin-based doublet chemotherapy regimens for stage IVB recurrent or persistent cervical cancer: a Gynecologic Oncology Group study. Gynecol Oncol 119 (3): 531-7, 2010. [PUBMED Abstract]
- Alberts DS, Kronmal R, Baker LH, et al.: Phase II randomized trial of cisplatin chemotherapy regimens in the treatment of recurrent or metastatic squamous cell cancer of the cervix: a Southwest Oncology Group Study. J Clin Oncol 5 (11): 1791-5, 1987. [PUBMED Abstract]
- Tumors of the cervix. In: Morrow CP, Curtin JP: Synopsis of Gynecologic Oncology. 5th ed. Churchill Livingstone, 1998, pp 107-151.
Cáncer de cuello uterino durante el embarazo
Durante el embarazo, no se justifica el tratamiento de lesiones preinvasivas del cuello uterino, ni siquiera del carcinoma in situ, aunque se recomienda que un especialista haga una colposcopia para excluir la posibilidad de cáncer invasivo.
Diagnóstico
El tratamiento del cáncer de cuello uterino invasivo durante el embarazo depende de la extensión de la enfermedad y la edad gestacional en el momento del diagnóstico. Las pacientes se deberán someter a una biopsia si es necesario y se obtendrán imágenes para establecer la extensión de la enfermedad y tomar decisiones más fundadas. Cuando se indique, la modalidad de imagen más apropiada durante el embarazo son las imágenes por resonancia magnética.
Tratamiento de la enfermedad en estadio I
El embarazo no altera la evolución del cáncer de cuello uterino. En consecuencia, en ciertos casos, las pacientes pueden optar por posponer el tratamiento hasta que se reduzcan al mínimo sus efectos en el embarazo. Es posible considerar esta estrategia en las pacientes con los subtipos histológicos más comunes y menos malignos: escamoso, adenocarcinoma y adenoescamoso. Debido al riesgo de progresión de la enfermedad, las pacientes con subtipos de riesgo alto, como los tumores de células pequeñas o los tumores neuroendocrinos, se deben asesorar sobre el tratamiento inmediato a pesar de los efectos sobre el feto.
Las pacientes con enfermedad en estadio temprano (IA) se pueden someter de manera inocua a tratamientos que conserven la capacidad reproductiva, como la conización del cuello uterino o la traquelectomía radical, cuando se indiquen. El momento óptimo para este procedimiento es en el segundo trimestre, antes de la viabilidad fetal. Algunos autores han indicado esperar hasta el fin del embarazo para iniciar el tratamiento.[1] En las pacientes con enfermedad IA2 y IB, es posible que diferir el tratamiento también sea inocuo, pero debido al riesgo de diseminación linfática, se debe comprobar primero el estado de los ganglios linfáticos. La mejor manera de determinar el estado ganglionar es por métodos quirúrgicos de disección ganglionar laparoscópica o abierta, que se puede realizar de forma inocua hasta alrededor de las 20 semanas de embarazo.[2,3] En las pacientes sin diseminación linfática, una opción es esperar la viabilidad fetal para iniciar el tratamiento. A las pacientes con compromiso ganglionar se les debe aconsejar que inicien un tratamiento inmediato.
Tratamiento de la enfermedad en estadios II, III y IV
Por lo general, no es aceptable que las pacientes con enfermedad en estadio II o más alto aguarden por la viabilidad fetal.[4] El estándar de atención para las pacientes con compromiso ganglionar es quimioterapia y radioterapia. Este tratamiento es tóxico para el feto y, si no se hace una transposición ovárica, los ovarios no funcionarán después del tratamiento. El feto se debe evacuar antes de iniciar la radiación. Cuando esto no es posible, por lo general, la radiación provoca el aborto espontáneo entre 3 y 5 semanas después del inicio del tratamiento.
Quimioterapia neoadyuvante
Se ha ofrecido quimioterapia neoadyuvante a las pacientes con enfermedad localmente avanzada, como forma de iniciar el tratamiento mientras se mantiene el embarazo.[1] La mayoría de los fármacos quimioterapéuticos se pueden iniciar de manera inocua durante el segundo trimestre del embarazo y más tarde. El efecto secundario más común es una restricción leve del crecimiento fetal. Se notificó la restricción del crecimiento en un número relativamente pequeño de pacientes y se carece de datos sobre los desenlaces a largo plazo para estas mujeres. En consecuencia, se debe considerar con cautela esta estrategia. La mayoría de las pacientes en los informes se sometieron al tratamiento estándar (cirugía o radiación) después completar su embarazo.
Bibliografía
- Morice P, Uzan C, Gouy S, et al.: Gynaecological cancers in pregnancy. Lancet 379 (9815): 558-69, 2012. [PUBMED Abstract]
- Alouini S, Rida K, Mathevet P: Cervical cancer complicating pregnancy: implications of laparoscopic lymphadenectomy. Gynecol Oncol 108 (3): 472-7, 2008. [PUBMED Abstract]
- Favero G, Chiantera V, Oleszczuk A, et al.: Invasive cervical cancer during pregnancy: laparoscopic nodal evaluation before oncologic treatment delay. Gynecol Oncol 118 (2): 123-7, 2010. [PUBMED Abstract]
- Hunter MI, Tewari K, Monk BJ: Cervical neoplasia in pregnancy. Part 2: current treatment of invasive disease. Am J Obstet Gynecol 199 (1): 10-8, 2008. [PUBMED Abstract]
Actualizaciones más recientes a este resumen (03/20/2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Información general sobre el cáncer de cuello uterino
Se actualizaron las estadísticas de casos nuevos y defunciones a escala mundial para 2022 (se citó a Bray et al. como referencia 1).
Se actualizaron las estadísticas con el número estimado de casos nuevos y defunciones para 2025 (se citó a la American Cancer Society como referencia 2).
Tratamiento del cáncer de cuello uterino en estadio IVB y recidivante
Se añadió texto sobre los resultados de un ensayo internacional de fase III en el que participaron 502 mujeres con cáncer de cuello uterino metastásico o recidivante que se asignaron al azar para recibir tisotumab vedotina o la elección de quimioterapia del investigador. El criterio principal de valoración fue la supervivencia general (se citó a Vergote et al. como referencia 6 y nivel de evidencia A1).
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de cuello uterino. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
El revisor principal del sumario sobre Tratamiento del cáncer de cuello uterino es:
- Olga T. Filippova, MD (Lenox Hill Hospital)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de cuello uterino. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en: https://www.cancer.gov/espanol/tipos/cuello-uterino/pro/tratamiento-cuello-uterino-pdq. Fecha de acceso: <MM/DD/YYYY>.
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.